CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
环磷酰胺对稀有鮈鲫的遗传毒性
作者:刘汉伟 章跃龙 乐琪君 刘佳
刘汉伟 章跃龙 乐琪君 刘佳
摘要目的:利用稀有鮈鲫外周血红细胞微核试验方法对环磷酰胺的致突变性进行检测。方法:将稀有鮈鲫半静态暴露于环磷酰胺溶液中,测定不同浓度下各时间点的稀有鮈鲫外周血红细胞微核及细胞核异常千分率,并进行统计分析。结果:研究发现稀有鮈鲫在环磷酰胺溶液中暴露后,能明显观察到外周血红细胞微核和异常细胞核千分率增加,在一定条件下存在浓度-效应关系和时间-效应关系。结论:环磷酰胺可以作为稀有鮈鲫外周血红细胞微核试验的阳性参比物监测遗传毒物对鱼类的遗传毒性。
关键词 稀有鮈鲫;外周血红细胞微核;环磷酰胺
Genotoxicity of Cyclophosphamide toGobiocypris rarus
LIU Han-WeiZHANG Yue-LongLE Qi-JunLIU Jia
AbstractOBJECTIVE: The mutagenicity of cyclophosphamide was detected by peripheral blood erythrocyte micronucleus test of Chinese rare minnow (Gobiocypris rarus). METHODS: The in vivo micronucleus assay was conducted by exposuring G. rarus in cyclophosphamide solution followed by collecting the peripheral erythrocytes of the fish. Statistical analysis was made on micronucleus and abnormal nuclear percentage of peripheral blood. RESULTS: It was found that after exposure to cyclophosphamide solution, the micronucleus and abnormal nuclears of erythrocyte in peripheral blood could be significantly increased, and there was a concentration-effect relationship and a time-effect relationship under certain conditions. CONCLUSIONS: Cyclophosphamide might be used as a positive reference for peripheral blood erythrocyte micronucleus test in Chinese rare minnow to monitor the genetic toxicity of genetic toxicants to fish.
Keywords Gobiocypris rarus; piscine micronucleus assay in peripheral erythrocytes; cyclophosphamide
微核试验方法建立于20 世纪70 年代,具有简便、快速、敏感、准确等特点,作为致突变剂和致癌剂的快速初筛试验,被广泛用于检测各种外来物质导致的生物体染色体——纺锤体损伤[1]。鱼类是水环境最直观的哨兵,是食物链中连接污染物和人类的载体,水环境中的遗传毒物能诱发鱼体产生微核,通过监测鱼类红细胞微核率的变化可研究外源物的遗传毒性和评价环境水质,利用鱼类微核试验评价和检测外源物质引起的染色体断裂和纺锤体损伤对保护人类健康具有重要意义[2]。
环磷酰胺是微核试验和致畸试验常用的阳性参比物[3,4],可在较低浓度下引起啮齿类动物微核率升高,也可在妊娠期通过动物胎盘屏障,造成胎仔畸形。稀有鮈鲫鱼是我国长江上游的一种特有小型鱼类,具有生长周期短、产卵批次多、对环境污染物敏感等特点,现作为我国标准实验鱼种用于化学品和农药的水生毒性测试[5]。本研究采用环磷酰胺进行稀有鮈鲫外周血红细胞微核试验,旨在分析环磷酰胺对稀有鮈鲫的遗传毒性。
1 实验材料
1.1 实验鱼类
稀有鮈鲫种鱼购自中国科学院水生生物研究所,实验鱼为本实验室繁育得到,批号为:XYJJ20170713。供试鱼健康,无畸形,鱼龄102 d,体长34.0 mm~42.0 mm,体重1.09 g~1.37 g。每天正常喂食,光照光暗比为16 h∶8 h。
1.2 主要试剂和仪器
环磷酰胺(百灵威,分析纯);甲醇(国药集团,分析纯),染液(姬姆萨原液和磷酸缓冲液(pH6.8)的体积比为1:9)。奥林巴斯BX51荧光显微镜,梅特勒S975型水质多参数测定仪,哈纳HI93735水硬度计,赛多利斯Quintix 224-1CN分析天平。
2 实验方法
2.1 浓度设计与分组
试验采用半静态暴露试验法,每24小时更换一次实验溶液。试验设置0.3mg/L、0.6mg/L、1.2mg/L、2.4mg/L和9.6 mg/L 5个浓度组,另外设置1个空白对照组。每个浓度放入15L受试样品溶液和28尾鱼。
2.2 实验鱼染毒
在染毒后的3h、6h、12h、24h、48h、72h、96h和120h,分别对所有浓度组3尾稀有鮈鲫断尾采血,观察不同浓度和时间下环磷酰胺对稀有鮈鲫外周血红细胞微核率及细胞核异常率的影响。
2.3 制片及镜检
用手术刀在稀有鮈鲫尾部2mm~4mm处断尾取血涂抹到滴有磷酸缓冲液的载玻片上,用载玻片将血细胞推抹均匀。每尾鱼制作3张涂片,玻片自然晾干后用甲醇固定10min后取出晾干,然后用吉姆萨染色液染色12min,自来水洗净晾干后即可阅片。每张涂片在10×100倍显微镜下观察15000个细胞,记录微核细胞数和细胞核异常数量,结果以千分率( ‰)表示。
2.4 数据处理
结果以平均值±标准偏差表示,单因素方差分析环磷酰胺对稀有鮈鲫外周血红细胞微核率影响的浓度-效应和时间-效应关系,应用SPSS 22. 0 软件进行单因素方差分析和多重比较,Dunnett's t检验进行相关显著性分析。
3 实验结果
3.1 环磷酰胺在不同质量浓度和暴露时间对稀有鮈鲫外周血红细胞微核率的影响
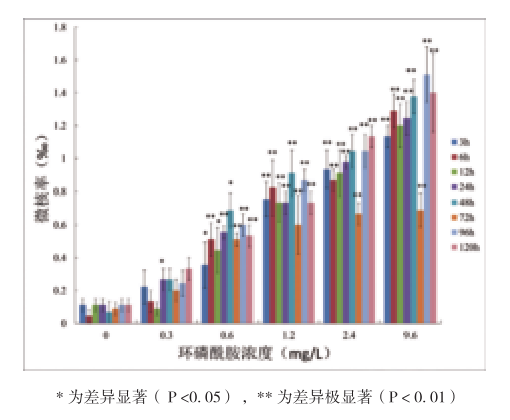
如图1所示,稀有鮈鲫微核率与环磷酰胺浓度成正相关,在9.6mg/L浓度下染毒96h微核千分率最高,其次为120h和48h,微核千分率在1.2‰以上;在1.2mg/L浓度下各时间点稀有鮈鲫微核率与空白对照组相比表现出极显著差异(P<0.01),微核率最高值为染毒48h。
图1 环磷酰胺对稀有鮈鲫外周血红细胞微核率的影响
3.2 环磷酰胺在不同质量浓度和暴露时间对稀有鮈鲫外周血红细胞核内凹的影响
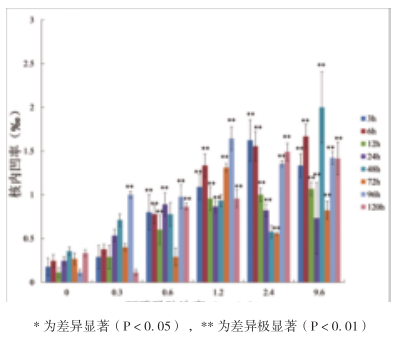
如图2所示,环磷酰胺可引起稀有鮈鲫外周血红细胞核内凹率升高,且随着环磷酰胺浓度的增加逐渐升高,在1.2mg/L浓度下增幅减弱。在9.6mg/L浓度下染毒48h核内凹千分率最高,其次为6h,千分率在1.5‰以上;在1.2mg/L浓度下,除染毒48h以外,其他染毒时间点核内凹千分率与空白对照组相比表现出极显著差异(P<0.01),染毒96h核内凹率最高。
图2 环磷酰胺对稀有鮈鲫外周血红细胞核内凹的影响
3.3 环磷酰胺在不同质量浓度和暴露时间对稀有鮈鲫外周血红细胞微核其他异常的影响
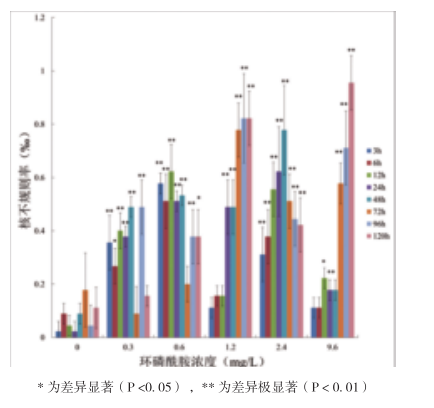
如图3所示,环磷酰胺还可引起稀有鮈鲫外周血红细胞核其他异常,包括双核、外凸、小核及细胞核不规则等,异常率与浓度具有一定的相关性,在1.2mg/L浓度下先升高至0.8‰后,再出现降低,此浓度下染毒72h后细胞核其他异常千分率较高,而最高值出现在9.6mg/L浓度下染毒120h。在2.4mg/L浓度下,各染毒时间点细胞核其他异常千分率与空白对照组相比表现出极显著差异(P<0.01),染毒48h细胞核异常率最高。
图3 环磷酰胺对稀有鮈鲫外周血红细胞核其他异常的影响
4 讨论
作为检测染色体或有丝分裂器损伤的一种遗传毒性试验方法,微核试验常采用的实验生物有啮齿类动物、蚕豆、两栖动物和鱼类[2, 6-7],目前鲜有文献报道环磷酰胺对稀有鮈鲫微核率及细胞核异常的影响。与小鼠、蚕豆根尖及非洲爪蟾等动物微核试验相比,鱼类微核试验的优势在于稀有鮈鲫个体大小适中、易人工饲养繁育、生长速度快,微核操作周期短、检测成本低,染毒过程直接与受试物持续接触,染毒效果更明显;稀有鮈鲫微外周血细胞染色后清晰、直观、无干扰,微核、内凹、外凸、小核、核分裂及双核等特征可直接在显微镜下读取,可避免哺乳动物正红染和嗜多染细胞的辨别干扰,操作简单,可提高检测效率,降低成本;稀有鮈鲫为我国特有的、环保部和农业部指定模型生物,微核模型的建立既拓展了稀有鮈鲫的应用范围,也有利于保护我国特有的物种资源;稀有鮈鲫作为一种鱼类,与哺乳动物比相对低级,实验过程动物应激反应相对弱,符合实验动物3R和福利原则。
在120h染毒期间,1.2mg/L环磷酰胺浓度下稀有鮈鲫外周血红细胞微核率和核内凹率与空白对照组相比表现出极显著差异(P<0.01),微核率高于0.6‰,核内凹率高于0.8‰,染毒48h时微核率最高,染毒96h时核内凹率最高。与空白对照组相比,双核、外凸、小核及细胞核不规则等其他核异常率在2.4mg/L浓度下表现出极显著差异(P<0.01),但低于1.2mg/L浓度时的细胞核异常率;2.4mg/L浓度下细胞核异常率最高的染毒时间为48h。综上分析,在1.2mg/L~2.4mg/L浓度下染毒环磷酰胺48h可对稀有鮈鲫产生明显的遗传毒性效应。
图4 稀有鮈鲫外周血红细胞形态图
A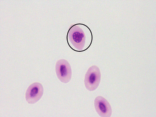 B
B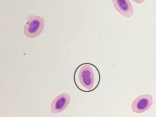 C
C 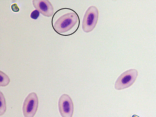
D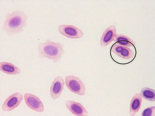 E
E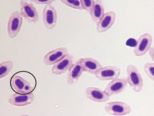 F
F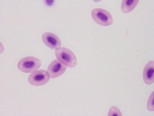
A外凸B内凹C微核D双核E小核F正常细胞核
参考文献
[1] Heddle J A. A rapid in vivo test for chromosomal damage [J]. Mutation Research/fundamental Molecular Mechanisms of Mutagenesis, 1973, 18(2):187-190.
[2] 刘楠楠, 吕碧平, 厉以强,等. 稀有鮈鲫外周血红细胞微核试验方法研究[J]. 中国环境监测, 2012, 28(3):121-126.
[3] 欧红梅, 周长慧, 涂宏刚,等. 流式细胞术检测体外微核方法的建立[J]. 癌变·畸变·突变, 2015(1):39-43.
[4] 李培宁, 江漪, 陈秀娟,等. 致畸试验中3种常用阳性对照物的效果比较[J]. 癌变·畸变·突变, 2017, 29(3):235-240.
[5] 吴本丽, 曹岩, 罗思,等. 封闭群稀有鮈鲫对几种常见化学品的敏感性[J]. 中国环境科学, 2014, 34(4):1059-1066.
[6] 王超, 阮鸿洁, 豆捷雄,等. 采用蚕豆根尖微核试验检测自来水厂水体的遗传毒性[J]. 癌变.畸变:突变, 2016, 28(6):481-483.
[7] 李贤宾, 李少南, 袁丙强,等. 乙草胺对热带爪蟾的早期致畸效应及遗传毒性研究[J]. 农药学学报, 2011, 13(1):40-46.







