CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
快速鉴定虾夷马粪海胆及其制品分子生物学方法
作者:孙晓飞1 王 耀1 贾 赟1 万 超1 宋大贺1
孙晓飞1 王 耀1 贾 赟1 万 超1 宋大贺1
摘 要 通过在虾夷马粪海胆CoxI序列差异处设计特异性引物,建立了一种虾夷马粪海胆SYBR Green荧光PCR定性检测方法,并进行了引物特异性和灵敏度分析。结果表明:检测的虾夷马粪海胆和7种近缘物种中,只有虾夷马粪海胆出现明显扩增,该方法检测灵敏度可达0.1ng/μL。通过对市售海胆制品的检测验证,该方法特异性强,灵敏度高,可用于食品中虾夷马粪海胆成分的鉴定。
关键词 虾夷马粪海胆;SYBR Green荧光PCR;CoxI
Biological Method for Rapid Identification Strongylocent Rotus Intermedius and Its Products
SUN Xiao-Fei1 WANG Yao1 JIA-Yun1 WAN Chao1 SONG Da-He1
Abstract Through strongylocentrotus intermedius CoxI designed the strongylocentrotus intermedius specific primers,establish the strongylocentrotus intermedius SYBR Green fluorescent PCR qualitative detection method containing of specificity and sensitivity of detection assays. The results showed that only the strongylocentrotus intermedius was significant amplification among 7 kinds of animal samples,and the detection sensitivity of this method could reach 0.1 ng / μL. By testing and verifying commercially available sea urchin products, this method has high accuracy and sensitivity, and can be used for the identification of strongylocentrotus intermedius in food.
Keywords Strongylocentrotus intermedius ;SYBR Green real-time fluorescence PCR;CoxI
海胆(Sea urchin)是棘皮动物门下的一个纲,是一类生活在海洋浅水区的无脊椎动物[1]。由于外形独特,又称为“刺锅子”“海刺猬”。在我国,海胆主要分布于黄海、渤海沿岸、辽东半岛及山东半岛的北部,向南至浙江以及舟山群岛等海域。海胆的食用部分主要是其生殖腺,又称海胆卵、海胆黄,营养价值极高。海胆壳是一种贵重的中药材,其提取物波乃利宁(Bonellinin)有抑制癌细胞生长作用。
海胆已经逐渐被消费者追捧,大连是虾夷马粪海胆、紫海胆(又称光棘球海胆)的主产地,2015年大连冰鲜海胆首次出口我国香港,开拓了辽宁黄海沿岸的海胆进出口业务。其中,虾夷马粪海胆又称为中间球海胆,是海胆类中经济价值最高的种类之一。在海胆逐渐被追捧的同时,市面上出现了琳琅满目的海胆制品,海胆酱、海胆包、海胆保健品等,质量良莠不齐,也出现了不同程度的掺假现象,这不仅侵害了消费者的权益,还会影响我国海胆产业的经济效益。美国、欧盟、加拿大等水产进出口国家及地区开始陆续对贝类等水产品实施物种DNA的自主检验,以此预防和打击商业中的掺假和欺骗行为。为了保障消费者权益,保证进出口海胆制品质量,建立虾夷马粪海胆源性成分检测方法,为海胆源性成分鉴定、打击假冒伪劣产品提供技术支撑。本研究采用的是SYBR Green方法进行检测,SYBR Green是一种可以与所有ds双螺旋小沟区域结合的具有绿色激发波长的燃料[2];SYBR Green荧光PCR检测方法相对于常用的探针法,区别在于不需要额外添加探针引物,可以避免普通PCR法灵敏度不高等缺点,该方法兼有操作简单方便、灵敏度高、特异性强等优点[3]。
1 材料
1.1 试剂及耗材
检测试剂盒:海洋动物基因组DNA提取试剂盒(天根化科技有限公司),Premix Ex Taq(TaKaRa 公司),琼脂糖(北京沃比森),引物(TaKaRa公司)。
检测样品:海胆(虾夷马粪海胆、紫海胆、黄海胆),海参,海胆,扇贝,杂色蛤,牡蛎等。
1.2 检测仪器及设备
实时荧光PCR仪(7500 Fast,美国ABI公司),凝胶成像系统(GelDoc,美国Bio-Rad公司),超微量分光光度计(Nanorop 2000,美国ThermoFisher公司)。
1.3 检测方法
1.3.1 样本DNA提取
采用海洋动物DNA提取试剂盒提取海胆等样品模板DNA。具体操作如下:切取30 mg的组织材料,放入装有200 μl GA 缓冲液的离心管中,加入20 μl 蛋白酶K,在56 ℃条件下直至组织完全溶解,加入200 μl缓冲液GB,70 ℃放置10 min,加入200 μl 无水乙醇,其间,不时摇晃混匀,将离心管中溶液及絮状沉淀全部加入一个吸附柱CB3中(吸附柱放入收集管中),12 000 rpm离心30 sec,倒掉废液,向吸附柱CB3中加入500 μl缓冲液GD,12 000 rpm离心30 sec,倒掉废液,向吸附柱CB3中加入600 μl 漂洗液PW,12 000 rpm离心30 sec,倒掉废液,将吸附柱CB3转入一个干净的离心管中,加入100 μl洗脱缓冲液TE溶解DNA,于-20℃下保存备用。
用NanoVue微量分光光度计检测提取DNA浓度,均在50 ng/μL -200 ng/μL之间。通过在260 nm条件下测定样品提取DNA OD值,结果显示,所提取DNA 260/280值均为1.8~2.0,表明所有抽提的DNA适用于PCR 检测[4]。
1.3.2 反应条件的建立及优化
反应体系为20 μL,分别设定退火温度为55 ℃、58 ℃、60 ℃,进行荧光PCR试验,优化退火温度,通过灵敏度分析,确定最佳反应条件是94℃,2 min;94℃,5s;58℃,33s;40个循环,72℃,10 min。SYBR Green荧光PCR和普通PCR反应体系分别见表1、表2。
表1 荧光PCR扩增海胆的CoxI基因的反应体系
Table 1 Fluorescent PCR amplification of sea urchin CoxI gene reaction system
次序 | 组分 | 20μL反应体系 |
加样体积 (μL) | ||
1 | SYBR Premix反应液 | 10 |
2 | 上游引物 (10μmol/L) | 1 |
3 | 下游引物 (10μmol/L) | 1 |
4 | DNA模板 (100±50ng ) | 1 |
5 | 双蒸水 | 7 |
表2 普通PCR扩增海胆的CoxI基因的反应体系
Table 2 PCR amplification of sea urchin CoxI gene reaction system
次序 | 组分 | 20μL反应体系 |
加样体积 (μL) | ||
1 | 10*PCR buffer | 5 |
2 | dNTP mix | 2 |
3 | 上游引物 (10μmol/L) | 1 |
4 | 下游引物 (10μmol/L) | 1 |
5 | Taq 酶 | 1 |
6 | DNA模板 (100±50ng ) | 1 |
7 | 双蒸水 | 9 |
1.3.3 引物的设计
在Genebank上查找目的基因序列(160bp):
TAGTAAAATAGCACACGCCGGAGGGTCCGTCGATTTGGCAATCTTCTCCCTCCACCTTGCCGGTGCCTCTTCCATCCTAGCCTCAATTAAATTTATAACAACAATTATTAATATGCGAACACCAGGGATGTCTTTTGACCGTCTTCCCTTATTTGTCTGA,根据目的序列设计特异性引物。共设计5对引物,如表3。
表3 海胆引物序列
Table 3 Sequence of sea urchin primers
引物序号 | 引物序列 |
P1 | 5’- tagtaaaatagcacacgccg -3’(上游) |
P2 | 5’- tcagacaaataagggaagacg -3’(下游) |
P3 | 5’-ggagcagggactggatga-3’(上游) |
P4 | 5’-ggctaggatggaagaggc-3’(下游) |
P5 | 5’-tgggaatggatgttgata-3’(上游) |
P6 | 5’-agacccttggagtgttgc-3’(下游) |
P7 | 5’-tgggaatggatgttgata-3’(上游) |
P8 | 5’-aggacaatgcctgtgagt-3’(下游) |
P9 | 5’-gcaatcttctccctccac-3’(上游) |
P10 | 5’-cggtcaaacgacatccct-3’(下游) |
以P1P2、P3P4、P5P6、P7P8和P9P10这5对特异性引物PCR扩增虾夷马粪海胆的CoxI基因后,2%琼脂糖凝胶电泳进行检测,结果显示(如图1所示),经琼脂糖凝胶电泳检测后会分别产生160bp、185bp大小的特异性电泳条带,其他泳道无条带出现。以P1P2作为上下游引物进行特异性PCR扩增,电泳效果最好,PCR扩增效率最高,因此选取P1P2作为扩增体系的特异性扩增引物。
最终确认引物P1、P2效果最佳,用于虾夷马粪海胆物种检测,特异性好,检测灵敏度高。采用本方法检测海胆动物成分结果显示,采用虾夷马粪海胆物种特异性检测引物PCR扩增海胆的CoxI基因,PCR扩增后经琼脂糖凝胶电泳会产生一条160 bp大小的特异性电泳条带(见图2),即可将虾夷马粪海胆成分进行准确鉴定,具有很好的特异性。
上游引物:5′- tagtaaaatagcacacgccg -3′
下游引物:5′- tcagacaaataagggaagacg -3′

图1 5对引物PCR结果图
Fig.1 PCR results of 5 pairs of primers
图中:M为DL2000marker,1为P1P2引物扩增结果,2为P3P4引物扩增结果,3为P5P6引物扩增结果,4为P7P8引物扩增结果,5为P9P10引物扩增结果,6为阴性对照,7为空白对照

图2 PCR特异性检测结果图
Fig.2 PCR specificity detection results
图中:M为2000marker,1为黄海胆,2为紫海胆,3为杂色蛤,4为海参,5为虾夷马粪海胆,6为空白对照,7为海星
1.3.4 引物灵敏度分析
采用DNA提取试剂盒提取各待测样品的模板DNA,用微量分光光度计分别检测所提取的模板DNA梯度稀释,制备成10 ng/μL、5 ng/μL、1 ng/μL 、0.5 ng/μL 、0.1 ng/μL 5个浓度梯度样品,分别按照上述1.3.2中所述反应体系及反应参数进行PCR扩增,然后用2%琼脂糖凝胶电泳进行检测,以确定本标准方法的检测灵敏度,结果如图3所示,所产生的大小为160 bp的特异性电泳条带即为海胆,当DNA浓度≥0.1 ng/μL时均可以特异扩增,即该标准方法的检测灵敏度为0.1 ng/μL。此方法可以准确地对海胆成分进行鉴定,具有很好的灵敏度。
2 结果与分析
2.1 普通PCR结果
以合成的特异性引物PCR扩增海胆CoxI基因后,进行琼脂糖凝胶电泳检测2%琼脂糖凝胶电泳进行检测,结果显示(如图4所示),经琼脂糖凝胶电泳检测后会分别产生160 bp的特异性电泳条带,电泳效果最好,PCR扩增效率最高。
2.2 SYBR Green荧光PCR检测结果
进行灵敏度检测,将虾夷马粪海胆总DNA进行5倍梯度稀释,分别作为模板进行海胆成分的荧光PCR检测,当DNA浓度达到0.1 ng/μL时样品均可出现特异扩增(见图5),结果显示虾夷海胆DNA检测灵敏度可达0.1 ng/μL。
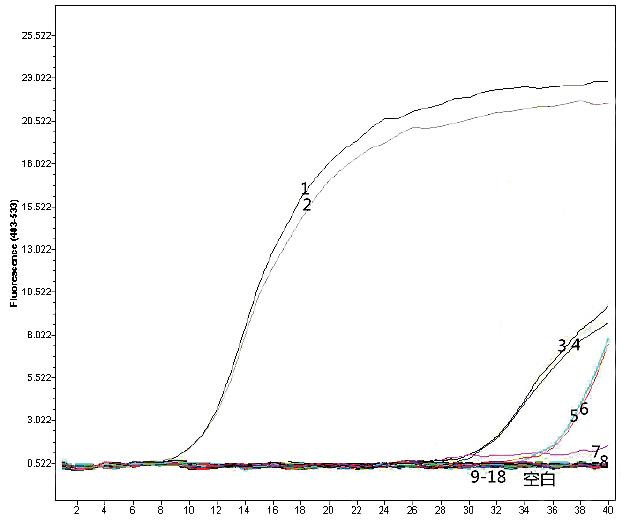
以虾夷马粪海胆样品和9份非海胆样品DNA作为模板进行PCR实验,每个样本进行2次重复实验。结果显示,只有虾夷马粪海胆出现显著扩增,Ct值为11,其余2份海胆样品和6种常见海洋动物样品扩增曲线Ct值均≥30,表明本方法针对海胆的特异性良好(见图6)。
2.3 实际应用检测结果
为了检测该方法实用性,选取虾夷马粪海胆、紫海胆、黄海胆、牡蛎、杂色蛤、扇贝、海胆酱、鸡肉等8种样品,采用盲样测试的方式,用本标准中检测方法进行马粪海胆源性成分检测,结果见图7。
结果显示,图中虾夷马粪海胆扩增出特异性曲线,其他海胆及水产制品虽然也有曲线扩增,但Ct值远远大于虾夷马粪海胆扩增曲线;检测结果显示8号鸡肉没有出现扩增曲线,说明该方法还可进行水产制品与其他类食品进行鉴别,说明特异性良好。
3 讨论
作为对食品掺假或以次充好等违法行为进行监管的有效手段,荧光PCR检测技术日渐成熟,已应用于多领域、多类别的物种鉴定工作中。SYBR Green实时荧光PCR方法是实时荧光定量PCR中的一种,该方法用荧光染料代替传统的荧光探针,灵敏度更高、特异性更强,使检测工作操作更加简单、便捷[5-6]。万超等通过该方法建立了快速鉴定大西洋鳕鱼及其制品方法[7];刘淑艳等建立了小体鲟物种的快速鉴定方法[8],均证明SYBR Green荧光PCR检测方法具有较高灵敏度,可以有效鉴定出目的基因。近几年,随着一些食品中掺假、假冒伪劣产品事故频发,物种鉴定工作的需求不断加大,目前,我国已发布实施多项涉及鱼类、贝类等水产品鉴定标准,但尚未有针对海胆、牡蛎、鲍鱼等经济型贝类的研究,选择虾夷马粪海胆作为研究对象也是因为具有较高的经济价值、营养价值,作为大连地区支撑产业,项目的研究具有重要指导作用。通过本研究所建立的虾夷马粪海胆成分SYBR Green荧光PCR显示出良好的特异性,灵敏度可达0.1 ng/μL,多类别样品检测结果显示,该方法适用于市面上虾夷马粪海胆的鉴定。同时,该方法实用性强,可应用于多领域多物种的源性成分鉴定工作。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为6.3%。】
基金项目:新型脂溶性贝类毒素关键检测技术的研究及相关贝类物种溯源库的构建(2013IK037)
第一作者:孙晓飞,大连海关技术中心,高级兽医师,研究方向:动物检疫
1. 大连海关 大连 11600 1. Dalian Customs, Dalian 11600
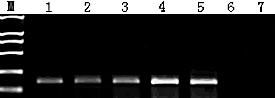
图3 灵敏度分析结果图
Fig.3 Results of sensitivity analysis
图 中:M为DL2000marker,1为0.1 ng/μL扩增结果,2为0.5ng/μL扩增结果,3为1 ng/μL扩增结果,4为5ng/μL扩增结果,5为10 ng/μL扩增结果,6为阴性对照,7为空白对照
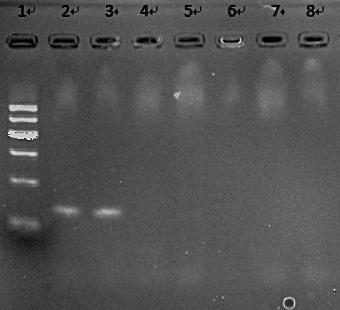
图4 引物PCR扩增的电泳检测结果图
Fig.4 Electrophoresis detection results of primer PCR amplification
图中:1为DL2000marker,2~3为阳性DNA模板引物扩增结果,4~6为阴性对照,7~8为空白对照

26.145
23.645
21.145
16.645
16.145
13.645
11.145
8.845
6.145
3.645
1.145
Fluorescence(483-533)
2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40
Cycles
图5 海胆DNA浓度灵敏度检测
Fig.5 Detection of sensitivity of sea urchin DNA concentration
图中:1为10ng/μL扩增曲线,2为5ng/μL扩增曲线,3为1ng/μL扩增曲线,4为0.5ng/μL扩增曲线,5为0.1 ng/μL扩增曲线,6为空白对照
Cycles
图6 特异性检测
Fig.6 Specificity detection
图中:1~2为虾夷马粪海胆,3~4为紫海胆,5~6为黄海胆,7~18分别为海胆样品和其他海洋动物样品

图7 8种样品检测结果
Fig.7 Test results of 8 samples
图中:1为虾夷马粪海胆,2~7为海胆及其他水产制品,8为鸡肉
参考文献
[1]刘晓慧, 黄佳琪,周遵春等. 5种经济海胆线粒体16S rRNA基因片段的序列分析[J] .水产科学, 2007, 26(6):331-334.
[2]郭云霞,张舒亚,谌鸿超等.SYBR Green实时荧光 PCR检测食品中鲨鱼源性成分真实性方法的建立[J].食品与生物技术学报, 2012, 31(12):1673-1689.
[3]袁亚男 , 刘文忠.实时荧光定量 PCR 技术的类型、特点与应用[J].中国畜牧兽医 , 2008, 35(3):27-30.
[4]田金辉.食品中动物源性成分定性鉴定方法研究[D].西安:西北农林科技大学, 2011.
[5]李新光, 赵峰, 马丽萍等.基于SYBR-Green溶解曲线快速鉴别挪威三文鱼及其制品的方法[J].中国食品学报, 2014(3) :70-176.
[6] R.Scudiero,C.Capasso, V.Carginale, et al .PCR amplification and cloning of metallothionein complementary DNAs in temperate and Antarctic sea urchin characterized by a large difference in egg metallothionein content[J]. Cellular and Molecular Life Sciences, 1997, 53 (5), 472-477.
[7]万超,蒋丹,吕泉等.太平洋无须鳕鱼及其制品的PCR鉴定 食品安全质量检测学报, 2017, (1):71-75.
[8]刘淑艳,孙晓飞,万超.建立一种快速鉴定欧鳇及其制品的SYBR Green荧光PCR方法.食品科技, 2016,11:259-261.
(文章类别:CPST-C)







