CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
不同RT-PCR扩增试剂盒检测甲肝病毒效果评价
作者:齐 欣1 曲世超1 田 卓1 麻丽丹2 崔 妍1 徐文英1 王 煜1
齐 欣1 曲世超1 田 卓1 麻丽丹2 崔 妍1 徐文英1 王 煜1
摘 要 讨论评价ABI公司、天根公司和Roche公司扩增试剂盒用于检测食品中甲肝病毒结果的差异,为甲肝病毒扩增检测提供便捷、准确的技术参考。在食品样品中添加盔甲病毒作为病毒富集的过程质控,甲肝减毒疫苗作为阳性对照。根据一步法RT-PCR检测人工污染样品的Ct值对三种扩增试剂盒的扩增效率、特异性和灵敏度进行评价和数据分析。ABI公司扩增试剂盒扩增效率最高(EFF%:91.584),灵敏度最高(0.314CCID50/μL),三种扩增试剂盒均具有良好的特异性。采用盔甲病毒作为过程控制病毒进行食品中甲肝病毒的检测,为甲肝病毒的质量控制提供分析依据。ABI公司扩增试剂盒在总体性能上优于其他两个厂家,更适用于各级实验室甲肝病毒的日常检测工作,为一线检测工作提供最佳的扩增方案及质量控制措施。
关键词 扩增试剂盒;甲肝病毒;盔甲病毒;评价
Effective Evaluation of Different RT-PCR Amplification Kits for Detection of Hepatitis A Virus
QI Xin1 QU Shi-Chao1 TIAN Zhuo1 MA Li-Dan2 CUI Yan1 XU Wen-Ying1 WANG Yu1
Abstract The aim of this work is to discuss and evaluate the detection difference of Hepatitis A virus from food by three various kinds of amplification kits produced by ABI, Tiangen and Roche, to provide a convenient and accurate technical reference for Hepatitis A virus amplification test. Armored virus were added into the food samples as the process quality control of virus enrichment and hepatitis A attenuated vaccine with different titers was used as a positive control. The cycle threshold (Ct) of artificial contaminated negative samples was detected by one-step RT-PCR and used as the index for evaluation and analysis of extraction efficiency, detection specificity and sensitivity of three different amplification kits. Although all the three amplification kits have good detection specificity,the ABI amplification kit shows highest extraction efficiency (EFF%: 91.584) and detection sensitivity (0.314 CCID50/μL). Armored virus was used as a process control virus to detect hepatitis a virus in food, providing an analytical basis for quality control of hepatitis A virus. The performance of ABI amplification kit is superior to the other two kits. It is more suitable for daily detection of hepatitis a virus in lab, providing an excellent amplification solution and quality control measurement for first-line testing.
Keywords amplification kits; Hepatitis A virus; armored virus; evaluation
甲型病毒性肝炎(简称甲肝)是由甲型肝炎病毒(Hepatitis A virus, HAV)通过粪-口途径传播引起的一种以肝脏损害为主的急性肠道传染病[1-2]。极易以未煮熟、生的或缺少热处理的食品作为载体进行感染及传播,其中,贝类和水果是其传播的主要介质[3-5]。全球各个国家每年都会发生因甲肝病毒感染而引起甲型肝炎的暴发流行和急性胃肠炎的发生[6]。2017年8月至2018年9月美国西弗吉利亚洲和肯塔基州就有两波甲型肝炎暴发流行,造成14人死亡,我国同样也是甲型肝炎的高发流行区。伴随着发病急、易高发及难消除的特点,甲肝病毒现已成为世界范围内与环境卫生及个人卫生水平有关的的高频传染病之一,引发食品安全问题的频繁发生[7]。
随着RT-PCR技术的发展及应用,国内外普遍采用RT-PCR方法进行食品中肠道食源性病毒的检验[8]。与此同时,市面上出现的一步法RT-PCR扩增检测试剂盒以操作简便、快速、稳定性好等特点,深受科技工作者的青睐及喜爱[9-12]。但目前市售检测甲肝病毒所用的一步法RT-PCR扩增试剂盒种类颇多,各个生产厂商所用技术和扩增目的片段会略有不同,使不同扩增试剂盒在扩增效果、灵敏性等方面存在不同的效果差异[13]。商业化扩增试剂盒虽给检测工作者提供了更广泛的选择机会,也使检测工作者难以选择适合自身实际样本的扩增试剂盒,以防止检测结果的偏差。目前,针对不同类型病毒的PCR扩增试剂盒扩增效果的比较研究已有许多报道,但是针对食源性甲肝病毒扩增试剂盒扩增效果的比较评估鲜有报道[14-15]。因此,为保证甲肝病毒检测的准确性,减少使用者验证试剂盒扩增效果的工作量,扩增试剂盒的准确选择具有十分重要的作用。本试验采用自行研发的盔甲病毒IAC监测检测的全过程,以软质水果和水产品为研究对象,对目前市售较权威的三种甲肝病毒一步法RT-PCR扩增试剂盒扩增效果进行评估,分析其检验的扩增效率、特异性和灵敏性,为各级实验室病毒检测工作者在扩增试剂盒上的选择提供参考,对食品中甲肝病毒PCR检测结果质量控制因素的研究、提高检测的灵敏度及准确度均具有重要的意义。
1 材料和方法
1.1 主要材料与试剂
1.1.1 材料来源
草莓、黑莓、树莓样品均来自丹东海关出口样品;贝类样品来自东港海关和大连海关出口样品。
1.1.2 试剂
High Pure Viral RNA isolation Kit(货号:11858882001),Roche EvoScript RNA Probes Master(货号:07912293001) Roche公司;ABI AgPath-IDTM One-step RT-PCR Kit(货号:AM1005) ABI公司;TIANGEN FastKing One Step RT-qPCR Kit(货号:FP314)天根生化技术有限公司;阳性对照为HAV减毒疫苗(滴定度:106.5CCID50/mL) 长春长生生物科技股份有限公司;盔甲病毒IAC为实验室自行研发产品;诺如病毒基因型GI和GII、轮状病毒A群和C群由中国疾病预防控制中心赠与[16]。
1.1.3 引物及探针
引物和探针均由invetrogen公司合成。
HAV[17](正向引物 HAV-F: 5′-TCACCGCCGTTTGCCTAG-3′;反向引物 HAV-R: 5′-GGAGAGCCCTGGAAGAAAG-3′;探针 HAV-P: 5′-FAM- CCTGAACCTGCAGGAATTAA-MGBNFQ-3′)。
盔甲病毒IAC(正向引物F: 5′-GACATCGATATGGGTGCCG-3′;反向引物R: 5′-AATATTCGCGAGACGATGCAG-3′;探针P: NED –5′-TCTCATGCGTCTCCCTGGTGAATGTG-Eclipse 3′)。
1.2 主要仪器与设备
3-18K台式高速冷冻离心机,德国Sigma;7300实时荧光定量PCR系统,美国ABI公司;SK-1快速混匀器,江苏省金坛市荣华仪器制造有限公司。
1.3 方法
1.3.1 人工污染样品的制备
剪取各20g±0.1g已知甲肝病毒、轮状病毒和诺如病毒阴性的草莓、黑莓、树莓(未完全解冻或冷藏)样品及2g±0.1g贝类样品放至离心管中,每类样品各20份,每份样品分别加入10 μL的HAV减毒疫苗和10 μL盔甲病毒IAC,将其放置在生物安全柜中室温静置20 min,使病毒与样品能够充分吸附[6, 16]。
1.3.2 样品中病毒的富集
参照ISO/TS 15216-2方法[17]中不同基质分别进行病毒富集。
1.3.3 样品中病毒RNA的提取
按照Roche High Pure Viral RNA isolation Kit提取试剂盒说明书提取病毒RNA,-80℃保存。
1.3.4 扩增试剂盒反应体系及反应参数
Roche扩增试剂盒反应体系为:RT-PCR混合液4 μL,正向引物0.625 μL(20 μM),反向引物1.125 μL(20 μM),荧光探针0.3125 μL(20 μM),RNA模板5 μL,补水至25 μL。反应参数为:60℃,15 min; 95℃,10 min;95℃,15 s,60℃,30 s,45个循环。
ABI扩增试剂盒反应体系为:25×RT-PCR酶预混液1 μL,2×RT-PCR 缓冲液12.5 μL,正向引物0.625 μL(20 μM),反向引物1.125 μL(20 μM),荧光探针0.3125 μL(20 μM),RNA模板5 μL,补水至25 μL。反应参数为:45℃,10 min;95℃,10 min;95℃,15 s,60℃,45 s,40个循环。
TIANGEN扩增试剂盒反应体系为: 25×FastKingRT-PCR酶预混液1 μL,2×FastKingRT-PCR缓冲液12.5 μL,正向引物0.625 μL(20 μM),反向引物1.125 μL(20 μM),荧光探针0.3125 μL(20 μM),RNA模板5 μL,补水至25 μL。反应参数为:50℃,30 min;95℃,3 min;95℃,15 s,60℃,30 s,40个循环。
1.3.5 结果判定
Ct值≤35,可判断本样品中甲肝病毒核酸检测阳性;Ct值≥40,可判断本样品中甲肝病毒核酸检测阴性;35<Ct值<40,重新检测样本,重新检测结果Ct值≥40者为阴性,反之阳性。
1.3.6 盔甲病毒IAC指示方法研究
分别对人工污染样品中HAV减毒疫苗和盔甲病毒IAC的10倍稀释核酸Ct值与未稀释核酸Ct值差值进行t检验,比较两组数据间是否存在显著差异,以确认盔甲病毒IAC的有效性。
1.3.7 扩增效率评价
参照1.3.3方法提取盔甲病毒IAC核酸,将10μL盔甲病毒IAC核酸进行数次10倍梯度稀释,采用上述三种不同扩增试剂盒进行RT-PCR扩增并建立对应标准曲线,以IAC未稀释RNA浓度为1,IAC梯度稀释RNA浓度分别为10-1、10-2、10-3、10-4和10-5。同时对添加于草莓样品中的HAV减毒疫苗和盔甲病毒IAC核酸分别进行RT-PCR扩增,比较不同扩增试剂盒扩增效果。
1.3.8 特异性评价
采用1.3.4中三种扩增试剂盒的反应体系及参数检测甲肝病毒、诺如病毒GI、GII型和轮状病毒,对其特异性进行评价。
1.3.9 灵敏度评价
将滴定度为106.5 CCID50/mL的HAV减毒疫苗病毒RNA样品分别进行10倍梯度稀释,按照1.3.4中三种扩增试剂盒的反应体系和参数进行多次RT-PCR反应,确定其灵敏度。
2 结果
2.1 盔甲病毒IAC指示方法研究结果
加入盔甲病毒IAC的各类样品核酸扩增后未稀释样品平均Ct值和其10倍稀释样品平均Ct值见表1。可知盔甲病毒IAC可有效监控RT-PCR的整个扩增过程(相差10倍Ct值相差约为3.3),没有出现假阳性或假阴性现象。
对不同种类人工污染样品各20份分别添加盔甲病毒IAC和HAV减毒疫苗后其原倍样品平均Ct值与10倍稀释样品平均Ct值的差值进行差异分析,结果见表2。可见各种类样品中添加盔甲病毒IAC和HAV减毒疫苗进行甲肝病毒检测无显著差异(P>0.05)。结果表明,在样品中添加盔甲病毒IAC可用于监测甲肝病毒、诺如病毒、轮状病毒的RNA病毒检测过程。
2.2 扩增效率评价
建立三种不同扩增试剂盒盔甲病毒IAC标准曲线如图1~图3所示。通过Ct值表明,扩增效率为ABI(Eff%:91.584)>天根(Eff%:87.986)>Roche(Eff%:82.567),ABI公司RNA病毒核酸一步法RT-PCR扩增试剂盒具有三者中最高的扩增效率。三种扩增试剂盒对于草莓样品中添加盔甲病毒IAC和HAV减毒疫苗的扩增结果如表3所示,结果表明ABI公司扩增试剂盒在同一种类样品中扩增效果最好。
2.3 特异性评价
如图4、图5所示,甲肝病毒双重扩增Ct值与单重PCR 扩增的Ct值无明显变化,结果表明不存在PCR扩增抑制现象,也没有非特异性扩增,说明这三种检扩增剂盒特异性均较好。
2.4 灵敏度评价
采用Roche扩增试剂盒检测甲肝病毒灵敏度结果如图6所示,在稀释度为10-3时,结果为阳性(Ct值≤35),且重复性和稳定性良好,稀释度分别为10-4无典型扩增曲线,结果表明,Roche扩增试剂盒对于HAV病毒的检测灵敏度为31.362 CCID50/μL。
采用ABI扩增试剂盒检测甲肝病毒灵敏度结果如图7所示,ABI试剂盒在甲肝病毒RNA稀释度为10-5时,Ct值≤35.0(结果为阳性),且重复性和稳定性良好;稀释度为10-6时结果可疑;稀释度为10-7时无典型扩增曲线。结果表明,ABI扩增试剂盒对于HAV病毒的检测灵敏度为0.314 CCID50/μL。
采用天根扩增试剂盒检测甲肝病毒灵敏度结果如图8所示,在稀释度为10-4时,结果为阳性(Ct值≤35),且重复性和稳定性良好,稀释度分别为10-5~10-6无典型扩增曲线。结果表明,天根扩增试剂盒对于HAV病毒的检测灵敏度为3.136 CCID50/μL。
3 讨论
甲肝病毒作为易引起食源性疾病暴发的元凶之一,却由于在食品中的含量较低、不能在体外进行繁殖,并且病毒培养周期较长等特点,难以建立该病毒的快速检测方法。因此,PCR反应的扩增效率和灵敏度直接影响检测结果的准确性。针对一线检测工作人员面对大批量食源性病毒的检测任务,选择一种高效、准确的检测方法是非常重要的,不仅可以降低检测风险,还能提高工作效率。
本研究通过在样品中添加自行研发的盔甲病毒IAC对RT-PCR的整个扩增过程进行有效的监控,该盔甲病毒IAC即可以全程指示假阴性现象的出现,又能在有阳性对照添加的情况下不影响RT-PCR检测灵敏度进行PCR快速检测,结果表明,此盔甲病毒IAC稳定可靠、生物安全性高、能全程参与病毒核酸的反应,可以用于监测食品中甲肝病毒、诺如病毒和轮状病毒的RNA病毒检测,以此来判定病毒检测结果的可靠性,具有较好的应用前景[18]。
研究选用的三种不同一步法RT-PCR扩增试剂盒是目前国内甲肝病毒检测常用的扩增试剂盒,对三者的扩增效率、特异性和敏感性行进比较分析[13]。三者在扩增效率存在一定差异,ABI(Eff%:91.584)>天根(Eff%:87.986)>Roche(Eff%:82.567);三者均具有良好的特异性,未出现非特异性扩增;三者灵敏度存在结果为ABI(0.314 CCID50/μL)>天根(3.136 CCID50/μL)>Roche(31.362 CCID50/μL),由此可见,在反应体积和RNA模板添加量相同的情况下,三种扩增试剂盒却存在较大的差异,分析还是和厂家自身试剂盒研发技术及退火时间、循环数的设定有直接关系。Roche公司的扩增试剂盒扩增效率和灵敏度较其他两个厂家的试剂盒低,如甲肝病毒含量低则易出现假阴性而造成检测事故。因此,本研究中优选出的ABI公司AM1005 AgPath-IDTM One-step RT-PCR Kit不仅能为各个检测实验室提供高效的扩增方法,还能为各实验室在甲肝病毒检测能力和提高结果一致性上进行有效的监测,具有较好的使用价值及应用前景。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为7.5%。】
辽宁省自然基金项目(2019-MS-395)资助
第一作者:齐欣(1984-),女,河北昌黎人,硕士,中级工程师,主要从事食品安全与检测,E-mail: 110697186@qq.com
1.大连海关技术中心 大连 116001 2.丹东海关 丹东 118001
1. Technical Center of Dalian Customs, Dalian 116001 2. Dandong Customs, Dandong 118001
表1 不同样品中添加盔甲病毒IAC后提取核酸扩增Ct值
Table 1 The cycle threshold value of Nucleic acid amplification in different samplesby using armored virus IAC
平均Ct值 | 样品名称 | |||
草莓 | 黑莓 | 树莓 | 贝类 | |
未稀释核酸 | 26.836 | 29.322 | 23.68 | 30.86735 |
10倍稀释核酸 | 30.022 | 32.552 | 26.794 | 34.04535 |
表2 不同样品中添加盔甲病毒IAC和HAV的差异分析
Table 2 The Difference analysis of Armored virus IAC and HAV in different samples
样品名称 | 草莓 | 黑莓 | 树莓 | 贝类 | ||||
IAC | HAV | IAC | HAV | IAC | HAV | IAC | HAV | |
平均Ct值差值 | 3.19 | 3.22 | 3.23 | 3.21 | 3.11 | 3.26 | 3.18 | 3.22 |
P值 | 0.1083 | 0.2899 | 0.1358 | 0.1059 | ||||
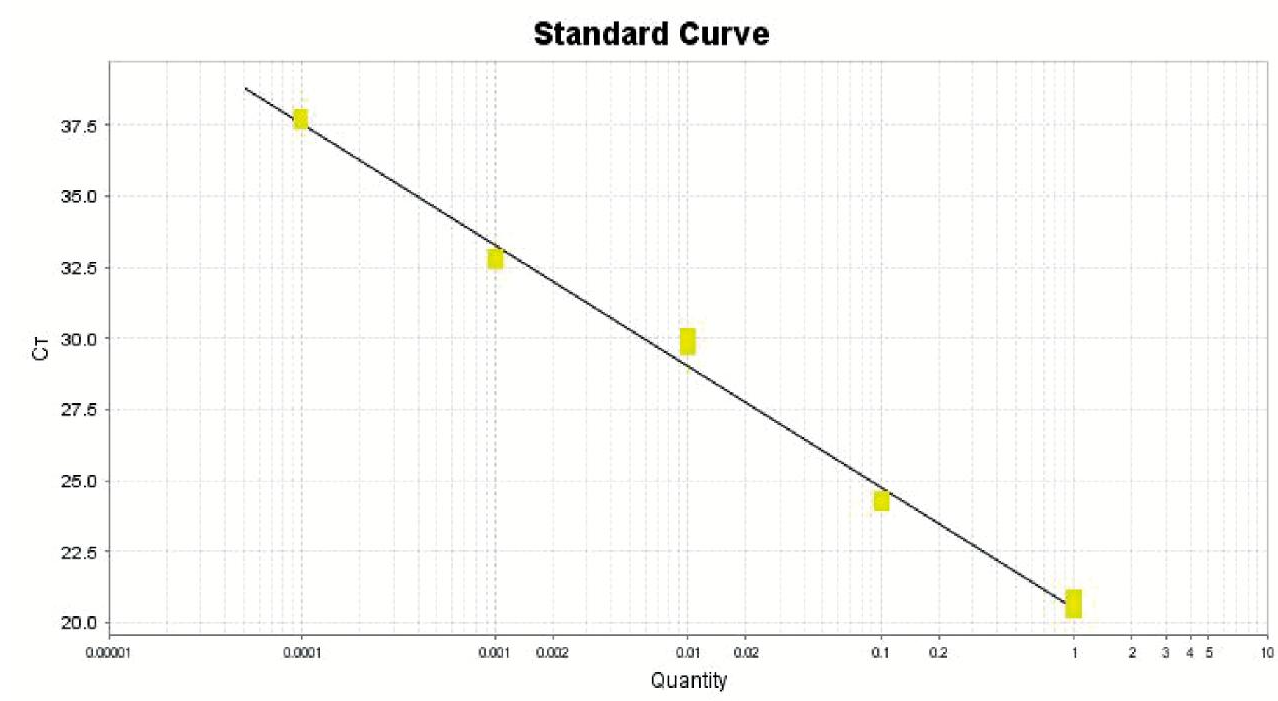
Slope:-3.542;Y-Inter:16.859;R2:0.999;Eff%:91.584
图1 ABI一步法RT-PCR扩增试剂盒标准曲线
Fig. 1 A standard curve by ABI AgPath-IDTM One-step RT-PCR Kit
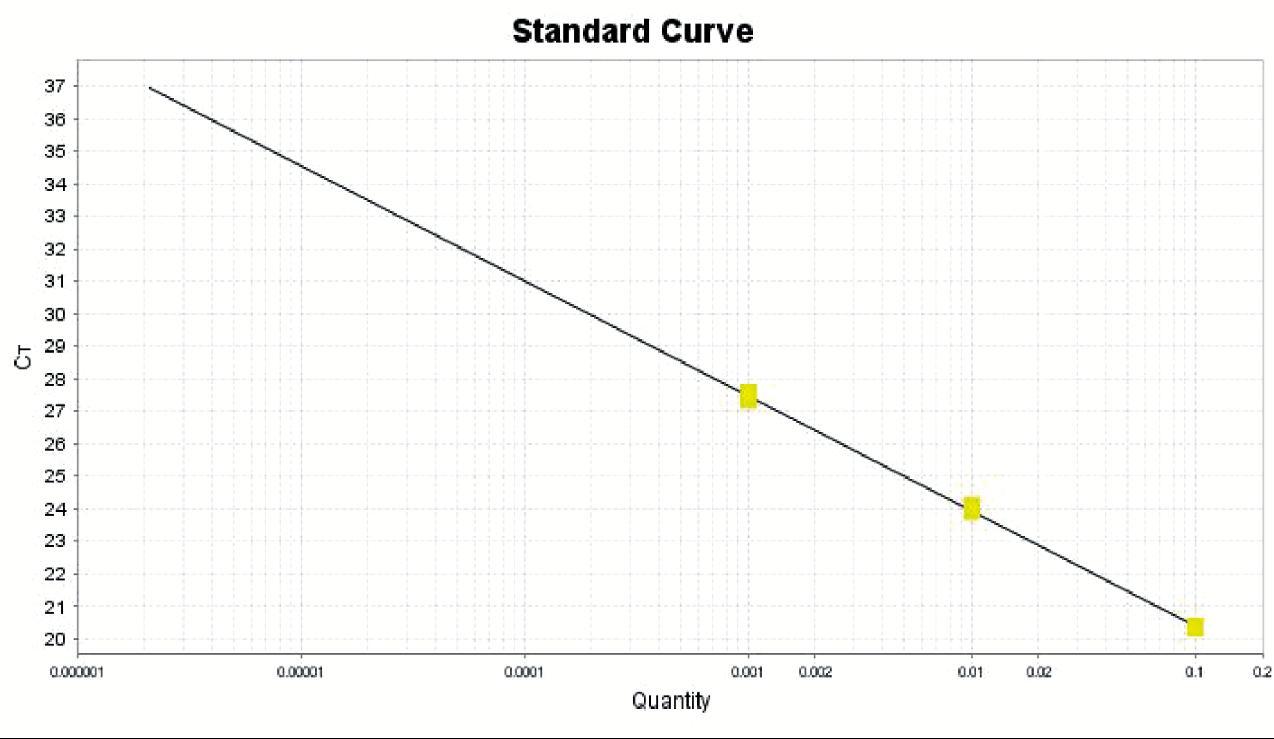
Slope:-4.142;Y-Inter:19.019;R2:0.985;Eff%:82.567
图2 Roche一步法RT-PCR扩增试剂盒标准曲线
Fig. 2 A standard curve by Roche EvoScript One-step RT-PCR Kit
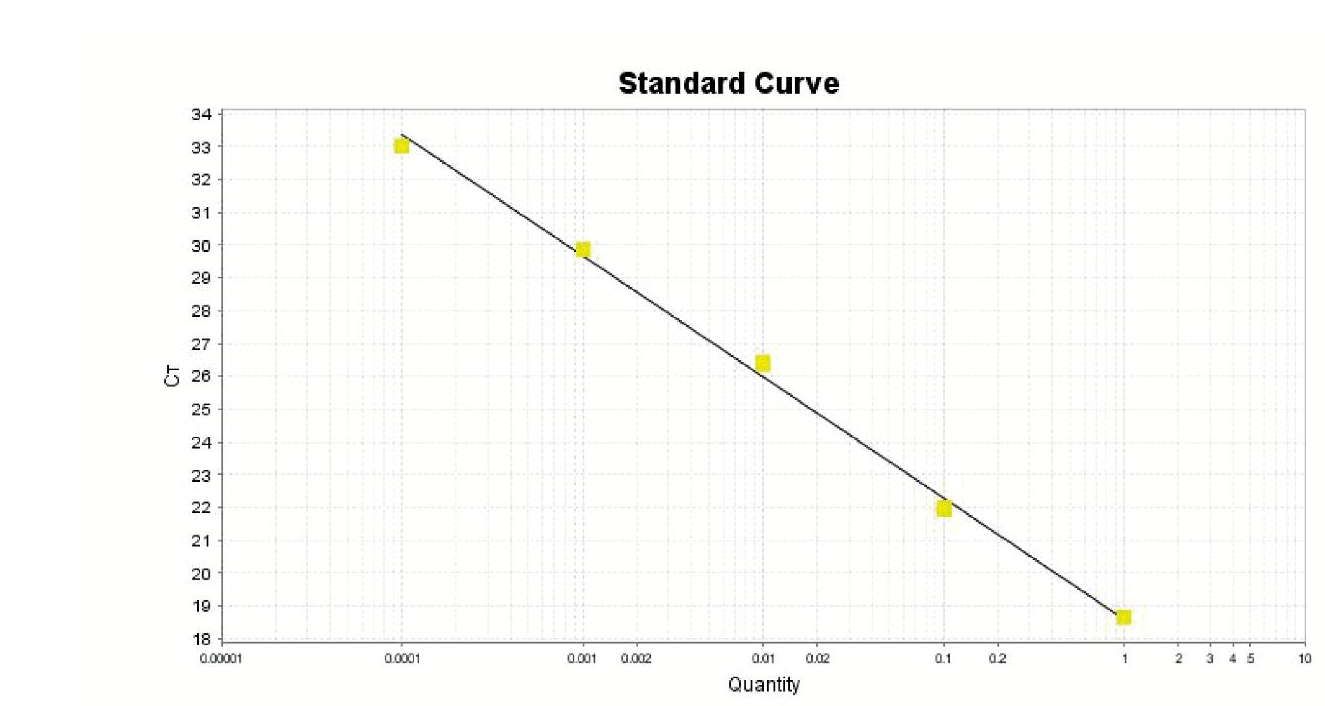
Slope:-3.698;Y-Inter:18.604;R2:0.996;Eff%:87.986
图3 天根一步法RT-PCR扩增试剂盒标准曲线
Fig. 3 A standard curve by TIANGEN FastKing One Step RT-qPCR Kit
表3 三种病毒RNA扩增试剂盒对添加于草莓样品中盔甲病毒IAC和HAV的扩增结果
Table 3 Amplification results of three viral RNA amplification kits in Strawberriesby using armored virus IAC and HAV
草莓平行样品 | 天根试剂盒 | Roche试剂盒 | ABI试剂盒 | |||
Ct值 | IAC | HAV | IAC | HAV | IAC | HAV |
1 | 26.969 | 30.822 | 28.984 | 29.172 | 24.387 | 25.470 |
2 | 26.696 | 30.986 | 28.986 | 29.081 | 24.409 | 25.669 |
3 | 26.932 | 30.766 | 28.676 | 29.536 | 24.493 | 25.645 |
4 | 26.804 | 30.843 | 28.834 | 29.360 | 24. 454 | 25.544 |
5 | 26.984 | 30.799 | 28. 979 | 29.654 | 24.537 | 25.528 |
6 | 26.011 | 30.632 | 28.623 | 29.689 | 24.568 | 25.586 |
7 | 26.007 | 30.908 | 28.980 | 29.576 | 24.433 | 25.533 |
8 | 26.799 | 31.001 | 28.987 | 29.023 | 24.764 | 25.746 |
平均值 | 26.900 | 30.845 | 28.899 | 29.388 | 24.513 | 25.590 |
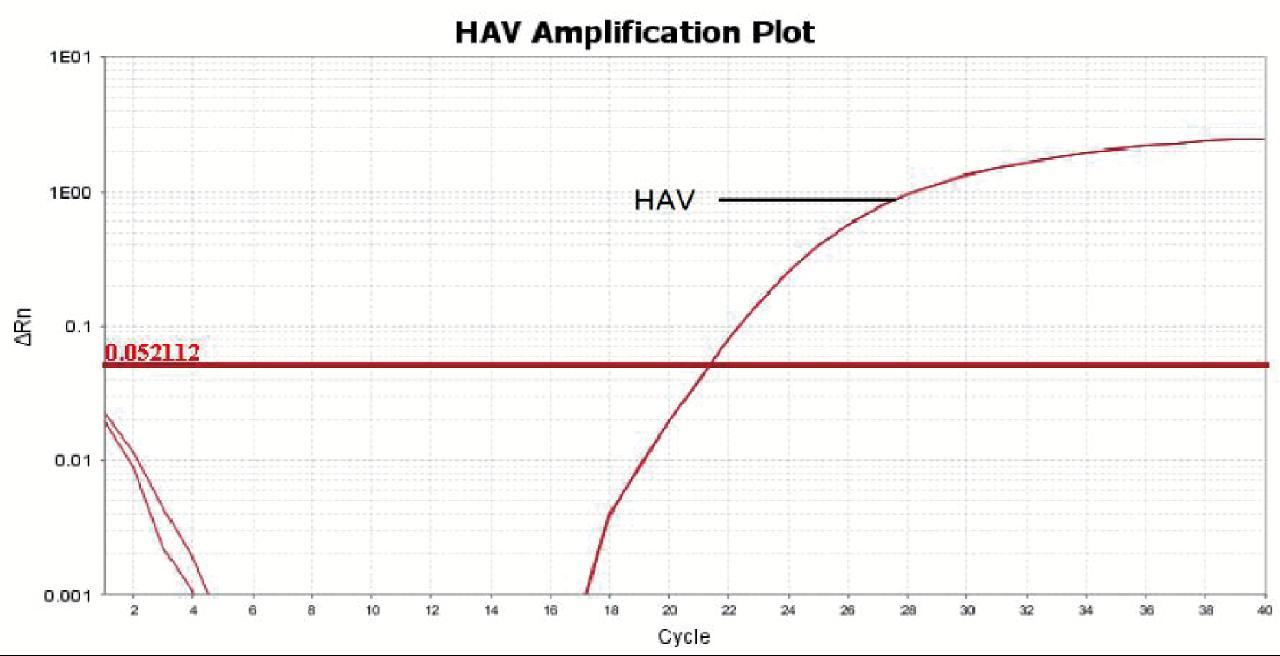
图4 甲肝病毒RT-PCR特异性结果
Fig. 4 Specific results of HAV by RT-PCR

0.053228
图5 甲肝病毒和盔甲病毒IAC的双重RT-PCR结果
Fig. 5 The duplex RT-PCR results of HAV and Armored virus IAC
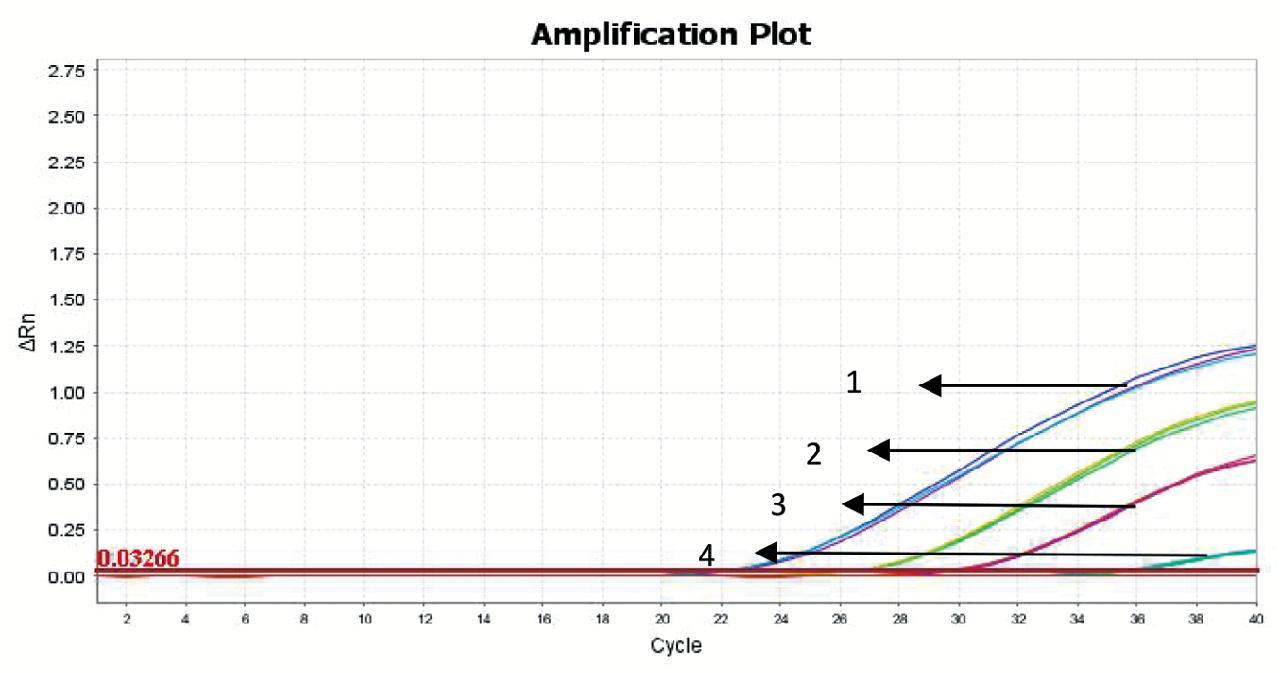
1:3.136×104 CCID50/μL;2:3.136×103 CCID50/μL;3:3.136×102 CCID50/μL;4:31.362 CCID50/μL
图6 Roche试剂盒检测甲肝病毒的灵敏度实验结果
Fig. 6 Results of the HAV detection sensitivity with Roche kit

1:3.136×10 4 CCID 50 /μL;2:3.136×10 3 CCID 50 /μL;3:3.136×10 2 CCID 50 /μL;4:31.362 CCID 50 /μL;
5:3.136 CCID 50 /μL;6:0.314 CCID 50 /μL
图7 ABI试剂盒检测甲肝病毒的灵敏度实验结果
Fig. 7 Results of the HAV detection sensitivity with ABI kit
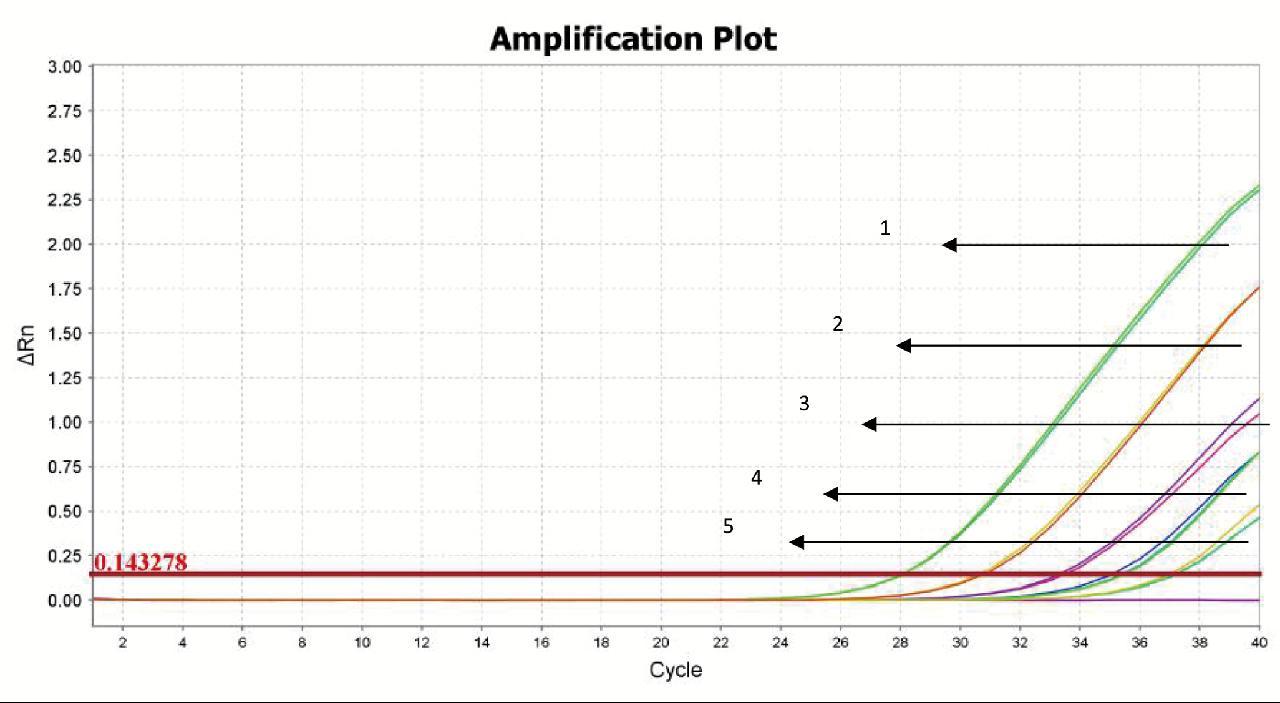
1:3.136×10 4 CCID 50 /μL;2:3.136×10 3 CCID 50 /μL;3:3.136×10 2 CCID 50 /μL;4:31.362 CCID 50 /μL;5:3.136 CCID 50 /μL
图8 天根试剂盒检测甲肝病毒的灵敏度实验结果
Fig.8 Results of the HAV detection sensitivity with TIANGEN kit
参考文献
[1] 陈琳,陈立,盛望,等.甲型肝炎疫苗应用现状及研究进展[J].医学综述, 2012, 18(17): 2802-2804.
[2] 陈广全,张慧媛,曾静.食品安全检测培训教材微生物检测[M]. 北京:中国标准出版社, 2010: 480-481.
[3] 冯华炜,艾海新,杨天舟,等.小浆果中食源性甲型肝炎病毒和诺如病毒流行状况及检测方法的研究进展[J].食品科学, 2019, 40(19):307-317.
[4] TheEuropeanUnionsummary report on trends and sources of zoo noses, zoonotic agents andfood- borne outbreaks in 2014 [J]. EFSA Journal, 2015, 13(12): n/a-n/a.
[5] Painter J A, Hoekstra R M, Ayers T, et al. Attribution of foodborne illnesses, hospitalizations,and deaths to food commodities by using outbreak data, United States, 1998-2008 [J]. Emerginginfectious diseases, 2013, 19(3): 407.
[6] 高世光,王海燕,郭慧,等.草莓中甲型肝炎病毒检测[J].食品科学, 2014, 35(24): 213-218.
[7] 冯华炜,闫平平,艾海新,等.食品中甲型肝炎病毒RNA提取方法的比较及应用[J].食品科学, 2019, 40(06): 325-330.
[8] 王静.甲型肝炎病毒检测方法研究进展[J].中国实用医刊, 2009, 36(17): 16-18.
[9] Randazzo W, Piqueras J, RordGuez-D Az J, et al.Improving efficiency of viability-qPCR forselective detection of infectious HAV in food and water samples [J]. Journal of appliedmicrobiology, 2018, 124(4): 958.
[10] Rump B O, Visser O, TeWierik M J M, et al. Use of PCR for detection of fecal HAV as ascreening tool in an outbreak of hepatitis A in daycare Centres [J]. 2013, 141(3): 549-55.
[11] 华哲云,褚维,宋黎黎,等.实时荧光RT-PCR在人感染H7N9禽流感病毒检测中的应用[J].检验医学, 2013, 28(9): 755-757.
[12] 罗宝正,莫秋华,李儒曙,等.新型H7N9亚型禽流感病毒多重荧光RT-PCR 快速检测方法的建立[J].病毒学报, 2013, 30(1): 1-5.
[13] 郑丽兰,张海明,张海冰,等.不同荧光RT-PCR试剂盒检测H7亚型禽流感病毒的比较[J].中国动物检疫, 2014, 31(9): 73-76.
[14] 邹伟华,顾金华,茅华英.等.不同试剂盒检测戊型肝炎病毒感染结果比较[J].浙江预防医学, 2008, 20, (8): 28-33.
[15] 郑丽兰,张海明,张海冰.等.不同荧光RT_PCR试剂盒检测H7亚型禽流感病毒的比较[J].中国动物检疫, 2014, 31(9): 73-76.
[16] 高世光,冯华炜,林天闻,等. 草莓中诺如病毒和甲肝病毒的多重实时荧光逆转录PCR检测方法的建立[J].中国食品卫生杂志, 2015, 27(5): 512-517.
[17] ISO/TS 15216-2: 2013 Microbiology of food and animal feed-Horizontalmethod for determination of hepatitis A virus and norovirus in food usingreal-time RT-PCR - Method for qualitative detection [S].
[18] 温和心,龙英全,蒋荣华,等.RNA病毒质控物研究进展[J].动物医学进展, 2013, 34(1): 97-101.
(文章类别:CPST-B)







