CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
4种实时荧光PCR试剂在大米转基因检测中的应用比较
作者:权永兵1 闫邦奇1 王 进2 林 伟1 徐淼锋1 水克娟1 廖 力1 张卫东1
权永兵1 闫邦奇1 王 进2 林 伟1 徐淼锋1 水克娟1 廖 力1 张卫东1
摘 要 本文比较评价了4种荧光PCR试剂在大米转基因检测中的应用效果,筛选出最适合转基因成分检测的试剂,并建立相关检测方法体系。将同一大米样品提取的核酸做5个浓度梯度,用4种不同品牌的荧光探针PCR试剂同时扩增大米内源Gos9基因,分析4种试剂检测结果的差异和相关性。4种试剂对目标基因均有特异性扩增,模板量最高(250 ng)时,编号为Ti的试剂扩增的Ct值最小(23.36),Bi是25.19,Pr和Ta差异不明显(分别为27.76和27.35);当模板量为25 pg时,编号为Bi的试剂扩增的Ct值最小(35.45),其余分别为Ta(37.85)、Ti(35.85)和Pr(42.26)。由结果可以看出,Bi试剂的扩增效率、灵敏度和稳定性都优于其他试剂,特别是在模板量浓度低的情况下检测结果最佳。不同试剂对相同模板的扩增效率不同,综合评价得出Bi试剂的稳定性、灵敏度和准确度在4种试剂中最好,可稳定用于大米及其加工产品的转基因检测。
关键词 实时荧光PCR;转基因;检测
Comparison of 4 Real-time Fluorescence PCR Regents in Detection of Genetically Modified Rice
QUAN Yong-Bing1 YAN Bang-Qi1 WANG Jin2 LIN Wei1 XU Miao-Feng1
SHUI Ke-Juan1 LIAO Li1 ZHANG Wei-Dong1
Abstract The efficacy of 4 real-time fluorescence quantitative PCR diagnostic kits used in detection of genetically modified rice was compared and evaluated. Diluted the rice DNA to 5 concentration dilutions, amplified the rice endogenous Gos9 by 4 different q-PCR diagnostic kits, then analyze the divergence and relation of the results. 4 kits were used to amplify the target gene specifically, When the amount of template is the highest (250 ng), the Ct value of the reagent Ti is the smallest (23.36), the Ct value of the reagent Bi is 25.19, the difference between Pr and Ta is not obvious (respectively 27.76 and 27.35); when the amount of template is 25 pg, the Ct value of the reagent Bi is the smallest (35.45), followed by Ta (37.85), Ti (35.85) and Pr (42.26). The result showed that the amplification curve of Bi reagent was most stable. Different regents showed different amplification efficiency, the results reflected their respective superiority, and comprehensive evaluation results showed that the regent of Bi was the best choice for detecting genetically modified rice and its derived products from plants.
Keywords real-time fluorescence PCR; genetically modified; detection
拱北海关科技项目(ZH2017-24)资助
第一作者:权永兵(1986-),男,汉族,陕西宝鸡人,硕士,农艺师,主要从事植物转基因及有害生物分子检测工作,E-mail:qyb19860224@163.com
1. 拱北海关技术中心 珠海 519000
2. 珠海宝锐生物科技有限公司 珠海 519015
1. Technical Center of Gongbei Customs District, Zhuhai 519000
2. Zhuhai Biori Biotechnology Co., Ltd, Zhuhai 519015
引言
转基因植物是指通过重组DNA技术将外源基因人工插入其他物种,通过基因改造获得特别性状的植物。目前的转基因植物通常具有耐旱、抗虫、抗病、抗菌、高油等生物性状。自1983年首例烟草转基因问世以来,转基因生物迅猛发展。据国际农业生物技术应用服务组织(International Service for the Acquisition of Ari-biotech Applications, ISAAA)的统计,截至2018年全球有28个国家种植转基因,种植面积从1996年的1700万公顷增加到1.917亿公顷 [1]。随着越来越多的转基因植物商业化生产的批准,主要的粮食作物如大豆、玉米、水稻等转基因农产品和食品越来越普遍地存在于人们的日常生活中。
转基因的发展一方面体现了科技发展对生产力的促进,另一方面其安全性问题越来越引起人们的关注。由于转基因产品含有外源DNA及由外源基因编码的蛋白质,其安全性在短时间内无法确定,可能存在危害人体及生物环境的潜在风险。世界上大部分国家和地区对转基因植物的系统管理制定了严格的法律法规,明确了标签标识的问题,并规定了最低限量 [2]。挪威是首个要求对转基因含量作出标识的国家,转基因成分限量标识低限为2% [3];瑞士和欧盟规定食品中含有超过1%的转基因成分时,必须在标签上明确标识 [4-5];韩国和日本规定的食品中转基因标识的限量分别为3%和5%,高于以上数值必须在标签上明确标识[6-7];我国发布的《农业转基因生物标识管理办法》中规定,凡是列入标识管理目录并用于销售的农业转基因生物,应当进行标识[8]。因此,建立准确有效的转基因检测技术,针对转基因产品中的转基因成分作出准确检测,区别转基因和非转基因,选择性地标记转基因产品,并对食品产品中的转基因含量进行准确定量,才能更合理规范地管理转基因植物及其加工产品,保障食品安全[9]。
目前,国内外在植物转基因检测中运用最为广泛的是PCR方法,包括普通PCR和实时荧光PCR(Real time fluorescence PCR)技术。普通PCR方法是通过一对特异性引物检测转基因成分,已在国内外植物转基因检测中被广泛运用[10-15]。实时荧光PCR方法是在引物的基础上加一条特异性荧光探针,PCR扩增过程中通过释放探针上标记的荧光基团进行荧光信号积累,通过收集荧光信号实时监测PCR的扩增[16]。实时荧光PCR方法具有快速、灵敏、高通量、特异性强、自动化程度高、重复性好、能准确定量、有效减少和控制污染等特点,越来越多的学者倾向于研究建立实时荧光PCR方法,目前在转基因大米、玉米等农作物及其产品的转基因检测中已有相关应用[17-18]。实时荧光PCR方法在检测过程中受模板浓度和PCR反应缓冲液扩增效率的影响较大,不同反应体系的检测灵敏度有一定差距。因此,针对不同体系选择合适的实时荧光PCR反应试剂非常重要。本文选择了4种不同品牌的实时荧光PCR试剂,针对转基因检测中大米内源Gos9基因的不同浓度梯度进行扩增,并比较检测结果,以筛选最适合的试剂,优化最佳的反应体系,建立高效灵敏特别是针对微量和痕量大米转基因成分的检测方法,为企业安全生产、政府把关提供有力的技术支持。
1 材料与方法
1.1 材料
1.1.1 转基因大米样品
取本实验室留存检测转基因的大米样品240 g,用样品粉碎机打磨成粉状,以备提取基因组DNA使用。
1.1.2 试剂和仪器
购买4种不同厂家的实时荧光反应试剂盒,分别编号为Pr、Ti、Bi、Ta;引物和探针由大连宝生物公司合成;DNA提取采用的仪器为核酸自动提取仪Kingfisher mL(美国Thermo Fisher公司);核酸质量和浓度测定仪器为NanoDrop1000微量分光光度计(美国Thermo Fisher公司);实时荧光PCR仪为Roche Light Cycler 480II实时荧光PCR仪(瑞士罗氏诊断公司)。
1.1.3 引物和探针
检测方法采用欧盟针对Bt转基因大米的检测方法[19],大米内源基因Gos9作为检测目标基因,引物探针根据该方法合成,序列见表1。
1.2 方法
1.2.1 大米基因组DNA提取
采用磁珠法提取DNA:取0.2 g样品于2 mL离心管中,加入1 mL DNA抽提液,65℃孵育16 h,10000 rpm离心10 min;在Kingfisher mL核酸自动提取仪5联管的第一个和第二个孔中分别加入离心上清300 μL、CTAB沉淀液600 μL,第一个孔中加入20 μL磁珠,第三个和第四个孔中分别加入800 μL 75%乙醇,第五个孔中加入300 μL灭菌双蒸水,随后将5联管放入核酸自动提取仪中提取DNA;结束后收集第五个孔中的DNA溶液,紫外分光光度计检测DNA浓度和质量。
1.2.2 模板DNA准备
将基因组DNA的浓度调整至50 ng/μL,作为原液,然后按照10倍比例依次稀释为5 ng/μL、5×10-1 ng/μL、5×10-2 ng/μL和5×10-3 ng/μL,以10倍的比例做5个浓度梯度的DNA模板,4 ℃保存备用。
1.2.3 实时荧光PCR扩增
在96孔板中配置以下反应体系:每反应总体积25 μL,分别加入2×premix 12.5 μL,10 pm/μL的上下游引物各0.75 μL,10 pm/μL的探针0.5 μL,模板DNA加入5 μL(含量分别为250 ng、25 ng、2.5 ng、0.25 ng和0.025 ng),最后加入5.5 μL ddH2O补足体积,每个反应设置3个平行。将96孔板放入实时荧光PCR仪中,设置程序,反应条件为95 ℃预变性10 min,45个循环为95 ℃ 15 sec,60 ℃ 1 min。
2 结果与分析
2.1 实时荧光PCR对大米Gos9基因的扩增结果
用试验中采用的4种试剂盒对大米转基因检测中常用的Gos9基因进行扩增,实时荧光PCR扩增结果如图1~4所示,分别为4个不同试剂盒对Gos9基因的实时荧光PCR扩增结果。每种试剂对Gos9基因都有稳定的扩增,但结果之间又有一定差异,模板浓度相同的情况下扩增的效果不同。
将模板DNA原液(浓度为50 ng/μL)按10倍浓度梯度进行稀释,扩增Ct值结果见表2。在模板浓度最高为50 ng/μL的情况下,Ti的Ct值最低,为23.36,反应速度最快;随后是Bi,Ct值为25.27;Pr和Ta的Ct值分别为27.76和27.35,无明显差异。当模板浓度为5 ng/μL时Ti的Ct值最小,为25.61;Pr的Ct值最大,为30.70;Bi和Ta的Ct值较近,分别为28.57和29.27。当模板浓度为5×10-1 ng/μL时,Ct值最低的是Ti,为29.68。当模板浓度为5×10-2 ng/μL时,Ct值最低的是Bi,为32.94。当模板浓度最低,即5 pg/μL的情况下,不同试剂之间的扩增结果差别较大:Pr的Ct值最大,为42.26,且荧光值非常低;Ta的Ct值为37.85,Ct值有所提前,荧光值相对较高,但未形成典型的S型扩增曲线,扩增效率相对较低;Ta和Bi形成了荧光扩增曲线,但相比于Ti的Ct值36.25,Bi的Ct值35.45最小,比Ta的Ct值小约一个循环数,而且荧光值更高,在模板浓度最低的情况下为扩增效率最高的一个试剂。综合以上结果可以看出,模板浓度较高的情况下,Ti试剂的扩增灵敏度较高,Ct值相对较小。但在模板浓度低的情况下,Bi试剂的表现更好,Ct值相对较小,灵敏度高,扩增效率高。在理想条件下,当模板浓度以10倍梯度稀释时,实时荧光PCR扩增结果的Ct值以3.3个循环数依次增加,4种试剂中最接近该数值的是Bi试剂,每个梯度之间的Ct值差趋近于3.3,稳定性最好。
2.2 实时荧光PCR结果对转基因检测影响的分析
综合以上数据结果可以看出,4种试剂对Gos9基因的扩增效果不尽相同,Pr试剂和Ta试剂无论在模板较高浓度还是较低浓度时,表现都不理想,Ct值相对较晚,而且在低浓度模板的情况下扩增曲线较差,无法作出很明确的判定;Bi和Ti试剂在高浓度和低浓度的情况下都表现得相对较好,Ct值相对较早,荧光值高,扩增效率稳定。相比之下,在模板浓度相对更低的情况下,Bi试剂的扩增效率更高,Ct值更早,不同浓度之间的Ct值差在3.3左右,扩增效率稳定,证明本次试验采用的试剂中Bi的结果最为理想。
Gos9基因是一个水稻根部的表达基因,在水稻、大米及其加工产品的转基因成分检测中运用最为普遍。内源基因是同一类产品中含量最高的基因,在转基因检测中作为内参照基因来对照判定实验结果的可靠性,特别是加工产品中的基因组DNA往往含量更低。内源基因和外源基因的含量都可能在加工过程中严重流失,影响检出率。因此,内源基因的稳定扩增是转基因成分检测的前提和关键,直接影响转基因成分的检测结果。从本实验的结果可以得出,Bi试剂最适用于大米转基因成分检测,特别是在样品中基因组DNA含量低的情况下。
3 讨论
目前针对转基因检测的方法有两大类,分别为核酸检测方法和蛋白质检测方法,但主要为针对基因片段的普通PCR和实时荧光PCR方法。常规PCR方法由于其开放式的操作模式,容易造成污染且污染难以消除,同时检测灵敏度低,因此最佳的检测方法当属实时荧光PCR方法。实时荧光PCR方法以其高效、快速、灵敏、特异性强等特点,在诸多检测领域中已被广泛应用[20-22]。
根据结合方式的不同,实时荧光PCR方法分为SYBR Green染料法实时荧光PCR和TaqMan探针法实时荧光PCR两种。植物产品中转基因检测对准确度和灵敏度有较高要求,要在样品基因组DNA含量很低的情况下更有效地检测到转基因成分,因此需要先控制好内源基因的检测结果,才能稳定有效地反映不同试剂的特性。本文利用植物产品中转基因成分检测常用的探针法实时荧光PCR,选择大米转基因检测中常用的Gos9内源基因,针对4种不同荧光试剂盒的扩增反应进行探索。Ct值是荧光PCR反应中对模板浓度的相对测量,因此模板浓度是影响Ct值的一个因素。除此之外,还有一些非模板依赖性的因素影响Ct值,反应液的pH值和盐离子浓度就是影响分子荧光发射的环境因素。由于本实验采用不同品牌的实时荧光PCR试剂,每种试剂的各个组分配比和浓度有所不同,因此扩增的效果不同。Bi试剂所用的是化学修饰酶,相比其他类型的热启动酶在反应初期酶活性释放较少,可能会使该试剂检测的起始Ct值略推后。但在扩增过程中随着温度的变化,酶的活性逐渐释放,使该试剂能够有效抑制低浓度模板扩增时的非特异性扩增,从而对低浓度模板的检测具有更高的灵敏度,Ct值较其他试剂更早。综合上述分析,从灵敏度、稳定性和重复性方面分析,Bi试剂比其他3种试剂在大米转基因成分检测方面具有更明显的优势。
4 结论
通过以上试验结果的综合评价可以得出,4种试剂中Bi的表现最好,因此可普遍运用于大米及其加工产品中转基因成分的检测。此外,在实际检测工作中发现,该试剂在其他植物及其加工产品的转基因成分检测方面也具有明显优势,特别是在植物产品可能受到转基因的污染,含有微量的转基因成分,或者诸如酱油、初榨油等深加工植物产品提取的DNA量相对较低,Bi试剂的检测效果最好。同时,Bi试剂可运用在植物成分鉴定、中药材真伪鉴定等分子生物学检测领域,在目前已进行的实际检测中取得了良好的使用效果。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为2.2%。】
表1 大米内源基因Gos9引物和探针
Table 1 Primers and probe of endogenous gene Gos9 in rice
Target gene | Sequences of primers and probe | Sequence size |
Gos9 | 5’-TTA GCC TCC CGC TGCAGA-3’ | 68bp |
5’-AGA GTC CAC AAG TGC TCC CG-3’ | ||
5’-FAM-CGG CAG TGT GGT TGG TTT CTT CGG-BHQ1-3’ |
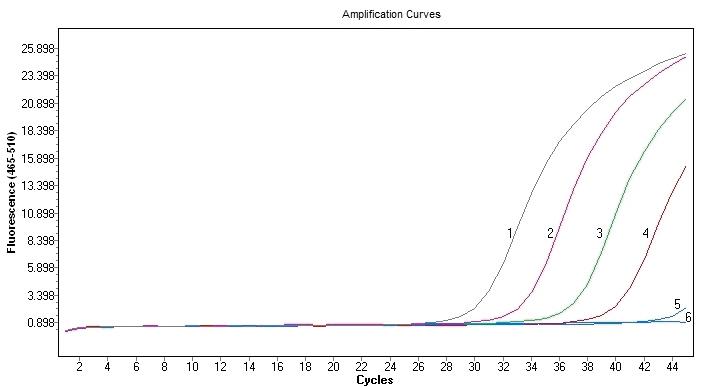
图1 Pr试剂盒对Gos9基因的实时荧光PCR检测结果
Fig. 1 Results of rt-PCR for detecting Gos9 gene with Pr kit
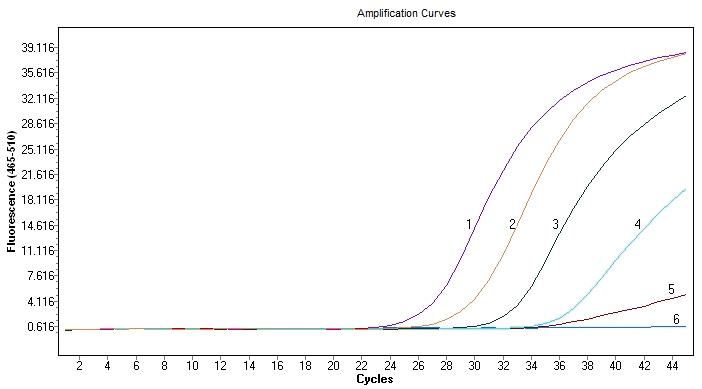
图2 Ti试剂盒对Gos9基因的实时荧光PCR检测结果
Fig. 2 Results of rt-PCR for detecting Gos9 gene with Ti kit

图3 Ta试剂盒对Gos9基因的实时荧光PCR检测结果
Fig. 3 Results of rt-PCR for detecting Gos9 gene with Ta kit
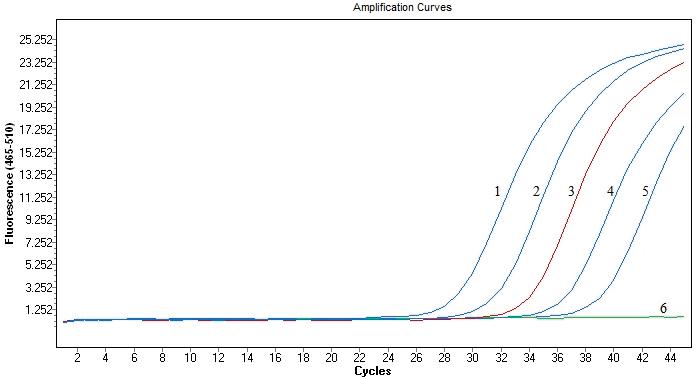
图4 Bi试剂盒对Gos9基因的实时荧光PCR检测结果
Fig. 4 Results of rt-PCR for detecting Gos9 gene with Bi kit
注:1-5分别为50 ng/μL、5 ng/μL、5×10-1 ng/μL、5×10-2 ng/μL和5×10-3 ng/μL浓度DNA模板的实时荧光PCR扩增曲线
6是阴性对照
表2 4种不同试剂对不同浓度的DNA模板扩增的Ct值
Table 2 Ct values of 4 kits for different DNA concentrations
模板浓度(ng/L) | Ct值(Ct value) | |||
Pr | Ta | Ti | Bi | |
50 | 27.76 | 27.35 | 23.36 | 25.27 |
5 | 30.70 | 29.27 | 25.61 | 28.57 |
5×10-1 | 33.55 | 31.35 | 29.68 | 31.51 |
5×10-2 | 37.44 | 33.83 | 33.93 | 32.94 |
5×10-3 | 42.26 | 37.85 | 36.25 | 35.45 |
参考文献
[1]国际农业生物技术应用服务组织.2018年全球生物技术/转基因作物商业化发展态势[J].中国生物工程杂志, 2019, 52(8): 7-12.
[2]张秀丰.五重PCR检测转基因大豆及其食用油脂的研究[D].保定:河北农业大学, 2017.
[3] Mayer R. Development and application of DNA analytical methods for the detection of GMOs in food [J]. Food Control, 1990, 10: 391-399.
[4] Swiss Food Ordinance. Eidgenossissche drucksachenund materialzentrale [S]. CH-3003 Bern, Switzerland,1995, R817, 02.
[5] Regulation E C.Official journal of the european communities [S].Brussels, Belgium,1998.No.L159/4: 4-7.
[6] Ministry of Agriculture and Forestry of Korea [S]. Ministry of agriculture and forestry of Korea notification, 2000, No.2000-31.
[7] Food and Marketing Bureau Ministry of Agriculture [S].Forestry and fisheries of Japan notification, 2000, No.1775.
[8] 2002年农业部令第10号,2017年第8号修订.农业转基因生物标识管理办法[S].北京, 2017.
[9] Lüthy, Jürg. Detection strategies for food authenticity and genetically modified foods[J].Food Control, 1999, 10(6): 359-361.
[10] Li F W, Li C C, Dong L M. Establishment of event-specific qualitative PCR method for genetically modified soybean MON89788 [J]. Agricultural Science Technology, 2010, 11(3): 82-86.
[11]覃文,董洁,邓鸿玲,高东微. PCR法定性检测食用油脂中转基因成分[J].中国油脂, 2002, 27(2): 4-6.
[12]蒋利平,翁绿水,肖国樱.转基因水稻A2B68时间特异性坚持方法的建立 [J].杂交水稻, 2013, 28(5): 60-67.
[13]李小飞,谭小力,李俊,武玉花,曹应龙.转基因水稻检测用阳性质粒分子的构建应用 [J].生物技术通报, 2013, 7: 71-77.
[14]于彩虹,田少亭,路兴波,李凡,杨淑珂,孙红炜.转植酸酶基因(phyA2)玉米定性/定量PCR检测[J].农业生物技术学报, 2004, 20(4): 365-361.
[15]于中娜,苗向阳,单虎,李建霞,丁兆中.转基因豆粕中内源基因和外源基因检测方法的建立[J].黑龙江畜牧兽医, 2008, 2: 50-52.
[16] Kenneth J, Livak, Susan J A, Flood, et al. Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization [M].Cold Spring Harbor Laboratory Press, 2015, 4: 357-362.
[17]陈颖, 徐宝梁,苏宁,葛毅强,王曙光.实时荧光定量PCR技术在转基因玉米检测中的应用研究[J].作物学报, 2004, 30(6): 602-607.
[18]赵卫东,郑文杰,贺艳.荧光PCR方法定性和定量检测BT63转基因大米[J].食品研究与开发, 2009, 30(3): 133-135.
[19] Dietrich M, Christine D, Lutz G. Detection of genetically modified rice: a construct-specific real-time PCR method based on DNA sequences from transgenic Bt rice[J].European Food Research and Technology, 2006, 224: 271-288.
[20] HECHT M,OEHEN B, CHULZE J,BRODMANN P, BAGUTTI C. Detection of feral GT73 transgenic oilseed rape (Brassica napus) along railway lines on entry routes to oilseed factories in Switzerland [J].Environment Science Pollut Reserach, 2014, 21: 1455-1465.
[21] KAMLE S, ALI S. Genetically modifified crops: Detection strategies and biosafety issues[J].Gene, 2013, 522: 123-132.
[22]王颢潜,陈锐,李夏莹,王梦雨,刘鹏程.转基因产品成分检测技术研究进[J].生物技术通报, 2018, (34)3: 31-38.
(文章类别:CPST-B)







