CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
气质联用法同时测定干紫菜中扑草净和4种多环芳烃
作者:范广宇1 孟祥龙1 王 恒1 张云青1 唐 秀1 段宏安1
范广宇1 孟祥龙1 王 恒1 张云青1 唐 秀1 段宏安1
摘 要 本文建立了一种分散固相萃取法提取净化、气相色谱-质谱联用法(GC-MS)同时测定干紫菜中扑草净和4种多环芳烃的方法。样品粉碎均匀后加入去离子水,用分散固相萃取方法净化,Agilent HP-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm)分离,气相色谱-质谱联用法检测,外标法定量。5种物质在2 ng/mL~100 ng/mL范围内线性良好(r2>0.999),在5 μg/kg、10 μg/kg、50 μg/kg 3个添加水平下平均回收率在72%~106%之间,相对标准偏差(n=6)在1.4%~11.3%之间。用该方法检测紫菜样品,结果表明可以应用于干紫菜中扑草净和4种多环芳烃同时测定。
关键词 干紫菜;扑草净;多环芳烃;气相色谱-质谱联用仪
Determination of Prometryn and 4 Polycyclic Aromatic Hydrocarbons in Dry Prophyra by Gas Chromatography-Mass Spectrometry
FAN Guang-Yu1 MENG Xiang-Long1 WANG Heng1 ZHANG Yun-Qing1
TANG Xiu1 DUAN Hong-An1
Abstract This paper established a method for the determination of prometryn and 4 polycyclic aromatic hydrocarbons (PAH4) in dry prophyra with dispersive solid phase extraction (DSPE) and gas chromatography mass spectrometry (GC-MS). After added deionized water, the samples were extracted and cleaned up with DSPE method, and then determined by GC-MS. The quantification of 5 compounds was performed with external standard method. The calibration curves showed good linearity in the range of 2-100 ng/mL (r2>0.999). The mean recoveries were in a range of 72%-106% when spiked 5 μg/kg, 10 μg/kg, 50 μg/kg, and relative standard deviations(n=6) were 1.4%-11.3%. The method was suitable for the determination of prometryn and PAH4 in dry prophyra.
Keywords dry prophyra; prometryn; polycyclic aromatic hydrocarbons; gas chromatography mass spectrometry
紫菜是我国出口创汇的主要海产品之一,尤其是条斑紫菜约占国际市场贸易总量的一半以上。近年来,条斑紫菜养殖产业快速发展,养殖规模不断扩大,但在出口中也遇到技术性贸易措施的影响,如农药残留和污染物残留等[1- 2]。据统计, 2014年以来,欧盟因我国出口紫菜中扑草净检出通报2次 [3]。扑草净是一种被广泛使用的除草剂,也被用于养殖水体中的水草及有害藻类的清除。因扑草净化学性质稳定,能够长期存在于环境中,并随降水和地表水径流等过程造成环境污染,进一步进入食物链,影响人类身体健康[4]。
多环芳烃(PAHs)是化学致癌物中最大的一类,其中,苯并[a]芘(BaP)被国际癌症研究机构归为第一类致癌物。PAHs常以混合物的形式出现,对于PAHs的检测通常选取BaP作为代表物。2008年,欧洲食品安全局根据数据分析认为仅用BaP作为PAHs代表物不合适。随后,欧盟于2011年8月发布法规Regulation 835/2011,规定采用4种PAHs的总量(即PAH4,包括苯并[a]蒽、䓛、苯并[b]荧蒽和苯并[a]芘)来衡量PAHs的存在水平,并对部分食品规定了相应的限量标准[5-6]。欧盟的法规要求高、更新快,对我国食品出口造成一定影响,因此,建立相应的检测方法可以给我国相关产品进出口提供有力的技术保障。
目前,对紫菜中的扑草净和多环芳烃测定主要采用的前处理方法有固相萃取、液液萃取等[7-9],紫菜中多环芳烃检测文献报道较少[10-11]。分散固相萃取法(Dispersive solid phase extraction,DSPE)将提取和净化步骤一次完成,具有操作简单、成本低廉、有机试剂用量少和不需要特殊设备等优点,在食品检测领域已经有了较多研究。本研究拟建立一种分散固相萃取法结合气质联用仪同时测定干紫菜中的扑草净和4种多环芳烃的方法。
1 实验部分
1.1 仪器与试剂
7890A-5975C气相色谱-质谱联用仪配备电子轰击电离源(EI源),HP-5 MS毛细管色谱柱(30 m×0.25 mm×0.25 μm)(美国Agilent公司);XS 204分析天平(瑞士Mettler公司);A10 Milli-Q超纯水机(美国Millipore公司);N-EVAP TM氮气吹干仪(美国Organomation Associates公司);TDL-40B 低速离心机(上海安亭科学仪器厂);XW-80A 旋涡混合器(上海青浦沪西仪器厂)。
100 mg/L扑草净和200 mg/L 多环芳烃混合标准溶液(上海安谱公司),使用时用正己烷稀释至所需质量浓度;正己烷、乙腈、丙酮(色谱纯,Merck公司);无水硫酸镁、氯化钠(分析纯,上海国药集团公司);N-丙基乙二胺(PSA,美国Agilent公司)。
1.2 仪器工作条件
1.2.1 气相色谱条件
HP-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm);进样口温度280℃;载气为高纯氦气,流速为1.0 mL/min;进样量1 μL,不分流进样;柱升温程序:初始温度60℃,保持1 min,再以20℃/min升至230℃,然后以5℃/min升至290℃,保持2 min。
1.2.2 质谱条件
EI电离源,电离能70 eV;离子源温度230℃;四极杆温度150℃;传输线温度280℃;溶剂延迟时间:5 min;扫描方式:选择离子监测模式(SIM)。各化合物扫描离子和定量离子详见表1。
表1 扑草净和4种PAHs的保留时间、扫描离子
Table 1 Retention times and scanning ions of prometryn and 4 PAHs
序号 | 化合物 | (min) | (m/z) |
1 | 扑草净 | 10.25 | 241*,184,226,199 |
2 | 苯并[a]蒽 | 14.74 | 228*,226,229 |
3 | 䓛 | 14.84 | 228*,226,229 |
4 | 苯并[b]荧蒽 | 18.08 | 252*,253,12 |
5 | 苯并[a]芘 | 19.12 | 252*,253,125 |
注:*为定量离子
1.3 前处理方法
干紫菜粉碎均匀后,称取2 g样品于50 mL离心管,加入去离子水4 mL,静置30 min。随后,加入10 mL正己烷,再加入4 g无水硫酸镁、1 g氯化钠,漩涡混匀1 min,3500 r/min离心5 min,取5 mL上清液转移至试管中,氮气流下浓缩至干。最后,用1.0 mL正己烷溶解残渣,加入100 mg PSA,旋涡混匀1 min, 3500 r/min离心5 min,上清液过0.22 μm滤膜,在GC-MS上测定。
2 结果与讨论
2.1 仪器条件选择
首先用混合标准溶液做质谱全扫描,根据扑草净和4种多环芳烃的保留时间和分离度确定气相色谱工作条件,然后根据各化合物的离子丰度和干扰情况选择定量离子和辅助定性离子等质谱工作条件,最终选择的仪器条件见1. 2。在该仪器条件下,目标物的保留时间见表1。
2.2 前处理方法选择
食品样品中的扑草净和多环芳烃检测前处理主要采用液液萃取法和固相萃取法,分散固相萃取法具有有机溶剂用量小、操作简单快速、不需要特殊设备等优点,在食品中农兽药残留等检测中已经广泛应用。经初步试验,分散固相萃取法处理干紫菜中扑草净和4种多环芳烃时回收率符合理化检验要求,因而选择分散固相萃取法做进一步实验。
2.3 加水量的影响
因干紫菜中含水量较少,加水浸泡能够更好地提取待测物质。本试验考察了加水量对提取效果的影响,不同加水量提取出的目标化合物的量对比见图1。由图可知,在不加水时扑草净及PAH4的提取量明显小于加水后的,4种多环芳烃不加水直接提取时测定值均小于检出限。随加水量增加提取出的扑草净及PAH4的量也在增加,扑草净的提取量受加水量影响最小,苯并[b]荧蒽的提取量受加水量影响最大。加水量为4 mL时提取量与6 mL时相当,考虑后续除水步骤,选择加水4 mL。
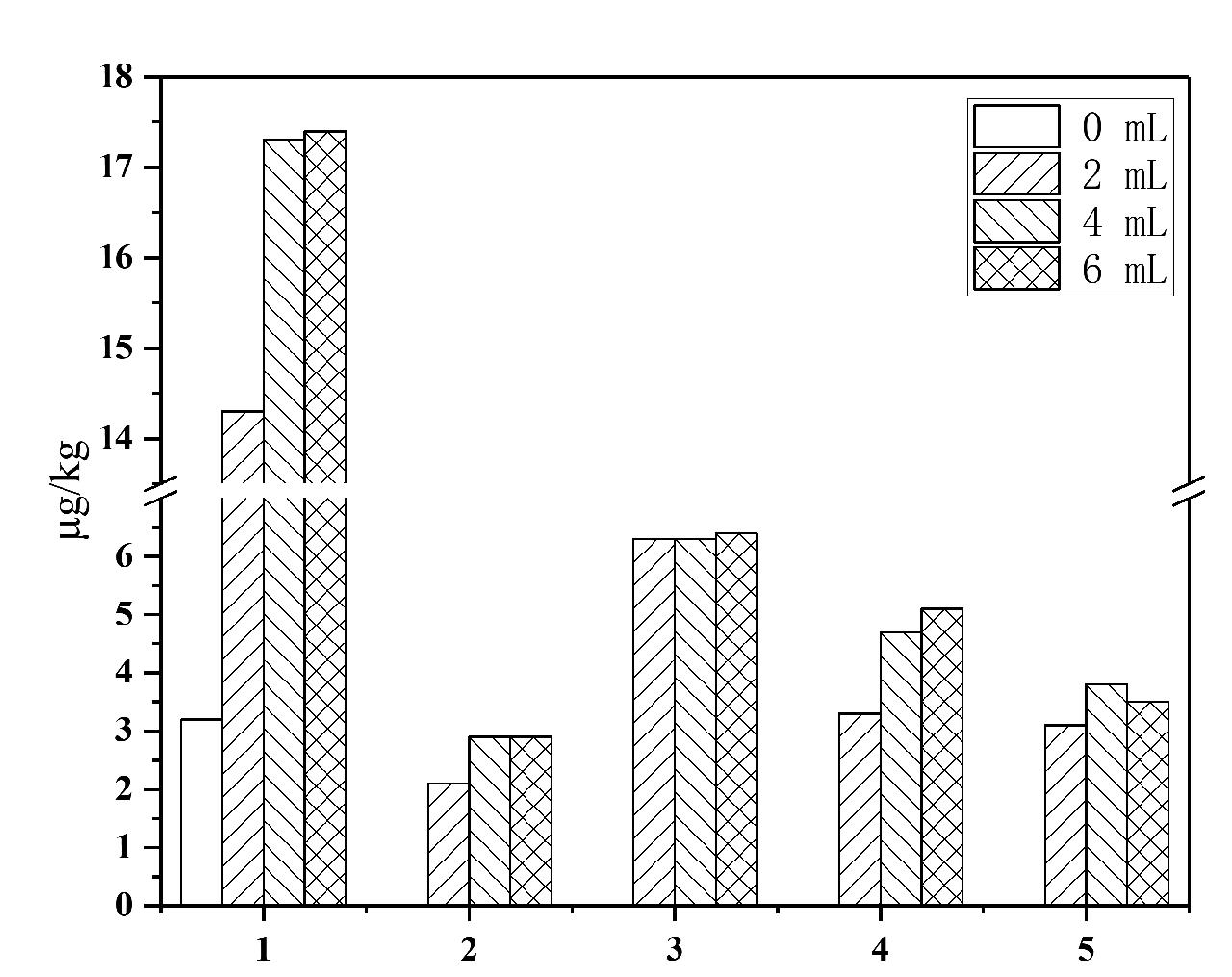
图1 加水量对提取的影响
Fig.1 Effect of amount of water on extraction
注:图中化合物序号与表1中对应
2.4 前处理条件的选择
考虑到扑草净和4种多环芳烃结构差异,本试验考察了同时提取测定所需的溶剂。选择乙腈、正己烷、丙酮和丙酮-正己烷(1+1)混合溶剂等几种溶剂分别试验,结果表明:采用乙腈、丙酮和丙酮-正己烷(1+1)混合溶剂提取时,提取液颜色为亮绿色,正己烷作为溶剂提取时提取液颜色更浅,可能是由于正己烷提取出的色素等杂质较少,因而更容易净化,且正己烷提取时5种物质的回收率在80%~110%之间,因此选择正己烷作为提取溶剂。
参考之前的研究[10],本试验考察了基质分散固相萃取净化剂PSA的用量,分别添加0 mg、50 mg、100 mg、150 mg、200 mg的 PSA,结果显示随PSA用量的增多,与未添加PSA时的谱图和标准溶液的图谱相比,主要干扰峰在逐渐变小,在使用量大于150 mg以后,干扰峰变化不大,因此PSA添加量定为100 mg。
2.5 标准曲线和检出限
将混合标准溶液分别配制成2 ng/mL、5 ng/mL、10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL的系列标准溶液,用气相色谱-质谱联用仪测定。以化合物的质量浓度(x, ng/mL)为横坐标、峰面积(y)为纵坐标绘制标准曲线。5种化合物的线性范围均为2 ng/mL~100 ng/mL,其线性回归方程及相关系数见表2。
向干紫菜样品中添加不同浓度的扑草净和4种PAHs标准溶液,以10倍信噪比计算方法的定量限,结果见表2。
表2 标准曲线方程、相关系数和定量限
Table 2 Linear equations, correlation coefficients and limits of quantitation
化合物 | 标准曲线 | 相关系数r2 | 定量限(μg/kg) |
扑草净 | y = 167x - 56 | 0.9994 | 5 |
苯并[a]蒽 | y = 279x - 267 | 0.9993 | 4 |
䓛 | y = 357x - 433 | 0.9995 | 4 |
苯并[b]荧蒽 | y = 312x - 361 | 0.9992 | 5 |
苯并[a]芘 | y = 298x - 248 | 0.9998 | 3 |
2.6 回收率和精密度
向干紫菜样品中分别添加5 μg/kg、10 μg/kg、50 μg/kg的5种物质标准溶液,每个加标浓度平行测定6次,采用选择的实验方法进行测定,回收率和相对标准偏差见表3。5种物质的平均回收率在72%~106%之间,相对标准偏差(n=6)在1.4%~11.3%之间,满足食品理化检测的要求。
表3 扑草净和4种PAHs的加标回收率及相对标准偏差(n=6)
Table 3 Recoveries and relative standard deviations of prometryn and 4 PAHs(n=6)
化合物 | 添加5 μg/kg | 添加10 μg/kg | 添加50 μg/kg | |||
(%) | (%) | (%) | (%) | (%) | (%) | |
扑草净 | 95 | 7.0 | 101 | 7.3 | 98 | 1.4 |
苯并[a]蒽 | 72 | 11.3 | 82 | 3.9 | 89 | 3.0 |
䓛 | 82 | 6.2 | 94 | 4.0 | 91 | 2.1 |
苯并[b]荧蒽 | 106 | 10.3 | 105 | 2.5 | 83 | 3.3 |
苯并[a]芘 | 105 | 3.1 | 100 | 1.6 | 86 | 1.4 |
2.7 实际样品的测定
本试验选取了8批次干紫菜样品,在选定的实验条件下测定,结果在8批样品均检出扑草净,含量在15 μg/kg~39 μg/kg之间;2批次检出苯并[b]荧蒽,分别是15 μg/kg和16 μg/kg。结果说明,在干紫菜样品中存在扑草净和4种多环芳烃残留风险,需要予以关注。
3 结论
本文建立了同时测定干紫菜中扑草净和4种多环芳烃的方法,采用分散固相萃取方法提取净化、气相色谱-质谱联用法测定。通过在干紫菜样品中加入去离子水后提取,提高了提取效率,同时使用分散固相萃取法净化能够去除样品中的主要干扰物。该方法简单、快速、有机试剂用量小、无需特殊设备,可同时测定干紫菜中的扑草净和4种多环芳烃,能应用于进出口紫菜质量控制和风险监测。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为9.1%】
第一作者:范广宇(1986-),男,汉族,河南封丘人,硕士,工程师,主要从事食品农产品检测和研究工作,E-mail:gyfan@foxmail.com
1.连云港海关 连云港 222042
1. Lianyungang Customs, Lianyungang 222042
参考文献
[1]朱文嘉,王联珠,郭莹莹,等.我国紫菜产业现状及质量控制[J].食品安全质量检测学报, 2018, 9(13), 3353-3358.
[2]于宁,戴卫平,高永刚,等.中国紫菜国际贸易现状及主要问题研究[J].中国渔业经济, 2018, 36(5), 39-45.
[3]王志聪,刘桃英,胡月珍,等.江苏出口条斑紫菜产业质量状况研究[J].安徽农业科学, 2018, 46(11), 207-209.
[4]唐秀,范广宇,张云青,等.固相萃取-气质联用法测定水产品中扑草净[J].食品研究与开发, 2016, 37(19), 142-144.
[5] Wenzl T.,Simon R.,Anklam E.,et al.Analytical methods for polycyclic aromatic hydrocarbons (PAHs) in food and the environment needed for new food legislation in the European Union [J].Trends in Analytical Chemistry, 2006, 25(7), 716-725.
[6] Purcaro G.,Moret S.,Conte L.S.Overview on polycyclic aromatic hydrocarbons:occurrence, legislation and innovative determination in foods[J].Talanta, 2013, 105(4), 292-305.
[7]周青,林洪,付晓婷,等.固相萃取-气相色谱-串联质谱法测定紫菜中扑草净的残留量[J].食品安全质量检测学报, 2018, 9(8), 1823-1828.
[8]倪鹏,施锦辉,张文国,等.气相色谱-质谱法测定出口紫菜中扑草净的残留量[J].理化检验-(化学分册), 2014, 50(9), 1160-1162.
[9]朱晓华,王凯,张燚,等.固相萃取-气相色谱串联质谱法测定水产品中扑草净的残留[J].上海海洋大学学报, 2015, 24(6), 960-967.
[10]范广宇,吴琎,孟祥龙,等.分散固相萃取-气相色谱-质谱法测定干紫菜中16种多环芳烃 [J]. 理化检验(化学分册), 2018, 54(10), 1182-1187.
[11]王娟,杜鹃,李梦滢,等.紫菜中有机氯农药和多环芳烃的气相色谱-质谱联用测定法[J].环境与健康杂志, 2009, 26(5), 448-450.
(文章类别:CPST-A)







