CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
三种猪腹泻相关病原微芯片检测方法研究及初步应用
作者:高志强1 汪 琳1* 蒲 静1 赵相鹏1 尹 羿1 任 彤1 张 伟1 刘凤华2
高志强1 汪 琳1* 蒲 静1 赵相鹏1 尹 羿1 任 彤1 张 伟1 刘凤华2
摘 要 为同时快速筛查猪传染性胃肠炎病毒(Transmissible gastroenteritis virus, TGEV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)以及猪圆环病毒2型(Porcine circovirus type 2, PCV2)3种可致猪腹泻的猪病病原,本研究基于微芯片技术,针对3种病毒特异性基因分别建立微量实时荧光(RT-)PCR检测体系,并将其组合在微芯片上。结果显示,该方法可特异性检出以上3种病毒核酸,但不能检出本实验室保存的其他5种猪病病毒核酸,而且相互之间无交叉反应;灵敏度试验显示TGEV和PEDV检测灵敏度均可达到1TCID50/0.1 mL,对于含PCV2全基因组质粒,检测极限为41 fg/μL。对237份送检样品的检测结果显示,PEDV和PCV2检出率分别为0.8%和7.2%,但未检出TGEV,与常规管式荧光(RT-)PCR检测结果一致。该项技术可大大降低筛查的试剂成本,因为每个反应池只需要1.2 μL的(RT-)PCR试剂混合物,而且比传统的实时(RT-)PCR系统的热平衡和热均匀性更快。本研究表明该技术可用于猪相关疫病的快速检测和筛查。
关键词 猪腹泻相关病毒;微芯片;荧光(RT-)PCR
A Study on and Preliminary Application of Microchip Detection Method for Three Kinds of Swine Diarrhea Related Pathogens
GAO Zhi-Qiang1 WANG Lin1* PU Jing1 ZHAO Xiang-Peng1
YIN Yi1 REN Tong1 ZHANG Wei1 LIU Feng-Hua2
Abstract In order to quickly and simultaneously detect 3 kinds of porcine pathogens including transmissible gastroenteritis virus (TGEV), porcine epidemic diarrhea virus (PEDV), and porcine circovirus type 2 (PCV2) that can cause porcine diarrhea, based on real-time (RT-) PCR technology, a microchip real-time (RT-) PCR detection system targeting three virus-specific genes was established. The results showed that the method could specifically detect the 3 kinds of viral nucleic acids above, but could not detect the other 5 kinds of virus nucleic acids stored in our laboratory with no cross reaction among them. Sensitivity test showed that the detection limits were about 1TCID50/0.1mL for TGEV and PEDV, but 41 fg/μL for plasmid containing complete PCV2 genome. A total of 237 delivered samples were detected by the developed methods, and positive rates of PEDV and PCV2 were 0.8% and 7.2% respectively, while all the results for TGEV were negative, which was consistent with the results of traditional real-time (RT-)PCR. This technology can greatly reduce the cost of screening reagents since only 1.2 μl of PCR reagent mixture is needed for each reaction pool, and compared with the traditional real-time PCR system, it allows faster thermal equilibrium and thermal uniformity. This study shows that this technology can be used for rapid detection and screening of swine-diarrhea-related diseases.
Keywords Keywords swine-diarrhea-related pathogens; microchip; real-time (RT-)PCR
基金项目:国家重点研发计划2017YFF0305,北京市科技计划课题(Z171100001317011)
通讯作者:汪琳(1974&—),女,汉族,湖北随州人,博士,研究员,研究方向为动物检疫,E-mail:15301090661@189.cn
1.北京海关技术中心 北京 100026
2.北京农学院 北京 102206
1. Beijing Customs Testing Center, Beijing 101113
2. Beijing College of Agriculture, Beijing 102206
中国口岸科学技术
自2010年以来,我国猪病毒性腹泻类疫病疫情较为严重,给养猪业造成重大威胁。猪传染性胃肠炎病毒(Transmissible gastroenteritis virus, TGEV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus)以及猪圆环病毒2型(Porcine circovirus type 2, PCV2)3种猪病病毒均与猪的腹泻病相关,而且3种病原是我国进出境动物检疫中较为关注的猪病病原。TGEV 为冠状病毒科成员,可引起猪的传染性胃肠炎,该病原目前呈全球分布(大洋洲除外),以散发为主,症状多为腹泻和呕吐,新生猪感染死亡率较高[1]。PEDV以猪的肠炎、呕吐、水样腹泻等消化道症状为特征,为高度接触性传染病,病原也属于冠状病毒科[2]。PCV2为圆环病毒科成员,该病原可引起猪的多种病症,包括断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)等,表现多为腹泻、消瘦以及死亡率升高[3]。
快速及时检测出样品中TGEV、PEDV及PCV2,从而进行提早干预,对于预防和控制猪腹泻病具有重要意义。目前,检测上述3种病的传统方法包括病毒分离、ELISA以及核酸扩增检测方法等。由于核酸扩增类检测方法快速、灵敏、特异,可以检出微量的病毒核酸,已逐渐成为送检样品中猪病病原快速检测的首选方法,其中(RT-)PCR和荧光定量(RT-)PCR方法应用最为广泛。基于荧光(RT-)PCR的微芯片技术,可将反应体系缩小至1.2 μL。与传统的实时RT-PCR方法比较具有一些明显优势,特别是在同时检测多种病原的情形下,为获得满意效果,往往每种反应体系都需要分别在独立的反应管(孔)中进行反应,微芯片检测体系可大大减少试剂和核酸样本的消耗。微芯片实时PCR检测技术升降温速度更快,可在18 min内完成45个循环扩增。与传统塑料反应板(管)相比,由铝(强热导体)制成的微反应板,温度分布更为均匀,因此其检测的精确性更好[4]。
由于这些特点,与现有技术相比,该技术具有高度的敏感性和特异性,甚至可以检测出微反应板中单拷贝的目标核酸。本研究基于微芯片荧光(RT-)PCR的微芯片技术,建立了同时检测TGEV、PEDV及PCV2的快速检测方法,经灵敏度特异性评价,取得满意效果。
1 实验材料与方法
1.1 实验材料
1.1.1 病毒核酸及被检样品
猪流行性腹泻病毒PEDV核酸、猪瘟病毒HCLV核酸、伪狂犬病毒PRV核酸和猪繁殖与呼吸综合征病毒MLV RespPRRS/Repro核酸、猪传染性胃肠炎病毒Purdue115核酸、猪链球菌2型C55606均为本实验室保存。被检样品包括200份本实验室保存的法国进口猪粪拭子和37份由北京顺义区动物卫生监督所送检病死猪采集的脏器样品。
1.1.2 主要试剂
TIANamp病毒基因组DNA/RNA提取试剂盒(DP315),购自天根生化科技有限公司;M-MLV反转录酶以及RNA酶抑制剂,购自Promega公司; Ex HS Taq DNA聚合酶、dNTP等购自TaKaRa公司。
1.1.3 主要设备
微芯片荧光PCR检测仪及6×5微芯片,LUMEX产品;QuantStudio 5荧光PCR仪,为Thermofisher公司产品。
1.2 实验方法
根据每种病毒特异基因序列设计合成引物探针,建立荧光PCR检测方法,进一步在微芯片上集成,验证微芯片检测方法的性能参数,再用于临床样品检测。
1.2.1 引物的设计合成
选取GenBank中3种病毒基因信息,选取TGEV S基因、PEDV M基因及PCV2 ORF2基因作为检测目的基因。经多重序列比对,使用Oligo 7.0软件设计筛选引物和探针。探针5'均标记FAM报告荧光基团,3'标记BHQ1淬灭基团(序列见表1)。引物和探针均由上海生工生物技术公司合成。
1.2.2 微芯片上样检测
采用1.2 μL 体系(包括试剂和模板),将混合的各种反应体系分别加入6×5的微芯片的槽中,反应板上覆盖620 μL硅油,以防止反应中的液体蒸发。
1.2.3 灵敏度试验
分别对0.1~104TCID50/0.1 mL TGEV Purdue115病毒液提取的核酸、0.1~104TCID50/0.1 mL PEDV病毒液提取的核酸及10-1~10-6稀释的含有PCV2全基因组的标准质粒(0.41 ng/μL)进行检测,每个稀释度设定2个平行,确定方法对每种病毒核酸检测的分析敏感性。
1.2.4 特异性试验
应用建立的反应体系对猪瘟病毒HCLV核酸、伪狂犬病毒PRV核酸、猪繁殖与呼吸综合征病毒MLV RespPRRS/Repro核酸、猪细小病毒PPV核酸、猪链球菌2型C55606核酸进行检测,以验证方法的特异性。
1.2.5 送检样品的检测
应用建立的方法对200份本实验室保存的法国进口猪粪拭子和37份由北京顺义区动物卫生监督所送检病死猪采集的脏器样品进行了检测,同时与常规的荧光RT-PCR检测方法进行了比较[5~7]。
2 实验结果
2.1 反应体系优化结果
经多次重复试验确立最终反应体系,如表2所示。
表1 微芯片荧光RT-PCR检测引物探针序列
Table 1 The primer probe sequence of the fluorescence RT-PCR detection microarray
病毒名称 | 引物序列 (5′-3′ ) | 探针序列 (5′-3′ ) |
TGEV | TCTGCTGAAGGTGCTATTAT | FAM-CACTCACTACCCCAATTGCAAGTC-BHQ1 |
GAAGGACATATAGGGAACTTAT | ||
PEDV | TGGCGCAGGACACATTCTTG | FAM-CTTTCAATCCTGAAACWGACGCGCTTC-BHQ1 |
TGTCGGCCCATCACAGAAGTA | ||
PCV2 | TCATGTCYACCGCCCARGAG | FAM-TTC AAY RCC CGC CTC TCC CGC WCC-BHQ1 |
CACCGYTACCGYTGGAGAAGGA |
表2 3种微芯片荧光(RT-)PCR反应条件优化结果
Table 2 The optimized conditions of fluorescent RT- PCR with microchip for 3 viruses
组分 | 终浓度 | ||
TGEV | PEDV | PCV2 | |
5×RT Buffer或10×PCR Buffer | 1×RT Buffer | 1×RT Buffer | 1×PCR Buffer |
25 mmol/L MgCl2 | 0 | 0 | 3.0 mmol/L |
2.5 mmol/L dNTP | 0.1 mmol/L | 0.05 mmol/L | 0.2 mmol/L |
10 μmol/L 上游引物 | 0.3 μmol/L | 0.3 μmol/L | 0.2 μmol/L |
10 μmol/L 下游引物 | 0.3 μmol/L | 0.3 μmol/L | 0.2 μmol/L |
10 μmol/L 探针 | 0.16 μmol/L | 0.15 μmol/L | 0.1 μmol/L |
200 U/μL M-MLV反转录酶 | 4 U/μL | 4 U/μL | 0 |
40 U/μL RNA酶抑制剂 | 0.4 U/μL | 0.4 U/μL | 0 |
5 U/μL HS Taq酶 | 0.01 U/μL | 0.01 U/μL | 0.01 U/μL |
核酸模板 | 0.24 μL | 0.24 μL | 0.24 μL |
总体积 | 1.2 μL | 1.2μL | 1.2μL |
表2(续)
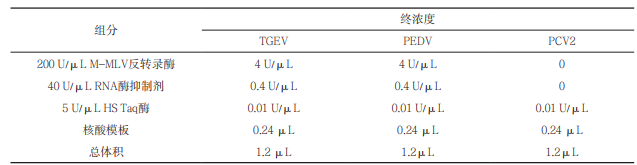
优化后的反应参数为42℃ 25 min,94℃ 2 min,94℃ 5 s,55℃ 5 s,60℃ 25 s并收集荧光,45个循环。
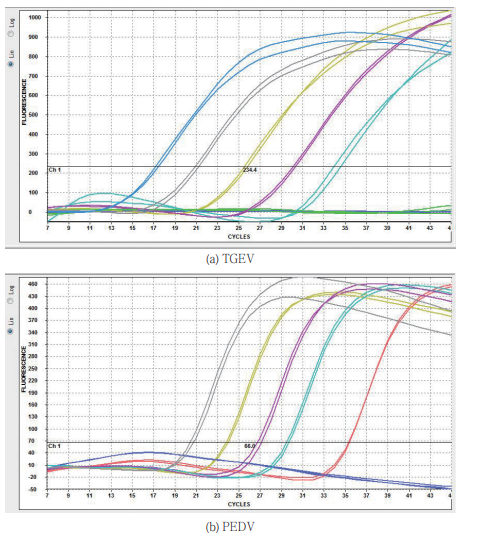
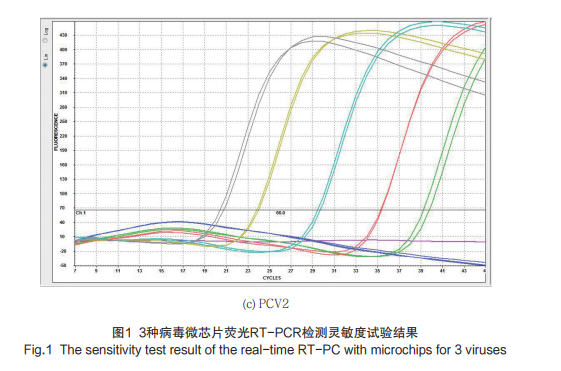
2.2 灵敏度试验结果
对0.1~104TCID50/0.1 mL TGEV Purdue115及PEDV病毒液提取的核酸进行检测,可检出1个TCID50提取的病毒RNA;对于10-1~10-6稀释的含有PCV2全基因组的标准质粒(0.41 ng/μL)进行检测,可检出41 fg/μL的PCV2质粒DNA。如图1(a)~(c)所示。
2.3 特异性试验结果
应用建立的微芯片检测反应体系对猪瘟病毒HCLV核酸、伪狂犬病毒核酸、猪繁殖与呼吸综合征病毒MLV RespPRRS/Repro核酸、猪细小病毒核酸、猪链球菌2型C55606核酸进行检测,结果显示建立的检测方法与上述病原核酸无交叉反应,如图2所示。
2.4 对送检样品的检测结果
分别使用建立起来的3种病毒微芯片荧光RT-PCR方法对200份粪拭子和37份病死猪的脏器样品进行检测,并与常规的管式荧光RT-PCR检测方法结果进行比较,结果如表3所示。 可以看出对于237份样品,两种方法的检出情况完全一致,均未检出TGEV阳性样品,但PEDV和PCV2均有检出,检出率分别为0.8%和7.2%。
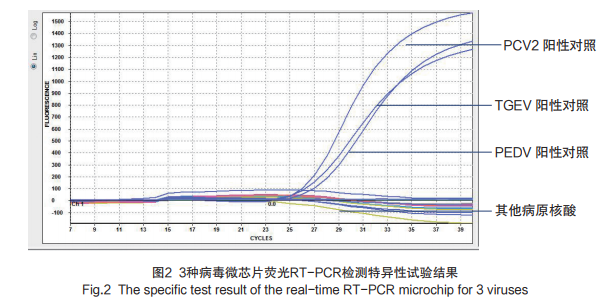
表3 送检样品的微芯片与常规荧光RT-PCR检测结果
Table 3 The comparative test results of clinic samples by the microchip and ordinary fluorescent RT-PCR
样品来源 | 样品数 | 微芯片荧光(RT-)PCR | 标准的常规荧光(RT-)PCR | ||||
TGEV | PEDV | PCV2 | TGEV | PEDV | PCV2 | ||
猪粪拭子 | 200 | 0 | 0 | 0 | 0 | 0 | 0 |
猪肺脏 | 5 | 0 | 0 | 3 | 0 | 0 | 3 |
猪肝脏 | 5 | 0 | 0 | 3 | 0 | 0 | 3 |
猪心脏 | 5 | 0 | 0 | 0 | 0 | 0 | 0 |
猪肾脏 | 5 | 0 | 0 | 4 | 0 | 0 | 4 |
猪淋巴结 | 5 | 0 | 0 | 2 | 0 | 0 | 2 |
猪脾脏 | 5 | 0 | 0 | 3 | 0 | 0 | 3 |
猪肠组织 | 7 | 0 | 2 | 2 | 0 | 2 | 2 |
总计 | 237 | 0 | 2 | 17 | 0 | 2 | 17 |
检出率 | 0 | 0.8% | 7.2% | 0 | 0.8% | 7.2% | |
3 讨论
国内外猪腹泻相关类疫病病原引发疫情时有发生,给养殖企业造成持续性损失。其中,TGEV和PEDV常造成新生仔猪大量死亡,因此养殖企业对其检测防控十分重视。PCV2作为一种免疫抑制病,在国内外感染率和检出率相当高,该病可与PEDV混合感染,加重仔猪腹泻,而且由于其免疫抑制作用,还可影响疫苗免疫效果。因此,该研究选择TGEV、PEDV和PCV2作为研究对象,建立了微芯片快速荧光RT-PCR检测方法。
由于TGEV存在同源性很高的自然缺失变异株猪呼吸道管状病毒(PRCV),该毒株S基因缺失B、C抗原位点, PRCV为呼吸道病原,致病性不强,为避免干扰,准确检测TGEV,因此该研究中使用了在以前研究中针对TGEV S基因设计的引物、探针[5,8]。
微芯片荧光PCR技术与常规荧光PCR技术相比,其主要优势是体系小,总体系仅为1.2 μL,仅需要极少量的核酸样本就可以开展检测。检测体系的微小可大大减少试剂和核酸样本的消耗,而且微芯片为金属直接导热,升降温速度更快,可在短时间内完成循环扩增。该技术还可将检测体系冻干于微芯片上,检测时只需加入微量核酸样本即可,有助于最大限度减少人为错误。而且,冻干芯片在常温下稳定性好,在转运时甚至不需要冷链[4]。
本研究采用6×5微芯片,将3种检测反应体系分别加入微芯片独立槽中,建立了针对TGEV、PEDV和PCV2的微芯片实时荧光RT-PCR检测方法,每次可同时对8个样品进行以上3种病的快速检测。在灵敏度试验中,对于TGEV和PEDV分别使用PK15和Vero细胞培养,测定其毒价,然后系列稀释,确定微芯片检测方法检测灵敏度可达1个TCID50;对于PCV2,由于其在细胞上不产生细胞病变(CPE),难以测定其毒价,因此使用了前期构建的含有PCV2全基因组的质粒进行测定,结果显示微芯片可检出41 fg/μL质粒DNA。在对送检的237份样品的检测中,共检出17例PCV2核酸阳性和2例PEDV核酸阳性,与常规标准的荧光RT-PCR检测方法检测结果一致,表明利用本研究建立的 3种猪腹泻相关病原实时荧光(T-PCR)微芯片检测方法,可实现对微量样品中TGEV、PEDV和PCV2进行快速核酸检测,具有临床实用意义。
4 结论
本研究针对3种猪腹泻相关病原(TGEV、PEDV和PCV2)建立了微芯片实时荧光(RT-)PCR检测技术。建立的方法不仅灵敏、特异,且由于该技术反应体系更小,反应池由金属制成,因此还具有试剂成本低、热平衡和热均匀性更快的技术优势。对送检样品的检测结果显示,与常规管式(RT-)PCR检测结果一致,表明建立的方法可用于上述3种猪腹泻相关病原的快速检测和筛查。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为5.8%。】
参考文献
[1] Office International des Epizooties. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Office International des Epizooties,2019,Paris,France.www.oie. int.
[2] Diel D G, Lawson S, Okda F, et al. Porcine epidemic diarrhea virus: An overview of current virological and serological diagnostic methods[J]. Virus research, 2016, 226: 60-70.
[3] Wellenberg GJ,Stockhofe-Zurwieden N, Boersma WJ, et al.The presence of co-infections in pigs with clinical signs of PMWS in the Netherlands:a case-control study[J]. Res Vet Sci, 2004, 77:177-184.
[4] Rajwant Gill, Sikander Gill, Maxim Slyadnev, et al. Identification and Quantitation of Cashmere (Pashmina) Fiber and Wool Using Novel Microchip Based Real-Time PCR Technology[J]. Journal of Textile Science and Technology, 2018, 4: 141-150.
[5]王慧珊,高志强,王金宝,等.猪传染性胃肠炎病毒与猪呼吸道 冠状病毒荧光 RT-PCR 鉴别检测方法建立与应用[J].中国动物检疫, 2011, 28(10): 31-34.
[6]《猪流行性腹泻检疫技术规范 》SN/T1699-2017[S] .中华人民共和国出入境检验检疫行业标准.
[7]《猪圆环病毒病检疫技术规范 》SN/T2708-2010[S] . 中华人民共和国出入境检验检疫行业标准.
[8] Costantini V, Lewis P, Alsop J, et al.Respiratory and fecal shedding of porcine respiratory coronavirus (PRCV) in sentinel weaned pigs and sequence of the partial S-gene of the PRCV isolates[J]. Arch Virol, 2004, 149(5): 957- 974.
(文章类别:CPST-C)







