CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
超高效液相色谱-串联质谱法测定大豆中多菌灵残留量
作者:李文敏1 张健玲1 柳映青2 谢思瑶1 蒋小良1*
李文敏1 张健玲1 柳映青2 谢思瑶1 蒋小良1*
摘 要 本文建立了一种超高效液相色谱-串联质谱法快速检测大豆中多菌灵药物残留量的分析方法。样品采用乙腈进行提取,经正己烷净化,通过多反应检测模式测定,外标法定量测定。实验结果表明,多菌灵在质量浓度0.5~50 μg/L范围内具有良好的线性系数,线性方程为y=7523.32x+786.168,相关系数为0.9993,方法的检出限和定量检出限分别为0.0029 μg/kg和0.0097 μg/kg。进行加标回收试验,添加多菌灵质量浓度水平分别为1、5、10 μg/L,加标回收率分别为88.2%、92.4%和95.1%,相对标准偏差小于6.26%。本方法具有快速、简便、灵敏度高等优点,能适用于大豆中多菌灵的残留量检测。
关键词 超高效液相色谱-串联质谱法;多菌灵;大豆
Determination of Carbendazim Residues in Soybean by Ultra High Performance Liquid Chromatography-tandem Mass Spectrometry
LI Wen-Min1 ZHANG Jian-Ling1 LIU Ying-Qing2 XIE Si-Yao1 JIANG Xiao-Liang1*
Abstract The ultra high performance liquid chromatography-tandem mass spectrometry method was developed for the rapid detection of carbendazim drug residues in soybean. The samples were extracted with acetonitrile, purified by n-hexane, determined by multiple reaction detection mode and quantified by external standard method. The results show that the linear coefficient of carbendazim is good in the range of 0.5-50 μg/L with a correlation at 0.9993, and the detection limit and limit of quantification are 0.0029μg/kg and 0.0097μg /kg, respectively. The recovery rates of the samples with the concentration of 1, 5, 10 μg/L are 88.2%, 92.4% and 95.1% respectively, with relative standard deviation(RSD) below 6.26 %. The method is fast, simple, and highly sensitive for determination of carbendazim in soybean.
Keywords ultra high performance liquid chromatography-tandem mass spectrometry (UHPLC-MS/MS); carbendazim; soybean
多菌灵又名绵萎灵、苯并咪唑44号,化学名为N-(2-苯并咪唑基)-氨基甲酸甲酯,分子式为C9H9N3O2,结构式见图1。多菌灵是一种广谱性杀菌剂,具有杀菌高效、毒性低、内吸等优点,能有效抑制病原菌的繁殖和生长,对多种作物由真菌(如半知菌、多子囊菌)引起的病害有防治效果,是一种环境内分泌干扰物。多菌灵化学性质稳定,难溶于一般有机溶剂和水,能溶于盐酸、醋酸和硫酸等,残留期比较长,不容易降解。多菌灵作为杀菌剂在我国杀菌行业使用范围非常广,多用于蔬菜、水果、粮食、棉花、粮油作物等真菌病害的防治中。由于多菌灵对人有一定的毒性,长期食用含有多菌灵的食物,经消化道吸收后,能引起头昏脑胀、恶心呕吐等中毒症状,严重时可引起肝病和染色体畸变,同时对哺乳动物神经具有一定的毒性作用[1]。我国颁布的食品安全国家标准GB 2763-2019《食品中农药最大残留限量》中规定了多菌灵在大豆中最大残留量为0.2 mg/kg。国际食品法典委员会规定多菌灵在大豆、小麦、玉米等经济作物中的46项有关限量,其中限量最低为0.05 mg/kg,欧盟、美国、日本等组织和国家先后制定了多菌灵在农产品及加工食品中的最大残留限量(MRL)。美国食品药品监督管理局(FDA)也全面禁止进口含有多菌灵残留的农产品。为了更好地应对国外有关农产品多菌灵的技术壁垒,本文选择大豆为研究对象,建立超高液相色谱-串联质谱法快速测定大豆中多菌灵药物残留量的分析方法。
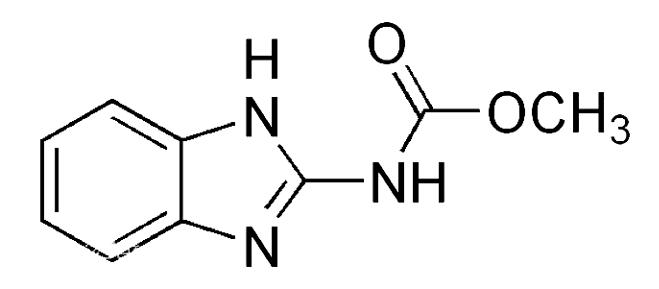
图1 多菌灵分子结构式
Fig.1 Molecular structure of carbendazim
目前,测定多菌灵残留量的分析方法主要有分光光度法[2,3]、电化学传感器法[4]、气相色谱法[5,6]、高效液相色谱法[7-9]和液相色谱-串联质谱法[10-13]等。目前大多使用液相色谱-串联质谱法对苹果、西瓜、火龙果、葡萄、猕猴桃、脐橙、大米等水果及农作物中的多菌灵残留进行检测,相关的操作方法也多,但是对于大豆的多菌灵残留检测的操作方法较少。所以本文对大豆中多菌灵残留的检测进行了研究,简化了提取和净化等前处理方式,采用外标法定量,建立了超高效液相色谱-串联质谱法检测大豆中多菌灵残留量的分析方法。
1 实验部分
1.1 仪器和试剂
UHPLC 超高效液相色谱-串联质谱仪( Acquity UPLC Core System)、Quattro Premier XE 三重四极杆质谱仪、MassLynx V4. 1质谱工作站软件等(美国Waters公司);2-16PK离心机(德国SIGMA公司); K15高速离心机(德国SIGMA公司);VORTEX 3旋涡混合器(上海达姆实业有限公司);SQP电子天平(赛多利斯科学仪器公司);XB2超声仪(英国GRANT公司);氮吹仪(美国Caliper公司)。
多菌灵标准物质(1000 μg/mL)(色谱纯,含量>99%,北京坛墨质检科技有限公司);乙腈(分析纯,天津大茂化学试剂厂);乙腈(色谱纯,美国BCR公司);正己烷(分析纯,天津市百世化工有限公司);正己烷(色谱纯,德国默克公司);乙酸铵(上海安谱实验科技有限公司);甲酸(色谱纯,美国Sigma-Aldrich公司);乙酸(色谱纯,美国Sigma-Aldrich公司);甲醇(色谱纯,美国BCR公司);实验室用水为超纯水,由美国密理博公司纯水设备制备提供。
1.2 标准溶液配置
多菌灵标准储备液(10 mg/L):准确移取1000 μL多菌灵标准物质(1000 mg/L)到100 mL容量瓶中,用甲醇稀释定容至刻度, -18℃冰箱避光保存,该多菌灵标准储备液的质量浓度为10 mg/L。
多菌灵标准工作液(1 mg/L):准确吸取10.0 mL上述配制的多菌灵标准储备液到100 mL容量瓶中,用甲醇稀释定容至刻度,4℃冰箱避光保存,该多菌灵标准工作液的质量浓度为1 mg/L。
流动相:0.1%甲酸水溶液+0.1%甲酸乙腈。
1.3 仪器分析条件
1.3.1 液相色谱分析条件
色谱柱:ACQUITY UPLC BEH C18,50 mm(柱长)×2.1 mm(内径),1.7 μm;柱温:40℃;进样量:5 μL;流动相:0.1%甲酸水溶液+0.1%甲酸乙腈溶液;流速:0.20 mL/min;梯度洗脱程序见表1,整个分析时长为3.5 min。
1.3.2 质谱分析条件
电离方式:采用电喷雾离子化(electrospray ionization, ESI);毛细管电压:3.0KV;离子源温度:110℃;去溶剂气流量:800L/hr;去溶剂气温度:400℃;在多反应检测模式(MRM)下进行检测,其他参数见表2。
1.4 样品前处理方法
1.4.1 提取
准确称取5.0 g(精确值0.01 g)已研磨捣碎过筛的大豆粉末样品,置于50 mL离心管中,加入15 mL乙腈提取液,涡旋混匀5 min,室温下超声波提取15 min,然后将样品在4000 r/min离心5 min,倒出上清液。再向残渣中加入15 mL乙腈溶液,重复以上步骤提取一次,合并上清液,待净化。
1.4.2 净化
取上清液15 mL到50 mL的离心管中,然后加入正己烷10 mL,涡旋混匀后,在6000 r/min离心5 min,去除上层液体,下层清液再加10 mL正己烷重复以上步骤。吸取下层清液于45℃氮吹仪吹至近干。加入1 mL样品溶解液以及0.5 mL乙腈饱和正己烷溶液,涡旋溶解后,过0.22 μm双层微孔滤膜,采用高效液相色谱-串联质谱测定。
2 结果与讨论
2.1 提取溶剂的选择
目前,常用提取多菌灵残留物的提取方式主要有超声波提取、固相萃取、微波萃取及溶剂萃取等方法,本实验分别试验了超声波提取、固相萃取、微波萃取和溶剂萃取,实验结果表明,采用超声波提取法简单方便,提取效率高,耗时少,所以本实验选择采用超声波提取法。常用的提取剂有甲醇、丙酮、乙酸乙酯、乙腈、0.1%乙酸-乙腈混合溶液等。采用超声波提取方式,试验了上述溶剂并对提取效果进行比较。实验结果表明,采用乙酸乙酯提取,很容易造成样品乳化现象,主要因为大豆样品中为粉末状且蛋白质含量高。乙腈提取效果高于0.1%乙酸-乙腈混合溶液,丙酮的提取效果最差,同时乙腈的回收率也最高,提取杂质也少,所以实验选择乙腈来作为提取剂。
表1 梯度洗脱程序参数
Table 1 Parameters for procedure of gradient elution
序号 | 时间/min | 流速/(mL/min) | 0.1%甲酸水/% | 0.1%甲酸乙腈/% |
1 | 0.00 | 0.200 | 90.0 | 10.0 |
2 | 2.00 | 0.200 | 60.0 | 40.0 |
3 | 2.50 | 0.200 | 10.0 | 90.0 |
4 | 3.50 | 0.200 | 90.0 | 10.0 |
表2 多菌灵的质谱参数
Table 2 Mass spectrometry parameters of carbendazim
名称 | 母离子/(m/z) | 子离子/(m/z) | 驻留时间/s | 锥孔电压/V | 碰撞能量/eV |
多菌灵 | 191.86 | 131.78 | 0.100 | 25.00 | 28.00 |
159.89* | 0.100 | 25.00 | 18.00 |
注:带*的子离子用来做定量分析
2.2 液相条件的优化
实验过程中,分别试验了0.1%甲酸水溶液+0.1%甲酸乙腈和(0.1%乙酸+乙酸铵水溶液)+0.1%甲酸乙腈两种流动相对分析结果的影响。试验结果表明,采用(0.1%乙酸+乙酸铵水溶液)+0.1%甲酸乙腈为流动相时,多菌灵的峰形存在严重拖尾且峰形宽,改用0.1%甲酸水溶液+0.1%甲酸乙腈作为流动相,多菌灵的峰宽变小,峰形尖锐对称性好,同时离子化效率较好,响应更高。因此,实验选择0.1%甲酸水溶液+0.1%甲酸乙腈为流动相。
2.3 线性范围、检出限与定量限
逐级稀释多菌灵标准工作液,得到其质量浓度分别为0.5、5.0、10、20、50μg/L的系列标准工作溶液,然后依次从低浓度将标准工作溶液注入超高效液相色谱-串联质谱仪中测定,外标法定量。以标准溶液质量浓度(μg/L)为横坐标,以多菌灵峰面积为纵坐标绘制标准工作曲线,结果如图2所示。实验表明,多菌灵在质量浓度范围0.5~50 μg/L呈现良好的线性关系,并进行线性回归,得出其线性方程为y=7523.32x+786.168,相关系数为0.9993。当添加水平为1.0 μg/L时,以S/N≥3(信噪比)和S/N≥10计算得出方法检出限和定量限分别为0.0029 μg/L和0.0097 μg/L,详见图3。

图2 多菌灵的线性回归曲线
Fig.2 Linear regression graph of carbendazim
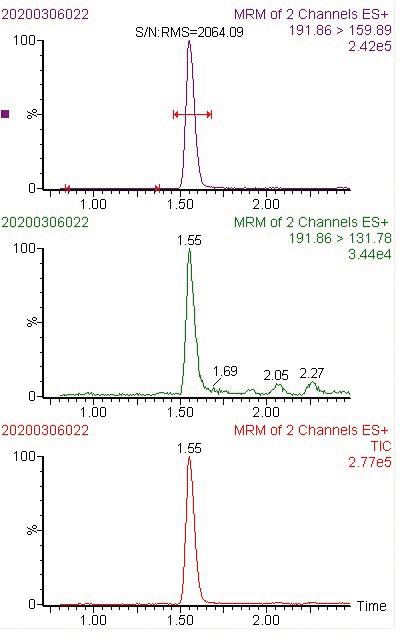
图3 多菌灵色谱图(1.0 μg/L)
Fig.3 Chromatogram of carbendazim (1.0 μg/L)
2.4 方法准确度和精密度
分别在制备好的大豆样品中加入多菌灵标准溶液进行加标回收率实验。加标水平为1.0、5.0和10 μg/L,每个水平制备6份平行样品。同时测定6份平行样品并计算平均回收率和相对标准偏差,结果见表3,平均回收率分别为88.2%、92.4%和95.1%,相对标准偏差在2.44%~6.26%之间,表明方法具有良好的准确度和精密度。
2.5 实际样品的测定
采用已建立的超高效液相色谱-串联质谱法测定市售大豆样品20份。其中6份大豆样品中检测出多菌灵残留量,检出含量范围为0.06~0.24 mg/kg,平均值为0.18 mg/kg。通过实际样品测试,表明该方法灵敏度高,操作简便,样品处理快速,检出定量限低,适用于大豆中多菌灵残留量的快速分析测定。
表3 不同添加水平下的平均回收率和精密度
Table 3 Recoveries and precisions at different spiked levels
名称 | 加标浓度 | 平均回收率 | 相对标准偏差 |
(μg/L) | (%) | (%) | |
多菌灵 | 1 | 88.2 | 6.26 |
5 | 92.4 | 3.38 | |
10 | 95.1 | 2.44 |
3 结论
本研究基于超声波提取,建立了超高效液相色谱-串联质谱法测定大豆中多菌灵残留量的分析方法,简化了样品前处理流程,优化了仪器工作条件,缩短了多菌灵出峰时间,达到快速准确分析检测大豆中多菌灵残留量的效果。在实验选择最佳条件下,多菌灵出峰时间为1.55 min,方法的检测限和定量检出限分别为0.0029 μg/L和0.0097 μg/L,样品的平均加标回收率在88.2%~95.1%范围内,相对标准偏差小于6.26%,并用于实际大豆样品测试,取得很好的效果。该方法具有灵敏度高、操作简单、成本低、快速等特点,能满足实验室大豆中多菌灵快速准确分析的需要。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为11.9%。】
参考文献
[1]朱俭勋,钟石,王新全,等.桑园常用杀菌剂多菌灵诱导鼠源神经细胞PC12凋亡的研究.蚕业科学, 2016, 42(4): 0668-0673.
[2]华孝成,柯建赛,黄兆册.分光光度法检测果蔬中多菌灵残留量的改进[J].浙江农业科学, 2013(8): 1016-1018.
[3]段云青,王富祥,亢慧瑾.同步荧光增敏法测定蔬菜中的多菌灵[J].内蒙古农业大学学报(自然科学版), 2020, 41(2): 8-12.
[4]尹文青,闫玥,彭娟,等. 基于纳米金/二硫化钼构建的电化学传感器对多菌灵的灵敏检测[J].分析试验室, 2018, 37(12): 1402-1406.
[5]李贝妮,王亚林,贾金平.水果中多菌灵的衍生炭纤维固相微萃取气相色谱测定法[J].环境与健康杂志, 2008, 26(3): 255-257.
[6]许行义,邹巧莉,钟光剑,等.衍生化气相色谱法测定环境水样中的多菌灵[J].中国环境监测, 2012, 28(1): 41-43.
[7]刘铭扬,冯敏玲,邹学仁,等.超高效液相色谱-紫外法测定火龙果中多菌灵农药残留[J].现代农业科技, 2019(5): 108-109.
[8]李军,顾亚南,李冠华.高效液相色谱法同时快速测定土壤中多菌灵、灭多威和克百威的残留[J].环境研究与监测, 2018, 31(3): 31-33.
[9]杨丽芬,杨忠平,邵林,等.QuEChERS-高效液相色谱法测定苹果中多菌灵和噻菌灵[J].食品安全质量检测学报, 2020, 11(7): 2257-2262.
[10]李柱梅,韩洛利,朱其丛.高效液相色谱-串联质谱法检测小麦中11种农药残留[J].河南农业, 2019(31): 17-18.
[11]张玉换,胡静,赵月钧.固相萃取-超高效液相色谱-串联质谱法测定食用植物油中多菌灵残留[J].浙江农业科学, 2020, 61(7): 1421-1423.
[12]高洁,陈达炜,赵云峰.分散微固相萃取-超高效液相色谱-高分辨质谱法测定葡萄酒和啤酒中多菌灵和噻菌灵[J].色谱, 2018, 36(2): 143-149.
[13]刘萍,蒋振国,刘旭,等.超高效液相色谱-串联质谱法测定大米中的敌瘟磷、莠去津和多菌灵[J].粮食与饲料工业, 2019(2): 53-56.
(文章类别:CPST-A)







