CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
双重RT-PCR快速检测水仙普通潜隐病毒和尼润潜隐病毒
作者:陈细红1 蔡 伟1 肖 颖1 李 敏1 高芳銮2 沈建国1*
陈细红1 蔡 伟1 肖 颖1 李 敏1 高芳銮2 沈建国1*
摘 要 目的:针对水仙上水仙普通潜隐病毒(Narcissus common latent virus, NCLV)和尼润潜隐病毒(Nerine latent virus, NeLV)建立同时检测两种病毒的双重RT-PCR方法。方法:参照GenBank上已报道的NCLV和NeLV CP基因序列设计特异性引物,在单一RT-PCR检测方法的基础上,通过对PCR反应体系和反应条件的优化,建立了可以同时检测NCLV和NeLV的双重RT-PCR方法,并对其特异性、灵敏度进行了测定,同时应用于水仙实际样品的检测。结果:建立的双重RT-PCR检测方法具有良好的特异性和灵敏度,能够有效区分水仙上NCLV、NeLV两种病毒,并且检测灵敏度不低于单一RT-PCR,水仙实际样品检测结果与单一RT-PCR检测结果相符。结论:建立的NCLV、NeLV双重RT-PCR检测方法特异性强、灵敏度高、准确性好,适用于口岸及农业生产上NCLV、NeLV的快速检测。
关键词 水仙普通潜隐病毒;尼润潜隐病毒;双重RT-PCR
Rapid Detection of Narcissus Common Latent Virus and Nerine Latent Virus by Duplex RT-PCR
CHEN Xi-Hong1 CAI Wei1 XIAO Ying1 LI Min1 GAO Fang-Luan2 SHEN Jian-Guo1*
Abstract This paper aims to develop a rapid, sensitive and specific duplex RT-PCR method to simultaneously detect Narcissus common latent virus (NCLV) and Nerine latent virus (NeLV). Two pairs of specific primers were designed from the conserved regions of CP gene in the published NCLV and NeLV sequences from GenBank. A duplex RT-PCR assay was established and optimized for simultaneous detection of these two viruses based on single RT-PCR. The specificity and sensitivity were also determined. In addition, this assay was applied to detect narcissus samples. The established duplex RT-PCR method can effectively distinguish NCLV and NeLV on narcissus which showed high specificity and sensitivity. The method demonstrating sensitivity is not lower than that of single RT-PCR. The result obtained from the duplex RT-PCR assay is consistent with those of single PCR assays. It is concluded that the duplex RT-PCR assay reported here is highly specific, sensitive and accurate, which could be applied to the rapid detection of both NCLV and NeLV at port and agricultural production.
Keywords Narcissus common latent virus; Nerine latent virus; duplex RT-PCR
基金项目:国家重点研发计划(2016YFF0203203)
第一作者:陈细红(1989&—),女,汉族,福建泉州人,学士,农艺师,主要从事植物病毒研究,E-mail:kaishilvxing00@163.com
通讯作者:沈建国(1978&—),男,汉族,安徽芜湖人,博士,研究员,主要从事植物病毒及其防治研究,E-mail:shenjg_agri@163.com
1.福州海关技术中心 福州 350001
2.福建农林大学植物病毒研究所 福州 350002
1. Technology Center of Fuzhou Customs District , Fuzhou 350001
2. Institute of Plant Virology, Fujian Agriculture and Forestry University, Fuzhou 350002
水仙属于石蒜科(Amaryllidaceae)水仙属(Narcissus)多年生草本植物,是我国重要的传统出口名花,兼具观赏和药用价值[1-2]。病毒病是水仙生产上最主要的病害之一,且多数呈复合侵染[3]。受病毒侵染的水仙往往表现为鳞球茎退化、花枝减少、香气变淡、植株矮化等症状,导致水仙产量和品质大幅下降,对水仙生产造成严重影响。水仙普通潜隐病毒(Narcissus common latent virus,NCLV)和尼润潜隐病毒(Nerine latent virus,NeLV)是水仙上的两种重要病毒,都属于乙型线状病毒科(Betaflexiviridae)、香石竹潜隐病毒属(Carlavirus)成员。NCLV和NeLV病毒基因组为正义单链RNA,含有6个开放阅读框,全长分别约8539 nt和8281 nt [4-5]。NCLV和NeLV病毒粒子形态为线状,侵染水仙后,通常表现为隐症,很难从症状上鉴定和区分两种病毒,在口岸及农业生产检测中容易漏检。
水仙病毒病的防治十分困难,目前没有有效的防治手段,因此,加强水仙NCLV和NeLV的早期检测和日常监测,对于控制这两种病毒的发生、传播和扩散,以及保护水仙安全生产具有重要意义。利用RT-PCR技术检测植物病毒具有快速、准确、特异性强、灵敏度高的优点,其中,在RT-PCR基础上改进的多重RT-PCR能够一次检测多个靶标病毒,检测效率显著提高,近年来已广泛用于植物病毒的检测鉴定[6-8]。但截至目前,关于NCLV、NeLV双重RT-PCR检测方法未见报道。本研究根据NCLV、NeLV的CP基因序列设计特异性引物,经过反应体系和反应条件的优化,建立了同时检测两种病毒的双重RT-PCR方法,旨在为水仙上NCLV、NeLV的快速检测提供技术支持。
1 材料与方法
1.1 材料
水仙样品为口岸截获和田间采集,共计80份。水仙普通潜隐病毒(NCLV)、尼润潜隐病毒(NeLV)毒源为本实验室保存。
RNeasy Plant Mini Kit,QIAGEN公司产品;DNA Marker、大肠杆菌 DH5α 感受态细胞、DNA 快速纯化回收试剂盒,天根生化科技有限公司产品;Random Hexamer Primer,Thermo Fisher scientific公司产品;反转录酶、RNA酶抑制剂,Promega公司产品;Taq DNA聚合酶、pMD-18T,TaKaRa公司产品;ABI Veriti PCR仪,美国应用生物系统公司产品;G: BOX F3凝胶成像系统,Syngene公司产品。
1.2 方法
1.2.1 引物设计与合成
参照美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)GenBank上已报道的NCLV和NeLV的CP基因序列设计2对特异性引物,引物由生工生物工程(上海)股份有限公司合成。引物名称、序列、长度及预期扩增目的片段大小见表1。
1.2.2 总RNA的提取
根据RNeasy Plant Mini Kit说明书提取水仙样品的总RNA,保存于-80℃的冰箱中备用。
1.2.3 cDNA合成
在PCR管中加入待测样品总RNA 3 μL、100 μmol/L Random Hexamer Primer 1μL、RNase-free ddH2O 7 μL,70℃水浴10 min,随后迅速置于冰上5 min,瞬离,再加入下列试剂:5× RT Buffer 5μL、10 mmol/L dNTPs 2 μL、200 U/μL反转录酶1 μL、40 U/μL RNA酶抑制剂1 μL。42℃水浴60 min,70℃水浴10 min后冷却至室温,合成cDNA。
表1 引物名称、序列、长度和预期目的片段大小
Table 1 Primer name, sequence, length and expected product size
引物名称 | 引物序列(5’-3’) | 引物长度/bp | 预期目的片段大小/bp |
NCLV-F | CCTGACCCCAGCAATCCTT | 19 | 479 |
NCLV-R | GGCCTCCGAATTAACCCCTC | 20 | |
NeLV-F | GTCCCGCCTGAATCAATAGCA | 21 | 218 |
NeLV-R | TTCGTCCCAATCATGTAGTTCC | 22 |
1.2.4 单一RT- PCR扩增
在PCR管中加入步骤1.2.3合成的cDNA 1 μL,按每管加5 U/μL Taq DNA聚合酶0.5 μL、2.5 mmol/L dNTPs 1μL、10×PCR Buffer 2.5 μL、25 mmol/L MgCl2 1.5 μL、10 μmol/L 上游引物0.5 μL、10 μmol/L 下游引物0.5 μL、ddH2O 17.5 μL,反应总体积为25 μL;混合后的反应液置于PCR仪上,设置反应程序94℃预变性3 min,94℃变性30 s,54℃ 退火45 s,72℃延伸45 s,共35个循环,最后一个循环结束后,72℃继续延伸10 min;取PCR反应产物10 μL,用1.5%琼脂糖凝胶电泳进行检测,在凝胶成像系统上观察并记录试验结果。
1.2.5 PCR产物的克隆和测序
利用DNA 快速纯化回收试剂盒回收目的片段,连接于pMD-18T连接载体,连接产物转化到大肠杆菌DH5α感受态细胞中,挑取阳性克隆子送生工生物工程(上海)股份有限公司进行测序,测得的序列在NCBI上进行BLAST一致性比对。
1.2.6 双重RT-PCR
cDNA合成同1.2.3。在单一RT-PCR的础上,通过对Mg2+浓度、引物浓度、dNTP浓度、Taq DNA聚合酶浓度、退火温度和循环数的筛选和优化,确定反应体系和反应条件,建立同时检测NCLV和NeLV的双重RT-PCR方法。
1.2.7 特异性测定
分别以NCLV、NeLV及两种病毒混合的水仙样品为材料进行双重RT-PCR,测定其特异性。
1.2.8 灵敏度测定
将NCLV、NeLV及两种病毒模板等量混合后,分别依次稀释至原液的10-1倍、10-2倍、10-3倍、10-4倍、10-5倍和10-6倍,随后进行单一RT-PCR和双重RT-PCR灵敏度的测定。
1.2.9 双重RT-PCR的应用
选取口岸截获和田间采集的水仙样品共80份,利用建立的双重RT-PCR方法进行检测,同时采用单一RT-PCR方法进行验证。
2 结果与分析
2.1 双重RT-PCR扩增
优化后的PCR反应体系为25 μL:cDNA 1 μL,5 U/μL Taq DNA聚合酶0.5 μL、2.5 mmol/L dNTPs 0.125μL、10×PCR Buffer 2.5μL、25 mmol/L MgCl2 1.5 μL、10 μmol/L上下游引物(共2对引物,分别为NCLV-F/R、NeLV-F/R)各0.5 μL、ddH2O 17.375 μL;反应条件为94℃预变性3 min,然后94℃变性30 s,54℃退火45 s,72℃延伸45 s,共30个循环,最后一个循环结束后,72℃继续延伸10 min。双重RT-PCR扩增结果显示,该方法能够从阳性对照及两种病毒混合的样品中同时检出NCLV和NeLV(见图1)。
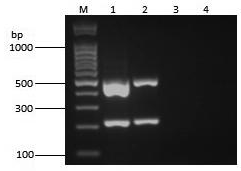
M:DNA分子量标准(100 bp);1:阳性对照;2:NCLV、NeLV混合的样品;3:阴性对照;4:空白对照。
图1 双重RT-PCR扩增
Fig.1 Amplification result of duplex RT-PCR
2.2 特异性测定结果
利用优化的双重RT-PCR方法检测NCLV、NeLV及两种病毒混合的水仙样品,结果显示,单一的NCLV、NeLV样品分别在479 bp、218 bp处出现单一明亮的DNA条带,两种病毒混合的样品同时在479 bp、218 bp处出现明亮的DNA条带,而从阴性对照上未扩增到任何特异性DNA条带。序列测定结果显示,获得的NCLV、NeLV目的片段序列分别与GenBank已报道的NCLV、NeLV的CP基因序列高度一致,一致性均达到98%以上。上述结果表明,本研究建立的双重RT-PCR方法具有良好的特异性(见图2)。
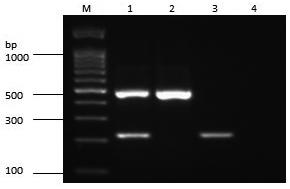
M:DNA分子量标准(100 bp);1:NCLV和NeLV混合的样品;2:NCLV;3:NeLV;4:阴性对照。
图2 双重RT-PCR特异性测定
Fig.2 Specificity test of duplex RT-PCR
2.3 灵敏度测定结果
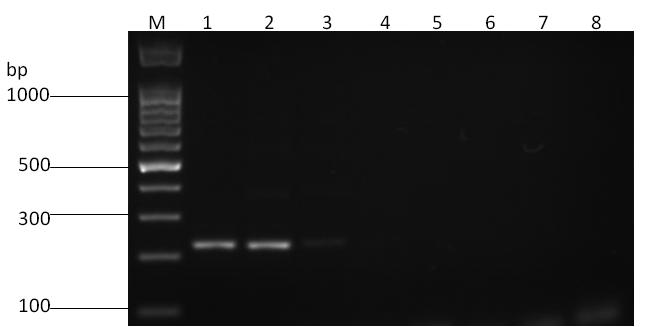
对优化的双重RT-PCR方法进行灵敏度测定,并与单一RT-PCR进行比较,结果见图3~图5。对于NCLV,单一RT-PCR和双重RT-PCR均能够检测到稀释至10-4倍的模板,但单一RT-PCR条带较亮;对于NeLV,单一RT-PCR能检测到稀释至10-2倍的模板,而双重RT-PCR最低检测到稀释至10-3倍的模板,但稀释至10-2倍后条带较淡。
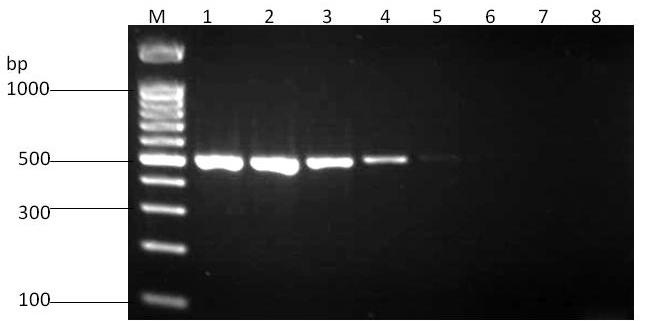
M:DNA分子量标准(100 bp);1:原液;2:10 -1 稀释;3:10 -2 稀释;4:10 -3 稀释;5:10 -4 稀释;6:10 -5 稀释;7:10 -6 稀释;8:阴性对照。
图3 双重RT-PCR灵敏度
Fig.3 Sensitivity test of duplex RT-PCR
M:Marker;1:原液;2:10 -1 稀释;3:10 -2 稀释;4:10 -3 稀释;5:10 -4 稀释;6:10 -5 稀释;7:10 -6 稀释;8:阴性对照。
图4 NCLV单一RT-PCR灵敏度
Fig.4 Sensitivity test of singal RT-PCR of NCLV

M:DNA分子量标准(100 bp);1:原液;2:10 -1 稀释;3:10 -2 稀释;4:10 -3 稀释;5:10 -4 稀释;6:10 -5 稀释;7:10 -6 稀释;8:阴性对照。
图5 NeLV单一RT-PCR灵敏度
Fig.5 Sensitivity test of singal RT-PCR of NeLV
2.4 双重RT-PCR的实际应用
应用建立的双重RT-PCR方法对80份水仙实际样品进行NCLV、NeLV两种病毒的检测,同时以单一RT-PCR方法进行验证。结果检出NCLV阳性的样品11份、NeLV阳性的样品32份,该检测结果与单一RT-PCR方法检测结果完全相符,说明本研究建立的双重RT-PCR方法有效可靠。
3 结论
目前,水仙上已报道的香石竹潜隐病毒属病毒仅有NCLV、NeLV 两种病毒,关于两种病毒的检测方法研究报道甚少。采用传统的植物病毒检测方法,如鉴别寄主测定、电镜观察和ELISA检测方法检测NCLV、NeLV,存在检测周期长、灵敏度低和需要专门的隔离设施或昂贵的设备等不足[9]。由于水仙病毒种类多,且同一植株常常携带多种病毒,单凭感病症状不易区分,因此,加强病毒检测,建立同时检测水仙多种病毒的快速、准确的检测方法,对于缩短检测周期、提高通关效率和及时采取防控措施具有重要意义。He等[10]建立了同时检测水仙黄条病毒、水仙潜隐病毒和水仙花叶病毒的多重RT-PCR方法,其灵敏度与单一RT-PCR相当。本研究针对NCLV、NeLV两种病毒,根据病毒CP基因保守序列分别设计特异性引物,在单一RT-PCR方法基础上,将两对特异性引物组合,并通过反应体系和反应条件的优化,建立了可同时检测NCLV、NeLV的双重RT-PCR方法,一次试验即可实现对NCLV、NeLV两种病毒的同时检测,能准确鉴定NCLV、NeLV是单一还是复合侵染,显著提高了检测效率。
特异性和灵敏度测定结果表明,建立的双重RT-PCR检测方法能够有效区分NCLV、NeLV两种病毒,并且检测灵敏度不低于单一RT-PCR方法。应用建立的双重RT-PCR方法实际检测口岸截获和田间采集的样品,结果80份样品中检出NCLV 11份阳性、NeLV 32份阳性,并且检测结果与单一RT-PCR验证结果一致,进一步验证了该方法的有效性。综上所述,本研究建立的双重RT-PCR方法特异性强、灵敏度高、准确性好,在口岸检疫和农业生产上具有广泛的应用前景。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为9.2%。】
参考文献
[1] 臧颖 , 严纯, 戴凯新, 等. 水仙病毒病研究进展[J]. 北方园艺, 2019, (05): 153-160.
[2] Anbari S, Tohidfar M, Hosseini R, et al. Somatic embryogenesis induction in Narcissus papyraceus cv. Shirazi[J]. Plant Tissue Culture and Biotechnology, 2007, 17(1): 37-46.
[3] JIN J, SHEN J G, CAI W, et al.Narcissus yellow stripe virus and Narcissus mosaic virus Detection in Narcissus via multiplex TaqMan-based reverse transcription-PCR assay[J]. Journal of Applied Microbiology, 2017, 122(5): 1299-1309.
[4] CHEN J, SHI Y H, LU Y W, et al. Narcissus symptomless virus: a new carlavirus of daffodils[J]. Archives of Virology, 2006, 151(11): 2261-2267.
[5] ZHENG H Y, CHEN J, Adams M J, et al. Complete nucleotide sequence and affinities of the genomic RNA of Narcissus common latent virus (genus Carlavirus)[J]. Archives of Virology, 2006, 151(8): 1667-1672.
[6] KUMAR R, JEEVALATHA A, BASWARAJ R, et al. A multiplex RT-PCR assay for simultaneous detection of five viruses in potato[J]. Journal of Plant Pathology, 2017, 99(1): 37-45.
[7] 杜真真, 刘艳, 王锡锋. 双重RT-PCR法同步检测单头异沙叶蝉携带的两种小麦病毒[J]. 植物保护, 2020, 46(03): 175-179, 187.
[8] VINAYARANI G, MADHUSUDHAN K N, DEEPAK S A, et al. Detection of mixed infection of tobamoviruses in tomato and bell pepper by using RT-PCT and duplex PCR[J]. International Jorunal of Plant Pathology, 2011, 2(2): 89-95.
[9] 陶源, 吴兴泉. 植物病毒检测方法的研究进展[J]. 分子植物育种, 2017, 015(007) : 2901-2906.
[10] HE Y P, GAO F L, SHEN J G, et al. A multiplex RT-PCR method for the simultaneous detection of Narcissus yellow stripe virus, Narcissus latent virus and Narcissus mosaic virus[J]. Canadian Journal of Plant Pathology, 2019, 41(1): 115-123.
(文章类别:CPST - C)







