CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
三种禽用疫苗外源病原多重荧光PCR检测方法建立
作者:王 艳1 张 强1 李 健1 张建峰2 朱小清3
王 艳1 张 强1 李 健1 张建峰2 朱小清3
摘 要 根据GenBank中收录的鸡毒支原体、禽白血病病毒和网状内皮细胞增生症病毒的基因序列,分别设计并合成了引物和相应的荧光探针,通过对反应条件和反应程序的优化,建立了一种可以同时检测3种禽用疫苗外源性病原污染因子的三重荧光PCR检测方法。结果显示,建立的三重荧光PCR灵敏度高,最低可检测到10 copies/μL的质粒,并具有良好的特异性,可用于禽用疫苗外源性污染因子的快速检测,也可用于相关疫病的诊断。
关键词 鸡毒支原体;禽白血病病毒;网状内皮细胞增生症病毒;实时荧光PCR
Development of a Triplex Real-time PCR Assay for Detection of MG, ALV, REV in Poultry Vaccines
WANG Yan1 ZHANG Qiang1 LI Jian1 ZHANG Jian-Feng2 ZHU Xiao-Qing3
Abstract Based on the sequences of mycoplasma gallisepticum (MS), Avian Leukosis virus (ALV) and reticuloendotheliosis virus(REV) genome from GenBank, three sets of primers and probes for the three pathogens were designed and synthesized. After the reaction conditions and processes were optimized, a triplex real-time PCR assay was established. The results showed that this assay had reasonable sensitivity, and the detection limits for plasmids was 10 copies/μL without cross reaction to other pathogens. This real-time PCR assay reported in the study can be used for the diagnosis of related diseases and rapid detection of exogenous contamination of poultry vaccines.
Keywords MG; ALV; REV; real-time PCR
禽用疫苗的外源性污染问题一直受到相关监管部门、产业部门的重视。中国兽医药品监察所2010年曾对全国部分禽用活疫苗进行外源污染检测,发现外源病毒污染的阳性率为36.1%[1]。外源病毒污染不仅会影响疫苗的效果,而且会导致疫病的暴发,给畜牧养殖业造成危害。
禽用疫苗主要以禽白血病病毒(Avian Leukosis Virus, ALV)、网状内皮组织增生症病毒(Reticuloendotheliosis virus, REV)的污染较为常见。ALV是引起禽白血病(Avian Leukosis, AL)的一种抑制生长和诱发多种良性肿瘤和恶性肿瘤的病原。ALV主要通过种鸡垂直传播,其次是水平传播。另外,疫苗污染也会引起该疫病的传播。2006年,美国发现鸡马立克氏疫苗中存在ALV-A污染[2]。2009年,邱波[3]等对山东省的20个种鸡场内常规使用的ALV疫苗进行外源污染检测,结果显示,在19个种鸡场使用的常规疫苗中检测出ALV-p27抗原,阳性率达到28.18%。2014年,胡晓苗[4]等发现安徽省鸡群接种的疫苗中ALV阳性率达28.57%。由于REV可以垂直传播,如果鸡群接种污染了REV的疫苗,会造成REV的流行。Awad A M等[5]在禽痘疫苗中发现REV污染。近年来,接种污染了REV的禽弱毒化疫苗被认为是REV流行的重要因素之一[6-8]。刘轶秋等[9]对141批次的生物制品进行了支原体检测,发现疫苗合格率仅为80.1%。宁宜宝[10]等通过对禽用活疫苗中支原体外源污染的调查发现,污染率达64.5%,情况相当严重。
目前,对疫苗中外源性污染的检测主要包括细胞培养法、SPF鸡检查法、ELISA法等。细胞培养法和SPF鸡检查法存在耗时费力、成本高等缺点;ELISA法可能会出现假阳性的结果,特别是检测活疫苗样品,利用抗体ELISA检测时,可能会漏检一些低剂量的污染。为了提高对禽用疫苗外源性污染的检测率,本研究利用荧光定量PCR技术探索可同时检测禽用疫苗中3种外源性病原的检测方法,以期提供一种可以快速检测疫苗中外源性ALV、REV、MG污染的方法,保障禽用疫苗的生物安全。
1 材料和方法
1.1 试剂和仪器
荧光定量PCR试剂购自宝生物工程(大连)有限公司;焦碳酸二乙酯(DEPC)购自生工生物工程(上海)股份有限公司;ABI7500 Fast荧光PCR仪购自美国应用生物系统公司(ABI)。
1.2 方法
1.2.1 引物及探针的设计与合成
依据GenBank中登录的ALV、REV和MG的基因序列(登录号分别为NC_015116.1、NC_006934.1、NC_004829.1),利用Primer软件针对3种病原的基因序列进行和比对分析,选择高度保守的区域,设计引物和探针(见表1)。其中,探针5'端标记的荧光报告基团分别为CY5、ROX和FAM。引物和探针均由生工生物工程(上海)股份有限公司合成。
表1 实时荧光PCR引物与探针
Table 1 The primer pairs and probes in the real-time qPCR
引物与探针 | 序列(5'-3') |
ALVF | CGGGACCCACTGTCTTTACC |
ALVR | GCGCGTGCTTCCAGTTGT |
ALVP | CY5-ACGCCTCCTCAAGCACCCATAAG-BHQ3 |
REVF | TCCCCGGCTAGCAGAGAAC |
REVR | CTACGGGTATACCAGTCCTATTGTC |
REVP | ROX-CTGGCTTTGCATGACTCTTGGAAC-BHQ2 |
MGF | GGATTAGATACCCTAGTAGTCCACA |
MGR | CGTGTACCGTCGAATTAAGCA |
MGP | FAM-CATGCTCCACCACTTGTGCGGG-BHQ1 |
1.2.2 三种基因序列的合成
利用Primer软件比对后选取的高度保守的区域,送生工生物工程(上海)股份有限公司合成相应的标准品质粒,分别命名为ALV、REV和MG。
1.2.3 多重荧光检测方法的建立
1.2.3.1 反应体系的优化和标准曲线的建立
基于单个目标基因荧光PCR方法,通过对引物、探针浓度和反应条件的优化,确定三重荧光PCR的反应条件。采用已建立的三重荧光PCR反应条件,对标准品质粒进行10倍稀释,浓度分别为10 copies/μL~105 copies/μL,以各浓度作为模板进行PCR的扩增。以CT值为Y轴,以标准品稀释后浓度为X轴制作标准曲线,建立扩增曲线及标准曲线。
1.2.3.2 特异性试验
利用已建立的荧光PCR方法,对本实验室保存的其他相关病原阳性质粒(马立克氏病、新城疫、禽流感)进行特异性检测。
1.2.3.3 敏感性试验
将3种病原模板进行10倍的倍比稀释,使其浓度分别为106 copies/μL、105 copies/μL、104 copies/μL、103 copies/μL、102 copies/μL、101 copies/μL,并进行敏感性检测。
1.2.4 样品的检测
利用建立的三重荧光PCR方法对市售的禽用疫苗(鸡痘活疫苗2批次、鸡新城疫-鸡传染性支气管活疫苗2批次、鸡新城疫La Sota株灭活疫苗2批次、鸡毒支原体灭活疫苗1批次、鸡传染性法氏囊病活疫苗2批次、鸡马立克氏病活疫苗2批次)进行检测。
2 结果
2.1 反应条件的优化及标准曲线的建立
各反应条件优化后,最终确定反应体系为TaqMan Mixture(2×)12.5μL,上下游引物(浓度为10 pmol/mL)各0.5μL,探针(浓度为10 pmol/mL)各0.4μL,模板各2μL,用ddH2O补足至总体系25μL。扩增程序为95℃预变性10 min;95℃变性20 s,60℃退火,延伸35 s,40个扩增循环;在60℃阶段收集荧光信号。整个检测过程仅需60 min即可完成。
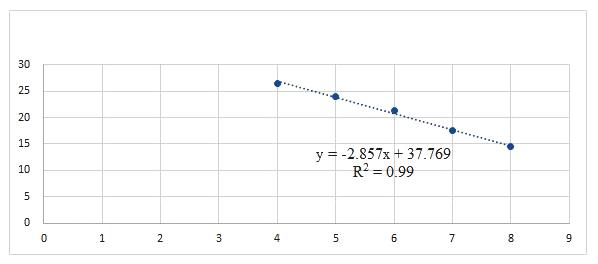
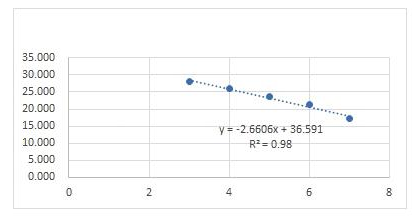
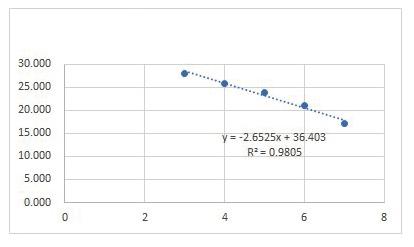
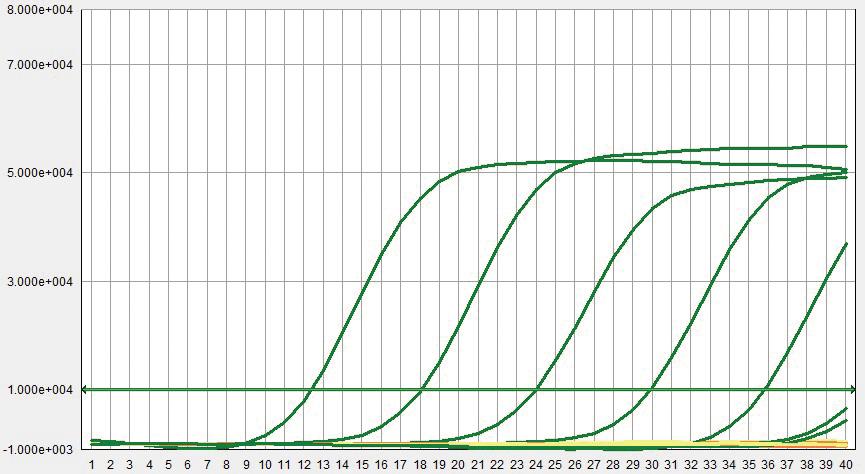
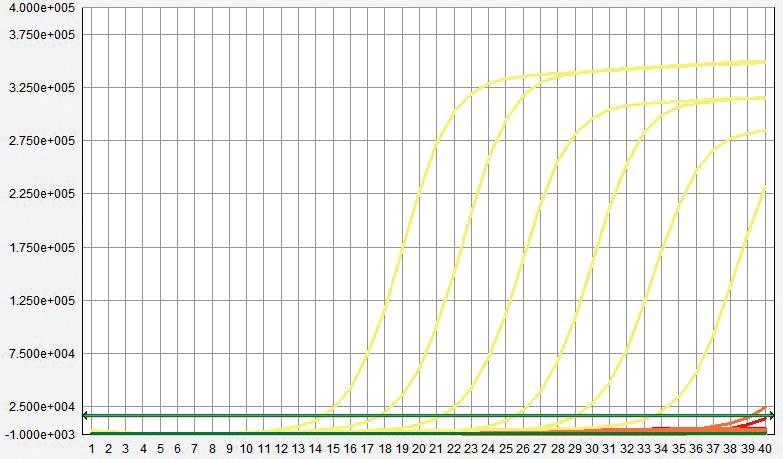
标准品质粒在浓度10 copies/μL~105 copies/μL之间都能检测到荧光信号,其扩增曲线较圆滑且平整,得到的标准曲线具良好线性关系。以标准品质粒的稀释浓度为X轴、Ct值为Y轴,得到三重荧光定量PCR对3种标准品的标准曲线,如图1所示。方程如下:
ALV:-2.857x + 37.769,R2 = 0.99;REV:-2.6606x + 36.591,R2 = 0.98;MG:-2.6525x + 36.403,R2 = 0.9805。
2.2 多重PCR检测特异性结果
结果表明,建立的方法具有良好的特异性,能特异地扩增ALV、REV和MG,能分别检测出各自的扩增曲线;对马立克氏病、禽流感和新城疫等相关病原核酸在Ct值30以内均未出现扩增曲线,无扩增,结果为阴性。上述试验结果如图2所示。
Standard Curve
A
Standard Curve
B
Standard Curve
C
A: ALV; B: REV; C: MG
图1 三重荧光定量PCR标准曲线A:ALV; B:REV; C:MG
Fig.1 The standard curve of real-time qPCR for ALV,REV,MG
2.3 多重PCR检测敏感性结果
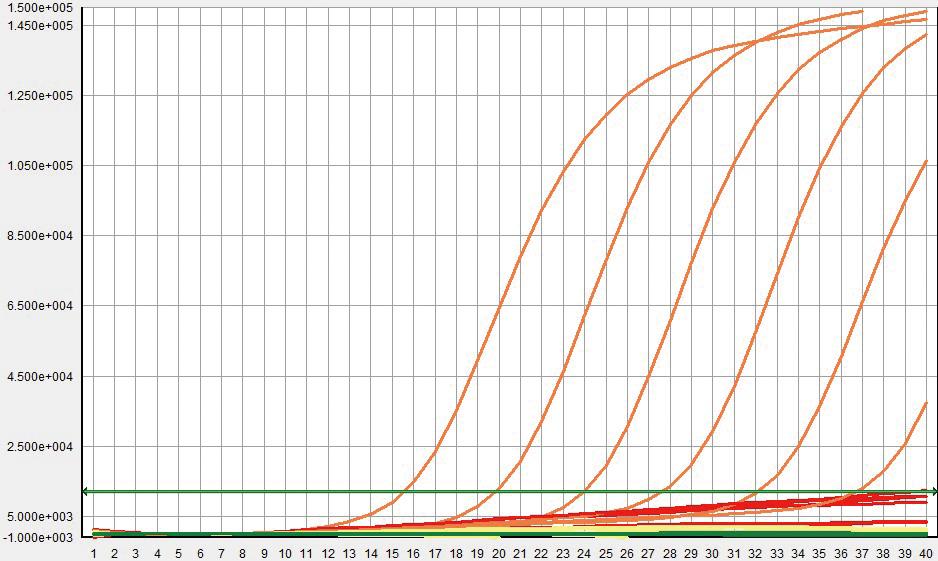
对10倍梯度稀释的ALV、REV和MG进行检测,结果表明,ALV质粒在100 copies/μL可以检测到荧光值,REV和MG质粒均在10 copies/μL可以检测到荧光信号值。以上结果表明,ALV的灵敏度可达100 copies/μL,REV和MG的灵敏度可达10 copies/μL,如图3所示。
2.4 多重PCR检测样品检测结果
检测结果表明,本研究采集的疫苗样品未检出ALV、REV和MG污染。这表明我国禽用疫苗的质量控制良好,与刘丹等[11]报道的结果一致。
Amplification Plot
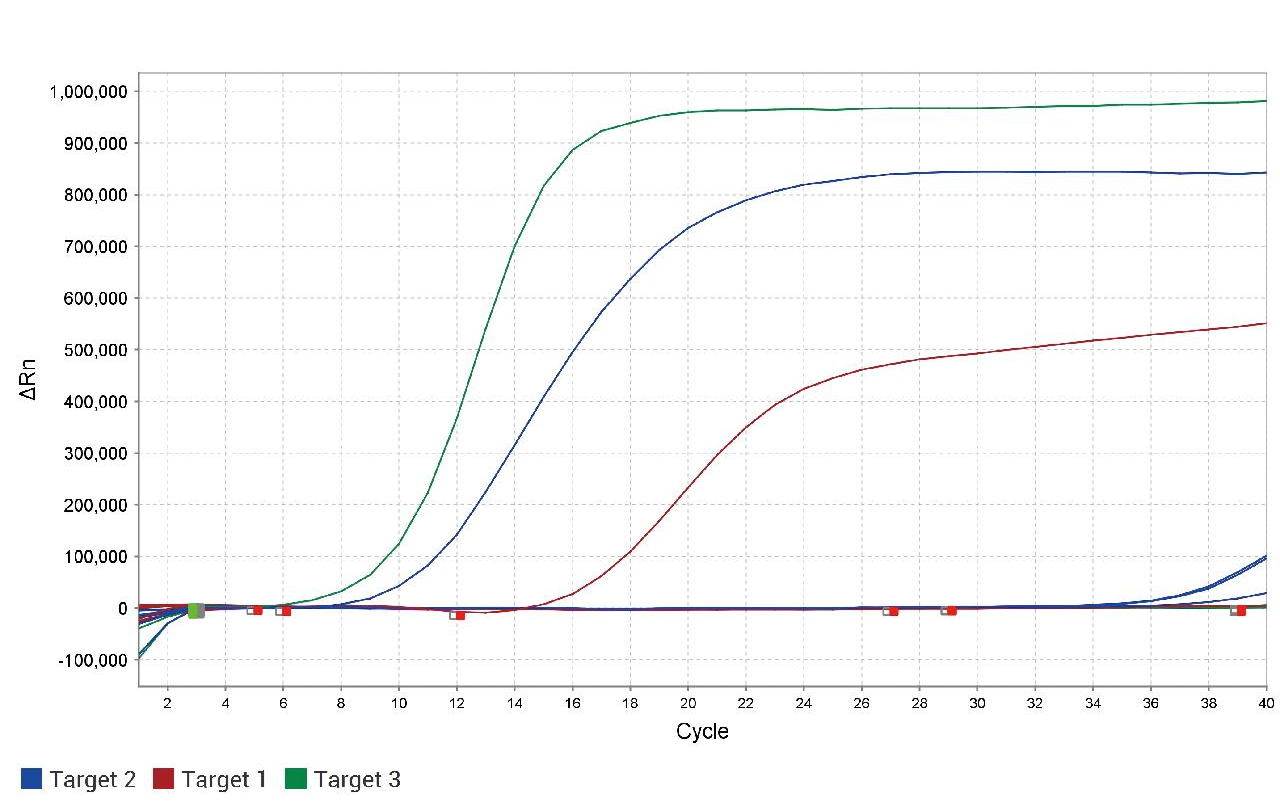
图2 三重荧光定量PCR特异性试验
Fig.2 The specificity results of real-time qPCR
3 讨论
疫苗接种是目前我国畜牧养殖业预防和控制疫病的有效手段之一。由于疫苗生产所采用的原材料大多来源于动物组织、血液等,存在外源性病原微生物污染的风险。外源性污染是指生物制品在生产过程中被细菌、病毒、细胞基质或者生物制品所使用的原辅材料及制品中的细菌、真菌、病毒和支原体污染。例如,牛血清中的牛病毒性腹泻病毒是疫苗中最为常见的外源性污染因子之一[12]。李海娟等[13]通过研究有外源性污染的活疫苗对鸡群的致病性,发现免疫有外源性ALV污染的疫苗是ALV在鸡群中流行的传播途径之一。外源性污染是目前影响我国禽用活疫苗质量的重要因素之一,国外也有多起疫苗中污染ALV或REV的报道[8,14]。20世纪80年代,使用普通鸡胚生产出的禽用活疫苗其支原体阳性率很高[14]。
目前,我国常用的禽用活疫苗的外源病毒检验方法包括细胞检查法、SPF鸡胚检查法和SPF鸡检查法,但是这些传统方法或多或少受到细胞传代、细胞密度、培养条件的影响,存在耗时耗力的缺点。培养法是支原体检测的传统方法,不过培养时间长,因此,开发特异、敏感的分子生物学检测方法有助于快速检测目标病原,有效降低外源病毒污染的风险。孙淼等[15]利用间接免疫荧光法(Indirect immunofluorescence assay, IFA)对污染了REV的鸡痘活疫苗进行检测,确定IFA方法的最低检出量为每500羽份疫苗中污染20TCID50的REV。胡晓苗等[4]利用PCR法检测禽活疫苗中ALV,证实PCR法可作为活毒疫苗中检测ALV污染的有效手段。英聪等[16]建立了可以用于检测兽用疫苗14种支原体的PCR方法。实时荧光定量PCR技术因其灵敏度高、特异性强的特点已经被广泛应用于多个领域,本研究通过对3种目标病原的基因比对分析,设计了引物及探针,为禽用疫苗外源性污染的检测提供了一种新的技术方法。研究结果表明,建立的检测方法对ALV、REV和MG均可以检出特异性,而对于其他病原无扩增,表现出较好的特异性;敏感性试验表明,本研究最低能检测ALV 100 copies/μL,REV和MG可达到10 copies/μL,该方法具有较高的敏感性。本研究在同一反应体系中,可以同时检测3个目标病原,省时省力,实现了对禽用疫苗外源性因子的快速检测,对禽用疫苗的安全把关具有重要意义。
A
B
C
图3 三重荧光定量PCR检测的敏感性试验A.ALV; B.REV; C.MG
Fig.3 The sensitivity results of real-time qPCR A.ALV; B.REV; C.MG
4 结论
综上所述,本研究建立的方法特异性较好、敏感性较高,能够对ALV、REV和MG进行快速、准确的检测,可以满足生物制品生产中外源病毒ALV、REV和MG污染的检测要求,也可用于相关疫病的诊断。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为8.3%。】
参考文献
[1] 李慧姣. 禽用病毒性活疫苗外源病毒污染现状[J]. 中国家禽, 2010, 32(22): 37-38.
[2] Guiilerm O Zavala, Sunny Cheng. Detection and characterization of Avian Leukosis Virus in Marek’s Disease Vaccines[J]. Avian Dis, 2006, 50(2): 209-215.
[3] 邱波, 成子强, 张洪梅, 等. 蛋种鸡中ALV-J、REV感染及相关疫苗的检测[A]. 中国畜牧兽医学会兽医病理学分会第十六次学术研讨会、中国病理生理学会动物病理生理专业委员会第十五次学术研讨会论文集[C]. 山东泰安, 2009: 217-221.
[4] 胡晓苗, 沈学怀, 戴银, 等. PCR法检测活毒疫苗中禽白血病病毒污染[J]. 中国兽医杂志, 2014, 50(09): 23-25.
[5] Awad A M, Abd El-Hamid H S, Abou Rawash A A, et al. Detection of reticuloendotheliosis virus as a contaminant of fowl pox vaccines[J]. Poult Sci, 2010, 89: 2389-2395.
[6] Li J P, Dong X, Yang C H, et al. Isolation, identification, and whole genome sequencing of reticuloendotheliosis virus from a vaccine against Marek's disease[J]. Poult Sci, 2015, 94(4): 643-649.
[7] 王景艳, 李中明, 赵鹏, 等. 禽痘病毒活疫苗中网状内皮组织增生病病毒的分离鉴定及其序列比对[J]. 中国动物传染病学报, 2010, 18(1): 35-39.
[8] Wei K, Sun Z, Zhu S, et al. Probable congenital transmission of reticuloendotheliosis virus caused by vaccination with contaminated vaccines[J]. PLoS One, 2012, 7(8): e43422
[9] 刘轶秋, 徐磊, 张瑞婷. 兽用生物制品支原体检验项近5年抽检情况分析[J]. 中国兽医杂志, 2012, 47(9): 45-47.
[10] 宁宜宝, 冀锡霖. 国内禽用活病毒疫苗中支原体污染的调查报告[J]. 中国兽药杂志, 1993, 27(01): 34-36.
[11] 刘丹, 侯力丹, 李启红, 等. 禽用活疫苗外源病毒污染情况的调查研究[J]. 中国兽药杂志, 2018, 52(04): 19-25.
[12] Falcone E, Tollis M, Conti G. Bovine viral diarrhea disease associated with a contaminated vaccine[J]. Vaccine, 1999, 18(5-6): 387-388
[13] 李海娟. 过去五年10株ALF-J分离株全基因序列分析及接种ALV-J污染的活疫苗对三黄鸡的致病性研究[D]. 广西: 广西大学, 2019.
[14] Jackson C A W, Dunn S E, Smith D I, et al. Proventriculitis, "nakanuke" and reticuloendotheliosis in chickens following vaccination with herpesvirus of turkeys (HVT)[J]. Australian Veterinary Journal, 1977, 53(9): 457-459.
[15] 孙淼, 李岭, 李启红, 等. 鸡痘病毒活疫苗污染禽网状内皮组织增生症病毒的间接免疫荧光法检测研究[J]. 中国兽药杂志, 2018, 52(05): 24-28.
[16] 英聪, 王海光, 刘灿, 等. 检测污染兽用疫苗14种支原体PCR方法的建立及应用[J]. 中国预防兽医学报, 2014, 36(01): 42-45.
(文章类别:CPST-A)







