CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
禽流感病毒H5N1的重组酶介导检测方法学研究
作者:陈淑丹1 廖 静1 王 玲1 罗 鹏1 郭利川2 郑 伟1* 吴忠华1 应清界2
陈淑丹1 廖 静1 王 玲1 罗 鹏1 郭利川2 郑 伟1* 吴忠华1 应清界2
摘 要 采用逆转录-重组酶介导核酸扩增技术(Reverse Transcription Recombinase- aided amplification, RT-RAA)建立检测禽流感病毒H5N1的快速方法。根据禽流感病毒H5N1保守序列设计引物及探针,将H5N1 RNA逆转录为cDNA,然后以cDNA作模板,扩增检测病毒核酸序列。本研究构建了带有H5N1核酸序列的质粒,以此为模板检测不同浓度的质粒,分析该方法的灵敏度,对已知样本进行检测来验证方法的特异性。设计的H5N1特异性引物和探针,能在39℃恒温下,10 ~30 min可有效扩增出相应病毒的核酸,与其他流感病毒无交叉反应;对质粒的检测灵敏度可达10拷贝。建立的RT-RAA检测禽流感病毒H5N1方法灵敏度和特异性均较高,且该方法操作简单,适用于禽流感病毒H5N1的快速检测。
关键词 禽流感病毒H5N1;逆转录-重组酶介导核酸扩增技术(RT-RAA);分子检测
Rapid Detection of H5N1 Avian Influenza Virus Based on RAA Fluorescence Assay
CHEN Shu-Dan1 LIAO Jing1 WANG Ling1 LUO Peng1
GUO Li-Chuan2 ZHENG Wei1* WU Zhong-Hua1 YING Qing-Jie2
Abstract A quick assay of detecting H5N1 avian influenza virus was established through reverse transcription recombinase-aided amplification assay (RT-RAA). H5N1 avian influenza virus RNA was transcribed into the cDNA by a reverse-transcription reaction, which served as template for RAA amplification. We design universal primer and probe according to the conserved nucleic acid sequence of H5N1 virus. Then constructed plasmid and clinical samples were used to evaluate the specificity and sensitivity of the method. The results showed that nucleic acids of H5N1 could be well amplified with specific primer and probe, while nucleic acids of other viruses had negative amplification results. The whole reaction was completed within 30 minutes under constant temperature of 39℃. The study indicates that the RT-RAA method is very sensitive and able to detect 10 copies. The established RT-RAA assay had high sensitivity and specificity, ready-to-hand for rapid detection of H5N1 avian influenza virus.
Keywords H5N1 avian influenza virus; reverse transcription recombinase-aided amplification(RT-RAA); molecular detection
禽流感病毒可通过空气传播,引起急性呼吸道感染[1]。高致病性禽流感H5N1 曾在亚洲、欧洲和非洲引起大量家禽的流感暴发[2]。野生鸟类包括海鸟、海鸥和家鸭被认为是病毒的天然宿主。这些动物可携带禽流感病毒,而不会出现任何疾病迹象[3]。然而,禽流感病毒H5N1 在人类中可引起严重的通常是致命的疾病,其特征是急性肺炎和多器官衰竭[4]。
自2003 年以来,17 个国家向世界卫生组织(WHO)报告了861 例人类感染H5N1 的病例,其中, 大多数病例发生在亚洲国家,而且所有病例的全球病死率超过50%[5]。流行病学研究发现,大多数人类H5N1 感染病例涉及有家禽接触史,例如,屠宰或食用病禽及处理受感染的活禽和死禽[6-7]。尽管报告的人类病例都具有散发性,但由于与家禽密切和频繁的相互作用,人类极易受到H5N1 病毒的侵害。因此,快速和准确地诊断感染,对于及时发现H5N1 病毒并阻断其在暴发初期的传播至关重要。
本研究建立了逆转录- 重组酶介导的等温核酸扩增(Reverse Transcription Recombinase- Aided Amplification, RT-RAA) 一步法检测禽流感病毒H5N1 的方法。
1 材料与方法
1.1 病毒样本
构建的携带禽流感病毒H5N1 基因质粒( 载体为pUC57,Amp 抗性,克隆位点为SmaI),由上海生工合成;呼吸道病原体(乙流病毒,H3N2 病毒及H1N1 病毒),由杭州国际旅行卫生保健中心提供。
1.2 试剂和仪器
试剂包括:RAA 试剂盒( 江苏奇天基因), 病毒RNA 提取试剂盒(life technologies,Ambion 1836),M-MLV 逆转录酶(Promega)。引物和探针由上海生工合成。
仪器包括: 全自动核酸提取仪(Thermo, 型号KinFisher Flex), 实时荧光RT-PCR 仪(ABI 7500),RAA-F1620 仪器(江苏奇天基因)。
1.3 探针和引物设计、质粒构建
在NCBI 网站中找到相应的H5N1 全基因序列, 运用DNASTAR 软件进行BLAST 序列同源性分析, 选出禽流感病毒H5N1 高度保守序列, 如SEQ ID No.5:TAACGGTTGTTTCGAGTTCTATCACAAATGTG ATAATGAATGTATGGAAAGTGTAAGAAACGGAACGT ATGACTACCCGCAGTATTCAGAAGAAGCAAGACTAA AAAGAGAGGAAATAAGT。
以高度保守序列作为检测目的基因,合成阳性质粒并进行引物探针设计;委托生工生物工程(上海) 股份有限公司进行合成质粒。重组质粒通过转接大肠杆菌培养并提取,得到质粒后用超微量紫外分光光度计进行拷贝数计算,按1.0×1010 拷贝/μL 至1.0×101 拷贝/μL 浓度梯度稀释制备模板,备用。
探针采用荧光报告基团和荧光淬灭基团进行修饰。荧光报告基团包括FAM、HEX、TET、JOE、VIC、ROX、Cy3 或Cy5,试验优选FAM 或HEX。荧光淬灭基团包括TAMRA、Eclipse、BHQ1、BHQ2、BHQ3 或DABCYL,试验优选BHQ1 或BHQ2。优选的修饰后探针序列见表1。
1.4 病毒基因组核酸提取
按照抽提说明书提取病毒核酸,浓度测定后分装冻存备用。
1.5 RAA反应
1.5.1 试剂盒组成
基于RAA 荧光法快速检测禽流感病毒H5N1 的试剂盒,包括RAA 荧光基础反应单元、反应缓冲液、阳性质控品、阴性质控品、引物和探针。其中,RAA 荧光基础反应单元为经过低温冷冻干燥的冻干粉, 主要成分为重组酶、单链结合蛋白、DNA 聚合酶、dNTPs 和ATP;反应缓冲液包括以下含量组分:浓度为300 mM 的Tris-HCl 缓冲液(pH=8.0)、120 mM 醋酸钾和质量分数为20% 的PEG 20000;阳性质控品中含有禽流感病毒H5N1 的基因组DNA,浓度为1×104 拷贝/μL;阴性质控品为ddH2O 或纯化水。
1.5.2 反应体系的优化与建立
先对引物和探针的扩增浓度及扩增反应温度进行优化。优化后,配制反应体系。反应体系最终为 50μL,见表1。
表1 RAA扩增反应体系
Table 1 RAA amplification reaction system
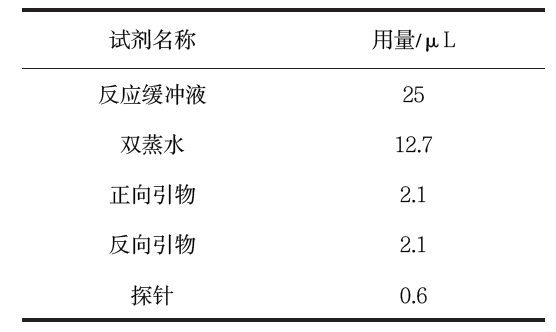
以上溶液混匀后加到 RAA 反应单元冻干粉中, 混匀离心。然后,加入 2.5μL 280 mmol/L 乙酸镁溶液, 以及5μL 样本于RAA 荧光基础反应单元中。最后, 震荡混匀,置于RAA-F1620 荧光检测仪中39℃反应 20 min,仪器每20 s 采集一次荧光值。
1.5.3 结果判读
根据RAA-F1620 检测仪器中的阳性判定方法, 将斜率值K ≥ 20 时,判定为阳性;斜率值K < 20 时, 判定为阴性。斜率值由仪器自动判读。
1.6 灵敏度试验
将携带有H5N1 基因序列的质粒进行稀释,浓度从106 拷贝/μL 倍比稀释到101 拷贝/μL,同时用蒸馏水作为阴性对照,分别按照建立的RAA 扩增体系进行扩增。
1.7 常规荧光PCR仪检测比对
采用上海之江禽流感病毒H5N1 核酸测定试剂盒(荧光PCR 法)作比较,根据试剂盒说明书配置反应体系(19μL 反应液、1μL 酶液),在反应体系中分别加入5μL 阴性质控品、5μL 含有不同浓度的合成质粒为模板(浓度从106 拷贝/μL 倍比稀释到101 拷贝/μL)。加样后每个反应管进行充分混匀,每个反应管总体积为25μL。将反应管放入ABI 7500 荧光PCR 仪中,设定反应条件为45℃ 10 min、95℃ 15 min;再按95℃ 15 s、60℃ 60 s 循环40 次。
1.8 重复性试验
按1.5.2 反应体系配置试剂进行重复性试验,加入5μL 浓度为103 拷贝/μL 的质粒进行扩增,且重复加样3 次,检测荧光信号。扩增反应温度39℃, 反应时间20 min。
1.9 特异性试验
特异性试验中禽流感病毒H5N1 以H5N1 重组DNA 质粒代替,H1N1、H3N2、乙流病毒样本提取病毒RNA,-80℃保存备用。
2 结果及分析
2.1 探针和引物设计
经比对,按照符合RAA 技术要求的原则进行引物及探针设计,根据仪器检测荧光的性能,以及探针的修饰方法优选原则进行筛选和评价,确定上下游引物,见表2。
表2 优化后选出的H5N1引物和探针信息
Table 2 Primers and probes of H5N1 selected after
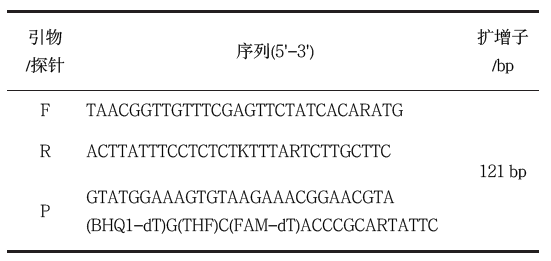
修饰方法:FAM:6-羧基荧光素;THF:四氢呋喃;BHQ:黑洞淬灭剂;phosphate:3' 磷酸盐终止延伸。
Modification method: FAM: 6-Carboxyfluorescein; THF: tetrahydrofuran; BHQ: black hole quencher; phosphate: 3' phosphate to block elongation.
2.2 引物优化
引物原始浓度为10μM,扩增体系中分别加入1.5 L(终浓度为0.30μM)、1.8μL(终浓度为0 . 3 6 0 μ M ) 、2 . 1 μ L ( 终浓度为0 . 4 2 0 μ M ) 、2 . 4 μ L ( 终浓度为0 . 4 8 0 μ M ) 和2 . 7 μ L ( 终浓度为0.540μM),见图1。由图1 可以看出,加入2.1μL 的量,即体系中浓度为0.420μM 时,扩增效果最好。
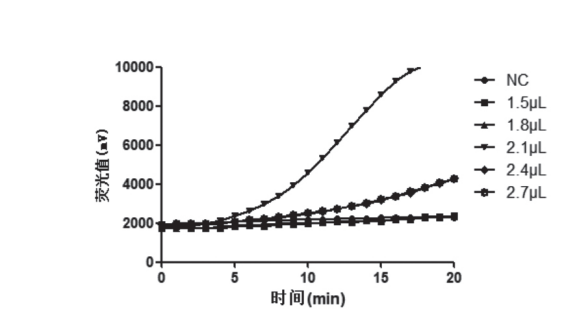
图1 不同引物浓度实验结果(样本:100拷贝/μL质粒)
Fig.1 Amplification results of primer with different concentrations (sample: 100 copies/μL plasmid)
2.3 探针优化
探针原始浓度为100μM,扩增体系中分别加入0.2μL( 终浓度为0.040μM)、0.4μL( 终浓度为0.080μM)、0.6μL(终浓度为0.120μM)、0.8μL(终浓度为0.160μM)及1.0μL(终浓度为0.200μM), 见图2。由图2 可以看出,加0.6μL 的量,即体系中浓度为0.120μM 时,扩增效果最好。
图2 不同引物浓度实验结果(样本:100拷贝/μL质粒)
Fig.2 Amplification results of probe with different concentrations (sample: 100 copies/μL plasmid)
2.4 扩增温度优化
扩增温度选用37℃、39℃及41℃进行比较。从图3 可以看出,在37℃~ 41℃之间进行扩增,扩增效果略有差异,最优选择为39℃。
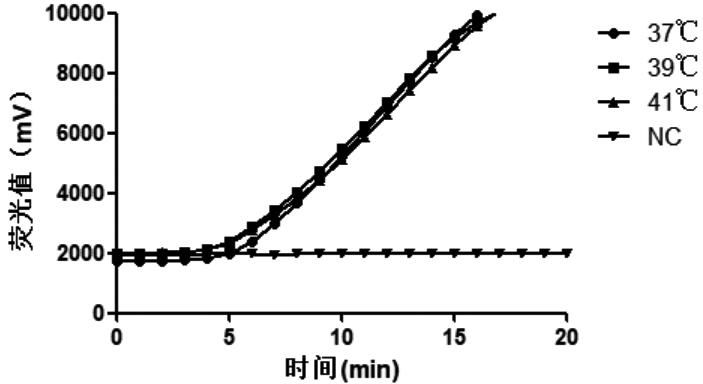
图3 不同温度条件扩增的实验结果(样本:100拷贝/μL质粒)
Fig.3 Amplification results under different temperatures (sample: 100 copies/μL plasmid)
2.5 灵敏度试验
将合成的H5N1 病毒质粒从106 拷贝/μL 倍比稀释到101 拷贝/μL,分别作为模板进行扩增,同时用蒸馏水做阴性对照,扩增结果如图4 所示。
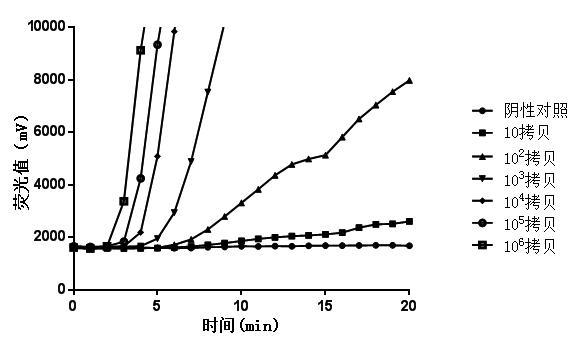
图4 检测不同浓度质粒DNA灵敏度结果
Fig.4 Sensitivity detection results of plasmid DNA with different copies
结果显示,RAA 法检测H5N1 病毒最快5 min 有明显扩增,20 min 内所有管中均有扩增,灵敏度可以达到1.0×101 拷贝,即在每个反应管中存在10 拷贝, 就可以在20 min 内检测出来。
2.6 与荧光PCR仪检测对比
比对试剂为禽流感病毒H5N1 核酸测定试剂盒(上海之江),以不同浓度的携带目的基因的质粒为模板,操作方法参考相应的试剂说明书。上海之江试剂盒扩增结果见图5,图中显示灵敏度下限为1.0×102 拷贝。
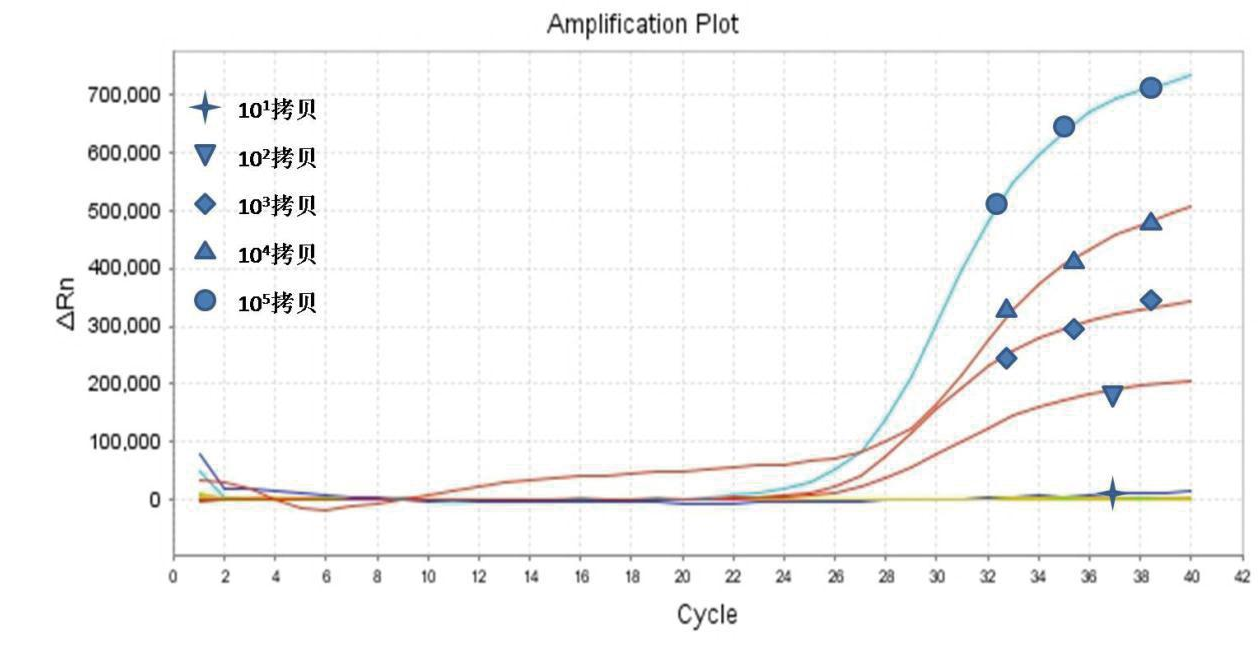
图5 上海之江试剂盒检测H5N1的扩增结果图
Fig.5 Amplification results of H5N1 detected by Shanghai Zhijiang Kit
2.7 重复性试验
不同浓度质粒的扩增反应重复性均较好。图6 所示为103 拷贝的质粒浓度扩增反应的情况。
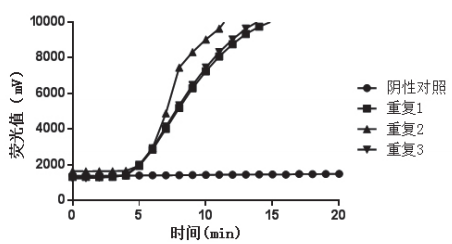
图6 质粒DNA重复性试验结果(103拷贝)
Fig.6 Repeatability test of plasmid DNA(103 copies)
2.8 特异性试验
检测H5N1 时,与其他呼吸道病毒,如乙流病毒、H1N1、H3N2 病毒均无交叉反应,可以很好地进行鉴别,如图7 所示。
图7 RAA检测禽流感病毒H5N1的特异性试验结果
Fig.7 Specific detection of H5N1 and other viruses using RAA method
3 结论
世界卫生组织一直在监测全球流感疫情,监测数据显示,H1N1、H3N2 和两种B 型Victoria 和Yamagata 病毒在世界各地广泛传播,造成每年67 万人死亡[8]。在过去的几年里,人类感染几种亚型禽流感病毒(如H5 型和H7 型禽流感)的情况偶尔出现[9]。自1997 年以来,高致病性禽流感H5N1 和H5N6 病毒已感染878 人,死亡率为53%[10]。截至2019 年4 月, 感染该病毒的人数已增加到1567 人[11]。
除了预防,准确地检测和诊断是防止病毒进一步扩散和疫情暴发的有效手段。近年来,许多研究利用生物传感器检测病毒[12],Wang Y 等提出了一种基于表面增强拉曼散射的数字微流体技术的免疫测定方法,可以灵敏地检测出H5N1 病毒[13]。另外,有学者使用反转录循环介导的等温扩增(RT-LAMP)诊断平台,采用比色可视化方法直观地检测H5N1 病毒[14]。这些方法都为改进和帮助流感感染的诊断,以及提高临床医生诊疗速度提供了帮助。
本研究提供了一种基于恒温扩增的荧光法检测禽流感病毒H5N1。该方法能够准确地鉴定禽流感病毒H5N1,且操作方便,检测时间短,无须训练有素的工作人员来执行,也无需通过高温变性、退火和延伸三阶段,只需在37℃~ 42℃下进行等温扩增即可完成检测。相比LAMP 技术,该方法无需复杂的引物设计,或使用多组引物在65℃情况下进行扩增。
检测试剂盒所用的检测方法快速,容易实现高通量,同时降低了检测成本。研究表明,提供的基于RAA 荧光法快速检测禽流感病毒H5N1 的试剂盒,检测禽流感病毒H5N1 时与其他流感病毒,如H1N1、H3N2、乙流病毒无交叉反应,特异性强,且不需要大型仪器设备,适用于现场检测或大规模筛选。
【该文经CNKI 学术不端文献检测系统检测,总文字复制比为4.6%。】
基金项目:海关总署科研项目(2019HK139)
通讯作者:郑伟(1979—),男,汉族,杭州人,博士,主任医师,主要从事口岸病原体检测工作,E-mail:30705177@qq.com
1.杭州国际旅行卫生保健中心(杭州海关口岸门诊部) 杭州 310012
2.江苏奇天基因生物科技有限公司 无锡 214135
1. Hangzhou International Travel Healthcare Center(Hangzhou Customs Port Outpatient Departments), Hangzhou 310012
2. Jiangsu Qitian Gene Bio-Sci&Tech Co.Ltd, Wuxi 214135
参考文献
[1] Brankston G, Gitterman L, Hirji Z, et al. Transmission of influenza A in human beings[J]. Lancet Infect Dis. 2007, 7(4): 257-265.
[2] OIE. Update On Avian Inflfluenza in Animals (Types H5 and H7). Available online: https://www.oie.int/animal-health-in-the-world/update-on-avian-inflfluenza/ (accessed on 15 September 2019).
[3] Hulse-Post, D.J., Sturm-Ramirez K.M., Humberd J., et al. Role of domestic ducks in the propagation and biological evolution of highly pathogenic H5N1 influenza viruses in Asia[J]. Proc. Natl. Acad. Sci. USA 2005, 102: 10682-10687.
[4] Tran, T.H. , Nguyen T.L. , Nguyen T.D. , et al. Avian influenza A (H5N1) in 10 patients in Vietnam[J]. N. Engl. J. Med. 350, 1179–1188 (2004).
[5] WHO. Cumulative Number of Confifirmed Human Cases of Avian Inflfluenza A(H5N1) Reported to WHO. Available online: https://www.who.int/inflfluenza/human_animal_interface/2019_09_27_tableH5N1.pdf?ua=1.%202019 (accessed on 10 October 2019).
[6] Beigel, J.H. , Farrar J, Han A.M. , et al. Avian inflfluenza A (H5N1) infection in humans[J]. N. Eng. J. Med. 2005, 353(13): 1374-1385.
[7] Dinh, P.N. , Long T.H. , Tien N.T.K. , et al. Risk factors for human infection with avian inflfluenza A H5N1, Vietnam, 2004[J]. Emerg. Infect. Dis. 2006, 12(12): 1841-1847.
[8] Influenza (Seasonal) Fact sheet. https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal) .
[9] Influenza (Avian and other zoonotic) Fact sheets. https://www.who.int/news-room/fact-sheets/detail/influenza-(avian-and-other-zoonotic).
[10] EMPRES Global Animal Disease Information System. http://empres-i.fao.org/eipws3g/.
[11] H7N9 situation update. http://www.fao.org/ag/againfo/programmes/en/empres/h7n9/situation_update.html.
[12] Han D, Wei C. A molecular beacon based on DNA-templated silver nanoclusters for the highly sensitive and selective multiplexed detection of virulence genes[J].Talanta, 2018,181: 24-31.
[13] Wang Y, Ruan Q Y, Lei Z C, et al. Highly Sensitive and Automated Surface Enhanced Raman Scattering-based Immunoassay for H5N1 Detection with Digital Microfluidics[J]. Analytical Chemistry, 2018, 90(8): 5224-5231.
[14] Ahn S.J. , Baek Y.H. , Lloren K.K.S. , et al. Rapid and simple colorimetric detection of multiple influenza viruses infecting humans using a reverse transcriptional loop mediated isothermal amplification (RT-LAMP) diagnostic platform[J]. BMC Infectious Diseases 2019, 19: 676.
(文章类别:CPST-C)








