CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
高效液相色谱质谱联用法检测牛血液4种β-受体激动剂残留
作者:刘建利1 梁玉婵1 赵锋1 史卫军1
刘建利1 梁玉婵1 赵锋1 史卫军1
摘 要 建立检测牛血液样品中莱克多巴胺、克伦特罗、沙丁胺醇和马布特罗等4种β-兴奋剂类药物的高效液相色谱质谱联用方法(LC-MS/MS)。采用β-葡萄糖醛酸苷酶对牛血液样品进行水解,采用pH 5.2的乙酸钠溶液对样品进行提取,通过固相萃取柱净化样品,浓缩提取物。在正离子模式下,采用多反应监测(MRM)模式对β-受体激动剂进行定性和定量分析,通过三个浓度水平(0.5μg/L、1.5μg/L、4.0μg/L)进行验证试验。所得样品回收率在95.4%~101.9%之间,相对标准偏差(RSD)在0.84%~8.56%。该方法具有简便、准确的优点,各项技术指标均符合国内外法规的要求,能够确证检测牛血液中β-受体激动剂类药物残留。
关键词 牛血液;β-受体激动剂类;多残留;液相色谱串联质谱仪;测定
Determination of Four Kinds of β-agonists in Bovine Blood by High Performance Liquid Chromatography-tandem Mass Spectrometry
LIU Jian-Li1 LIANG Yu-Chan1 ZHAO Xian-Feng1 SHI Wei-Jun1
Abstract To establish a liquid chromatography-mass spectrometry(LC-MS/MS)method for the determination of four kinds of β-agonists including ractopamine, clenbuterol, salbutamol and mabbuterol in bovine blood samples. Bovine blood samples were hydrolyzed with β-Glucuronidase, then the samples were extracted with sodium acetate solution of pH 5.2 and purified by solid phase extraction column, and the extract was concentrated.In positive ion mode, β-agonists were qualitatively and quantitatively analyzed using multiple reaction monitoring (MRM) models, and validation tests were performed at three concentrations levels (0.5μg/L, 1.5μg/L, 4.0μg/L). Results: The results showed that the recovery rate was 95.4%-101.9%, and the relative standard deviation was 0.84%-8.56%. This method has the advantages of simplicity and accuracy, all technical indicators are in line with the requirements of domestic and foreign laws and regulations, and can confirm the detection of β-agonist drug residues in bovine blood.
Keywords Bovine blood;β-agonists;Multi-residue;Liquid chromatography tandem mass spectrometry;Determination
β-受体激动剂,又名“瘦肉精”,在动物养殖中,当用药剂量达到治疗剂量5~10倍且长期使用时,可抑制动物体内脂肪沉积和促进蛋白质合成[1-2]。虽全球范围内已将其列为违禁药品,却陆续出现了其他的以β-受体激动剂作为替代物被违禁使用,使人类的健康安全受到极大影响。β-受体激动剂(β-agonists)是肾上腺素β受体激动剂的简称,是一类具有肾上腺素功能的苯乙醇胺类药物,可与动物机体大部分组织细胞膜上的β受体相结合而得名。本实验所涉及的4种β-受体激动剂分子结构见表1。关于检测防控β-受体激动剂的研究在动物食品安全领域一直是热门项目。
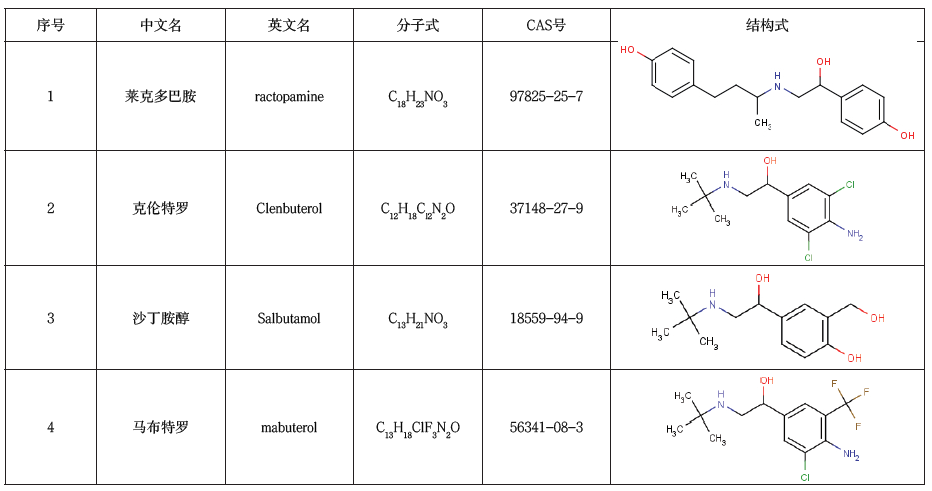
表1 β-受体激动剂类药物的分子结构信息表
Table 1 Molecular structure information of β-agonists drugs
当前,国内外对“瘦肉精”的研究大部分是针对猪展开的,相对较少有关于其他家畜。近年来,出于利益的驱使,部分无良商家也开始在肉牛上非法使用“瘦肉精”,在国内发生的一些“瘦肉精”中毒事件和报道不仅与猪肉有关,也与牛肉相关,甚至在部分地区,“瘦肉精”在肉牛上的使用已相当普遍。
在日常和进出口贸易中,直接宰杀活体家畜(尤其牛、羊、猪、马等)以获取检测样品需要相当高的费用支出,会给货主造成很大的经济压力,使得采集动物组织、内脏等样本难以进行。以动物尿液作为样品进行检测,家畜在采集尿液时会发生较大应激反应,且家畜排尿时间具有不固定性。以动物血液作为检测样品可以消除上述因素的影响,同时采血对待检动物的伤害相对较小,更加有利于开展屠宰前检测。因此,本研究建立检测牛血液中4种β-受体激动剂残留的仪器确证方法,节省人力物力,快速准确的测定违禁药物,进而确保动物源性食品的安全,保障消费者身体健康。
1 实验方法与仪器设备
1.1 材料与仪器
1.1.1 试剂
β-Glucuronidase/Arylsulfatase(葡萄糖醛酸苷酶,以下简称β-G);乙腈(Acetonitrile);甲醇(Methanol);氨水(NH3(aq));醋酸钠(Sodium acetate,乙酸钠);醋酸铵(Ammonium acetate,乙酸铵);乙酸(Acetic acid);一级水(符合GB/T 6682-1992要求);克伦特罗,纯度98%,LGM公司;莱克多巴胺,纯度97%,Dr.E 公司;沙丁胺醇,纯度98%,CARBOMER公司;马布特罗,纯度98%,LGM Pharma公司;沙丁胺醇-D3,纯度98.4%,WITEGA公司;克伦特罗-D9,纯度99.6%,WITEGA公司;氘代莱克多巴胺-D6,纯度97%,CDN公司。
1.1.2 仪器
HPLC-MS仪(Waters,ACQUITY UPLC/Xevo TQ-S);漩涡混合仪(Thermo,15920D);电子天平(sartorius);高速离心机(BECKMAN,Avanti);超声波仪(SinapTec);台式PH计(Thermo);恒温摇床(SI);多功能全自动氮吹浓缩仪(Biotage);机械真空泵(Leybold);固相萃取(以下简称SPE)仪(Supelco);移液枪若干。
1.2 方法
1.2.1 样品提取
取新鲜牛血液加入含抗凝剂的试管中,混匀,5000 r/min低温离心10 min,取上层血浆。取5 mL血浆于50 mL离心管中,用100μL的移液枪取100μL内标液(100 g/L)以及β-G酶50μL,再取乙酸钠溶液( 0.2 mol/L)15 mL,震荡10 min混匀,于37℃、220 r/min的摇床上振荡过夜酶解18 h,置于常温下降至室温,离心10 min,用容量适宜的清洁离心管盛放所得液体。精准量取混合后的β-受体激动剂标准工作溶液,将其加到5 mL空白家畜血浆中,使所配液体的终浓度分别为0μg/L、0.5μg/L、1.0μg/L、2.0μg/L、5.0μg/L、10.0μg/L,然后按1.2.1进行前处理。
1.2.2 萃取净化
将真空泵连接到SPE装置,安装萃取柱,在柱下阀门关闭的条件下,加甲醇6 mL后进行活化约十分钟,打开阀门,流完再加入6 mL水,离心液过柱。待样液全部流干,用6 mL的H2O和6 mL的甲醇水(Water Methanol)淋洗,待甲醇水流干,抽真空5 min以上,倒去萃取装置内的废液,换上干净的15 mL离心管。再量取氨水甲醇溶液4mL对萃取液进行洗脱,抽真空至少5 min,达到抽干效果。将洗脱下来的样液置于45℃的吹氮浓缩仪氮气吹干,加入1 mL甲酸水-甲醇(9:1)溶液,旋涡震荡均匀,取全部样液过0.22μm滤膜于进样小瓶中,盖上盖子,上机。
1.3 测定条件设定
1.3.1 液相色谱条件
色谱柱:Waters ACQUITY UPLC BEH C18,1.7μm,2.1×50 mm Column;流动相A:5 mm醋酸铵溶液(0.1%甲酸水),流动相B:甲醇;流速:0.4 mL/min;柱温:36℃;进样量:2μL;流动相及梯度洗脱条件:见表2。
表2 流动相及梯度洗脱条件
Table 2 Mobile phase and gradient elution conditions
时间/time | 流动相A% | 流动相B% |
0.00 | 95 | 5 |
3.00 | 50 | 50 |
4.00 | 10 | 90 |
5.50 | 95 | 5 |
1.3.2 质谱条件:详见表3、表4。
表3 质谱条件
Table 3 Mass spectrometry conditions
电离方式 | ESI+ | 分辨率 | 单位质量分辨率 |
毛细管电压 | 500 V | 去溶剂气流 | 氮气,15 L/min |
锥空气流量 | 2.5 L/min | 碰撞气 | 氮气 |
毛细管温度 | 500 V | 去溶剂气温度 | 500℃ |
离子源温度 | 120℃ | 监测模式 | 多反应监测(MRM) |
表4 多反应监测条件
Table 4 Multiple reaction monitoring conditions
化合物 | 母离子 | 子离子 | e | 能量 | 时间 | 窗口 |
莱克多巴胺 | 302.2 | 164.2* | 28 | 14 | 2.95 | 1 |
107.1 | 30 | 29 | 1 | |||
(Ractopamine-D3) | 308.2 | 168.1 | 30 | 14 | 2.93 | 1 |
克伦特罗 | 277.2 | 259.3 | 24 | 10 | 3.17 | 1 |
203.2* | 24 | 14 | 1 | |||
132.2 | 24 | 24 | 1 | |||
(Clenbuterol-D9) | 286.2 | 204 | 36 | 19 | 3.15 | 1 |
沙丁胺醇 | 240.2 | 222.2 | 24 | 10 | 1.84 | 1 |
166.2 | 24 | 13 | 1 | |||
148.1* | 24 | 20 | 1 | |||
(Salbutamol-D3) | 243.1 | 151 | 32 | 18 | 1.83 | 1 |
马布特罗 | 311.0 | 237.1* | 35 | 24 | 3.54 | 1 |
217.1 | 35 | 36 | 1 |
注:离子右上角标“*”为定量用
2 结果与分析
2.1 流动相选取和优化
选取0.1%的甲酸水-甲醇,可完全分离本实验所涉及的所有种类β-受体激动剂,且其所显示的峰形良好,质谱响应佳。甲酸(0.1%)在流动相中的作用是可以明显提效β-受体激动剂的离子化,达到更好的灵敏度,此外,因为在前处理时使用了酸碱,可能会发生色谱峰漂移现象,通过该步骤优化也可以一并消除其影响。鉴于以上结果,将其作为分析用流动相。同时,采用梯度洗脱方式,β-受体激动剂类化合物达到上佳的色谱分离结果(图1),5 min即可完成单次分析工作。
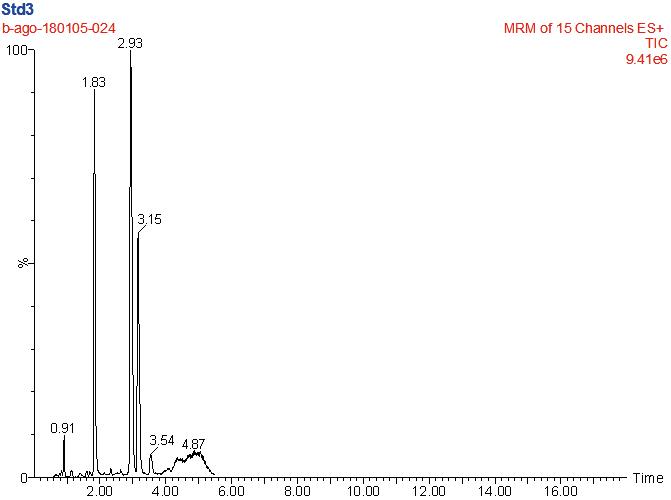
图1 β-受体激动剂剂类药物的总离子流图
Fig.1 Total ion chromatogram of β-agonists drugs
2.2 质谱条件优化
配制β-受体激动剂类化合物标准液(1 mg/L),在正离子模式(positive ion mode)下,先全扫描母离子以确定上述4种受体激动剂的分子离子;再把上述分子离子作为母离子,再次全扫描,其中体现较好的丰度、所受干扰更轻微的2对子离子可作为定量和定性离子。经过上述步骤后还需优化质谱参数,本实验选择多反应监测(MRM)正离子模式,使之达到最佳多反应监测条件(见表4)。
2.3 样品基质效应消除
对空白样品进行前处理,在所得的提取溶液里加入标准溶液,以降低样品的基质效应。样品基质对大气压喷雾电离离子源(ESI)的干扰影响,消除该效应,使标准溶液和样品溶液的离子化条件保持一致(见图2、3)。
2.4 回归方程、线性范围和定量限
用克伦特罗-d9、莱克多巴胺-D6、沙丁胺醇-D3分别作为克伦特罗、莱克多巴胺、沙丁胺醇的内标,马布特罗用外标法。4种β-受体激动剂浓度在0.5~10.0 μg/L范围时,峰面积与目标化合物浓度呈现良好的线性关系。向空白基质样品中添加浓度为0.5 g/L的β-受体激动剂类时,所测谱图中待测化合物响应值的信噪比>10。不同基质牛血中β-受体兴奋剂药物的相关系数、回归方程、线性范围、定量限(LOQ)(见表5,图4)(y为峰面积,x为待测物的浓度,μg/L),本方法满足β-受体激动剂类残留检测的要求。
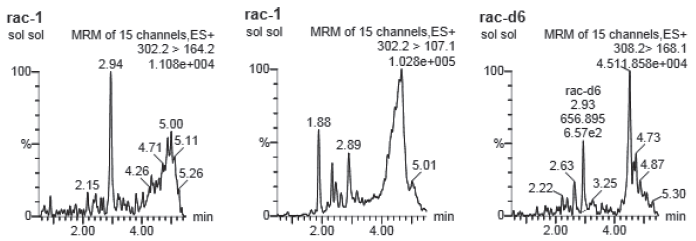
图2 牛血空白样品莱克多巴胺质谱图
Fig.2 Mass spectrum of ractopamine in blank bovine blood sample
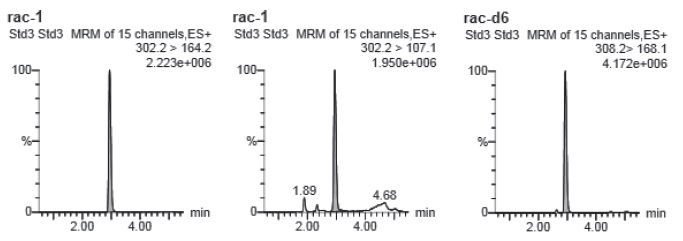
图3 牛血加标样品莱克多巴胺质谱图(1.0μg/L)
Fig.3 Mass spectrum of ractopamine in bovine blood sample(1.0μg/L)
表5 β-兴奋剂类药物定量离子的回归方程、相关系数及定量限
Table 5 Regression equations, correlation coefficients and LOQs for β-stimulant drugs
样品名 | 待测物 | 相关系数 | 回归方程 | 线性范围 (μg/L) | 定量限 (μg/L) |
牛血 | 莱克多巴胺 | 0.9998 | y = 0.522443X + 0.00277827 | 0.5~10 | 0.5 |
克伦特罗 | 0.9989 | y = 0.386393X + 0.00453609 | 0.5~10 | 0.5 | |
沙丁胺醇 | 0.9981 | y = 0.0779421X + 0.00553835 | 0.5~10 | 0.5 | |
马布特罗 | 0.9977 | y = 27157.3x + -342.812 | 0.5~10 | 0.5 |
2.5 方法的回收率与相对标准偏差
实施添加回收试验验证回收率和相对标准偏差。采用空白牛血样品(不含有待测β-受体激动剂类药物),设置3个梯度的浓度水平(0.5μg/L、1.5μg/L、4.0μg/L),各梯度分别取平行样6个,所得到的回收百分比与RSD数据如下(见表6)。由此可以看出,本实验所采取的方法,总体平均回收率介于95.4%~101.9%之间;同时,RSD在0.84%~8.56%,该结果符合残留检测的要求。
3 讨论
当前,对食用动物进行β-受体激动剂残留检测的主要方法是尿液检测,但对动物采尿过程产生的应激反应可能对采样工作造成一定影响。本研究采用β-G酶解,乙酸钠缓冲液提取,SPE净化,串联HPLC-MS检测,建立了牛血液中4种β-受体激动剂残留的HPLC-MS/MS联用测定方法。在实验实施过程中选取了甲酸作为流动相,甲酸(0.1%)在流动相中的作用是可以明显提效β-受体激动剂的离子化,达到更好的灵敏度;质谱条件经过步骤优化和质谱参数优化后,已达到最佳多反应监测条件;样品基质对大气压喷雾电离离子源(ESI)的干扰影响,消除该效应,使标准溶液和样品溶液的离子化条件保持一致。
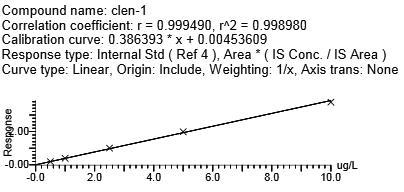
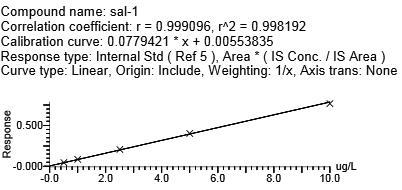
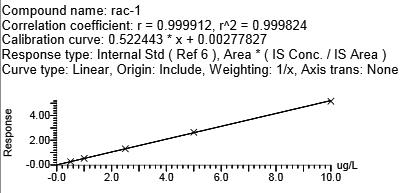
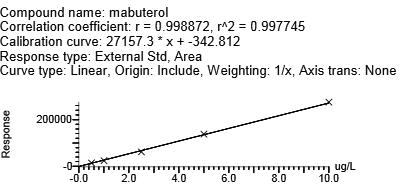
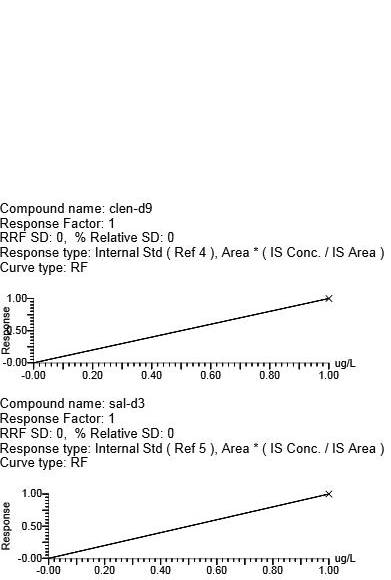
图4 牛血清基质标准曲线
Fig.4 Bovine serum matrix standard curve
表6 牛血样品中4种β-兴奋剂类药物回收率(%)与相对标准偏差(%)
Table 6 Recoveries(%) and RSD(%) of 4 kinds ofβ-stimulant drugs in bovine blood sample
化合物 | μg/L | 测定次数 | μg/L | % | (RSD)% | |||||
1 | 2 | 3 | 4 | 5 | 6 | |||||
莱克多巴胺 | 0.5 | 0.505 | 0.496 | 0.498 | 0.497 | 0.505 | 0.497 | 0.4997 | 99.9 | 0.84 |
1.5 | 1.588 | 1.488 | 1.559 | 1.511 | 1.514 | 1.510 | 1.528 | 101.9 | 2.44 | |
4.0 | 3.932 | 3.990 | 3.870 | 3.920 | 3.872 | 3.950 | 3.922 | 98.1 | 1.18 | |
克伦特罗 | 0.5 | 0.498 | 0.488 | 0.507 | 0.509 | 0.473 | 0.504 | 0.497 | 99.3 | 2.76 |
1.5 | 1.455 | 1.444 | 1.477 | 1.467 | 1.507 | 1.474 | 1.471 | 98.0 | 1.47 | |
4.0 | 3.942 | 3.953 | 3.930 | 3.986 | 3.931 | 3.961 | 3.951 | 98.8 | 0.54 | |
沙丁胺醇 | 0.5 | 0.484 | 0.491 | 0.395 | 0.495 | 0.489 | 0.507 | 0.477 | 95.4 | 8.56 |
1.5 | 1.520 | 1.496 | 1.503 | 1.496 | 1.500 | 1.437 | 1.492 | 99.5 | 1.90 | |
4.0 | 3.903 | 3.970 | 3.857 | 3.918 | 3.882 | 3.974 | 3.917 | 97.9 | 1.20 | |
马布特罗 | 0.5 | 0.505 | 0.514 | 0.521 | 0.448 | 0.526 | 0.533 | 0.508 | 101.6 | 6.08 |
1.5 | 1.365 | 1.494 | 1.322 | 1.463 | 1.497 | 1.490 | 1.439 | 95.9 | 5.27 | |
4.0 | 4.008 | 3.945 | 3.984 | 3.931 | 3.994 | 3.879 | 3.957 | 98.9 | 1.22 | |
实验证明,高效液相色谱质谱联用法检测牛血中4种β-受体激动剂残留,可以对尿检方法形成有效补充和替代。
此外,相对于尿液检测,血液检测具有可检测物质更多、可对假阳性进行确认等优势,相关检测项目有待进一步研究探索。
4 结论
本研究在建立牛血液中4种β-受体激动剂残留的HPLC-MS联用测定方法的基础上,对于前处理的提取条件、HPLC和MS分离效率进行了优化设计和有针对性地研究。经上述实验证明,这种新方法的优化平均回收率数值在95.4%~101.9%,相对标准偏差(RSD)为0.84%~8.56%,其专一性、线性范围、回收率、精密度、定量限均符合国内外相关法规的要求。该方法简便、快速、准确,可用于牛血中4种β-受体激动剂残留的仪器确证检测。
【该文经 CNKI 学术不端文献检测系统检测,总文字复制比为 2.2%。】
基金项目:国家重点研发计划项目(2017YFD0501805)
第一作者:刘建利(1982—),男,山东人,硕士研究生,高级兽医师,从事动物疫病与药物残留检测工作,E-mail:56546521@qq.com
1.深圳海关动植物检验检疫技术中心 深圳 518405
1. Animal and Plant Inspection & Quarantine Technology Center of Shenzhen Customs District,Shenzhen 518045
参考文献
[1] 庄宏, 杨红建, 曹兵海. 盐酸克伦特罗在牛体不同组织中的代谢和残留分析综述[J]. 中国农业大学学报, 2010, 15(2): 35-39.
[2] 刘佳, 张凯, 龙瑞军, 等. 不同β-受体激动剂添加模式对肉牛血液生化指标和激素水平的影响[J]. 中国畜牧兽医, 2017, 44(09): 2638-2643.
(文章类别:CPST-C)







