CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
天津空港经济区枣疯病植原体的分子鉴定
作者:唐 芳1 牛春敬1 王仲敏1 冯 洁1 廖 芳1 高 建1 胡佳续1*
唐 芳1 牛春敬1 王仲敏1 冯 洁1 廖 芳1 高 建1 胡佳续1*
摘 要 利用分子生物学技术对天津空港经济区枣疯病样品进行分类鉴定。采用植原体 16S rDNA 通用引物 R16mF2/ R16mR1 对患病植株总 DNA 进行 PCR 扩增,得到约 1.4 kb 特异性片段。经克隆测序、Blast 比对和系统进化树构建分析,结果表明,天津空港枣疯病植原体 16S rDNA 基因片段长 1432 bp,与国内枣疯病植原体 Jinsimizao 株系相似性最高,达99.93 %,归属于 16Sr Ⅴ 组 (Elm yellows group,榆树黄化组 )。本研究首次在天津空港地区检测到了枣疯病植原体,可为植原体病害流行学分析以及病害防治提供参考。
关键词 枣疯病;植原体;分子鉴定;16S rDNA
Molecular Identification of Phytoplasma Associated with Jujube Witchs' Broom in Tianjin Air Port Economic Area
TANG Fang1 NIU Chun-Jing1 WANG Zhong-Min1 FENG Jie1 LIAO Fang1 GAO Jian1 HU Jia-Xu1*
Abstract The pathogenic agent of jujube witches' broom (JWB-TJKG) collected from Tianjin air port economic area was identified by molecular biology. Universal phytoplasma primer pairs R16mF2/R16mR1, were used to amplify 16S rDNA by PCR, specific fragment about 1.4 kb was yielded in the end. After cloning andsequencing, blast searching and phylogenetic tree analysis, the result showed that the JWB-TJKG consists of 1432 bp in 16S rDNA gene, which shared the highest similarity (99.93%) with the strain of JWB -Jinsimizao, and belongs to Elm yellows group (16Sr Ⅴ group). This paper is the first report to detect jujube witches' broom in Tianjin air port economic area, which provides a reference for epidemic analysis and prevention of phytoplasma disease.
Keywords jujube witches' broom;phytoplasma;molecular identification;16S rDNA
枣树(Ziziphus jujuba Mill),属于鼠李科枣属植物,源于中国,已有两千多年的种植历史,除营养价值外,还是街道绿化、农田防护、果粮间作、水土保持的优良树种[1]。枣疯病(Jujube Witches' Broom Disease)是枣树最严重的病害之一,病树轻者减产减值,重者绝产绝收,甚至死亡。枣树一旦发病,难以根治。其主要症状是叶片纤细,枝条节间缩短,叶腋间生长出细小的叶芽,变成丛生枝叶,并且叶片黄化,花变异,局部枝条或全株枯死[2]。
我国在20世纪50年代对枣疯病病原开始进行研究,最早认为病原是病毒,1981 年将其病原认定为类菌原体,在1994年召开的国际菌原体组织大会,将其更名为植原体(phytoplasma)[3]。根据核糖体蛋白(rp)和16S rRNA基因序列,中国枣疯病植原体属于16SrⅤ-B亚组(榆树黄化组B亚组)[4]。陈妮等依据secA 基因序列,对山东省11个地区的枣疯病样品进行系统进化分析,结果显示该基因变异相对较大,适合用于划分亲缘关系较近的亚组,有利于植原体的分类鉴定 [5]。王洁等对山东枣疯病植原体的全基因组进行测序,结果发现其环状染色体全长750803 bp,GC含量23.3%,包含694个蛋白编码基因,2个rRNA操作子基因,4个潜在移动单元(PMUs)[6]。
枣树在天津种植广泛,是农业生产、园林绿化的优良树种。近些年来,全国多个主产区有枣疯病发生,天津鲜有报道。2019年9月在天津空港地区首次发现枣疯病病株,并采集到了具有典型丛枝黄化症状的枣树样品,提取样品总DNA,使用通用引物R16mF2/R16mR1,针对总DNA中16S rDNA 基因进行核酸扩增,对扩增产物进行测序,将测序结果导入数据库进行比对,与已报道的其他地区枣疯病植原体以及其他植原体序列,一同构建系统发育进化树。本研究有助于了解天津地区枣疯病植原体基因变异及遗传进化,为植原体病害流行发生规律研究以及病害防控措施制定提供参考。
1 材料与方法
1.1 材料
2020年9月,在天津空港经济区农贸市场院内,随机从患病枣树植株上采集枝条叶片,对其表面进行清洗,置于4℃保藏。核酸扩增采用PCR预混合溶液(TaKaRa公司)、克隆质粒和感受态细胞分别是pMD18-T(TaKaRa公司)及E.coli Competent Cell DH5a(TaKaRa公司),核酸提取采用高效植物基因组DNA 提取试剂盒(DP350)(天根生化科技),PCR 产物回收采用琼脂糖凝胶DNA回收试剂盒(DP219)(天根生化科技),质粒回收采用快速质粒提取试剂盒(DP105)(天根生化科技)。
1.2 植物总DNA提取
称取2g新鲜枣树叶片,用蒸馏水清洗叶片,用滤纸吸干水分,置于研钵中,液氮研磨成粉末,参照高效植物基因组DNA 提取试剂盒说明书,提取和纯化植物样品中的总DNA,于-20℃冰箱保存备用。
1.3 PCR扩增、克隆及序列测定
利用植原体16S rDNA基因引物 R16Fm2/ R16mR2(5'-CATGCAAGTCGAACGG-3'/5'-CTTAACCCCAATCATCGAC-3')[7],对植株总DNA进行扩增。
反应体系(25 μL): EmeraldAmp Max PCR Master Mix(2X)12.5 μL,引物(10 μmol/L)各1.0 μL,DNA 模板(30 ng/μL)1.0 μL,双蒸水 9.5 μL。扩增条件为:94℃ 4 min;94℃ 30 s,55℃ 30 s, 72℃ 1 min,共35 个循环;最后72℃ 7 min[8]。
使用2.0 % 琼脂糖凝胶电泳检测PCR产物,回收纯化目标产物,操作过程参照天根琼脂糖凝胶DNA回收试剂盒说明书(DP219),连接载体参照TaKaRa pMDTM18-T Vector说明书(D101A)。挑选阳性克隆质粒进行核酸测序。
1.4 序列分析及同源性比较
使用Mega 6.0 分子进化遗传分析软件,将测得序列与数据库序列进行多重比对,同源性分析,选择Neighbor-Joining(邻接法)构建系统进化树。
2 结果与讨论
2.1 枣疯病症状观察结果

A

B

C

D

E

F
图1 A~D:枣疯病症状图; E、F:健康枣树叶片
Fig.1 A-D: Symptoms of Jujube Witches' broom; E,F: Healthy Jujube leaves
2.2 PCR检测结果
发病植株总DNA 经直接PCR扩增后,得到大小为1400 bp左右 的特异性片段,片段大小与预期结果相符,而健康枣树样品和双蒸水空白对照均未出现任何扩增条带(图2)。将此检测到的植原体样品命名为枣疯病植原体天津空港株系(JWB-TJKG)。
2.3 基因序列分析
将JWB-TJKG 的16S rDNA 基因片段克隆,测序结果表明该扩增片段含有1432个核苷酸,碱基G+C的含量为45.9%。将该序列导入GenBank ,使用BLAST 程序对其进行同源性检索,结果显示JWB-TJKG与16SrⅤ组(Elm yellows group,榆树黄化组)中的植原体16S rDNA序列相似度均达到99%以上。其中与16SrⅤ-B组,来源于河北省枣疯病植原体Jinsimizao株系(登录号GU184185.1)相似度最高,为99.93%,与同组的重阳木丛枝植原体、榆树黄化植原体和樱桃致死黄化植原体相似度为99.86%,与桃树黄化植原体相似度为99.74%,与葡萄金黄化植原体相似度为99.65%,而与其它组植原体的相似度均在97%以下,表明JWB-TJKG应归属于16SrⅤ组。
2.4 天津空港枣疯病植原体系统树构建与分析
收集已发布的部分植原体16S rDNA基因序列下,与JWB-TJKG所测定的16S rDNA 序列进行同源性分析,使用MEGA7.0软件,构建系统发育树(图3),分支处的数值显示支持强度大于50%的分支强度值,重复度为1000次,基因序列变化强度表现为进化树的分支长度。由系统发育树可以看出,所收集的植原体序列聚为6个大支,分别为16SrⅡ-16SrⅦ,JWB-TJKG与甜樱桃绿变植原体以及其他地区枣疯病植原体聚在一支,且与河北省Jinsimizao株系亲缘关系最近,这与同源性比较结果一致,进一步表明JWB-TJKG为枣疯病植原体,属于16SrⅤ组。
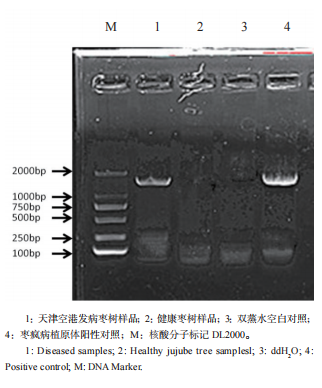
图2 JWB-TJKG 16S rDNA PCR扩增结果
Fig.2 Amplification results for PCR products of Phytoplasma 16S rDNA gene from JWB-TJKG
3 结语
目前,关于天津地区的枣疯病植原体16S rDNA序列同源性以及系统进化分析尚无报道,本研究首次在天津空港地区检测到了枣疯病植原体,与河北省枣疯病植原体亲缘关系最近,确定了天津地区枣疯病植原体的分类地位。16S rDNA序列比对分析表明,天津与河北枣疯病植原体序列遗传距离很小,但仍有一定的地理分布特点。
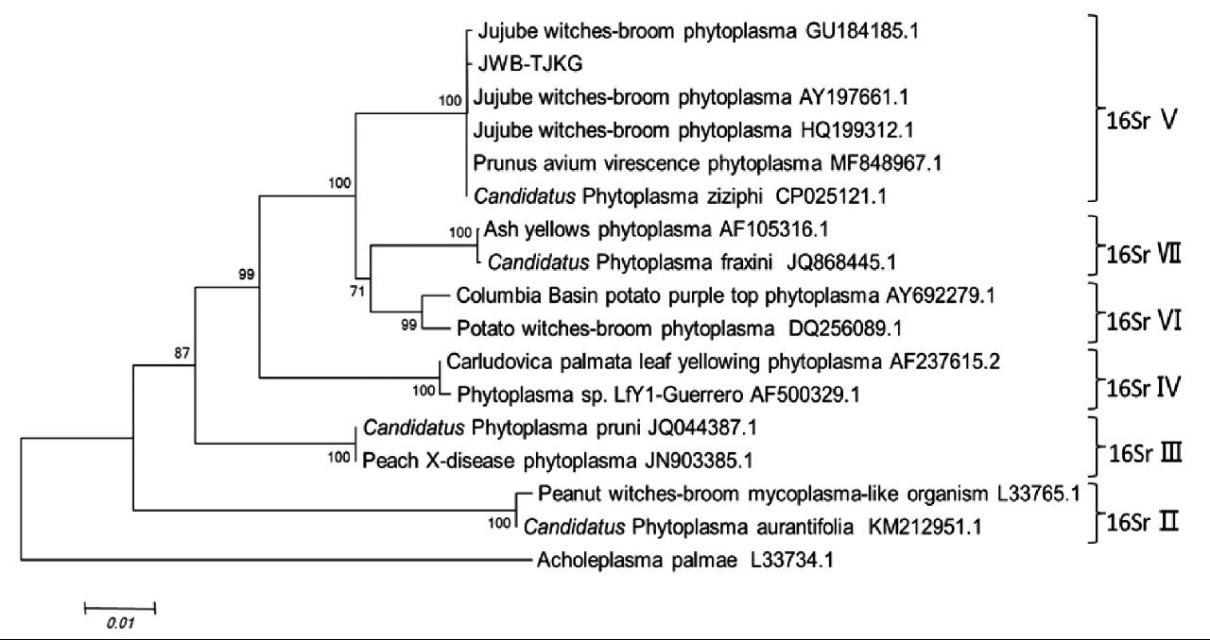
图3 基于16S rDNA序列构建的系统NJ树
Fig.3 Phylogenetic tree of 16S rDNA gene nucleotide sequences
针对植原体的检验检疫方法,主要包括症状鉴别、DAPI染色、电镜观察、血清学检测、普通PCR、巢式PCR、实时荧光PCR、免疫捕获PCR、PCR-RFLP、核酸杂交、核酸测序等分子生物学检测方法。其中DAPI染色法只能判断植物组织中是否存在植原体,但无法进行区分和鉴定。电镜技术成本高,技术条件要求严格,检测周期长。血清学检测操作简单,但抗体制备难度大,且特异性并不高。目前,PCR技术是使用最多的植原体检测方法,同时具有灵敏度好,特异性强,通量高等特点,广泛应用于植原体检测及分类鉴定研究。
枣疯病植原体的分类和鉴定中,16S rRNA 基因序列是首要依据,也是应用最多的基因序列。但16S rRNA 基因的进化速率慢,保守性相对较高,不适宜亚组或近似种的分类鉴定,研究表明蛋白延伸因子tuf基因、核糖体蛋白rp基因、分泌蛋白secY基因、胸苷酸激酶tmk基因等,进化速率较高,保守性稍差,变异性更大,可作为16S rRNA 基因的替代或补充[9-11]。
枣疯病传染性强,潜伏期不定[12-13],遍布于中国华北、西北、华东、华南等地区的25个省市[14-15],是一种具有代表性的植原体病害,且近年有快速蔓延扩大之势,具有重要的研究价值。天津地区枣树种植有一定规模,既有专业枣园,也有绿化观赏枣树,还有野生枣树存在[16],栽植面积为 1.87 hm2, 约占天津市果树栽植总面积的 34%[17]。本研究首次在天津空港发现了枣疯病植原体,可为制定枣疯病防控策略及进一步研究植原体病害的流行学提供理论基础。因此应加强苗木调运的检疫监管,及时铲除病树病枝[18-19],对病原多样性、传毒介体等进行调查[20],以防止枣疯病大面积流行。
【该文经 CNKI 学术不端文献检测系统检测,总文字复制比为 9.3%。】
参考文献
[1] 赵艳玲, 赵彦征. 枣树栽培技术及园林应用[J]. 现代农村科技, 2017(8): 60-61.
[2] 郭建民, 杨俊强, 薛新平, 等. 枣疯病研究进展[J]. 山西农业科学, 2017(8).
[3] 王雪莲. 枣疯病植原体的分子检测与同源性鉴定[J]. 新疆农业科学(04).
[4] 廖晓兰, 朱水芳, 罗宽. 植原体的分类及分子生物学研究进展[J]. 植物检疫, 2002(3).
[5] 陈妮, 刘永光, 仇平平, 等. 山东省枣疯病植原体的鉴定及分子变异分析[J]. 植物病理学报, 2015, 45(2): 113-120.
[6] Wang J , Song L , Jiao Q , et al. Comparative genome analysis of jujube witches'-broom Phytoplasma, an obligate pathogen that causes jujube witches'-broom disease[J]. BMC Genomics, 2018, 19(1).
[7] Lee I M . Universal Amplification and Analysis of Pathogen 16S rDNA for Classification and Identification of Mycoplasmalike Organisms[J]. Phytopathology, 1993, 83(8): 834-842.
[8] 胡佳续, 唐芳, 张莹, 等. 天津滨海新区泡桐丛枝病植原体16S rDNA基因序列分析[J]. 中国植保导刊, 2016, 36(1): 7-11.
[9] 张磊, 韩翔, 隋丹丹, 等. 枣疯植原体rp基因和secY基因序列分析[J]. 西北农林科技大学学报:自然科学版, 2014(7): 102-106.
[10] 林文力, 牟海青, 赵文军, 等. 枣疯病植原体tuf和rp基因的克隆与序列分析[J]. 微生物学报, 2010, 50(10): 1313-1319.
[11] 宋传生, 胡佳续, 林彩丽, 等. 泡桐丛枝植原体河北平山和江西吉安株系胸苷酸激酶基因多态性分析[J]. 林业科学, 2014, 50(8): 108-118.
[12] 田国忠. 枣疯病的预防和治疗策略研究[J]. 林业科技通讯, 1998(2): 14-16.
[13] 赵锦,刘孟军,周俊义,等. 枣疯植原体的分布特点及周年消长规律[J]. 林业科学, 2006, 42(8): 144- 146.
[14] 李正刚, 佘小漫, 汤亚飞, 等. 广东枣疯病植原体的鉴定[J]. 植物病理学报, 2019, 49(2): 140-141.
[15] 曲淑贞, 李登涛, 范春秋,等. 枣疯病研究进展[J]. 现代农业科技, 2014(7): 133- 135
[16] 范会鲜. 天津市静海县枣树生产发展现状及趋势[J]. 北京农业, No.461(36): 31-34.
[17] 王英超, 张桂霞, 高忠浩, 等. 天津地区枣树栽培现状、存在问题及发展方向[J]. 河北科技师范学院学报, 2017, 31(3): 76-80.
[18] 潘青华. 枣疯病研究进展及防治措施[J]. 北京农业科学, 2002, 20(3): 4-8.
[19] 田明君, 王振亮, 邵学红, 等. 枣疯病综合防控技术[J]. 河北林业科技, 2011(5): 53-54, 62.
[20] 王焯, 周佩珍, 于保文, 等. 枣疯病媒介昆虫—中华拟菱纹叶蝉生物学和防治的研究[J]. 植物保护学报, 1984(4).
(文章类别:CPST-C)







