CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
核酸试纸条法检测结核分枝杆菌的初步研究
作者:陈淑丹1 罗 鹏1 吴亦斐2 马 骉3 吴忠华1
陈淑丹1 罗 鹏1 吴亦斐2 马 骉3 吴忠华1
摘 要 本文建立了一种基于重组酶介导恒温扩增(RAA)反应的层析试纸条技术快速检测结核分枝杆菌的方法。根据结核分枝杆菌 IS6110 基因设计特异性引物及探针,并在引物和探针上进行生物素和 FAM 标记。试验先采用重组酶介导恒温扩增,扩增产物经稀释后进行试纸条层析,根据试纸条上显现的质控线和检测线读取结果,并分析该方法的灵敏度、重复性和特异性。核酸扩增反应可在 37℃恒温条件下完成,用时 15 min,扩增产物采用试纸条检测用时 15 min,可手工判读。试纸条方法的检测灵敏度为 104 拷贝 / μL。建立的核酸试纸条法检测快速、操作简单,且无需专业设备,适用于 POCT 检测
关键词 核酸试纸条;可视化;结核分枝杆菌;恒温扩增
Preliminary Study on a Nucleic Acid Strip Assay for
Mycobacterium tuberculosis Detection
CHEN Shu-Dan1 LUO Peng1 WU Yi-Fei2 MA Biao3 WU Zhong-Hua
Abstract This paper aims to establish a visual nucleic acid strip method for rapid detection of Mycobacterium tuberculosis.Primers and probes for Mycobacterium tuberculosis were designed according to IS6110 gene and were labeled with biotin and FAM.The recombinase-mediatedthermostatic amplification was carried out first, and then the amplification products were detected by dipstick after being diluted. The results were determined according to the quality control line and the test line.The sensitivity, repeatability and specificity of the method were analyzed.The reaction process of amplificationcould be completed at 37℃ , which takes 15 min and strip chromatography was used for the testing of products, which takes 15 min. Results were interpreted by naked eye. The sensitivity of the strip method in our study is 104 copies /μL. The establishment of nucleic acid test strip method is quick and easy to operate, and it is suitable for POCT detection without professional equipment.
Keywords nucleic acid strip; visual; Mycobacterium tuberculosis; isothermal amplification
随着经济全球化趋势的不断发展,世界各国之间的联系和交往越来越密切,经济全球化给世界带来不确定的冲击和影响,特别是在传染病防控方面,任何一种新疾病与传播区域之间,只有一个航班的距离。结核病是口岸监测传染病之一。世界卫生组织(WHO)早在《2013年全球结核病报告》中指出,全球结核病控制领域有两大挑战:一是不充分的患者发现;二是不充足的耐药患者治疗[1]。WHO预测如果2020年新冠肺炎疫情使医疗服务中断3个月,将导致发现和治疗结核患者的人数下降25%~50%。事实上,全球报告的确诊结核病患者数已同比大幅下降;印度、印度尼西亚和菲律宾的总体降幅达25%~30%。根据WHO报告估算,因新冠肺炎疫情,2020年全球结核病死亡人数较2019年同期增加约20万~40万人[2]。而目前临床诊断结核病的方法仍然操作烦琐且费时,限制了早期诊断,延迟了适时治疗。
层析试纸条是一种快速检测方法,在一些领域已有成熟技术和广泛应用。例如:在畜禽病毒诊断中,可检测猪瘟病毒抗体、猪蓝耳病抗体等多种传染病[3-4];在寄生虫病诊断中,可检测旋毛虫抗体、弓形虫抗体等[5-6];在兽药残留检测中,可在10 min内实现鸡肉组织中环丙沙星、恩诺沙星、沙拉沙星等药物检测[7]。在食品安全方面,简单快捷的免疫胶体金试纸条在临床上已被用于大肠埃希菌、单增李斯特菌、志贺菌、金黄色葡萄球菌、沙门菌、副溶血性弧菌等快速检测[8];在毒品检测中,可检测吗啡、冰毒、K粉等。层析试纸条是较成功的商业化POCT产品之一,通过肉眼即可判读检测结果,简单方便,从加样到判读结果一般在10 min左右[9]。
层析试纸条用于检测核酸,在检测细菌病毒领域也有了探索和发展。2019年,Claudia Kolm等学者开发了一种用于检测拟杆菌门粪便反刍动物相关遗传标记(16S rRNA)的HDA-strip检测方法。该方法不需要高端的PCR/qPCR仪器,解决了PCR技术的一些局限性问题[10]。同年,Zhao-Hua Wang等建立了用横向流动试纸快速检测猫细小病毒(FPV)的重组酶聚合酶扩增方法。重组酶聚合酶扩增(RPA)作为一种实时且等温的方法,当与横向流动试纸指示剂结合时,是一种更经济的替代PCR的方法。每次反应可检测102个拷贝的目标核酸,结果肉眼观察,并无需专业人员和昂贵且复杂的现场检测设备[11]。2020年,Qiuxue Han等科学家成功建立了基于LAMP技术检测裂谷热病毒(RVFV)的方法[12]。在结核分枝杆菌检测方面,2020年Nazari-Vanani R教授报道了纳米金用于肉眼检测结核分枝杆菌PCR产物的横向流动基因层析带的方法[13]。
本研究采用RAA扩增加层析试纸技术,原理是通过引物和探针两端进行标记(如生物素、FAM等),同时在试纸条上预先包被相应抗体,通过层析吸附特异性扩增产物,使之显色,从而实现扩增产物的手工快速检测。本研究通过核酸试纸条检测方法的建立,寻找适用于口岸筛查的POCT检测平台。
1 材料与方法
1.1 样品及来源
临床结核分枝杆菌与非结核分枝杆菌核酸标本由杭州市疾病预防控制中心提供,微生物标准菌株核酸由杭州国际旅行卫生保健中心提供。实验用样本来源和用途见表1。
1.2 试剂和仪器
RAA基础反应试剂盒(江苏奇天基因生物科技有限公司);QIAamp DNA纯化Mini试剂盒、引物和探针由生工生物工程(上海)股份有限公司合成;检测试纸条由中国计量大学提供;RAA-F1610仪器(江苏奇天基因生物科技有限公司)。
稀释液由1×PBS加3%吐温配制。
1.3 引物和探针
引物探针[生工生物工程(上海)股份有限公司合成]序列针对IS6110基因设计,用生物素标记引物,用FAM标记探针。
1.4 基因组核酸提取
按照QIAamp 抽提试剂盒说明书提取核酸,冻存备用。
表1 实验用样本来源和用途
Table 1 Source and use of samples for testing
序号 | 材料编号 | 菌株类型 | 来源 | 用途 |
1 | pUC-TB-Strip | 的质粒 | 生工生物工程(上海)股份有限公司 | 灵敏度试验 |
2 | ATCC700603 | 肺炎克雷伯菌肺炎亚种 | 杭州国际旅行卫生保健中心 | 特异性试验 |
3 | ATCC49619 | 肺炎链球菌 | 特异性试验 | |
4 | ATCC19615 | 化脓链球菌 | 特异性试验 | |
5 | ATCC33152 | 嗜肺军团菌 | 特异性试验 | |
6 | ATCC22019 | 近平滑念珠菌 | 特异性试验 | |
7 | 160735 | 堪萨斯分枝杆菌 | 杭州市疾控预防控制中心 | 特异性试验 |
8 | 160432 | 鸟胞内分枝杆菌 | 特异性试验 | |
9 | 160741 | 脓肿分枝杆菌 | 特异性试验 | |
10 | 160373 | 龟分枝杆菌 | 特异性试验 | |
11 | 草1 | 草分支杆菌 | 特异性试验 | |
12 | 160918 | 瘰疬分枝杆菌 | 特异性试验 | |
13 | 结核1号 | 结核分枝杆菌 | 临床试验 | |
14 | 结核2号 | 结核分枝杆菌 | 临床试验 | |
15 | 结核3号 | 结核分枝杆菌 | 临床试验 | |
16 | 结核4号 | 结核分枝杆菌 | 临床试验 |
1.5 RAA检测MTBC反应体系优化
在200 μL PCR管中分别加入反应缓冲液A 25 μL,上下游引物各2 μL,模板1 μL,加双蒸水17.5 μL,蜗旋混匀后加入有干粉的反应管中,再次混匀。每个反应管最后加入2.5 μL 280 mmol/L醋酸镁溶液并混匀。将上述反应管放置在37℃~42℃条件下(温度优化)反应15 min。反应结束后,将反应管取出,吸取10 μL扩增产物,用稀释液稀释后(稀释倍数优化)进行试纸条检测结果。
1.6 灵敏度试验
用携带目的基因的质粒DNA(pUC-TB-Strip)作为模板,将其浓度从104拷贝/μL稀释到100拷贝/μL进行重组酶介导恒温扩增,用试纸条检测稀释后的扩增产物,检测方法的灵敏度,同时设置阴性对照管。
质粒合成信息见表2。
表2 试验构建的质粒信息
Table 2 Plasmid information of experimental construction
名称 | 信息 |
载体 | pUC57 |
载体大小 | 2710 bp |
克隆位点 | SmaI |
宿主菌 | DH5α |
抗性 | 氨苄 |
质粒拷贝数计算方式:拷贝数(拷贝/μL)={[6.02×1023] ×[质粒浓度(ng/μL) ×10-9]}/[DNA长度×660]= [6.02×1014×质粒浓度(ng/μL)]/3140×660≈2.905×质粒浓度(ng/μL) ×108
质粒浓度用紫外分光光度计Nanodrop2000进行测定。
1.7 特异性试验
临床微生物标准株由本保健中心购买,非结核分枝杆菌分离株的DNA由杭州市疾病预防控制中心提供。以微生物菌株核酸和非结核分枝杆菌核酸为模板进行扩增,用其产物进行试纸条试验,评估试验的特异性。菌株见表1。
在200 μL PCR管中分别加入反应缓冲液A 25 μL,上下游引物各2 μL,模板1 μL,加双蒸水17.5 μL,蜗旋混匀后加入有干粉的反应管中,再次混匀。最后每个反应管加入2.5 μL 280 mmol/L醋酸镁溶液并混匀。将上述反应管放置在37℃条件下反应15 min后,将反应管取出,吸取10 μL扩增产物,用稀释液稀释10倍后进行试纸条检测。阳性对照管中加质粒做模板,阴性对照管中加双蒸水做模板。
1.8 临床样本检测
收集结核分枝杆菌临床样本4例,提取DNA进行核酸试纸条检测,见表1。
1.9 结果判读
试纸条同时出现质控线(C线)和检测线(T线)为阳性;只出现C线为阴性;其余情况为无效检测。
2 结果及分析
2.1 探针和引物设计及筛选
结合前期研究,筛选出引物和探针组合,如表3所示,产物大小为155 bp。
表3 RAA法检测结核分枝杆菌复合群的引物和探针序列
Table 3 Primers and probe for Mycobacterium tuberculosis complex by RAA method
引物/探针 | 序列(5' - 3') |
IS6110-F1 | GATCCTGCGAGCGTAGGCGTCGGTGACAAAGGCCACGTAG |
IS6110-R1 | Biotin-CTGATCCGGCCACAGCCCGTCCCGCCGATCTCG |
IS6110-P | FAM-CGAACCCTGCCCAGGTCGACACATAGGTGAG(THF)TCTGCTACCCACAGC-C3 Spacer |
Modif ication method: FAM: 6-Carboxyf luorescein; THF: tetrahydrofuran; Biotin: Biotin | |
2.2 扩增温度优化
使用表3所示引物组,采用1.5所述方法进行扩增反应,温度选择37℃、39℃和42℃,其扩增产物进行试纸条检测,结果如图1所示。

扩增温度: A(37℃);B(39℃);C(42℃)
从左到右模板浓度依次为:阴性对照、100拷贝/μL、101拷贝/μL、102拷贝/μL、103拷贝/μL和104拷贝/μL
图1 在不同温度条件下扩增后的试纸条检测结果
Fig.1 Dipstick results of amplification products under different temperatures
与此同时,同一管扩增产物进行琼脂糖核酸电泳检测,如图2所示。
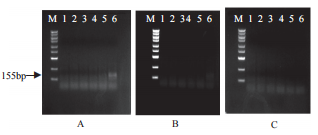
扩增温度: A(37℃);B(39℃);C(42℃)
从左到右电泳槽模板浓度依次为:Marker、阴性对照、100拷贝/μL、101拷贝/μL、102拷贝/μL、103拷贝/μL和104拷贝/μL
Marker分子量从下到上分别为:100 bp、250 bp、500 bp、750 bp、1000 bp、1500 bp、2000 bp、 3000 bp、5000 bp
图2 不同温度条件下扩增后产物电泳检测结果
Fig.2 Electrophoresis results of amplification products under different temperatures
从图2中可见,从37℃到42℃,扩增温度递增时,特异性扩增产物浓度逐渐减弱。相应的试纸条检测,均可检测到104拷贝/μL扩增的产物,但103拷贝/μL扩增在37℃扩增有弱阳性显色,其余温度下无显示,因此试验最优扩增温度为37℃。
2.3 不同稀释倍数
将104拷贝/μL模板在37℃扩增后的产物,用稀释液进行稀释后试纸条检测,结果如图3所示。

图3 扩增产物不同倍数稀释后试纸条检测结果(104拷贝/μL)
Fig.3 Dipstick results of amplification products after different dilutions (104 copies/μL)
从图3中可见,扩增产物稀释10倍和20倍时,检测线的颜色差异不大,但稀释30倍以上将可能影响检测结果。因此,后续试验稀释倍数选择10倍稀释。
2.4 灵敏度试验
试验条件为37℃扩增15 min。不同的质粒DNA拷贝数所扩增的结果如图4所示。从结果可以看出,能够稳定检测到104拷贝/μL模板扩增的产物,103拷贝/μL模板扩增出现不稳定显色。

从左到右模板浓度依次为:阴性对照、100拷贝/μL、101拷贝/μL、102拷贝/μL、103拷贝/μL和104拷贝/μL
图4 不同浓度质粒扩增后试纸条检测结果
Fig.4 Dipstick results of amplification products with different concentrations
试纸条检测的灵敏度基本与DNA电泳相符,DNA电泳图见图2中A。灵敏度低于荧光PCR技术,需进一步改善工艺,提高灵敏度。
2.5 重复性试验
对104拷贝/μL的质粒进行3次平行扩增,扩增产 物进行试纸条检测。3次结果重复性好,如图5所示。
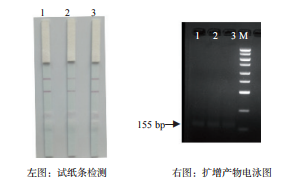
图5 重复性试验(104拷贝/μL)
Fig.5 Repeatability of dipstick test and electrophoresis results (104 copies/μL)
2.6 特异性验证
用质粒、非结核分枝杆菌以及临床常见菌株的核酸进行RAA扩增后试纸条检测,结果见图6~图7。
扩增产物进行DNA电泳,如图7所示。
1.龟分枝杆菌;2.脓肿分枝杆菌;3.瘰疬分枝杆菌;4.胞内分枝杆菌;5.草分枝杆菌;6.堪萨斯分枝杆菌;P.结核质粒;11.肺炎克雷伯菌;12.肺炎链球菌;13.化脓链球菌;14.近平滑念珠菌;15.嗜肺军团菌

图6 核酸试纸条法特异性检测结果
Fig.6 Specific detection of dipstick test
M:Marker;1.龟分枝杆菌;2.脓肿分枝杆菌;3.瘰疬分枝杆菌;4.胞内分枝杆菌;5.草分枝杆菌;6.堪萨斯分枝杆菌;7.结核分枝杆菌1号;8.结核分枝杆菌2号;9.结核分枝杆菌3号;10.结核分枝杆菌4号;11肺炎克雷伯菌;12.肺炎链球菌;13.化脓链球菌;14.近平滑念珠菌;15.嗜肺军团菌
Marker的分子量从下到上分别为:100 bp、250 bp、500 bp、750 bp、1000 bp、1500 bp、2000 bp、3000 bp、5000 bp

图7 特异性试验扩增产物电泳结果
Fig.7 Specific detection of electrophoresis test
2.7 临床结核分枝杆菌菌株检测
用临床样本提取的DNA进行核酸试纸条检测,见图8。其DNA电泳图见图7中的7~10号。

图8 核酸试纸条法检测临床结核菌株
Fig.8 Detection of clinical strains by nucleic acid strip method
3 结语
本研究初步建立了一种基于RAA技术的核酸试纸条法快速检测结核分枝杆菌的方法。项目的研究目的在于对现有检测方法进行改进,缩短检测时间,直观呈现检测结果,为常温核酸扩增技术真正应用到口岸一线提供技术基础。所用试纸条检测特异性高,但灵敏度低于荧光PCR,同一产物采用另一厂家的试纸条检测,灵敏度可达102拷贝/μL。因此,应在保证特异性的同时对试纸条工艺进一步改进,以提高灵敏度。
试纸条的优点是快速可视化结果,但也有不足之处。目前,单根试纸条的检测内容比较单一,当需要对同一检测对象进行多项检测时,只能逐一浸染各种测试项目的试纸条,效率低。未来核酸层析试纸条技术主要发展方向集中在提高检测灵敏度、实现定量检测、开发高通量检测、建立集成化检测、联合大数据技术等方面,将免疫层析技术简便快捷、成本低、特异性好等优势充分应用到核酸检测等领域,为口岸卫生防疫和生物安全保驾护航。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为8.5%。】
参考文献
[ 1] WHO. Global tuberculosis report 2020 [DB/OL].https://apps.who.int/iris/bitstream/handle/10665/91355/9789241564656_eng.pdf?sequence=1, 2020-10-14.
[2] WHO. Global tuberculosis report 22013[DB/OL].https://apps.who.int/iris/bitstream/handle/10665/336069/9789240013131-eng.pdf, 2013-11.
[3] 江地科, 尹清清, 项明源, 等. 检测猪瘟病毒胶体金和量子点试纸条的初步研制[J]. 江苏农业学报, 2020, 36(1): 116-121.
[4] 吴斌, 张秀云, 屈菲, 等. 高致病性猪蓝耳病免疫金标试纸条的研制与应用[J]. 中国动物检疫, 2014, 31(4): 80-84.
[5] 寇金华, 杨正涛, 刘维建, 等. 猪弓形虫感染免疫胶体金试纸条的制备与初步应用[J]. 中国兽医学报, 2018, 38(1): 82-87.
[6] Fu B Q, Li W H, Gai W Y, et al. Detection of anti-Trichinella antibodies in serum of experimentally-infected swine by immunochromatographic strip[J]. Veterinary Parasitology, 2013, 194(2-4): 125-127.
[7] 孙晓峥. 肉鸡组织中氟喹诺酮类抗生素快速检测的胶体金技术研究[D]. 邯郸: 河北工程大学, 2018.
[8] 黄欣迪, 涂晓波, 亓双, 等. 食源性致病菌的检测方法及其发展趋势[J]. 食品安全质量检测学报, 2016, 7(12): 4794-4800.
[9] 张玉雪, 伍钢, 韦佳塔, 等. 胶体金免疫层析技术在兽医临床中的应用[J]. 动物医学进展, 2020, 41(6): 120-123.
[10] Claudia Kolm,Roland Martzy, Manuela Führer. et al. Detection of a microbial source tracking marker by isothermal helicase-dependent amplification and a nucleic acid lateral-flow strip test[J]. Scientific Reports, 2019, 9(1): 393.
[11] Wang Z H, Wang X J, Hou S H. Development of a recombinase polymerase amplification assay with lateral flow dipstick for rapid detection of feline parvovirus[J]. Journal of Virological Methods, 2019, 271: 113679.
[12] Han Q X, Zhang S N, Liu D P, et al. Development of a visible reverse transcription-loop-mediated isothermal amplification assay for the detection of rift valley fever virus[J]. Frontiers in Microbiology, 2020, 11: 590732.
[13] R N V, G H T, R D V, et al. Lateral flow genochromatographic strip for naked-eye detection of Mycobacterium tuberculosis PCR products with gold nanoparticles as a reporter[J]. Journal of Biomedical Physics & Engineering, 2020, 10(3): 307-318.
(文章类别:CPST-C)







