CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
联合EA-IRMS和LC-MS/MS技术构建蜂蜜掺假基本鉴定体系
作者:王永健1 钱 宁1 施 滔1 湛 嘉2* 谢少冬2 殷居易2 陈先锋2 冯 睿2
王永健1 钱 宁1 施 滔1 湛 嘉2* 谢少冬2 殷居易2 陈先锋2 冯 睿2
摘 要 本研究联合元素分析-同位素比例质谱法(EA-IRMS)和液质联用法(LC-MS/MS)两种技术手段对蜂蜜进行掺假鉴定。前者用于判断是否掺入外源的蔗糖、玉米糖浆或高粱等C4植物糖,后者则同时分析大米糖浆、甜菜糖浆和木薯糖浆等典型的C3植物糖的糖浆特征物,从而建立了蜂蜜掺假鉴定的基本检测体系,能够对当前大多数常见掺假手段进行准确、快速和低消耗识别。实际样品分析结果显示,掺入C4植物糖和大米糖浆检出阳性率高,分别达到20.2%和16.7%。
关键词 蜂蜜;掺假鉴定;元素分析-同位素比例质谱联用;液相色谱-串联质谱联用
The Basic Identification System of Adulteration of Honey by Combining EA-IRMS with LC-MS/MS Method
WANG Yong-Jian1 QIAN Ning1 SHI Tao1 ZHAN Jia2* XIE Shao-Dong2 YIN Ju-Yi2 CHEN Xian-Feng2 FENG Rui2
Abstract In this study, EA-IRMS and LC-MS/MS were combined to identify honey adulteration. The former was used to determine whether C4 plants such as exogenoussucrose, corn syrup or sorghum were added, while the latter analyzed the markers of typical C3 plant sugars, such as rice syrup, beet syrup as well astapioca syrup, and abasic systemfor honey adulteration was thereby developed, which can accurately, rapidly, and low-costly identify most ways of current adulterations. The analysis results of actual samples showed that the positive rates of C4 plant sugar and rice syrup were 20.2% and 16.7%, respectively.
Keywords honey; adulteration identification; EA-IRMS; LC-MS/MS
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露与自身分泌物混合后,经充分酿造而成的天然甜物质,有着较高的食用和药用价值。随着国内外需求量的逐年增加,天然蜂蜜远不能满足市场需求,大量假蜂蜜在市场上出现,这不仅损坏消费者利益,而且沉重打击了合规蜂企和蜂农利益。由于造假鉴别难度大,当前尚无食品安全标准可直接判断造假蜂蜜。加上蜂蜜掺假利润空间大,越来越多的不良商家冒险掺假,即使在国外蜂蜜掺假也是让监管部门犯难的事情。目前国内外针对蜂蜜掺假的法规中只有概括的描述,即在蜂蜜中不允许加入任何食品成分,如添加剂,以及不允许加入非蜂蜜带入的任何外来物质。现有标准主要包括GB 14963-2011《食品安全国家标准 蜂蜜》[1],欧盟指令DIRECTIVE 2001/110/EC以及国际食品法典委员会发布的CODEX STAN12-1981及其修订规定[2-3]。上述标准都对蜂蜜相关指标进行限定,例如:CODEX STAN12-1981中对果糖和葡萄糖的含量(果糖和葡萄糖两者含量要求不得低于60%)、蔗糖含量以及水不溶固体物含量进行了规定;欧盟DIRECTIVE 2001/110/EC又增加了水分、电导率、游离酸以及淀粉酶的限量规定;国标GB 14963-2011则在保持同国际法规一致的基础上,仅对果糖和葡萄糖及蔗糖含量作出限值要求。由此可见,蜂蜜掺假鉴定的标准方法是相当缺乏的。
目前蜂蜜掺假鉴定方法有薄层析法[4]、糖或氨基酸指纹图谱技术[5-6]、红外光谱法[7]、等离子光谱法[8]、核磁共振法[9]以及元素分析-同位素比例质谱法(EA-IRMS)等[10-11]。除EA-IRMS技术较为成熟外,其他方法存在费时、灵敏度低、干扰强等缺陷,而且这些方法都无法鉴定C3植物糖掺假。由于C4植物糖掺假鉴定有成熟的国标方法GB/T 18932.1-2002(等同采用AOAC Official Method 991.41),通过EA-IRMS很容易被发现。如今不法分子甚至借助此项技术,蜂蜜掺假水平和手段也越来越高明,掺假原料越来越精细,给检测造成困难。如掺入大米糖浆、甜菜糖浆、木薯糖浆等典型的C3植物糖,用EA-IRMS法根本无法鉴别。
尽管如此,每一种糖浆都有其独特的特征物,采用液相色谱法(LC)或液质联用法(LC-MS/MS)则可以解决检测问题[12]。通过确定大米糖浆SMR(syrup mark-rice)及甜菜糖浆SMB(syrup mark-beet)和木薯糖浆CS(syrup mark-cassava)等特征物,并进行检测,可以判别是否掺假。然而,鉴定C4植物糖掺假往往优先采用同位素比例质谱法。
本研究拟联合EA-IRMS和LC-MS/MS两种技术手段,建立蜂蜜掺假的快速、可靠和低消耗的基本鉴定体系,应用于成品检验和原料收购环节把关服务,取得了满意效果。
1 材料与方法
1.1 仪器和试剂
稳定同位素质谱仪(IRMS, Isoprime 100, 配元素分析仪EA, Elementar);超高效液相色谱-串联质谱联用仪(Waters);分析天平(万分之一);锡囊;橄榄油标准品(δ13C为-28.74‰);离心机、旋涡混合仪、超纯水器、超低温冰箱;大米糖浆、甜菜糖浆和木薯糖浆均为纯品,购自跨境电商;固相萃取小柱Oasis HLB (60 mg, 3 mL),购自美国Waters公司。甲醇、乙腈、甲酸为色谱纯,购自美国天地公司;硫酸和钨酸钠为分析纯。
1.2 样品采集
在2015—2019年之间,从当地超市、进口商品市场以及电商陆续购入124份蜂蜜样品,常温下保存。纯正阴性洋槐蜂蜜由宁波金腾蜂业赠送,用于方法验证。
1.3 前处理步骤
1.3.1 C4植物糖分析
参照GB/T 18932.1-2002,称取10.0 g蜂蜜,用钨酸钠溶液和硫酸溶液沉淀蜂蜜蛋白,通过水洗提纯并干燥后,取3 mg左右的2份平行提纯物,锡舟包裹。另取该蜂蜜3 mg左右的2份平行样品于锡舟中包裹。试样在具有纯氧脉冲及催化剂存在的在线式全自动燃烧管中燃烧,经化学纯化及分离后,用稳定碳同位素质谱仪测定其δ13C值。以蜂蜜蛋白质δ13C值为标准,蜂蜜δ13C值与其进行比较,根据其差值计算蜂蜜中C4植物糖的含量。
1.3.2 C3植物糖的糖浆特征物提纯与分析
(1)特征物的确定与提纯。分别对大米糖浆、甜菜糖浆和木薯糖浆纯品进行特征物提纯。先将1.00 g糖浆溶解于20倍体积的水中,混匀后,过滤,通过HLB小柱,弃去流出液,并用10 mL水清洗,最后用2 mL乙腈洗脱,并经无水硫酸镁脱水。
(2) 主要糖浆特征物的分析。称取蜂蜜样品2.50 g置于50 mL塑料刻度试管中,加水定容至50.0 mL,充分混匀;取2000 μL置于15 mL塑料刻度试管中,加水定容至10 mL,混匀后,经0.2 μm水系滤膜于1.5 mL自动进样器样品瓶中,用LC-MS/MS进行分析。
1.4 仪器条件
1.4.1 EA-IRMS
EA:氧化管和还原管温度分别为920℃和600℃;载气:He,230 mL/min;氧气:13 mL/min;分流比为15∶1。IRMS:加速电压3890 V;灯丝电流100 μA;电压100 eV;参考气体为CO2,其稳定性(重复性)满足<0.06%,仪器方可采集样品。
1.4.2 LC-MS/MS
色谱柱为Acquity Waters HSS-T3 C18(2.1×100 mm,粒径1.8 μm);柱温:40℃;流动相A和B分别为甲醇[含甲酸0.1%(v/v)]和水[含甲酸0.1% (v/v)]。梯度洗脱条件为(tin min):t 0,A=0%;t 8.5~10.4,A=100%;t 10.5,A=0%,保持2.0 min;流速:0.25 mL/min;流路切换:0~2.0 min和6~13 min色谱柱流出液进入废液,2.0~6 min期间进行质谱采集。通过多反应监测(MRM)进行数据采集,正离子模式毛细管电压分别为3.5 kV,离子源和去溶剂温度分别为150℃和500℃;去溶剂和锥孔氮气流速:900 L/h和150 L/h;碰撞气体:氩气压力为4×10-3 mba。
1.5 糖浆特征离子确定与方法参数验证
在2.50 g阴性蜂蜜样品中分别加入混合糖浆,混匀后,按上述前处理方法处理后,以掺入糖浆的百分比浓度(2.5%、5%、10%、15%、20%、25%)为横坐标,以响应值为纵坐标,做基质添加标准曲线来定量。
对15个不同的蜂蜜样品进行前处理并分析,考察是否存在潜在的干扰峰。以10倍信噪比作为定量检测限。在2.50 g空白蜂蜜样品中加入5%、10%和20%的混合糖浆,按上述前处理方法处理后进行测定,计算每个添加水平的回收率和精密度(n=6)。
2 结果与讨论
2.1 糖浆特征物离子对和色谱条件的优化
根据文献以及南京海关技术中心和秦皇岛海关技术中心等单位发表的论文、专利等资料,确定大米糖浆、甜菜糖浆和木薯糖浆分别为2-乙酰呋喃-3-葡萄糖苷(SM-R)、3-甲氧基酪胺(SM-B)、亚麻仁苦苷(CS)[12-15]。通过提纯的产物,进行特征物的离子对的质谱方法优化,结果见表1。
在色谱柱的选择上,对比了Acquity HSS-T3 C18(2.1×100 mm,1.8 μm)和Acquity BEH C18(2.1×100 mm,1.7 μm)2种小颗粒填料色谱柱,响应强度相当,但前者能耐受100%的水,这样可以增强待测特征物的保留,因此最终选择前者。为获得更好的峰形和响应强度,还对比了包括对水(含0.1%甲酸)-甲醇(含0.1%甲酸)、水(含0.1%甲酸)-乙腈(含0.1%甲酸)、水(含2%乙酸)-甲醇(含2%乙酸)、水(含2.0 mmol/L乙酸铵)-甲醇等4种流动相。相比之下,水(含0.1%甲酸)-甲醇(含0.1%甲酸)获得峰型和响应强度最佳。
2.2 糖浆特征物的色谱行为和特异性
从图1~图6可以看出,在目标峰附近不存在明显的干扰峰。大米糖浆、甜菜糖浆和木薯糖浆特征物左右存在的峰,均不构成干扰,特异性良好。
从已报道的方法来看,液相色谱柱分离各种糖组分,柱后衍生,通过IRMS分析δ13C。此方法也能判别是否掺假C3植物糖[13-15],但糖组分的分离和灵敏度往往不太理想。与LC-MS/MS方法相比,本方法更加简便快速、灵敏度高,而且能准确地判别出掺入何种糖源。
2.3 糖浆特征物的回收率及精密度
在纯正蜂蜜中添加3种糖浆浓度分别为5%、10%和20%,结果显示大米糖浆特征物的平均回收率范围在83.1%~123.6%之间,相应的变异系数为3.1%~6.7%;甜菜糖浆特征物的平均回收率范围在81.3%~121.1%之间,相应的变异系数为1.9%~6.2%;木薯糖浆特征物的平均回收率范围在88.9%~94.3%之间,相应的变异系数为2.4%~5.7%,见表2。
2.4 实际样品分析
124份实际样品检测结果显示,掺假C4植物糖(蔗糖、玉米糖浆、高粱)有25份阳性,阳性率高达20.2%,其中δ13C严重偏离正常值的有5份,其范围在-17.06‰~-13.31‰之间。
另外,在124份实际样品中随机选取了60份进行糖浆特征物检测,掺假大米糖浆检出10份,阳性率16.7%,且与C4植物糖同时为阳性的样品有7份。甜菜糖浆检出3份,而木薯糖浆均未检出,这可能与样本数量不够多有关。
2.5 联合2种检测手段可构建蜂蜜掺假的基本鉴定体系框架
根据光合作用碳素同化的最初光合产物的不同,把所有高等植物分成两类:(1) C3植物,以3-磷酸甘油酸(分子中含3个碳)为最初产物的反应途径,如水稻、小麦、大豆等大多数植物;(2) C4植物,以草酰乙酸(分子中含4个碳)为最初产物的反应途径,如甘蔗、玉米、高粱等。这两类糖源的δ13C数值具有较大差异。
在蜂蜜中掺入C4植物糖,如蔗糖、玉米糖浆是较早发现且常见的掺假方式。另外,蜜蜂过冬时,大多数蜂农常常喂养蔗糖等,避免蜜蜂带着蜂蜜长途旅行寻找蜜源。添加C4糖会使蜂蜜δ13C数值显著减小。而纯正蜂蜜的δ13C一般在-27.5‰~-20‰(以-27.5‰~-23.5‰更为常见)之间,因此很容易通过成熟可靠的EA-IRMS技术鉴定。近年来,蜂蜜中掺入C3植物的淀粉糖浆,甚至同时掺入C3和C4等多种糖源,进行勾兑至δ13C在正常区间,以逃避检测。此时,对C3植物糖糖浆的特征物进行分析,具有重要意义。
采用EA-IRMS和LC-MS/MS两种技术手段,进行蜂蜜掺假联合鉴定判别。前者用于判断是否掺入外源的蔗糖、玉米糖浆和高粱等C4植物糖,后者则同时判断是否掺入大米糖浆、甜菜糖浆和木薯糖浆等典型C3植物糖。这两种判别手段能对大多数常用掺假手段进行准确、快速和低消耗的识别。当然,蜂蜜掺假糖源种类不止这6种,甚至还可能会不断增加,蜂蜜掺假鉴定任务具有长期性和艰巨性。
3 结论
通过添加3种糖浆的回收率、实验室内精密度等一系列实验,验证了LC-MS/MS方法适用于蜂蜜中掺假大米糖浆、甜菜糖浆和木薯糖浆等典型的C3植物糖的鉴定。结合EA-IRMS对C4植物糖的分析结果(判断是否掺入蔗糖、玉米糖浆或高粱),几乎可覆盖当前常见的几种掺假方式的鉴别,从而构建了一个蜂蜜掺假的基本鉴定体系,具有特异、可靠、灵敏度高和低消耗等特点。
表1 3种糖浆的保留时间、特征离子、锥孔电压、碰撞电压和检出限
Table 1 Retention time, characteristic ion, cone voltage, collision voltage and detection limit of the three syrups
化合物Compounds | 英文名称 | R.T (min) | 锥空电压 (V) | 离子对Transition 1(CE) | 检测限 (%) |
3-甲氧基酪胺 | SM-B | 2.37 | 12 | 168.2 > 119.1(18)* | 2.5 |
168.2 > 91.1(22) | |||||
2-乙酰呋喃-3-葡萄糖苷 | SM-R | 2.76 | 26 | 311.3 > 149.1(16)* | 2.5 |
311.3 > 185.1(14) | |||||
亚麻仁苦苷 | CS | 3.35 | 26 | 265.2 > 177.1(24)* | 2.5 |
265.2 > 117.1(46) | |||||
注:*为定量离子对 | |||||
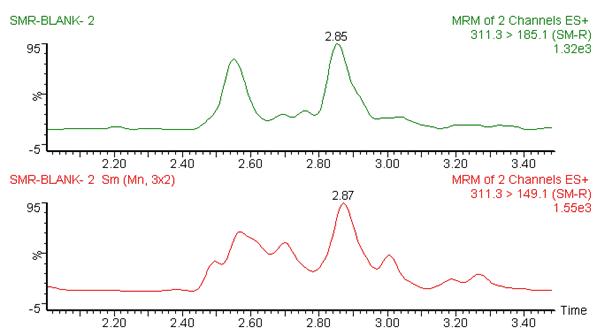
图1 大米糖浆阴性蜂蜜的图谱(稀释100倍)
Fig.1 Chromatograms of rice syrup-negative honey (Diluted 100 times)
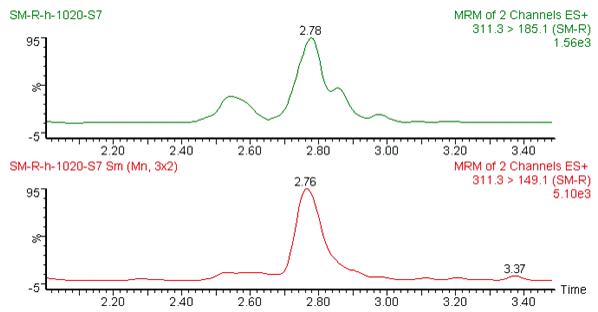
图2 大米糖浆阴性蜂蜜掺入2.5%大米糖浆图谱(稀释100倍)
Fig.2 Chromatograms of negative honey mixed with 2.5% rice syrup (Diluted 100 times)
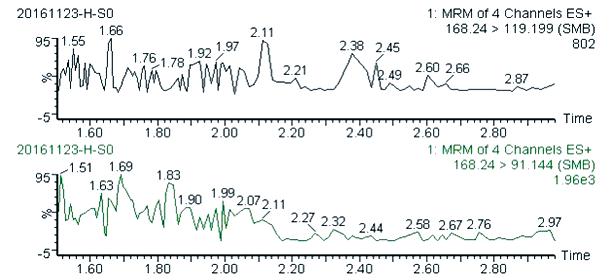
图3 甜菜糖浆阴性蜂蜜的图谱(稀释100倍)
Fig.3 Chromatograms of beet syrup-negative honey (Diluted 100 times)
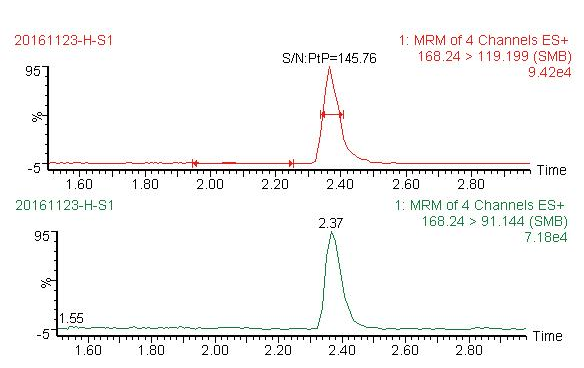
图4 阴性蜂蜜掺入2.5%甜菜糖浆图谱(稀释100倍,信噪比145倍)
Fig.4 Chromatograms of negative honey mixed with 2.5% beet syrup (Diluted 100 times, S/N 145 times)
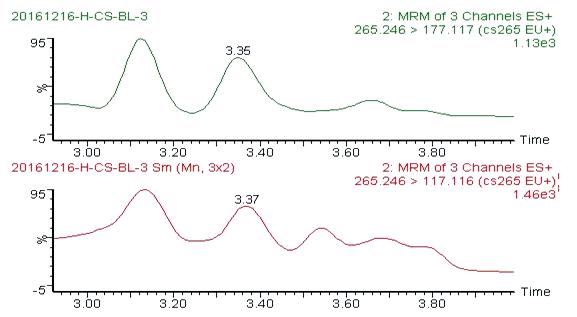
图5 木薯糖浆阴性蜂蜜的图谱(稀释100倍)
Fig.5 Chromatograms of cassava syrup-negative honey (Diluted 100 times)
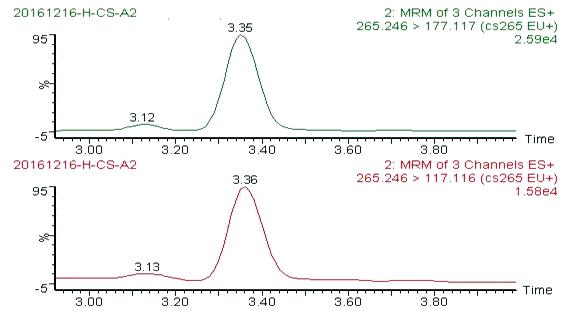
图6 阴性蜂蜜掺入5%木薯糖浆图谱(稀释100倍)
Fig.6 Chromatograms of negative honey mixed with 5% cassava syrup (Diluted 100 times)
表2 3种糖浆特征物在蜂蜜中的回收率和精密度结果(n=6)
Table 2 Recovery and precision of three syrup markers in honey(n=6)
Compounds | Added level (%) | Recovery value, R (%) | Average R (%) | RSD (%) | |||||
SM-R | 5 | 93.9 | 80.5 | 80.9 | 83.8 | 78.7 | 80.5 | 83.1 | 6.7 |
10 | 97.7 | 93.6 | 90.4 | 88.2 | 84.6 | 85.5 | 90.0 | 5.6 | |
20 | - | 125.1 | 123.5 | 128.9 | 121.7 | 118.7 | 123.6 | 3.1 | |
SM-B | 5 | 127.3 | 129.4 | 114.4 | 126.2 | 111.5 | 117.9 | 121.1 | 6.2 |
10 | 109.6 | 113.5 | 104.6 | 107.6 | 96.9 | 111.1 | 107.2 | 5.5 | |
20 | 82.6 | 82.5 | 80.1 | 80.1 | 83.1 | 79.5 | 81.3 | 1.9 | |
CS | 5 | 88.7 | 92.5 | 87.4 | 90.4 | 86.9 | 87.5 | 88.9 | 2.4 |
10 | 103.1 | 92.8 | 95.3 | 91.8 | 89.8 | 88.2 | 93.5 | 5.7 | |
20 | 100.0 | 95.5 | 96.5 | 95.0 | 88.9 | 89.7 | 94.3 | 4.5 | |
参考文献
[1] 中华人民共和国卫生部. 食品安全国家标准 蜂蜜: GB 14963-2011[S]. 北京: 中国标准出版社, 2011.
[2] 农业部蜂产品质量监督检验测试中心(北京)译.国内外蜂产品相关法律法规汇编[M]. 北京: 中国农业出版社, 2006.
[3] 杨林, 冯冠, 曹彦忠, 等. 中欧蜂产品法律法规及标准对比研究[J]. 中国蜂业, 2018, 69(1): 53-56.
[4] Puscas A, Hosu A, Cimpoiu C. Application of a newly developed and validated high-performance thin-layer chromatographic method to control honey adulteration[J]. J Chromatogr A. 2013; 1272: 132-135.
[5] Megherbi M, Herbreteau B, Faure R, et al. Polysaccharides as a marker for detection of corn sugar syrup addition in honey[J]. Journal of Agricultural and Food Chemistry, 2009, 57(6): 2105-2111.
[6] Cotte J F, Casabianca H, Giroud B, et al. Characterization of honey amino acid profiles using high-pressure liquid chromatography to control authenticity[J]. Analytical and Bioanalytical Chemistry, 2004, 378(5): 1342-1350.
[7] Başar B, Özdemir D. Determination of honey adulteration with beet sugar and corn syrup using infrared spectroscopy and genetic-algorithm-based multivariate calibration[J]. Journal of the Science of Food and Agriculture, 2018, 98(15): 5616-5624.
[8] Peng J, Xie W, Jiang J, Zhao Z, Zhou F, Liu F. Fast Quantification of Honey Adulteration with Laser-Induced Breakdown Spectroscopy and Chemometric Methods[J]. Foods. 2020, 9(3): 341.
[9] Spiteri M, Jamin E, Thomas F, et al. Fast and global authenticity screening of honey using ¹H-NMR profiling[J]. Food Chem, 2015, 189: 60-66.
[10] AOAC Official Method 991.41 C-4 plant sugars in honey[M]. Arlington, Virginia, USA: AOAC International, 1995.
[11] 中华人民共和国国家质量监督检验检疫总局. 蜂蜜中碳-4植物糖含量测定方法 稳定碳同位素比率法: GB/T 18932.1-2002[S]. 北京: 中国标准出版社, 2003.
[12] Du B, Wu L M, Xue X F, et al. Rapid screening of multiclass syrup adulterants in honey by ultrahigh-performance liquid chromatography/quadrupole time of flight mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2015, 63(29): 6614-6623.
[13] Fei X Q, Wu B, Sehn C, et al. Honey adulteration detection using liquid chromatography/ elemental analysis-isotope ratio mass spectrometry[J]. Se Pu, 2011, 29(1): 15-19.
[14] Dong H, Xiao K, Xian Y, et al. Authenticity determination of honeys with non-extractable proteins by means of elemental analyzer (EA) and liquid chromatography (LC) coupled to isotope ratio mass spectroscopy (IRMS)[J]. Food Chemistry, 2018, 240: 717-724.
[15] Xu J Z, Liu X H, Wu B, et al. A comprehensive analysis of ^13C isotope ratios data of authentic honey types produced in China using the EA-IRMS and LC-IRMS[J]. Journal of Food Science and Technology, 2020, 57(4): 1216-1232.
(文章类别:CPST-C)







