CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
磁性固相萃取装置在饮料中邻苯二甲酸酯检测的应用
作者:刘宇欣1 赵 琳1 占 昊1 朱美荣1 叶 菲2 周 磊2
刘宇欣1 赵 琳1 占 昊1 朱美荣1 叶 菲2 周 磊2
邻苯二甲酸酯(phthalate esters, PAEs)是环境激素类物质,具有类雌性激素的作用[1-2],作为一类常用的塑化剂和软化剂,被广泛用于食品包装、儿童玩具等各类产品中,以增加材料的柔韧性和拉伸性[3-4]。目前PAEs已成为食品中广泛存在的污染物,包括运动饮料、果汁、茶、果酱、果冻、胶囊状食品等多种类别在内的许多食品被PAEs污染,其中,邻苯二甲酸二正丁酯(DBP)、邻苯二甲酸二(2-乙基)己酯(DEHP)以及邻苯二甲酸二乙酯(DEP)对食品的污染尤为严重[5-6]。此外,茶叶、食用油、方便面油料包等食品中也被检出PAEs,严重影响了人类健康,引起多国相关部门的广泛关注。欧盟、美国等已陆续出台相关法规和指令,将PAEs列为重点控制污染物,监控的种类不断增加,限量值也日趋严格。我国2011年发布的关于通报食品及食品添加剂中邻苯二甲酸酯类物质最大残留量的函中规定,食品、食品添加剂中的DEHP、邻苯二甲酸二异壬酯(DINP)和DBP最大残留量分别为1.5 mg/kg、9.0 mg/kg和0.3 mg/kg[7]。
食品样品的基质复杂多样,邻苯二甲酸酯类物质在食品样品中的含量较低,常规的富集及提纯步骤操作烦琐,且不易检测出较低浓度的PAEs存在,所以建立一种操作简便、分离富集效率高的PAEs前处理方法很有必要。目前,分离萃取样品中的PAEs常用的方法有液-液萃取(LLE)[8]、液-固萃取(LSE)[9-10]、固相萃取(SPE)[11-13]、磁性固相萃取(MSPE)等[14-15]。液-液萃取、液-固萃取等传统方法选择性不高,在样品前处理时有大量化学及物理性质相近的基体干扰物被同时富集,处理基体复杂的样品时更加困难。虽然SPE是广泛使用的一种分离方法,但是传统的SPE过程由于一定量的吸附剂填料在萃取柱中,导致传质速度慢,消耗大量有机试剂,且易造成萃取柱堵塞致使萃取失败等。商品化的SPE小柱只能使用一次,具有特异性吸附作用的免疫亲和小柱价格昂贵,成本较高。
基于磁性功能化介孔材料的磁性固相萃取(MSPE)技术在样品前处理过程中表现出的显著优势引起了科研人员的广泛关注。磁性萃取材料可直接分散在实际样品中进行萃取,提高了萃取效率,同时克服了传统的SPE萃取过程传质速度慢、消耗大量有机试剂、成本高的缺点。随着MSPE成为样品前处理过程中很有前景的一项分离技术,将磁性介孔材料与表面分子印迹技术相结合,合成具有吸附容量高、特异性强的磁性吸附萃取材料是目前研究的热点[14,16-18]。Yang等[18]通过以一种新型的碳载体成功合成了磁性介孔-表面分子印迹聚合物材料(Fe3O4@void@C-MIPs),该材料对邻苯二甲酸酯类物质具有特异性吸附性能,兼具有特异性强、吸附容量高且易于分离的特点,结合了磁性纳米颗粒、介孔材料和分子印迹聚合物三者的优点,是一种理想的富集分离邻苯二甲酸酯类物质的MSPE材料。
目前传统的磁性固相萃取过程是加入磁性固相萃取材料到样液中,通过手动摇动烧杯或三角烧瓶进行萃取或洗脱,萃取或洗脱完成后,通过手持磁铁靠近萃取容器外壁吸附磁性萃取材料从而实现磁分离。整个操作过程自动化程度较低,较为烦琐,并且由于磁性固相萃取材料具有固有磁性,萃取和洗脱过程无法使用磁力搅拌器,因摇动不充分,易导致萃取不完全,造成结果的偏差。本文在磁性固相萃取过程中使用了一种适用于磁性萃取材料的固相萃取装置[19],在萃取和洗脱过程中加入搅拌及加热功能,既解决了磁力搅拌器不适用的问题,又提高了萃取效率,操作方便,自动化程度高。待测样品经实验室合成的磁性介孔-表面分子印迹聚合物材料[18]固相萃取并磁分离后进入GC-MS测定,建立了磁性固相萃取-气相色谱/质谱(MSPE-GC/MS)联用测定液态饮品中邻苯二甲酸酯类化合物的方法,磁性萃取过程中使用了一种适用于磁性萃取材料的磁性固相萃取装置,方法的检出限、精密度及回收率均优于传统的磁性固相萃取过程,适用于饮料、矿泉水等液态食品样品中的5种邻苯二甲酸酯类化合物的测定。
1 材料与方法
1.1 试剂、仪器设备及样品
5种邻苯二甲酸酯:(1) 邻苯二甲酸二(2-乙基)己酯,购自德国Dr. Ehrenstorfer公司,纯度>99.0%;(2) 邻苯二甲酸二正丁酯,购自北京百灵威公司,纯度>98.0%;(3) 邻苯二甲酸二乙酯,购自北京百灵威公司,纯度>99.0%;(4) 邻苯二甲酸丁基苄酯(BBP),购自北京百灵威公司,纯度>97.0%;(5)邻苯二甲酸二正辛酯(DNOP),购自德国Dr. Ehrenstorfer公司,纯度>97.5%。氯仿(色谱纯,上海安谱公司);磁性介孔碳-表面分子印迹聚合物材料(实验室自制[18]);Agilent 7890A-5975C 气相色谱/质谱联用仪(美国安捷伦公司);万分之一电子天平(瑞士梅特勒-托利多公司);磁性材料固相萃取装置(实验室自制,专利号:ZL201922363289.4[19]);实验所用样品均为市售液态饮品。
1.2 方法
1.2.1 标准溶液配制
将1.1中邻苯二甲酸酯类物质标准品用氯仿配制成10 mg/L的混合标准储备液,分别提取一定体积的标准储备液,氯仿稀释定容,配制PAEs的质量浓度分别为0.10 μg/L、0.50 μg/L、1.00 μg/L、2.00 μg/L、5.00 μg/L和10.0 μg/L的混合标准工作溶液。
1.2.2 样品前处理过程
(1) 准确称取15 mg磁性介孔碳-表面分子印迹聚合物材料,放入锥形瓶中,加入10 mL待测样品。将锥形瓶放入磁性固相萃取装置上,25℃机械搅拌萃取10 min,固液分离后加入0.6 mL有机洗脱液三氯甲烷(氯仿),超声15 min,磁性固液分离,加入0.5 g Na2SO4除水,将三氯甲烷洗脱液0.22 μm滤膜过滤收集至色谱进样瓶中,供GC-MS分析。
(2) 对比传统磁性固相萃取实验过程,参见课题组之前发表的文章中实验过程2.4[18],仅磁性固相萃取过程不同于(1),采用传统的手摇方式。
1.2.3 GC-MS分析条件
进样口温度:280℃;质谱接口温度:280℃;载气为He,流量1.0 mL/min;进样量:1 μL,不分流;离子源温度:230℃;溶剂切除时间:5 min;DB-5 MS(30 m×0.25 mm×0.25 μm)色谱柱;升温程序120℃保持1.0 min,以20℃ /min从120℃升温至280℃,并保持3.0 min。
2 结果与讨论
2.1 方法评价
按1.2.1和1.2.2进行标准工作溶液配制以及处理实际样品溶液后,按照1.2.3的条件进行上机分析,5种PAEs色谱峰分离效果较好(见图1a),样品溶液的杂质峰干扰较少(见图1b),方法对PAEs的吸附选择性较高。5种邻苯二甲酸酯类物质的线性范围、线性方程、相关系数及检出限见表1,线性相关系数R2均≥0.9970,平行测定6次PAEs的相对标准偏差为1.97%~5.11%,精密度较高。根据5种PAEs最低检测浓度信号响应的3倍信噪比计算出的检出限(LOD)在1.13~4.09 ng/L之间,方法的灵敏度较高,满足测定要求。
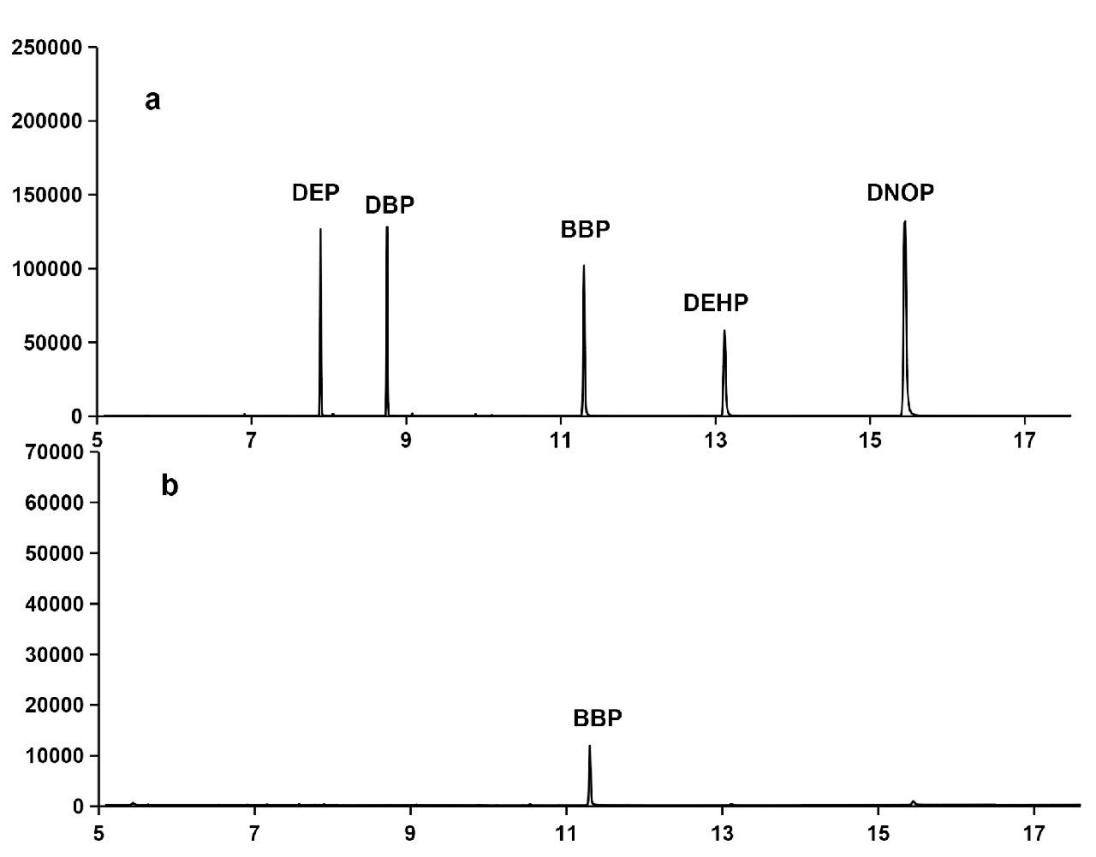
图1 标准溶液色谱图a和样品色谱图b
Fig.1 Chromatograms of standard solution(a) and samples(b)
表1 邻苯二甲酸酯方法评价相关参数
Table 1 The evaluated parameters of phthalate ester method
PAEs | (min) | 线性方程 | R2 | (ng/L) | (%) |
DEP | 4.89 | y=67911x+867.3 | 0.9986 | 2.63 | 3.37 |
DBP | 6.84 | y=109821x-7623.6 | 0.9989 | 1.13 | 1.97 |
BBP | 8.71 | y=18155x-2659.8 | 0.9971 | 3.91 | 4.21 |
DEHP | 9.54 | y=22570x-2423.1 | 0.9983 | 4.09 | 5.11 |
DNOP | 10.71 | y=63185x-3154.3 | 0.9970 | 3.86 | 4.62 |
2.2 实际样品的测定结果
选取了7种不同市售饮料用本文建立的方法进行5种PAEs的测定,样品1为橙汁,样品2为苹果汁,样品3为蛋白饮料,样品4为碳酸饮料,样品5为茶饮料,样品6为纯净水,样品7为矿泉水。为评价样品基质对萃取效率的影响,在实际样品中加入质量浓度为10 μg/L的5种PAEs的混合标准液,除了样品6,其余样品的回收率仅列出有检出的PAEs,测定结果及回收率见表2。本方法样品中5种PAEs的回收率在85.8%~103.6%之间,实验结果表明该实验方法能够准确有效地用于实际样品中邻苯二甲酸酯的检测。
表2 饮品中邻苯二甲酸酯的测量结果
Table 2 Measurement results of phthalate esters in beverages
饮品 | 检出的PAEs | 含量 (μg/L) | 回收率 (%) |
样品1 | DBP | 0.25 | 91.4 |
DEHP | 15.11 | 92.6 | |
样品2 | DEP | 2.10 | 85.8 |
DBP | 9.43 | 102.2 | |
样品3 | DBP | 2.30 | 91.1 |
DEHP | 3.55 | 97.8 | |
样品4 | DBP | 8.86 | 102.9 |
样品5 | DEP | 9.78 | 103.6 |
DBP | 2.62 | 97.1 | |
样品6 | -- | -- | 88.3~96.6* |
样品7 | DBP | 7.66 | 96.6 |
DEHP | 8.41 | 101.5 | |
注:*样品6未检出邻苯二甲酸酯类物质,回收率数值为5种PAEs的范围。 | |||
表2中的7种样品中有6个检出邻苯二甲酸酯类物质,总检出率85.7%,检出PAEs的含量在0.25~15.11 μg/L之间。其中,6个样品检出DBP,3个样品检出的DBP含量高于限值3 μg/L;3个样品检出DEHP,2个样品中的DEHP含量高于8 μg/L;2个样品检出DEP。由此可见,邻苯二甲酸酯类物质在瓶装饮料中的污染已成为不可忽视的问题。
2.3 与传统磁性固相萃取过程的结果对比
为了对比本实验采用磁性固相萃取装置的优异性能,本文采用本方法和同等条件下的传统磁性固相萃取的方式进行比较,前处理过程中采用磁性固相萃取装置替代传统的手摇式磁性固相萃取方式,样品的前处理过程分别采用1.2.2中的(1)和(2)。根据表3中方法的评价参数显示,采用磁性固相萃取装置的方法检出限更低、回收率高、精密度更好,说明采用磁性固相萃取装置替代统的手摇式磁性固相萃取对于分析测定实际样品具有更高的灵敏度。
表3 不同萃取方法的方法评价参数比较
Table 3 Method evaluation parameters of different extraction methods
样品 | 磁性固相萃取方式 | 检出的PAEs含量 (μg/L) | 线性范围 (μg/L) | LOD (ng/L) | RSD (%) | R (%) |
代表性样品 | 磁性固相萃取装置 | DEHP=8.41 | 0.010~10.0 | 1.13~4.09 | 1.97~5.11 | 85.8~103.6 |
传统磁性固相萃取方式 | DEHP=7.91 | 0.035~12.2 | 1.5~5.3 | 4.1~6.7 | 82.7~104.4 |
3 结论
本文建立了磁性固相萃取-气相色谱/质谱(GC/MS)联用测定液态饮品中DEP、DBP、BBP、DEHP、DNOP共5种邻苯二甲酸酯类化合物的方法,待测样品经合成的磁性介孔碳-表面分子印迹聚合物材料磁性固相萃取、基质分散洗脱并磁分离后进入GC-MS测定。结果表明,5种PAEs的检出限在1.13~4.09 ng/L之间,方法的精密度在1.97%~5.11%之间,样品的回收率在85.8%~103.6%之间,该方法适用于磁性固相萃取分离测定液态饮品中的邻苯二甲酸酯类化合物。
磁性复合材料的萃取过程采用一种适用于磁性萃取材料的磁性固相萃取装置,与传统手摇式磁性固相萃取过程进行比较,检出限、精密度及回收率均优于传统的磁性固相萃取过程。测定了7种不同饮料样品中的5种邻苯二甲酸酯类物质,总检出率85.7%,检出PAEs的含量在0.25~15.11 μg/L之间,可见邻苯二甲酸酯类物质在瓶装饮料中的污染已成为不可忽视的问题。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为5.6%。】
参考文 献
[1] 刘慧杰, 舒为群. 邻苯二甲酸酯类化合物的毒理学效应及对人群健康的危害[J]. 第三军医大学学报, 2004, 26(19): 1778-1781.
[2] 王民生. 邻苯二甲酸酯(塑化剂)的毒性及对人体健康的危害[J]. 江苏预防医学, 2011, 22(4): 68-70.
[3] 潘静静, 钟怀宁, 李丹, 等. 食品接触材料及制品中邻苯二甲酸酯类塑化剂的风险管控[J]. 中国油脂, 2019, 44(4): 85-90.
[4] X. L. Cao. Phthalate esters in foods: Sources, occurrence, and analytical Methods [J]. Compr. Rev. Food Sci. Food Saf., 2010(9): 21-43.
[5] 杨国良, 孔福奎, 张开翔, 等. 气相色谱-质谱法测定婴幼儿配方乳粉及原料中15种邻苯二甲酸酯[J]. 食品安全质量检测学报, 2013(3): 699-704.
[6] 郭爱静, 赵伟, 李丽敏, 等. 白酒中18种邻苯二甲酸酯的气相色谱串联质谱测定法[J]. 环境与健康杂志, 2016, 33(7): 649-652.
[7] 罗欣阳, 郑悦珊, 陈科. 食用油塑化剂事件监测技术体系的研究[J]. 广东化工, 2019, 46(9): 79-80.
[8] 王瑞, 吴晓萌, 栾传磊, 等. 饮料中邻苯二甲酸酯的分散式液液微萃取-高效液相色谱测定法[J]. 环境与健康杂志, 2015, 32(2): 158-160.
[9] 关皓月, 赵霞, 孙会敏. GC-MS/SIM法测定明胶空心胶囊中的邻苯二甲酸酯类化合物[J]. 中国新药杂志, 2013, 22(4): 482-485.
[10] 魏慧斌, 潘新, 薛燕波, 等. GC-MS法同时测定塑料中十六种微量PAEs[J]. 塑料, 2014, 43(4): 43-46
[11] 廖艳, 余煜棉, 赖子尼, 等. 固相萃取-气相色谱法检测水中的邻苯二甲酸酯[J]. 化工环保, 2006, 26(3): 235-238.
[12] Y. K. Lv, L. M. Wang, L. Yang, et al. Synthesis and application of molecularly imprinted poly(methacrylicacid)-silica hybrid composite material for selective solid-phase extraction and high-performance liquid chromatography determination of oxytetracycline residues in milk[J], J. Chromatogr. A , 2012, (1227) : 48-53.
[13] 廖艳, 佘煜棉, 赖子尼. SPE-GC法测定地表水中的痕量环境激素[J]. 中国给水排水, 2006, 22(16): 77-80.
[14] Penalver A, Pocurull E, Borrull F. Determination of phthalate esters in water samples by solid-phase microextraction and gas chromatography with mass spectrometric detection [J]. J. Chromatogr. A, 2000(872): 191-201.
[15] Luks-Betlej K, Popp P, Janoszka B, et al. Solid-phase microextraction of phthalates from water[J]. Journal of Chromatography A, 2001, 938(1-2): 93-101.
[16] Yang R, Liu Y, Yan X, et al. Simultaneous extraction and determination of phthalate esters in aqueous solution by yolk-shell magnetic mesoporous carbon-molecularly imprinted composites based on solid-phase extraction coupled with gas chromatography-mass spectrometry[J]. Talanta, 2016, 161: 114-121.
[17] Li J, Zhang X, Liu Y, et al. Preparation of a hollow porous molecularly imprinted polymer using tetrabromobisphenol A as a dummy template and its application as SPE sorbent for determination of bisphenol A in tap water[J]. Talanta, 2013, 117: 281-287.
[18] Yang R, Liu Y X, Yan X Y, et al. An effective method for the synthesis of yolk-shell magnetic mesoporous carbon-surface molecularly imprinted microspheres[J]. Journal of Materials Chemistry A, 2016, 4(25): 9807-9815.
[19] 刘宇欣,韩芳,吕亚宁,等.一种用于磁性固相萃取材料的萃取装置,专利号:ZL 2019 2 2363289.4.
(文章类别:CPST-C)








