CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
HPLC-MS/MS法测定鲤鱼中雌酚类的不确定度评估
作者:陶 蕾1 孙聪丽1 毛富伟1 王俊旭1 朱 丽1 王 英2*
陶 蕾1 孙聪丽1 毛富伟1 王俊旭1 朱 丽1 王 英2*
TAO Lei1 SUN Cong-Li1 MAO Fu-Wei1 WANG Jun-xu1 ZHU Li1 WANG Ying2*
二苯乙烯类激素为人工合成的雌激素类物质,主要包括己烯雌酚(diethylstilbestrol,DES)、己烷雌酚(hexestrol,HES)和双烯雌酚(dienestrol,DIS)。二苯乙烯类激素具有促生长作用,最初将其添加在家禽和水产品饲料中,但由于二苯乙烯类激素具有致畸,致癌,干扰内分泌,影响生殖、性别分化及生长发育等毒副作用,世界上许多国家已经规定在家养禽与水产品中禁止使用二苯乙烯类激素[1]。
本文依据国家计量技术规范《测量不确定度评定与表示》[2]、GB/T 21981-2008《动物源性食品中激素多残留检测方法 液相色谱-质谱/质谱法》[3],对液相色谱-串联质谱法测定鲤鱼中己烯雌酚、己烷雌酚及己二烯雌酚残留量的不确定度进行了测量和评估,通过对影响结果的不确定度分量的分析和量化,计算出被测定的标准不确定度和扩展不确定度,对各分量测定结果不确定度的贡献值加以分析,保证关键检测环节质量控制、确保检测结果的真实有效性[4]。
1 实验所用试剂、仪器设备与方法步骤
1.1 材料与试剂
鲤鱼样品来自国家食品监督抽样;乙酸钠(分析纯,西陇科学股份有限公司);β-葡萄糖醛酸酶(上海麦克林生化科技有限公司);乙酸、乙腈、甲醇、二氯甲烷、甲酸(色谱级,Tedia公司);己烯雌酚、己二烯雌酚(Dr. Ehrenstorfer Gmbh公司);己烷雌酚、氘代己二烯雌酚(BePure公司)。
1.2 实验仪器
超高效液相色谱四级杆串联质谱联用仪(Triple Quad- TM5500 美国ABSCIEX公司);Inertsil Sulfa C18色谱柱(1.7 μm ,100 mm×2.1 mm,日本岛津);ENVI-Carb固相萃取柱(500 mg,6 mL,上海精瑞仪器有限公司);氨基固相萃取柱(500 mg,6 mL,上海精瑞仪器有限公司);分析天平(瑞士Mettler公司感量0.1 mg和0.01 mg各一台);Milli-Q纯水系统(电导率为18.2 MΏ,美国Millipore公司);涡旋振荡器(中国Wiggens公司);高速离心机(3K15型德国Sigma公司);pH计(上海科晓科学仪器有限公司)。
1.3 实验方法
准确称取5 g试样(精确至0.01 g)于50 mL具塞离心管中,加入10 mL乙酸-乙酸钠缓冲溶液(pH 5.2)涡旋10 min后,加入β-葡萄糖醛酸酶溶液(4.5 U/mL)100 μL,于(37±1)℃水浴震荡酶解1 h,冷却至室温后加入25 mL甲醇超声提取30 min,4℃下9000 r/min离心10 min,将上清液转移至50 mL容量瓶中,并用水定容至刻度,混匀。将全部提取液以2~3 mL/min的速度上样于活化过的ENVI-Carb固相萃取柱。将ENVI-Carb固相萃取柱减压抽干后,再将活化好的氨基柱串接在ENVI-Carb固相萃取柱下方。用6 mL二氯甲烷-甲醇溶液(1+1,体积比)洗脱并收集洗脱液,取下ENVI-Carb小柱,再用2 mL二氯甲烷-甲醇溶液(1+1,体积比)洗氨基柱,将洗脱液在氮气流下吹干,用1 mL乙腈-水溶液(1+1,体积比)定容,涡旋混匀,过0.22 μm微孔滤膜,LC/MS/MS测定,外标法定量。
2 不确定度评价
2.1 数学模型
样品中己烯雌酚、己烷雌酚及己二烯雌酚测定浓度的不确定度是标准溶液浓度(CS)、样品质量(m)、溶液体积(V)、样品溶液峰面积(AX)、标准溶液峰面积(AS)和回收率(R)的函数[5]。
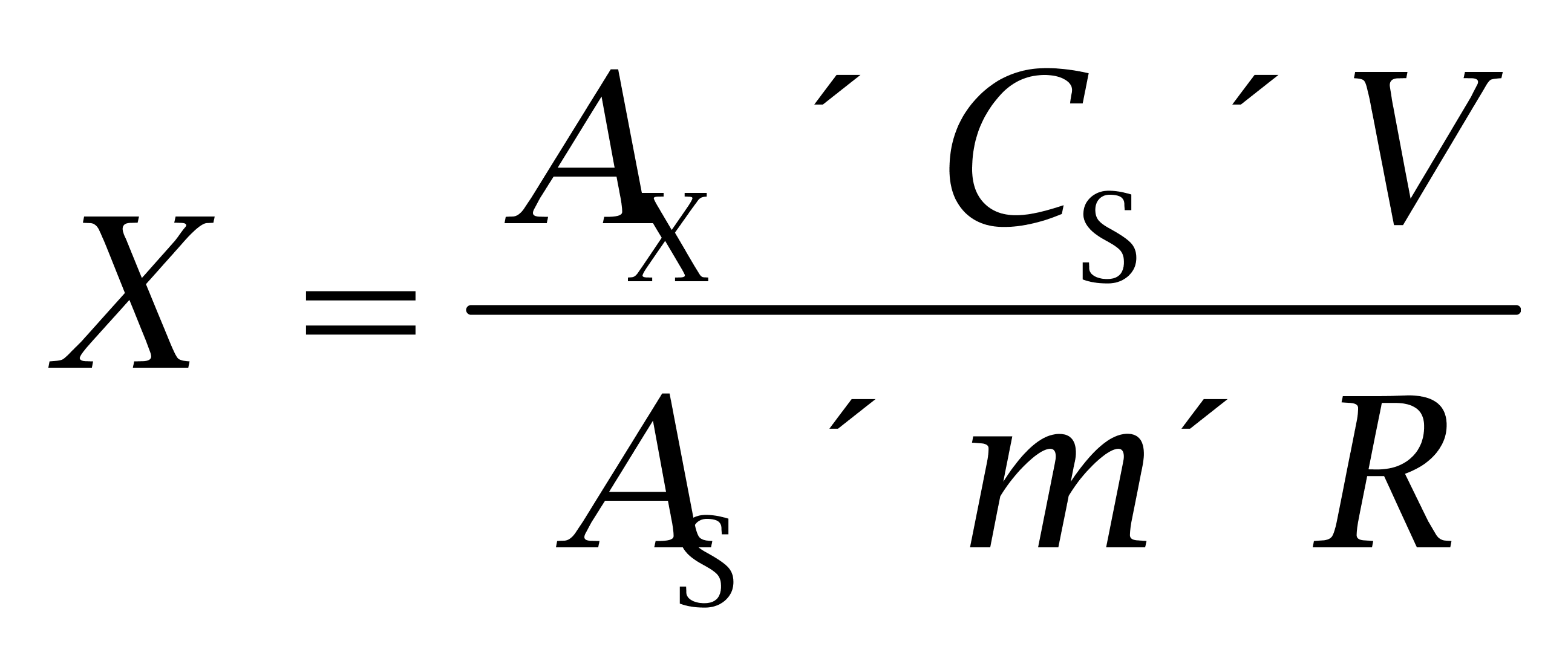 (1)
(1)
式(1)中:
X 为样品中待测组分的含量,μg/kg;AX 为测定液中待测组分的峰面积;CS 为标准液中待测组分的含量,μg/L;V为定容体积,mL;AS 为标准液中待测组分的峰面积;m 为样品称样量,g; R 为检测回收率,%。式中 CS、V、m、R互不相关,且回收率的不确定度已经包括了整个检测过程重现性的不确定度,在随后各步骤的计算中将不再考虑重现性的不确定度;峰面积为计算机自动积分所得,其不确定度可不予考虑。因此可根据式(2)计算液相色谱-串联质谱法测定鲤鱼中己烯雌酚、己烷雌酚及己二烯雌酚的含量的不确定度:
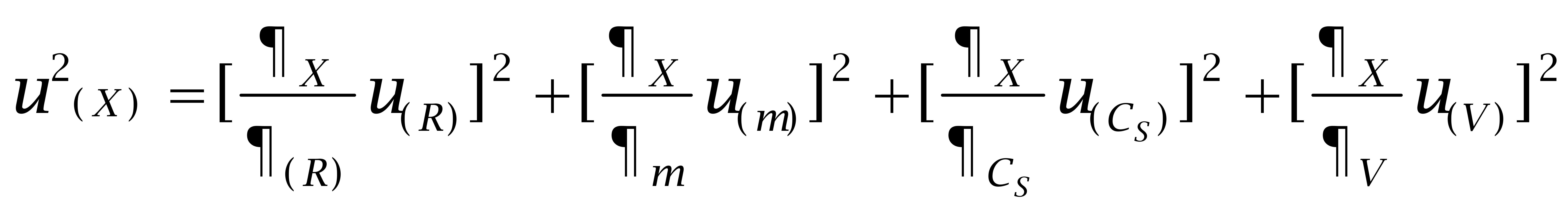 (2)
(2)
两边同除以X2并化简得:
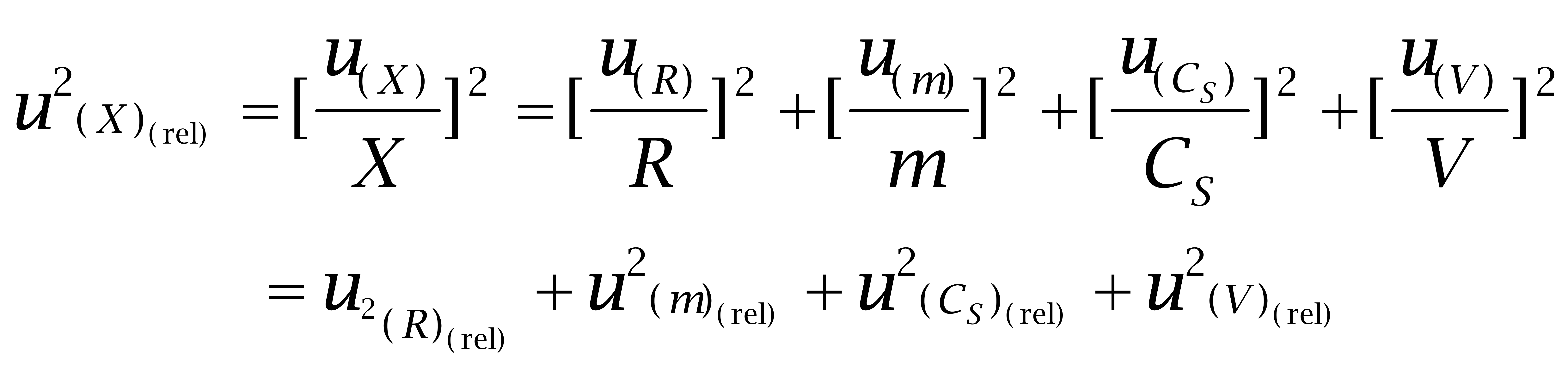
(3)
2.2 测量不确定度的主要来源
从测试过程和数学模型分析,己烯雌酚、己烷雌酚及己二烯雌酚含量的测量不确定度来源[6-9]主要包括:标准溶液的不确定度u(Cs);称取试样m引入的不确定度um;溶液体积引入的不确定度u(V);试验过程中回收率引入的不确定度u(R)。
2.3 各分量标准不确定度的评定
2.3.1 标准溶液的不确定度u(Cs)
己烯雌酚、己烷雌酚及己二烯雌酚标准溶液的不确定度u(Cs)由标准品纯度的不确定度u(R)、标准品称量的不确定度u(mstd)、标准储备液配制的不确定度u(Vstd)和标准溶液稀释的不确定度u(f)构成。
(1)标准品纯度引入的不确定度u(R)
购自Dr. Ehrenstorfer Gmbh的己烯雌酚纯度为97.4%、己二烯雌酚纯度为96.1%,购自BePure的己烷雌酚纯度为99.4%。按照均匀分布处理,转换成标准偏差为:
己烯雌酚:
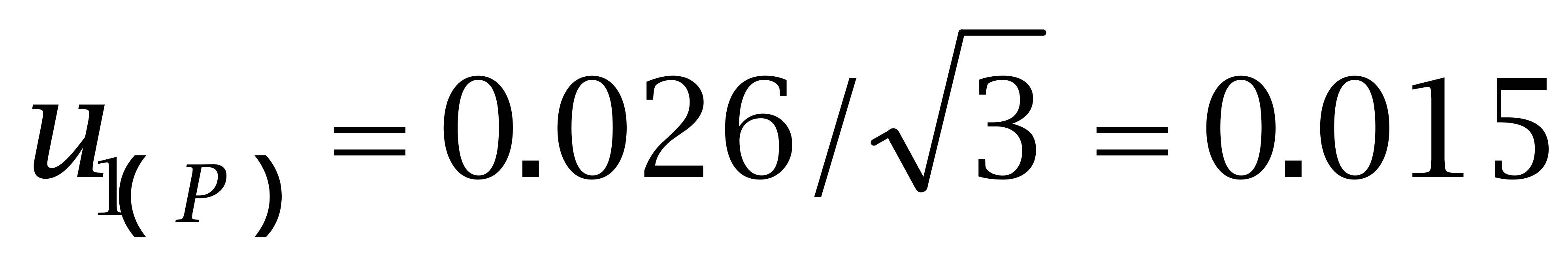
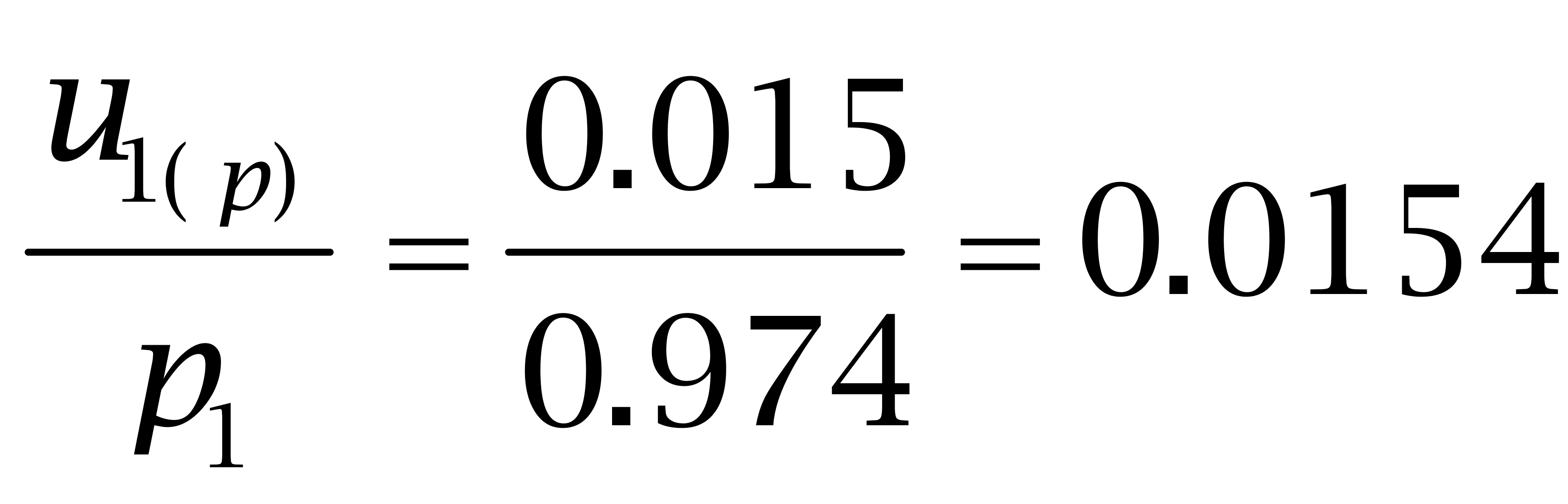
己二烯雌酚:
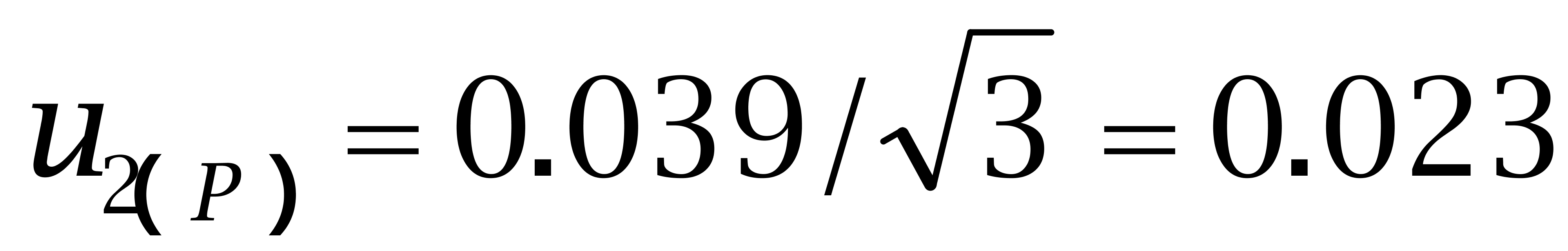
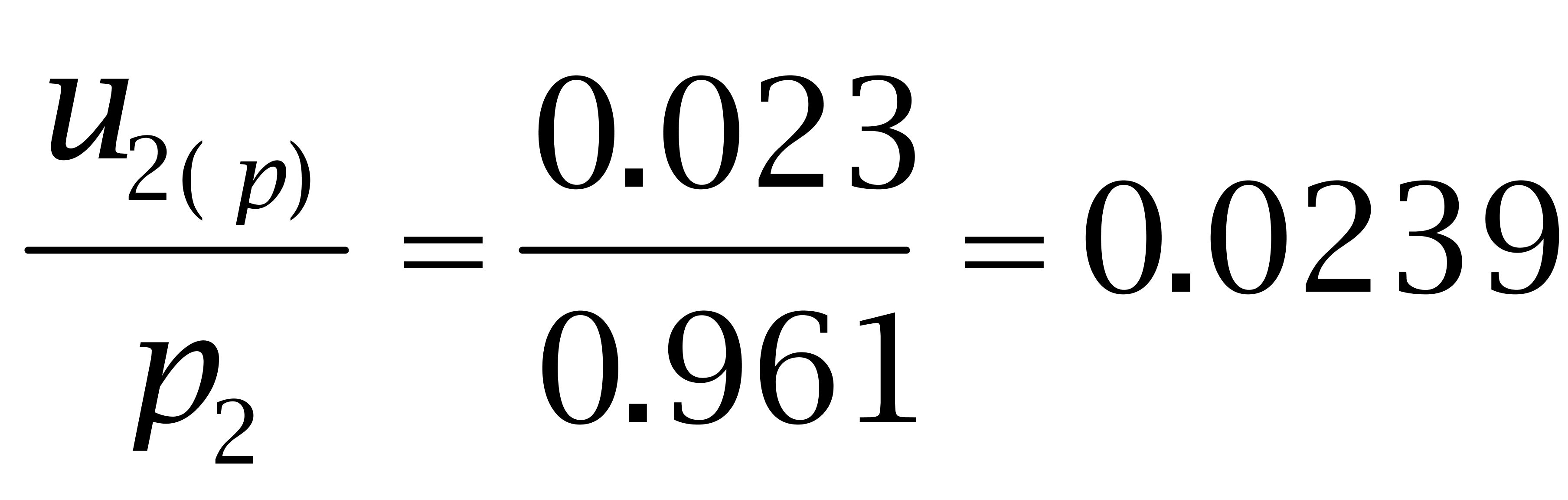
己烷雌酚:
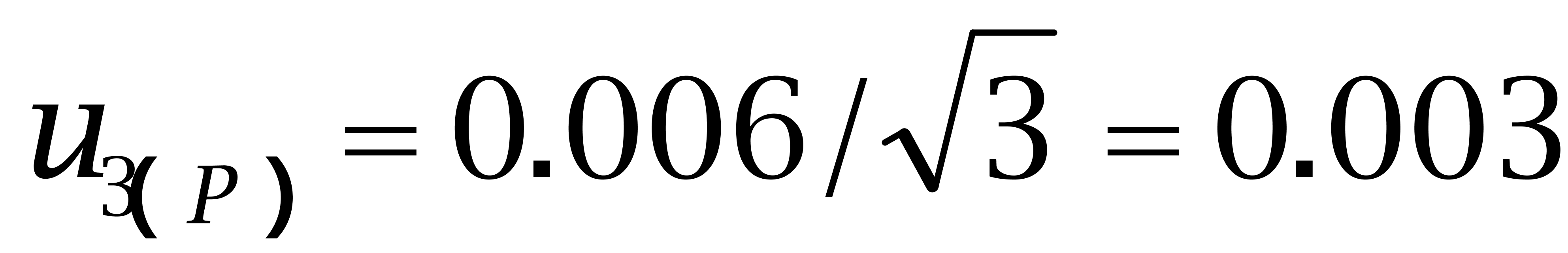

(2)标准品称量引入的不确定u(mstd)
使用万分之一天平称取己烯雌酚标准品10.61 mg,己二烯雌酚标准品10.92 mg,己烷雌酚标准品10.77 mg。根据证书,天平的最大允许误差为± 0.1 mg,称量2次,一次空盘,一 次盘加标准品。
己烯雌酚:
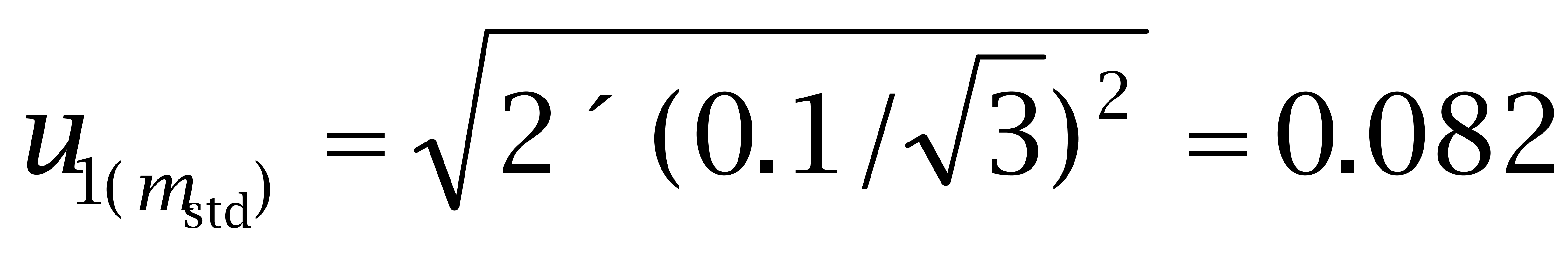
己二烯雌酚:
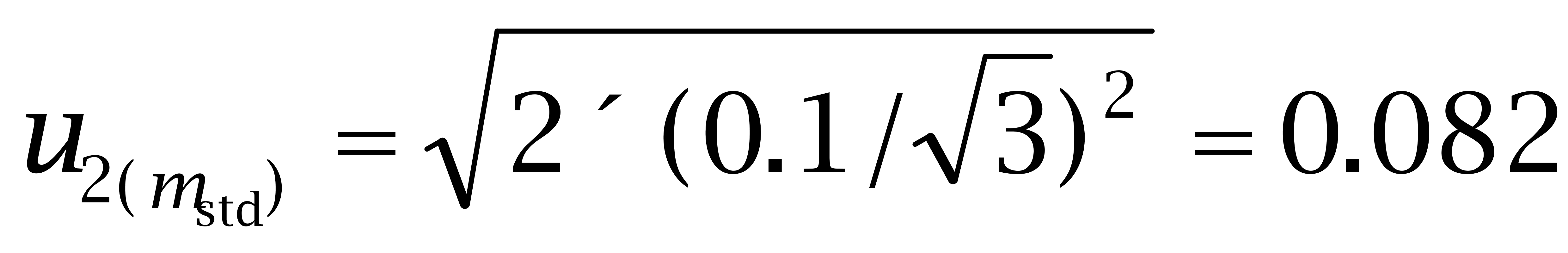
己烷雌酚:
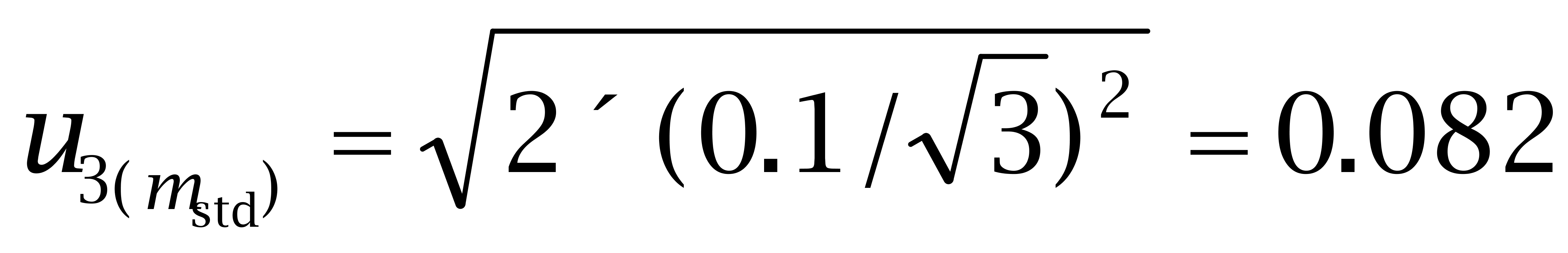
(3)标准储备液配制时引入的标准不确定度u(Vstd)
己烯雌酚、己二烯雌酚及己烷雌酚标准储备液分别使用10 mL A级容量瓶配制[10-11],其不确定度包括以下三点:
第一,10 mL A级容量瓶体积的不确定度,其允许差为±0.025 mL,按均匀分布换算成标准偏差为: mL。
第二,定量总体积为10 mL,但充满液体至容量瓶刻度存在变动性,可采用重复称量的步骤进行测量,重复10次计算出己烯雌酚、己二烯雌酚及己烷雌酚的标准偏差依次为0.016 mL、0.017 mL、0.024 mL。
第三,本次实验过程中的环境温度与容量瓶校准时温度基本相同,故可以忽略不计经由温度引入的不确定度。
己 烯雌酚:
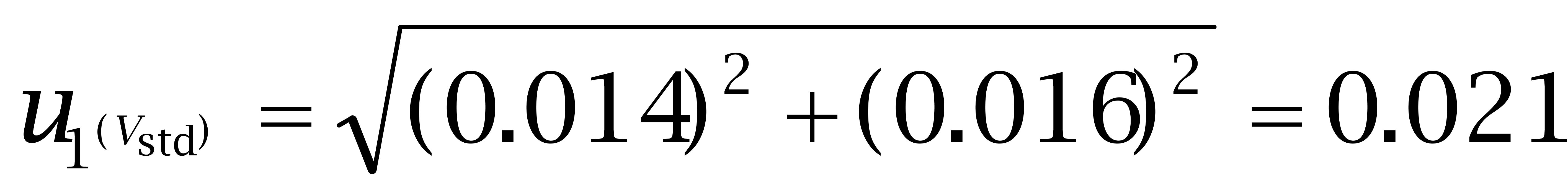
己 二烯雌酚:
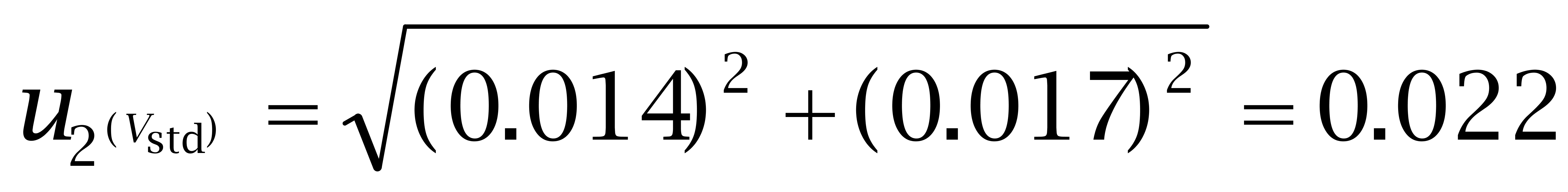
己烷雌酚:
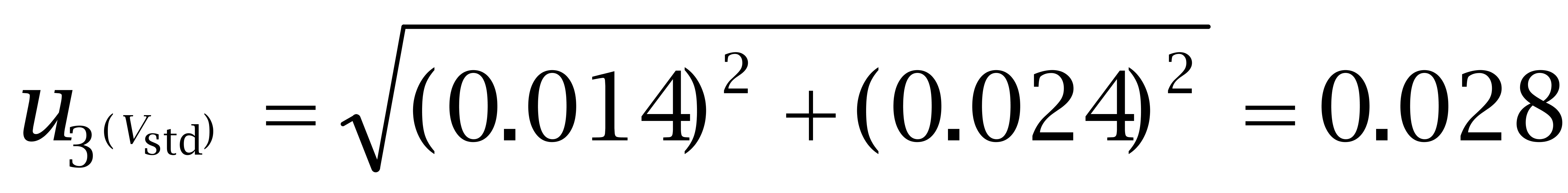
(4)标准工作溶液稀释引入的不确定度u(f)
标准工作溶液按1∶1000稀释,使用100 μL可调移液器分别准确吸取己烯雌酚、己二烯雌酚及己烷雌酚的标准储备液(100± 0.006)μL,转移至(10 ±0.025)mL A级容量瓶中,用甲醇定容至刻度得到100 μg/kg的标准工作溶液。由校准证书可知,100 μL可调移液器容量相对误差为0.46,按照均匀分布(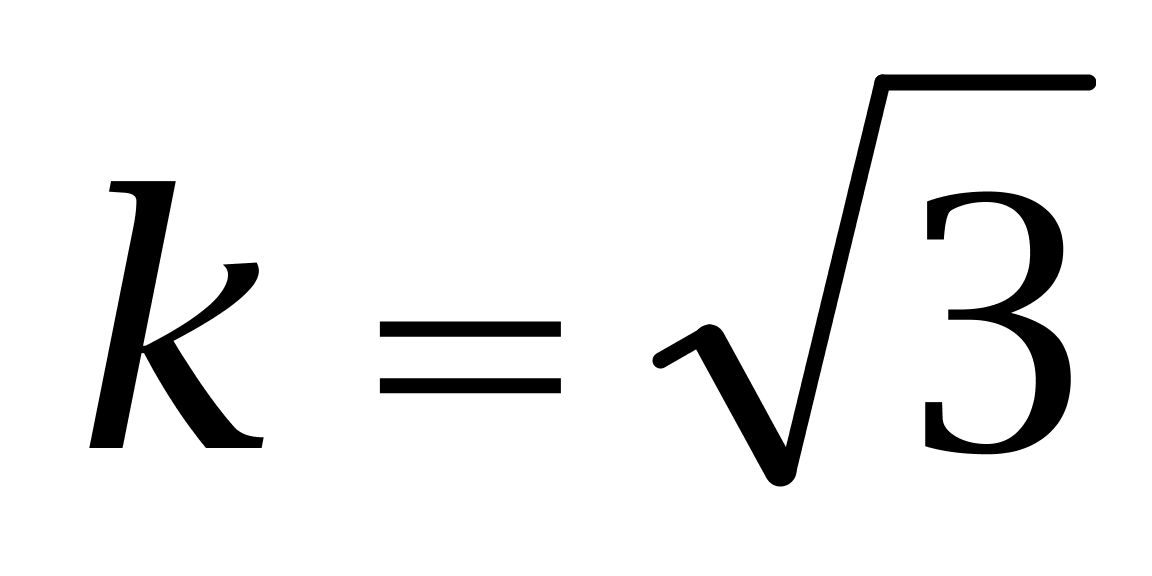 ),其标准偏差为
),其标准偏差为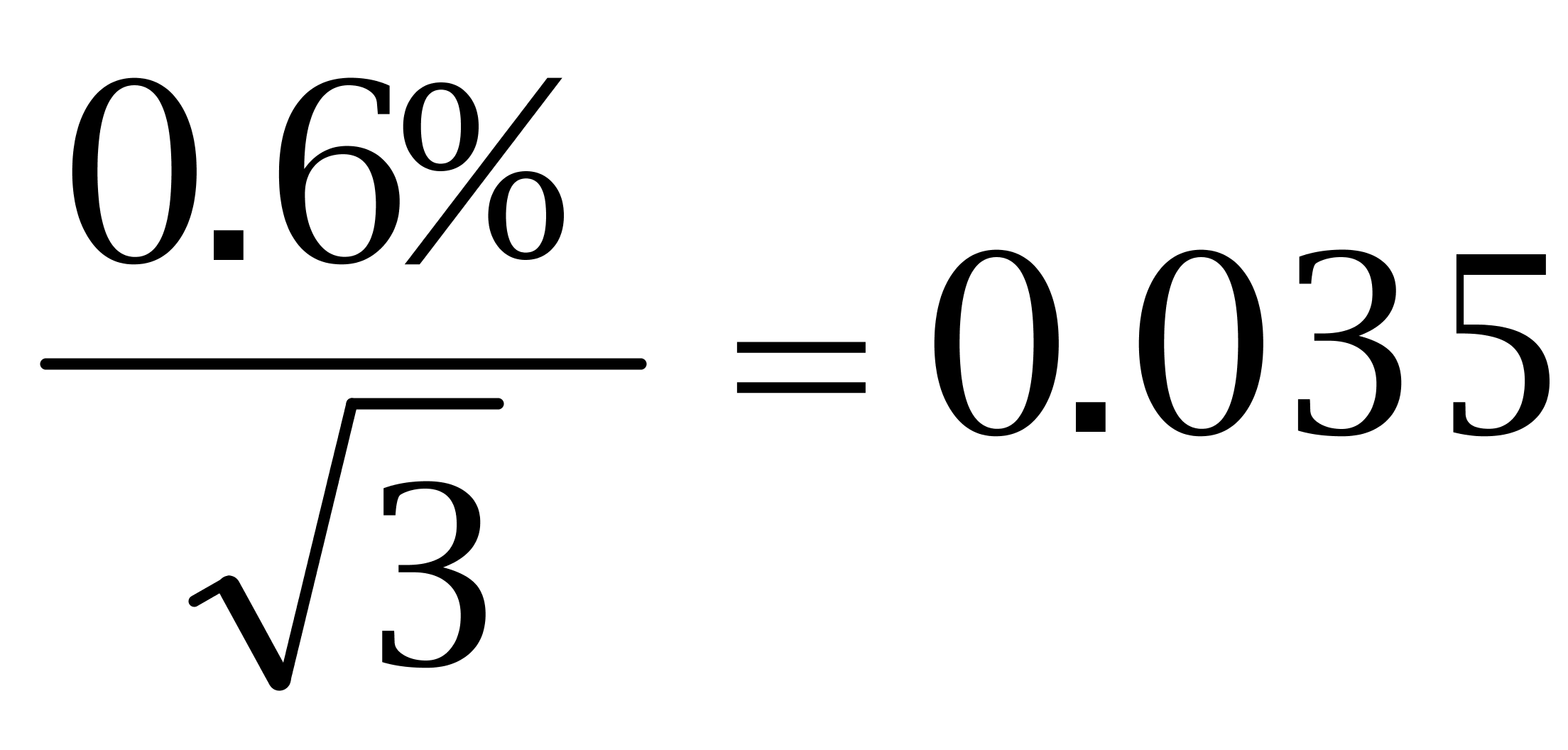 ;10 mL A级容量瓶的允许差为±0.025 mL,按照均匀分布(
;10 mL A级容量瓶的允许差为±0.025 mL,按照均匀分布(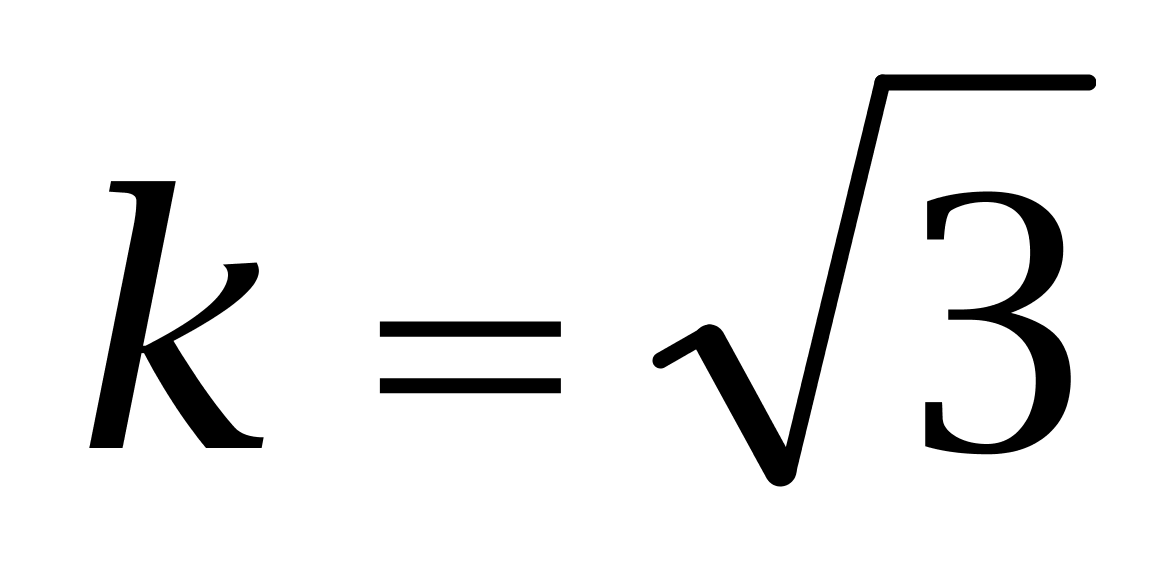 ),其标准偏差为
),其标准偏差为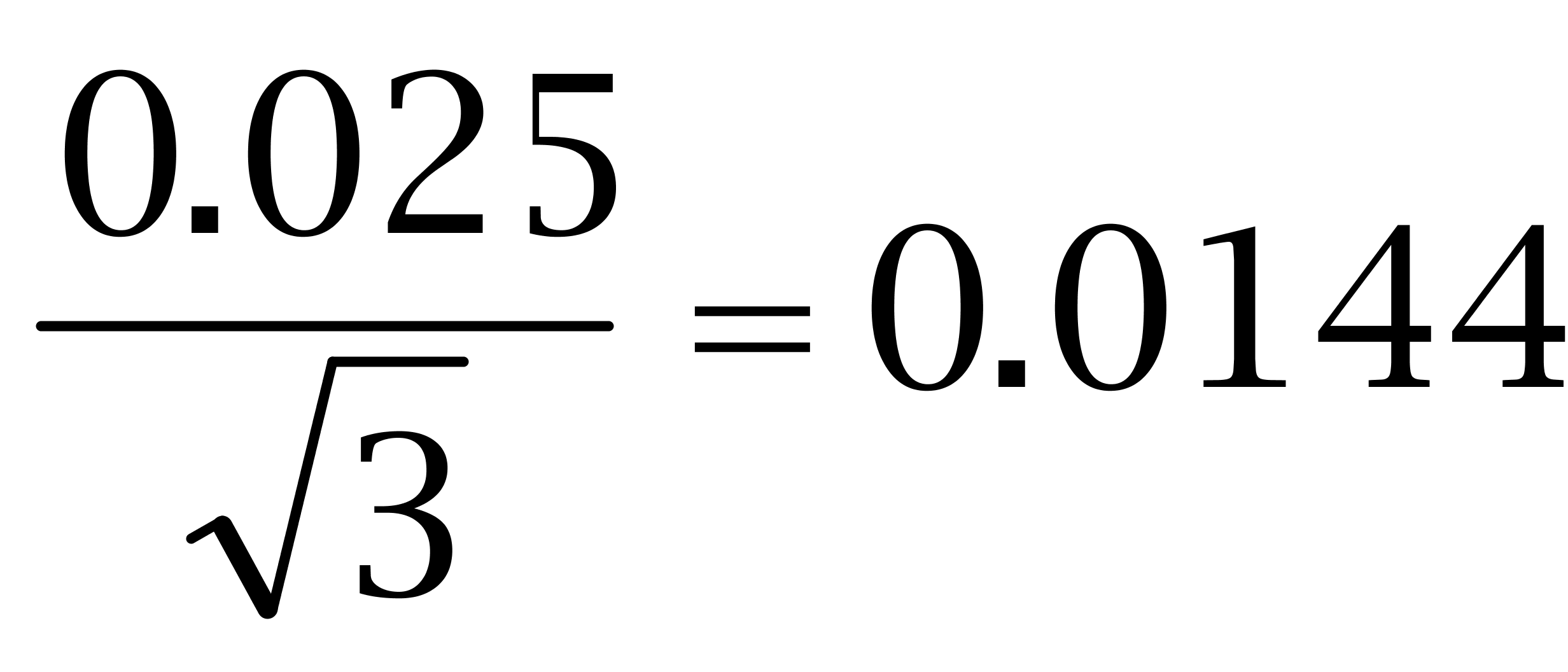 ,以上两项合成得出配制己烯雌酚、己二烯雌酚及己烷雌酚的标准工作溶液的不确定度为:。
,以上两项合成得出配制己烯雌酚、己二烯雌酚及己烷雌酚的标准工作溶液的不确定度为:。
(5)己烯雌酚、己烷雌酚及己二烯雌酚标准溶液的不确定度u(Cs)
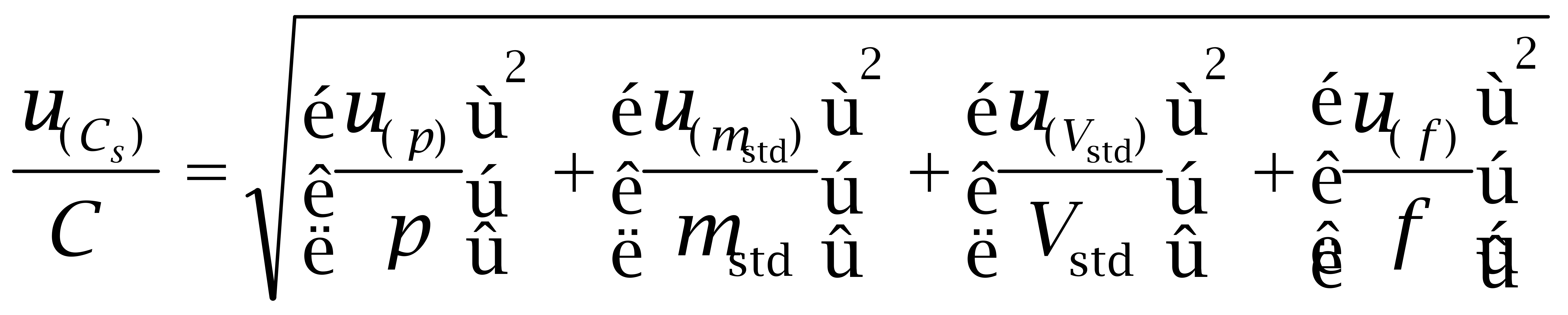 (4)
(4)
己烯雌酚:
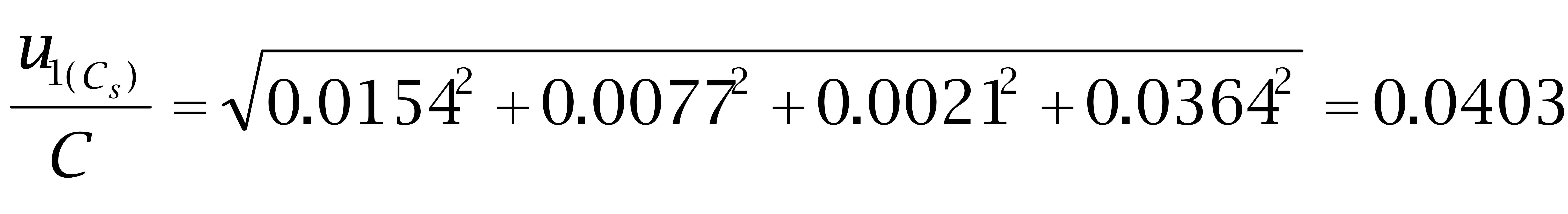
故: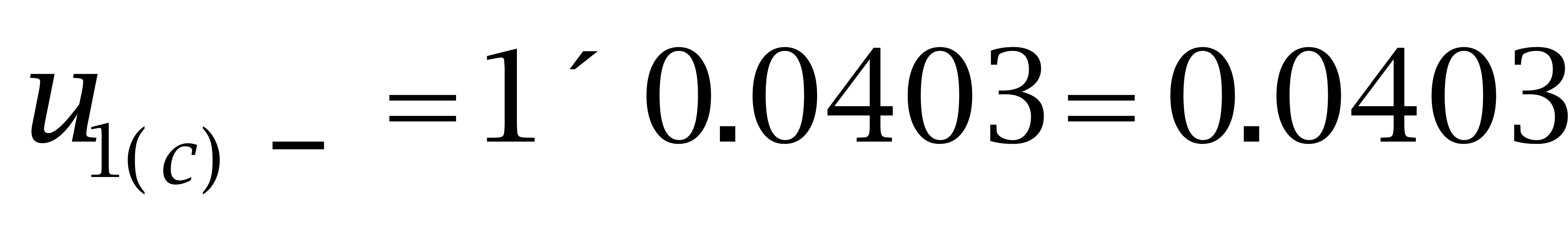
己二烯雌酚:
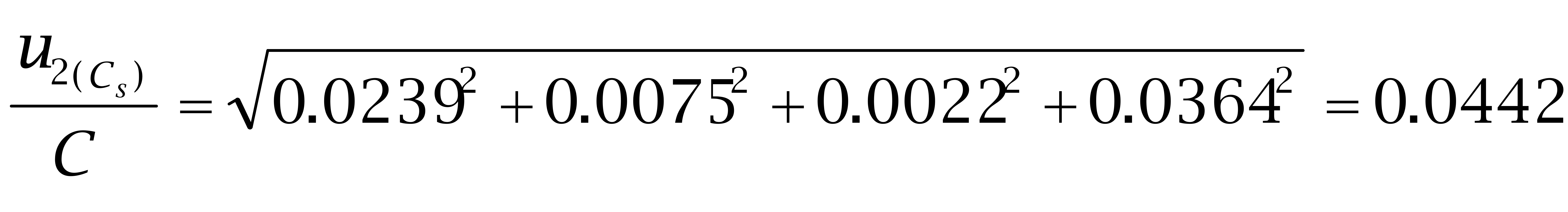
故: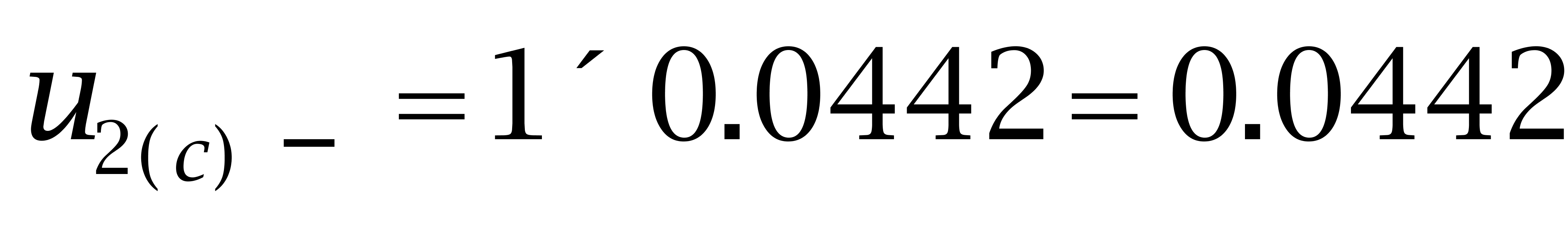
己烷雌酚:
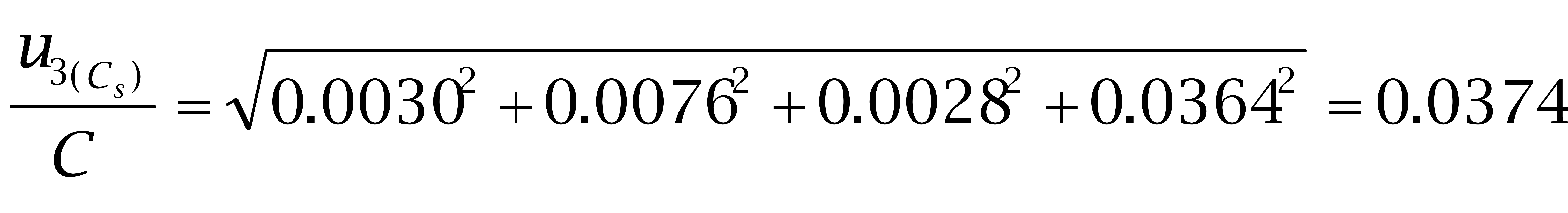
故: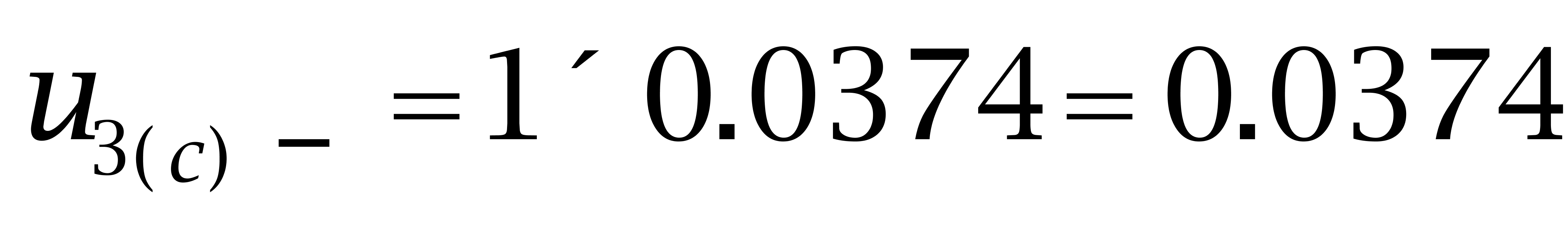
2.3.2 称取试样质量m引入的不确定度u(m)
称量由下列数据获得:容器和样品的质量为15.098 g;容器质量为10.012 g;故样品的质量为5.086 g。
称量不确定度来自两个方面:
第一:称量变动性,根据历史记录,在50 g以内,变动性标准偏差为0.1 mg;
第二:天平校准引入的不确定度,依据国家标准物质研究中心校准证书给出的在95%置信概率时为0.3 mg,换算成标准偏差为0.3 / 1.96=0.153 mg。
此两项合计得到的称量的标准偏差为:
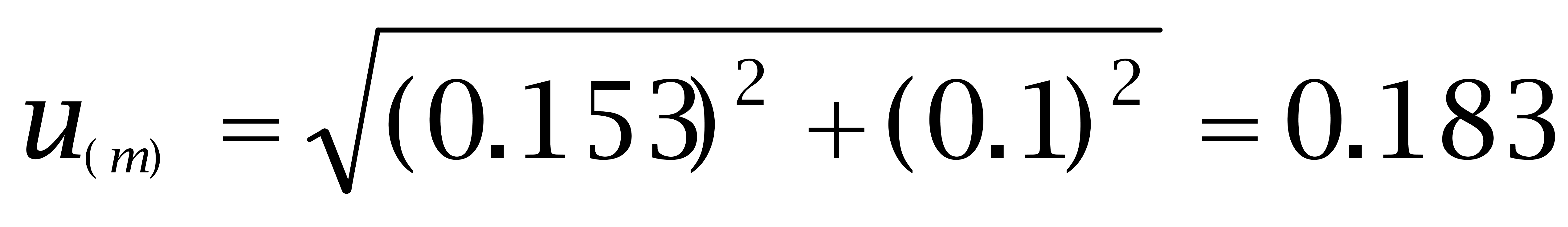
2.3.3 溶液体积引入的不确定度 u(V)
在本方法中涉及到定量的体积包括提取液定容体积(50 mL)、最终定容体积(1 mL)和仪器自动进样体积。参考(3)、(4)计算,具体计算结果见表1。
表1 溶液体积的不确定度
Table1 Uncertainty of solution volume
| 来源引入 | u (Vi)(mL) | 相对标准不确定度 u (Vi)/Vi |
V100 L | 自动进样器 | 0.0005 | 0.005 |
V1 mL | 1000 L可调移液器 | 0.0023 | 0.0023 |
V50 mL | 50ml容量瓶 | 0.08 | 0.0016 |
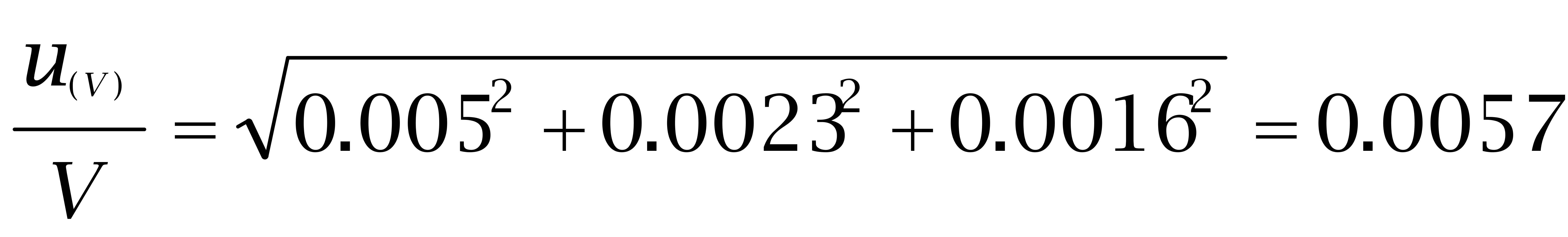
2.3.4 试验过程中测量重复性引入的不确定度u(R)
试验对己烯雌酚、己二烯雌酚及己烷雌酚做添加回收数据,10个样品的平均回收率依次为75.35%、78.56%、73.02%,具体结果见表2,相对标准偏差依次为4.3883%、3.1548%、3.453%。
己烯雌酚、己二烯雌酚及己烷雌酚回收率的相对标准不确定度如下:
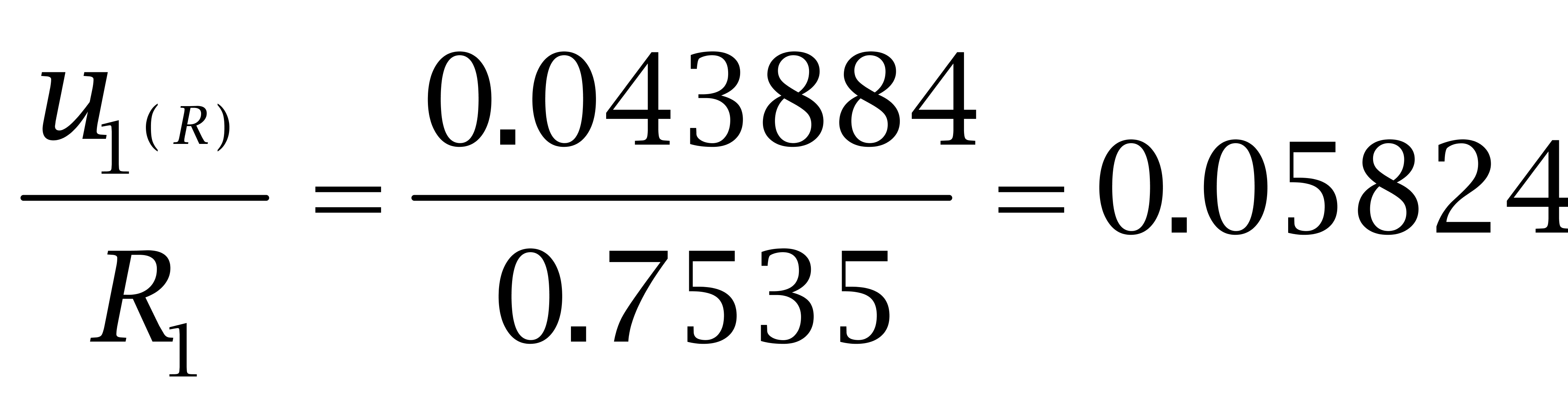
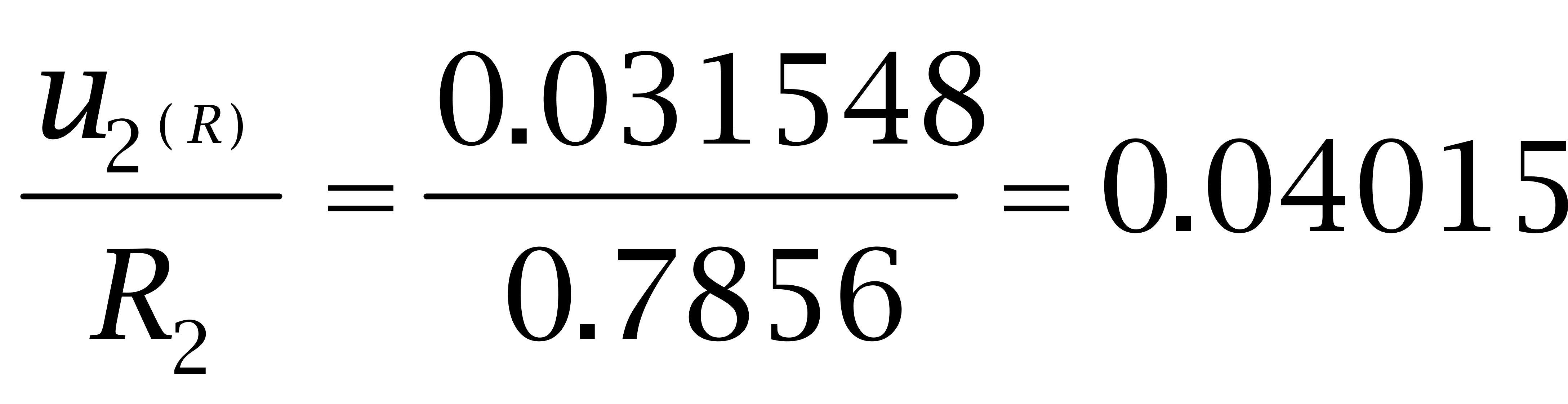

表2 己烯雌酚、己二烯雌酚及己烷雌酚回收率结果表
Table 2 Recovery of diethylstilboestrol, dienestrol and hexoestrol
次数 | 回收率(%) | 次数 | 回收率(%) | ||||
己烯雌酚 | 己二烯雌酚 | 己烷雌酚 | 己烯雌酚 | 己二烯雌酚 | 己烷雌酚 | ||
1 | 73.1 | 80.2 | 70.2 | 7 | 71.7 | 75.3 | 72.7 |
2 | 79.5 | 78.1 | 69.6 | 8 | 76.4 | 77.8 | 73.5 |
3 | 80.5 | 76.3 | 74.7 | 9 | 73.3 | 80.2 | 71.1 |
4 | 70.3 | 77.9 | 73.5 | 10 | 74.8 | 75.7 | 72.4 |
5 | 76.8 | 82.5 | 78.4 | 平均值(%) | 75.35 | 78.56 | 73.02 |
6 | 77.1 | 81.6 | 74.1 | 标准偏差(%) | 4.3884 | 3.1548 | 3.453 |
3 己烯雌酚、己烷雌酚及己二烯雌酚的标准不确定度分量
己烯雌酚、己烷雌酚及己二烯雌酚的标准不确定度分量[12]见表3。
表3 己烯雌酚、己烷雌酚及己二烯雌酚的标准不确定度分量
Table 3 The standard uncertainty of diethylstilboestrol, dienestrol and hexoestrol
序号 | 不确定度来源 | 项目 | 标准不确定度量值 |
1 | 标准溶液的不确定度 | 己烯雌酚 | 0.0403 |
己二烯雌酚 | 0.0442 | ||
己烷雌酚 | 0.0374 | ||
2 | 称取试样质量引入的不确定度 | 己烯雌酚 | 0.0000336 |
己二烯雌酚 | 0.0000336 | ||
己烷雌酚 | 0.0000336 | ||
3 | 溶液体积引入的不确定度 | 己烯雌酚 | 0.0057 |
己二烯雌酚 | 0.0057 | ||
己烷雌酚 | 0.0057 | ||
4 | 试验过程中测量重复性引入的不确定度 | 己烯雌酚 | 0.05824 |
己二烯雌酚 | 0.04015 | ||
己烷雌酚 | 0.04728 |
己烯雌酚、己烷雌酚及己二烯雌酚的标准不确定度分量贡献表见图1。
3.1 己烯雌酚的各分量相对合成标准不确定度:

己烯雌酚(100 μg/kg)的标准不确定度为:
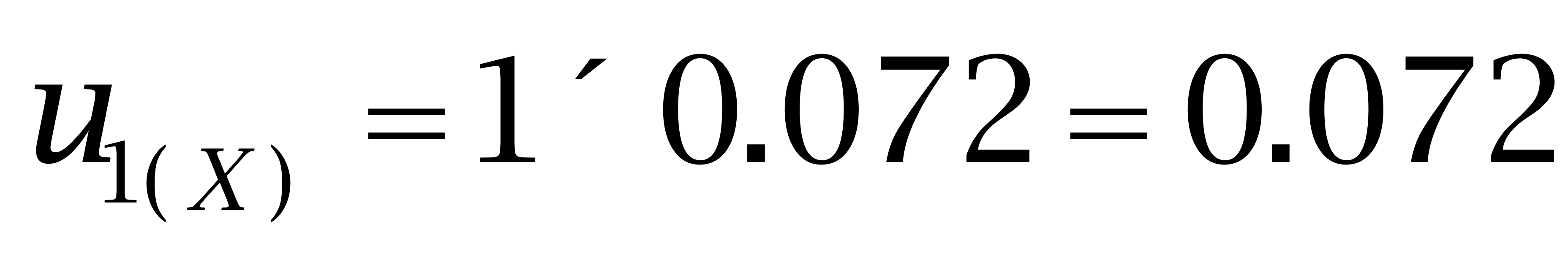
3.2 己二烯雌酚的各分量相对标准不确定度:
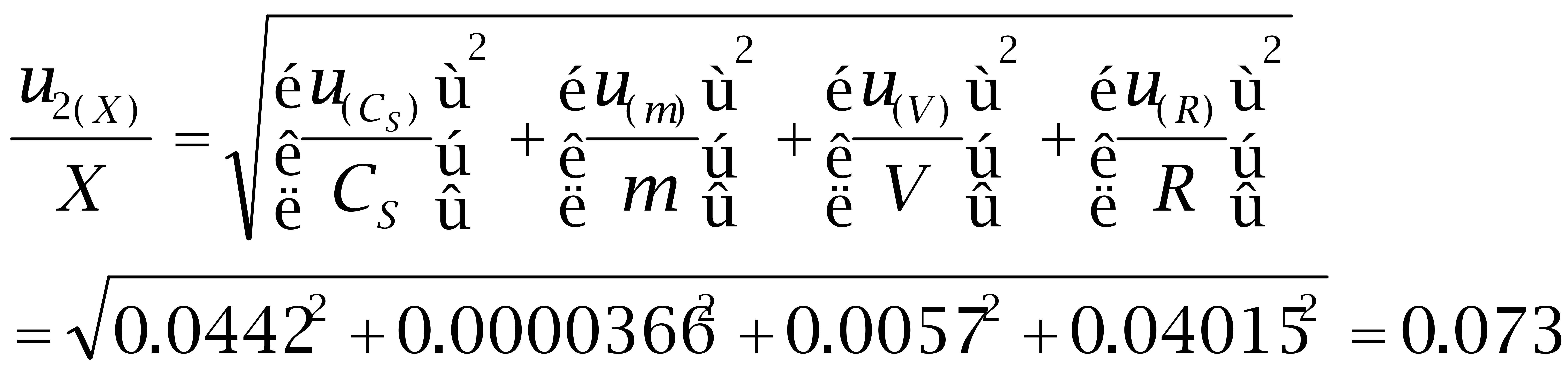
己二烯雌酚(100 μg/kg)的标准不确定度为:
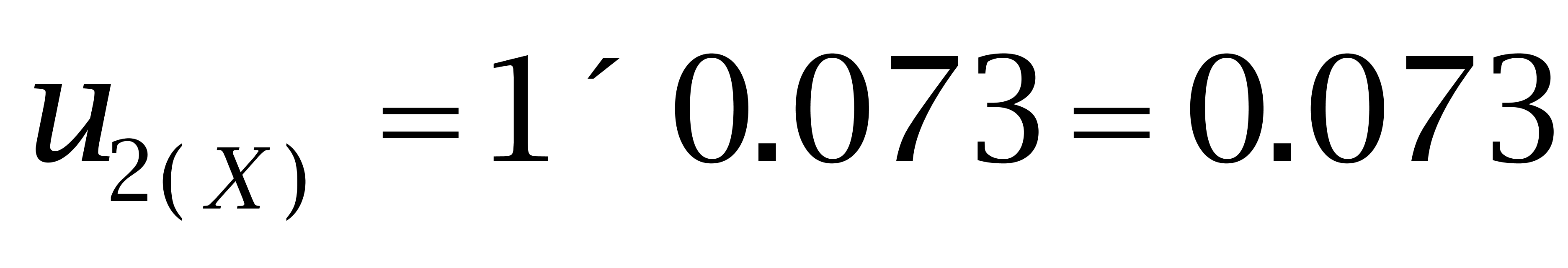
3.3 己烷雌酚的各分量相对标准不确定度:
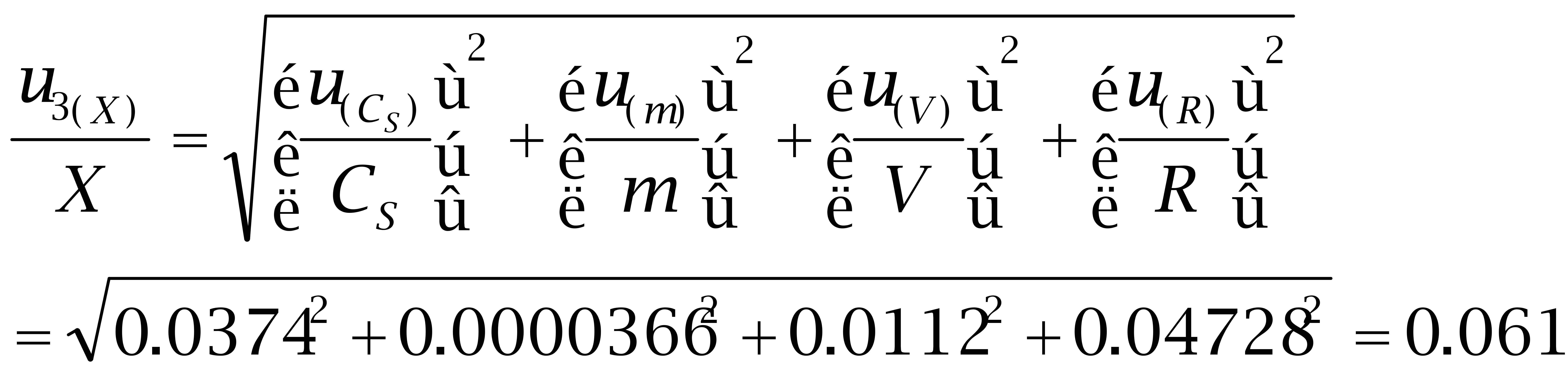 己烷雌酚(100 μg/kg)的标准不确定度为:
己烷雌酚(100 μg/kg)的标准不确定度为:

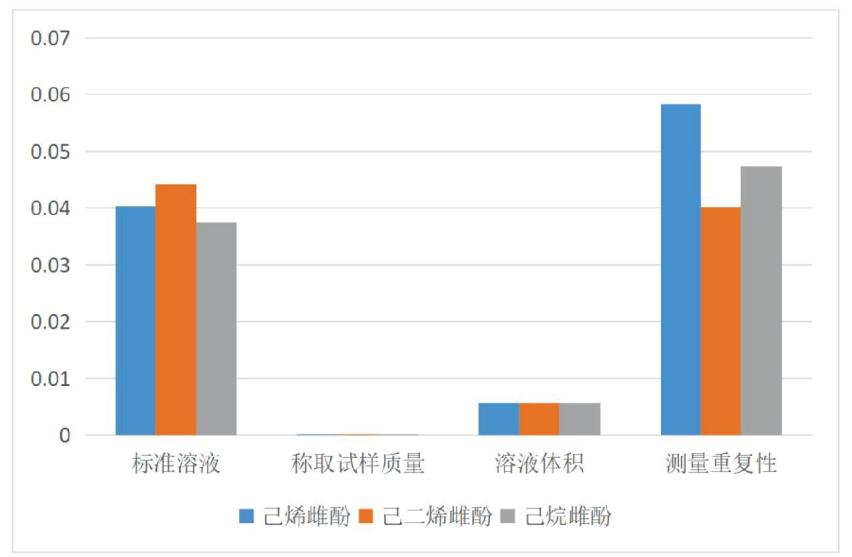
图1 己烯雌酚、己烷雌酚及己二烯雌酚的标准不确定度分量贡献图
Fig.1 The standard uncertainty contribution of diethylstilboestrol, dienestrol and hexoestrol
4 己烯雌酚、己二烯雌酚及己烷雌酚的扩展不确定度
4.1 己烯雌酚的扩展不确定度
取包含因子k=2,则己烯雌酚的扩展不确定度为: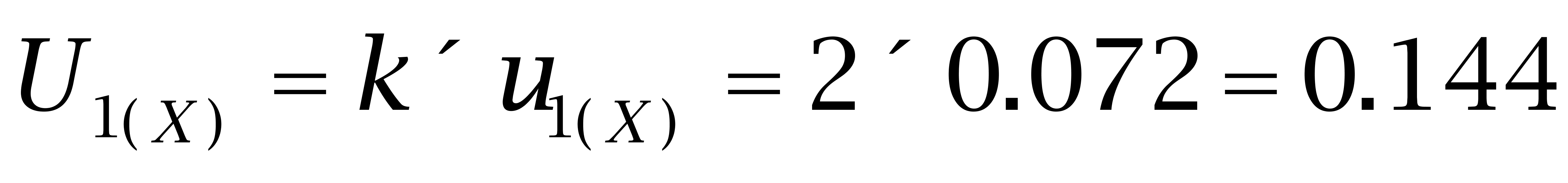
4.2 己二烯雌酚的扩展不确定度
取包含因子k=2,则己二烯雌酚的扩展不确定度为: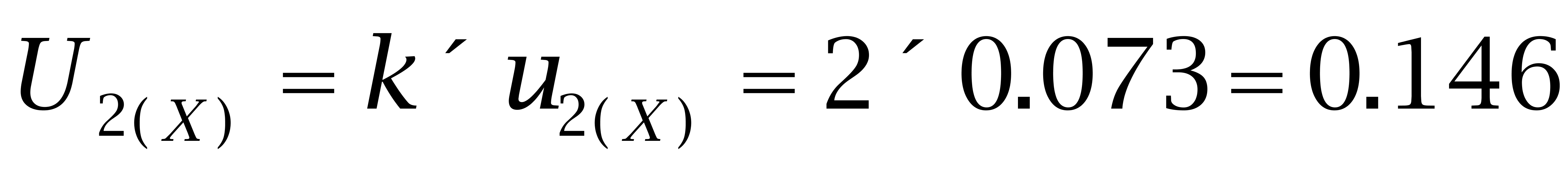
4.3 己烷雌酚的扩展不确定度
取包含因子k=2,则己烷雌酚的扩展不确定度为: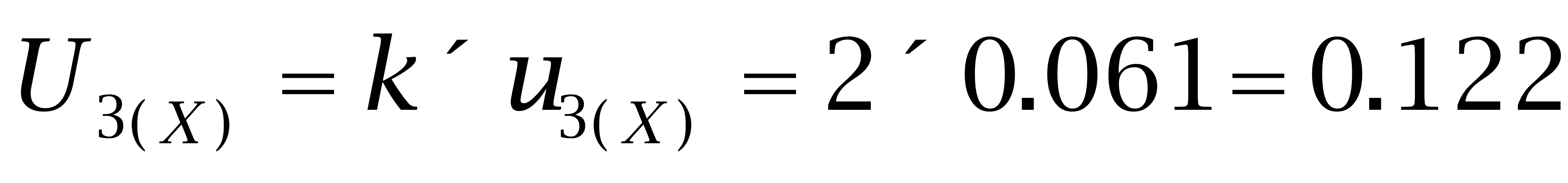
5 测定结果报告
根据公式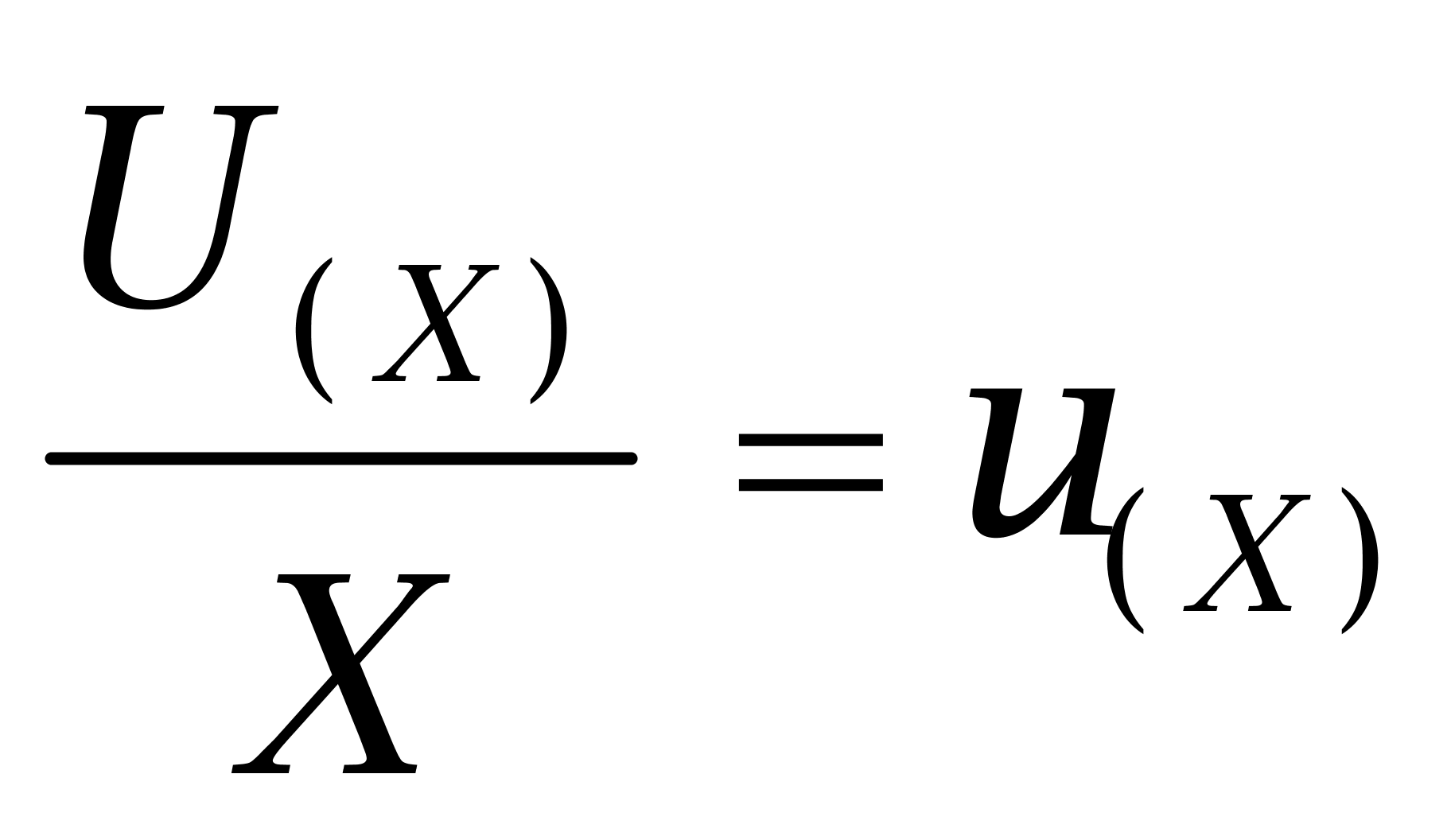 ,则合成标准不确定度为
,则合成标准不确定度为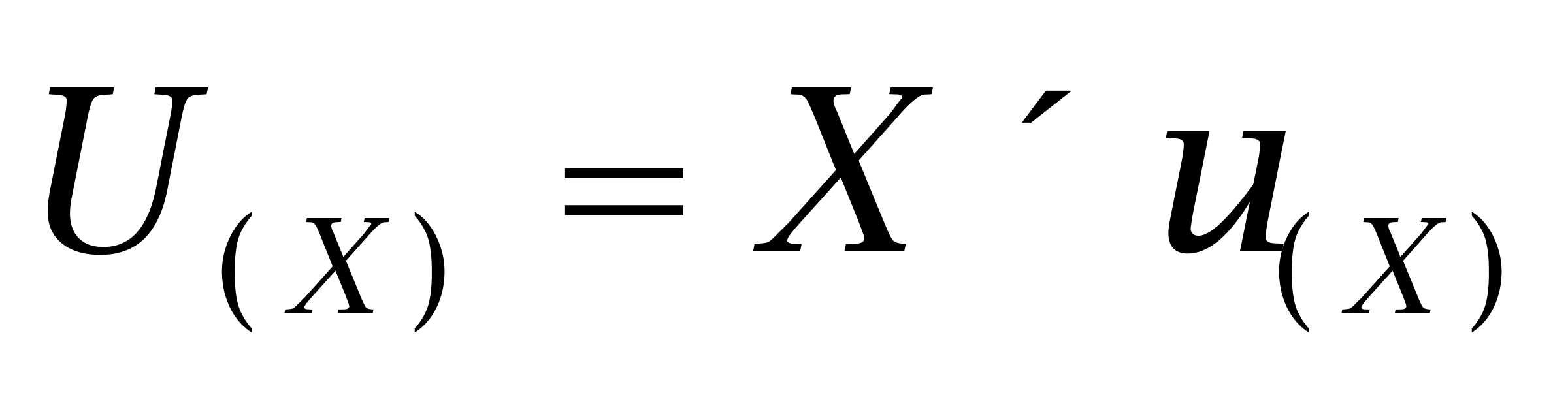 ,扩展不确定度可由合成标准不确定度乘以包含因子得到,即
,扩展不确定度可由合成标准不确定度乘以包含因子得到,即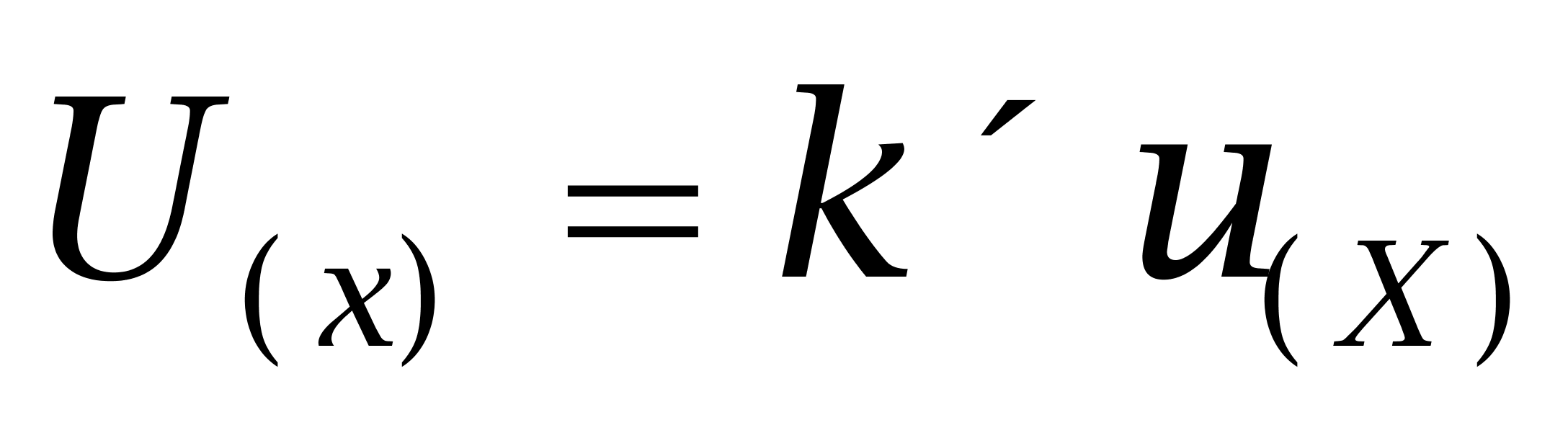 ;取 k=2,式中,
;取 k=2,式中,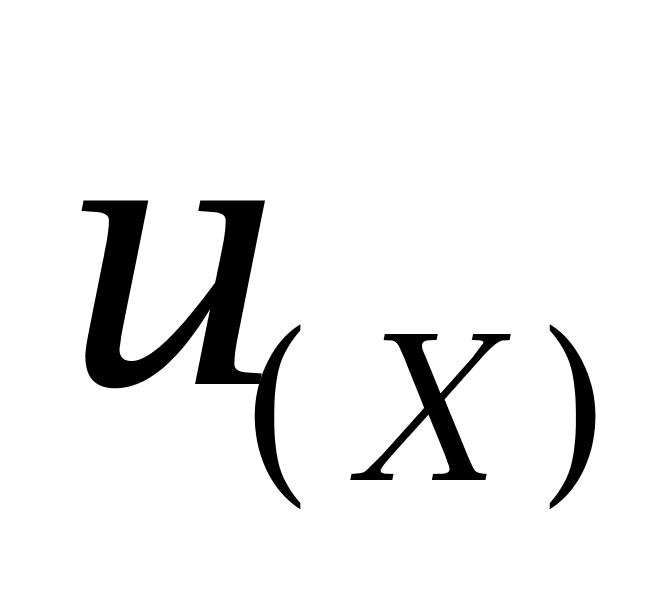 分别表示己烯雌酚、己二烯雌酚及己烷雌酚的相对合成不确定度;
分别表示己烯雌酚、己二烯雌酚及己烷雌酚的相对合成不确定度;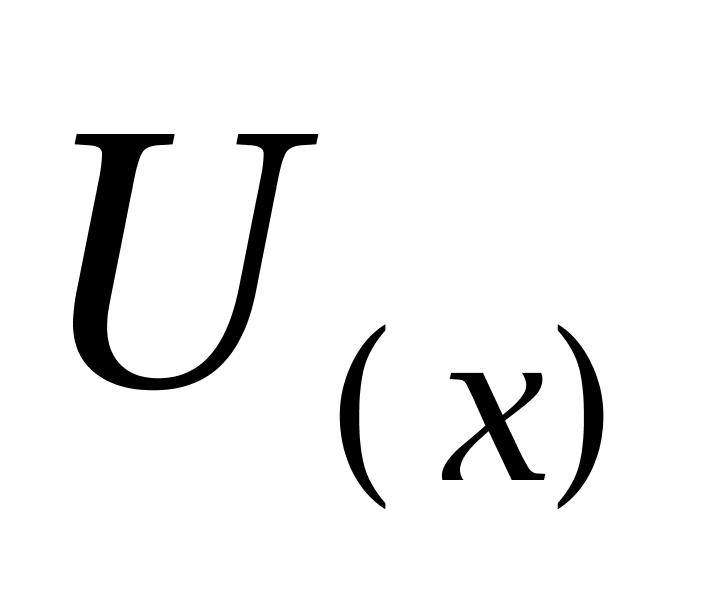 表示合成标准不确定度;X 表示样品鲤鱼中己烯雌酚、己烷雌酚及己二烯雌酚残留量,
表示合成标准不确定度;X 表示样品鲤鱼中己烯雌酚、己烷雌酚及己二烯雌酚残留量,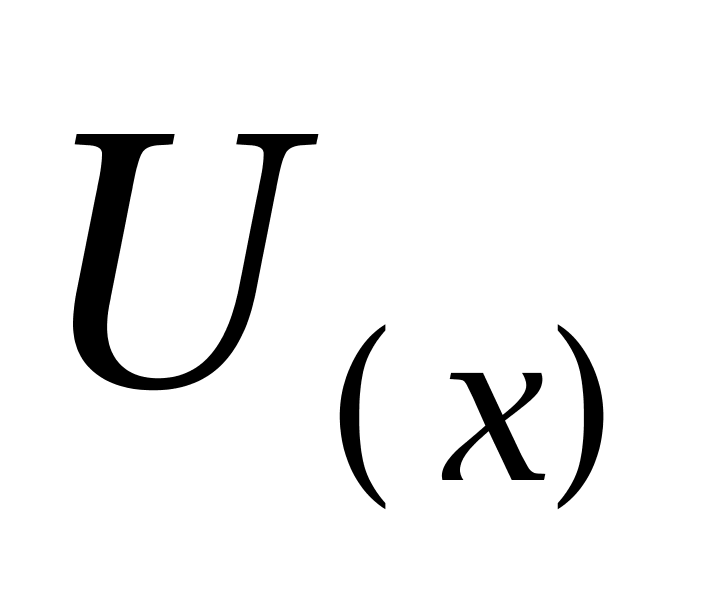 表示扩展不确定度。根据计算得到样品鲤鱼中己烯雌酚、己烷雌酚及己二烯雌酚残留量为 100 μg/kg,则鲤鱼中己烯雌酚、己二烯雌酚及己烷雌酚残留量的扩展不确定度分别为:
表示扩展不确定度。根据计算得到样品鲤鱼中己烯雌酚、己烷雌酚及己二烯雌酚残留量为 100 μg/kg,则鲤鱼中己烯雌酚、己二烯雌酚及己烷雌酚残留量的扩展不确定度分别为:
鲤鱼中己烯雌酚、己烷雌酚及己二烯雌酚残留量为:
X1=(100±28.2)μg/kg(k=2)
X2=(100±29.2)μg/kg(k=2)
X2=(100±24.4)μg/kg(k=2)
6 结论
本研究分析了高效液相色谱-串联质谱法测定鲤鱼中己烯雌酚、己烷雌酚及己二烯雌酚残留量的不确定度,通过计算给出了己烯雌酚、己烷雌酚及己二烯雌酚合成相对标准不确定度及扩展不确定度。从各不确定度分量对测量结果不确定度贡献大小的比较可以看出,测量重复性对己烯雌酚、己烷雌酚及己二烯雌酚残留量测定不确定度的影响最大,其次是标准溶液的不确定度,再次是移取和定容体积,样品称量对不确定度的影响最小,可以忽略不计。因此,在日常检测中,应严格控制实验条件,规范实验操作,保障测定结果的准确性。
【该文经CNKI学术不端文献检测系统检测,总文字复制比为9.8%。】
参考文献
[1]文红,李涛,王红. HPLC测定鱼肉中4种激素残留量及不确定度评估研究[J]. 中国卫生检验杂志, 2007, 17(6): 1111-1114.
[2]中华人民共和国国家质量监督检验检疫总局. 化学分析测量不确定度评定: JJF 1135—2005[S]. 北京: 中国计量出版社, 2005.
[3]中华人民共和国国家质量监督检验检疫总局, 国家质量监督检验检疫总局. 动物源食品中激素多残留检测方法 液相色谱-质谱/质谱法: GB/T 21981—2008[S]. 北京: 中国标准出版社, 2008.
[4]张敬敬,曹小妹,陈学武,等.畜产品中激素残留检测方法的进展[J].化学研究与应用, 2012, 24(11): 1617-1623.
[5]王凌云,汪澍,梁建怡.HPLC法测定水产品中四种雌激素的不确定度评价[J].计量技术, 2006(4): 53-56.
[6]刘一,杨静,李娜,等.液-质联用测定人血浆中己烯雌酚浓度的不确定度分析[J].中国医院药学杂志, 2013(3): 187-192.
[7]姜峰,王志龙,王巧云,等.双烯雌酚纯度标准物质的定值与不确定度评定[J].华南理工大学学报(自然科学版), 2014, 42(2): 44-49+56.
[8]王宇,孔祥瑞,李成久.气相色谱—质谱法测定水产品中己烯雌酚的不确定度分析评定[J].水产科学, 2016, (3): 284-288.
[9]文红, 李涛, 王红. HPLC测定鱼肉中4种激素残留量及不确定度评估研究[J]. 中国卫生检验杂志, 2007, 17(6): 1111-1111.
[10]姜峰,王志龙,李明,等.己烷雌酚纯度标准物质的研究[J].化学试剂, 2014, (2): 143-146.
[11]季军.常用玻璃量器测量结果的测量不确定度评定[J].工业计量, 2017, (S2): 67-69.
[12]周琼.测量不确定度及其评定步骤、方法浅析[J].武钢技术, 2007, (6): 10-13.
(文章类别:CPST-C)







