CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
应用数字PCR对新型冠状病毒核酸检测结果的分析
作者:王体辉1 江亚娟1 范莹莹1 孔 政1* 焦伯延1*
王体辉1 江亚娟1 范莹莹1 孔 政1* 焦伯延1*
关键词 数字PCR;实时荧光定量PCR;新型冠状病毒;核酸检测
Analysis of the Detection Results of SARS-COV-2 Nucleic Acid Detected by Digital PCR
WANG Ti-Hui1 JIANG Ya-Juan1 FAN Ying-Ying1 KONG Zheng1* JIAO Bo-Yan1*
Abstract This study analyzes the results of the nucleic acid deteCtion of severe acute respiratory syndrome coronavirus 2(SARS-CoV-2) with digital PCR(dPCR) and Quantitative Real-time PCR (qPCR), to provide data for deteCtion of SARS-CoV-2 samples with low content by dPCR. N and ORF1ab genes of SARS-CoV-2 from 17 COVID-19 cases were tested respectively, in which N genes of 17 confirmed COVID-19 cases were all positive by qPCR tests while ORF1ab genes of 15 cases were positive. There was no significant difference in Ct values between N gene and ORF1ab gene. However, there was significant difference when Ct values were larger than 32. Concentration of N gene and ORF1ab gene of 17 cases detected by dPCR tests was highly correlated with the Ct values detected by qPCR tests. In addition, two cases whose ORF1ab gene could not be detected by qPCR tests could be detected by dPCR tests. The results of dPCR and qPCR were consistent. The sensitivity and accuracy of dPCR were higher than those of qPCR. Thus, dPCR could be an effective supplement to qPCR, especially for cases with large Ct values or only single target gene tested positive by qPCR.
Keywords digital PCR; quantitative real-time PCR; severe acute respiratory syndrome coronavirus 2; nucleic acid detection
第一作者:王体辉(1985—),男,汉族,山东济宁人,本科,主管技师,主要从事微生物检验工作
通讯作者1:焦伯延(1983—),男,汉族,山东济宁人,博士,副主任技师,研究方向为微生物检验,E-mail: j198319831983@126.com
通讯作者2:孔政(1985—),女,汉族,山东济宁人,本科,主管技师,主要从事微生物检验工作,E-mail: 306495806@qq.com
1.济宁市疾病预防控制中心检验科 济宁 272000
1. Jining Center for Disease Control and Prevention, Jining 272000
新型冠状病毒肺炎(Coronavirus disease 2019,COVID-19)是由新型冠状病毒(Severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染导致的肺炎,以发热、咳嗽、乏力、流涕为主要临床表现,重症病例可出现呼吸衰竭,甚至死亡[1-2]。SARS-CoV-2感染严重威胁人体健康,并给全球的政治和经济带来巨大影响[3]。
实验室检验检测是COVID-19有效防控的关键,实时荧光定量PCR(Quantitative Real-time PCR,qPCR)具有操作简单、价格低、速度快,特异性和敏感度高等优点。qPCR检测SARS-CoV-2的N基因开放读码框(Nucleocapsid open reading frame,N-ORF)和开放读码框1ab(Open reading frame 1ab,ORF1ab)是目前COVID-19实验室诊断最常用的方法[4-5]。然而,样品中SARS-CoV-2浓度较低时,qPCR检测可能出现单基因弱阳性或假阴性,给COVID-19的实验室检测和防控带来困扰[6-7]。数字PCR(Digital PCR,dPCR)是在传统PCR和qPCR技术基础之上发展形成的一种新型核酸定量检测技术,能够将扩增体系分配至数万个独立的微滴,有效降低反应体系内抑制剂和背景信号对结果判定的影响,并能够有效获得靶基因的精确浓度[8]。此外,dPCR比qPCR具有更高的灵敏度[9]。
本研究利用dPCR和qPCR对17份COVID-19确诊患者的核酸样品进行检测,比较两种检测方法的一致性和差异性,探讨不同检测技术在COVID-19实验室检验检测中可能出现的问题,为qPCR检测单基因弱阳性或假阴性临床样本的综合检测提供数据支持。
1 材料和方法
1.1 仪器和试剂
QIAcuity One数字PCR仪购自QIAGEN公司;Lightcycler 480 II实时荧光定量PCR仪购自Roche公司;GeneRotex 96全自动核酸提取仪购自西安天隆科技有限公司;新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)购自北京金豪制药股份有限公司(国械注准:20203400322);病毒RNA提取试剂盒购自西安天隆科技有限公司;QuantiTect® Reverse Transcription Kit、QIAcuity™ Probe PCR Kit和QIAcuity™ Nanoplate 26K 24-well均购自QIAGEN公司。
1.2 实验方法
1.2.1 实时荧光定量PCR检测
取200 μL COVID-19确诊患者标本进行核酸自动提取,按商品化试剂盒说明书进行检测,Ct值≤38结果判定为阳性。利用阈值线将N基因和ORF1ab基因的阳性对照的Ct值调为等值(本次检测阳性对照的Ct值均为25.62)后,判读标本Ct值。
1.2.2 数字PCR检测
按商品化试剂盒说明书进行检测。标本浓度(copies/mL)=反应体系浓度(copies/μL) ×40×1000/12。
1.3 统计学分析
利用SPSS17.0软件对数据进行配对t检验和线性回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 qPCR检测结果
qPCR检测17份样本核酸的SARS-CoV-2 N基因和ORF1ab基因,N基因均阳性;ORF1ab基因15份阳性、2份阴性,即两份样本N基因检测单阳。N基因Ct值平均值为30.38,ORF1ab基因Ct值平均值为30.80(见表1)。N基因Ct值和ORF1ab基因Ct值差异无统计学意义(P=0.23)。但ORF1ab基因Ct值大于32的7份样本,N基因Ct值均小于ORF1ab基因,差异有统计学意义(P<0.001)。
2.2 dPCR检测结果
17份样本经dPCR检测后,获得N基因和ORF1ab基因的浓度,其中N基因浓度范围为530~10796333 copies/mL,平均943015 copies/mL;ORF1ab基因浓度范围为417~16161000 copies/mL,平均1143730 copies/mL(表1),N基因和ORF1ab基因浓度差异无统计学意义(P=0.55)。但是,对于实时荧光定量PCR检测N基因阳性、ORF1ab基因阴性的2份样本数字PCR均有检出,但拷贝数均低于500,见表1。说明数字PCR比实时荧光定量PCR有较高的灵敏度。
表1 qPCR和dPCR新型冠状病毒核酸检测结果
Table 1 Comparison of the detection results of SARS-CoV-2 nucleic acid by dPCR and qPCR
编号 | 实时荧光定量PCR | 数字PCR | ||
Ct值 | Ct值 | (copies/mL) | (copies/mL) | |
1 | 20.60 | 18.99 | 10796333 | 16161000 |
2 | 25.88 | 24.99 | 1817667 | 967667 |
3 | 26.03 | 25.81 | 690000 | 431333 |
4 | 26.55 | 24.72 | 1158667 | 880000 |
5 | 26.76 | 26.21 | 748667 | 378667 |
6 | 28.69 | 28.09 | 433000 | 319000 |
7 | 28.82 | 28.92 | 302667 | 228333 |
8 | 29.46 | 29.51 | 19067 | 32000 |
9 | 31.12 | 31.67 | 15000 | 14667 |
10 | 31.19 | 30.59 | 13333 | 13000 |
11 | 31.85 | 32.47 | 10667 | 3667 |
12 | 32.71 | 33.96 | 5667 | 3667 |
13 | 33.21 | 35.84 | 9667 | 4667 |
14 | 33.43 | 34.91 | 5000 | 1713 |
15 | 34.61 | 36.94 | 4667 | 3177 |
16 | 37.56 | - | 663 | 430 |
17 | 37.91 | - | 530 | 417 |
2.3 Ct 值和浓度在对数坐标系呈线性关系
以N基因qPCR检测的Ct值为横坐标,以dPCR检测的浓度为纵坐标,在对数坐标系,经线性回归分析,R-Square值为0.93,说明N基因Ct值与浓度的log值呈线性负相关关系,见图1。以ORF1ab基因qPCR检测的Ct值为横坐标,以dPCR检测的浓度为纵坐标,在对数坐标系,经线性回归分析,R-Square值为0.94,说明ORF1ab基因Ct值与浓度的log值呈线性负相关关系,见图2。说明数字PCR检测新冠病毒基因的浓度和实时荧光定量PCR检测的Ct值高度相关。
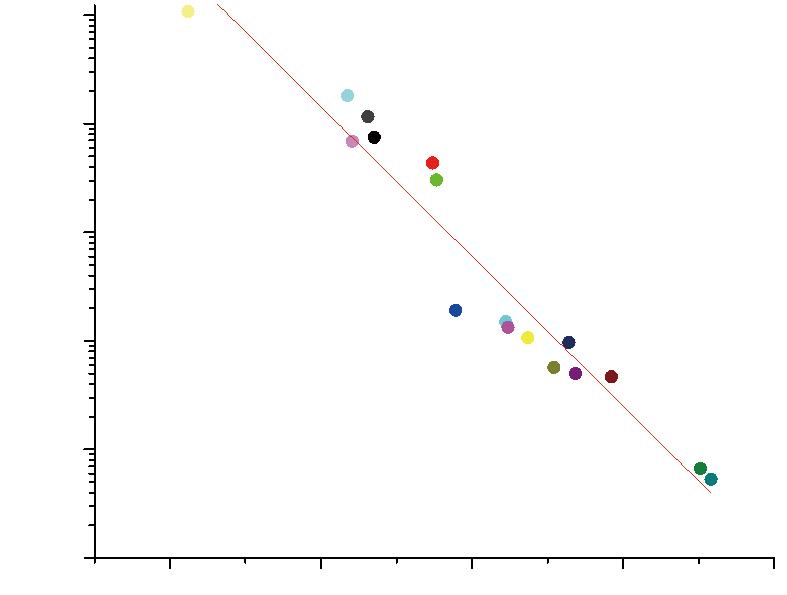
图1 SARS-CoV-2 N基因Ct值与浓度在指数坐标系线性关系
Fig.1 The linear relationship between Ct value and concentration of SARS-CoV-2 N gene in exponential coordinate system
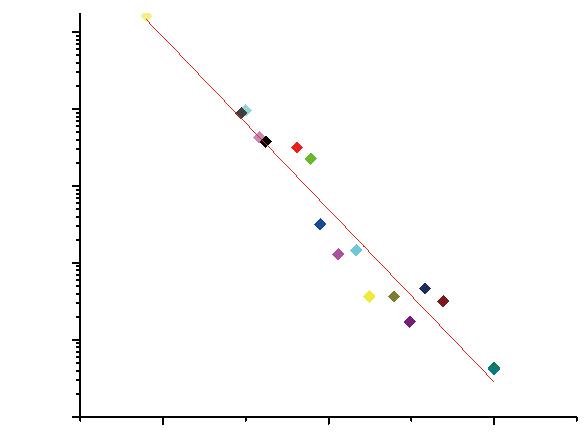
图2 SARS-CoV-2 ORF1ab基因Ct值与浓度在指数坐标系线性关系
Fig.2 The linear relationship between Ct value and concentration of SARS-CoV-2 ORF1ab gene in exponential coordinate system
3 讨论
全球COVID-19疫情形势依然不容乐观,我国面临境外输入和本土暴发的风险依然存在[10]。快速准确地确定COVID-19患者是疫情防控的关键。qPCR是COVID-19实验室检测最关键的技术,但是其检测结果受多方面因素影响,此外,Ct值的判读、阈值线的位置和S扩增曲线的判断需要一定的技术和经验[4,11]。不同试剂厂家的灵敏度和精确度也不同[12]。患者发病早期和治疗后,病毒浓度可能较低,qPCR可能出现假阴性[7]。对于浓度较低样本的检验检测依然是实验室诊断的难点。芯片式dPCR是基于纳米微孔板的一体化集成数字PCR系统,利用微流体技术,每份样本核酸可随机分布至26000个体积均一的微反应体系,具有更高的敏感性和稳定性[13]。目前,dPCR广泛应用于微生物、转基因产品、肿瘤相关基因等检验检测[14-16]。此外,在COVID-19实验室诊断过程中,dPCR比qPCR具有更高的敏感性[7,17]。
本研究对17份COVID-19样本进行qPCR,结果发现qPCR对于ORF1ab基因Ct大于32的低浓度样本的检测结果,ORF1ab基因的Ct值均大于N基因Ct值,与天津市检测结果高度相似,原因可能是N基因的含量高于ORF1ab基因或N基因的扩增效率高于ORF1ab基因[11]。此外,与天津、四川等地qPCR检测出现N基因单基因阳性且接近临界值类似[11,18-19],本研究qPCR两份样本N基因Ct值分别为37.56和37.91,接近阳性判断临界值38,而ORF1ab基因阴性。说明在临床上确实存在一定数量的qPCR较难检测判断的病毒载量较低的COVID-19样本,这类样本需要在实验室检验检测过程中高度关注。而利用dPCR检测获得17份COVID-19样本的N基因和ORF1ab基因浓度值。
此外,本研究dPCR对N基因和ORF1ab基因检测浓度的log值与qPCR检测的两个基因的Ct值呈线性关系,说明dPCR和qPCR检测具有较好的一致性。但是,dPCR检测能够获得N基因和ORF1ab基因准确的浓度,特别是对于qPCR检测N基因弱阳性而ORF1ab基因阴性的两份样本,dPCR检测均获得了N基因和ORF1ab基因的准确浓度,说明在低拷贝数SARS-CoV-2核酸的检测过程中,dPCR比qPCR有显著的优势,再次确证dPCR比qPCR有更高的敏感性和准确性。
4 结论
综上所述,利用dPCR检测SARS-CoV-2核酸是qPCR的有效补充,dPCR能够弥补qPCR检测敏感性较低、出现假阴性和单基因弱阳性的难题。对qPCR检测SARS-CoV-2核酸难以判断结果的样本,特别是COVID-19患者发病早期样本、经治疗后要出院患者的样本、进口产品等较低病毒浓度样本的检测,dPCR能够及时准确地判断阳性患者或物品,为较早确诊患者并提前控制COVID-19疫情提供可能。
1E7
1000000
100000
10000
1000
100
20 25 30 35 40
1E7
1000000
1 0 0000
10000
1000
100
20 30 40
参考文献
[1] Jin Y, Yang H, Ji W, et al. Virology, epidemiology, pathogenesis, and control of COVID-19[J]. Viruses, 2020, 12(4): 372.
[2] Lai C C, Shih T P, Ko W C, et al. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and coronavirus disease-2019 (COVID-19): The epidemic and the challenges[J]. International Journal of Antimicrobial Agents, 2020, 55(3): 105924.
[3] Nicola M, Alsafi Z, Sohrabi C, et al. The socio-economic implications of the coronavirus pandemic (COVID-19): a review[J]. International Journal of Surgery (London, England), 2020, 78: 185-193.
[4]梁圣楠, 刘漩, 梅金红. 基于实时荧光RT-PCR法对新型冠状病毒核酸检测的研究[J]. 病毒学报, 2020, 36(6): 1171-1176.
[5]荆扬, 马志倩, 肖书奇. 新型冠状病毒检测技术研究进展[J]. 动物医学进展, 2020, 41(6): 115-119.
[6] 高维寅, 张洪, 罗阳. 新型冠状病毒肺炎核酸检测中的假阴性分析及对策[J]. 国际检验医学杂志, 2020, 41(6): 641-643.
[7] Suo T, Liu X J, Feng J P, et al. ddPCR: a more accurate tool for SARS-CoV-2 deteCtion in low viral load specimens[J]. Emerging Microbes & InfeCtions, 2020, 9(1): 1259-1268.
[8] Mao X, Liu C, Tong H, et al. Principles of digital PCR and its applications in current obstetrical and gynecological diseases[J]. American Journal of Translational Research, 2019, 11(12): 7209-7222.
[9] Dong L, Zhou J, Niu C, et al. Highly accurate and sensitive diagnostic deteCtion of SARS-CoV-2 by digital PCR[J]. Talanta, 2021, 224: 121726.
[10]沈思鹏, 魏永越, 赵杨, 等.全球新型冠状病毒肺炎疫情对我国的输入风险评估[J].中华流行病学杂志, 2020, 41(10): 1582-1587.
[11]李晓燕, 高鑫, 郭丽茹, 等. 天津市新型冠状病毒肺炎确诊病例病原学检测结果及影响因素分析[J]. 中华微生物学和免疫学杂志, 2020, 40(5): 330-335.
[12]熊丹, 阚丽娟, 王萌萌,等. 七种国产新型冠状病毒核酸检测试剂盒的一致性和检出能力评价研究[J]. 中华检验医学杂志, 2020, 43(8): 787-793.
[13]詹成, 燕丽, 王琳, 等. 数字PCR技术的发展和应用[J]. 复旦学报(医学版), 2015, 42(6): 786-789.
[14]黄瑾, 梁涛波, 许恒毅, 等. 数字PCR在生物学检测中应用的研究进展[J]. 生命科学, 2021, 33(2): 255-264.
[15]卢海强, 焦新雅, 吴思源, 等. 数字PCR在食源性致病菌检测中的应用进展[J]. 生物技术进展, 2021, 11(3): 260-268.
[16]曹紫阳, 吴伟, 侯立坤, 等. 微滴数字PCR与Super-ARMS PCR检测非小细胞肺癌患者表皮生长因子受体(EGFR)酪氨酸激酶抑制剂治疗耐药后血浆游离DNA EGFR基因T790M突变的对比分析[J]. 中华病理学杂志, 2018, 47(12): 910-914.
[17] Liu X, Feng J, Zhang Q, et al. Analytical comparisons of SARS-COV-2 deteCtion by qRT-PCR and ddPCR with multiple primer/probe sets[J]. Emerging Microbes & InfeCtions, 2020, 9(1): 1175-1179.
[18]李宝林, 李芹, 吴刚, 等. 15例COVID-19患者治疗后痰、粪便标本新型冠状病毒核酸检测结果比较[J]. 中国感染控制杂志, 2020, 19(3): 239-244.
[19]黄玉兰, 韩声付, 曾林子, 等. 3种实时荧光PCR仪对120份新型冠状病毒检测标本的检测结果比较[J]. 国际检验医学杂志, 2020, 41(22): 2732-2735.
(文章类别:CPST-A)







