CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
氮杂环含能材料热分解动力学的TG/DSC差热分析研究
作者:熊中强1* 张媛媛1 于艳军1 李宁涛1
熊中强1* 张媛媛1 于艳军1 李宁涛1
Thermogravimetric Differential Thermal Analysis (TG/DSC) Study on the Thermal Decomposition Kinetics of Nitrogen-Heterocyclic Energetic Materials
XIONG Zhong-Qiang1* ZHANG Yuan-Yuan1 YU Yan-Jun1 LI Ning-Tao1
Abstract The comprehensive thermal analysis method of Thermogravimetric/Differential Scanning Gauge (TG/DSC) is used to analyze the thermal decomposition and non-isothermal kinetics of the nitrogen heterocyclic energetic material (2,4,6-triamino-3,5-dinitropyridine-1-oxidation,TANPyO) . The results show that the thermal decomposition process of TANPyO is greatly affected by the sample particle size. Large-size samples (100-120 μm) are affected by local chemical effects such as crystal surface defects and crack force field unsaturated points. The thermal decomposition process presents a two-stage process. When the particle size is less than 2 μm, it presents an intrinsic kinetic decomposition mode. And changes in temperature affect the rate of thermal decomposition. The kinetic parameters of the thermal decomposition of TANPyO are calculated by Archar differential method and Coats-Redfen integral method: the activation energy E=160.0 kJ/mol, and A=4.474×1020. The kinetic simulation results indicate that the thermal decomposition mechanism of TANPyO conforms to both the "nucleation-growth-acceleration" process and the kinetic mechanism of the Avrami-Erofeev equation model, and the thermal decomposition reaction order is "n=3".
Keywords nitrogen heterocyclic energetic materials; thermal decomposition; differential thermal analysis; non-isothermal kinetics
基金项目:天津海关科研项目(2020THK003)
第一作者:熊中强(1977—),男,湖北襄阳人,正高级工程师,主要从事危险化学品分类及包装检测工作,E-mail: xiongzhongqiang@customs.gov.cn
1.天津海关工业产品安全技术中心 天津 300308
1. Technical Center for Safety of Industrial Products of Tianjin Customs, Tianjin 300308
新型氮杂环含能材料,其主要特征在于分子中拥有N-N键、C-N键,使得其分子结构内部拥有更高的环张力,从而获得更高的能量密度,也是目前国内外高能量密度物质(HEDM)研究的主要方向。2,4,6-三氨基-3,5-二硝基吡啶-1-氧化物(TANPyO)具有六元环氮杂环分子结构,除1个N取代杂环外,拥有3个-NH2取代基,能量密度较高。TANPyO可通过2,6-二氨基吡啶经硝化、酸化、氨基化3步反应合成,作为新型HEDM类氮杂环含能化合物的代表,具有爆速快、热稳定性高的特点,与金属、非金属材料均拥有较好的相容性,有望成为溶注炸药的主要成分。
在不同类型HEDM材料能量密度的研究中,材料热分解过程及质量能量基本动力学和热力学研究是获得HEDM材料基础能量数据的重要领域[1]。如对于氮杂环化合物热分解过程采用差热分析技术进行模拟研究,包括温度跃升/傅里叶变换红外(T Jump/FTIR)联用法、热重/差示扫描量热法(TG/DSC),开展HEDM材料在模拟分解燃烧条件下的自加速快速反应研究,通过反应压力、反应温度等参数的变化,模拟计算反应动力学参数、分解反应机理,建立起相应燃烧/爆炸分解反应模型。在机理研究领域,Irvine,Solomon等[2]通过四氮杂环辛烷类化合物研究提出,在氮氧杂环含能材料分解过程中,通常首先发生NO2自由基断裂与母体环迅速协同破裂,自由基CH2=N•生成,并氧化分解生成碳氧化物、氮氧化物,引发链反应,且伴随部分反应生成CO、CO2、NO等气相产物。本研究以TANPyO为对象,采用TG/DSC分析仪,结合非等温动力学方法,研究TANPyO热分解动力学行为、计算回归热分解反应动力学参数。研究结果获得TANPyO的材料相容性、使用及存储安定性基础数据,模拟回归TANPyO材料热分解机理,为爆轰理论研究的开展提供基础理论模型。
1 试验
1.1 试验试剂
本研究所用TANPyO通常以2,6-二氨基吡啶为原料,通过硝化、酸化、氨基化3步反应合成[3],如图1所示,反应总产率约40%。TANPyO密度约1.88 g/cm3。
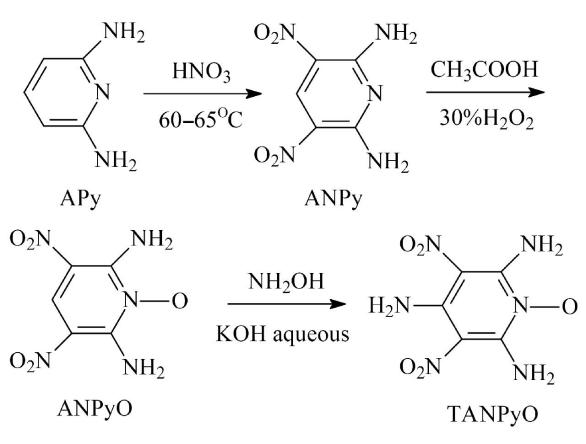
图1 TANPyOy合成过程
Fig.1 Synthesis of TANPyO
1.2 试验仪器与过程
试验使用NETZSCH公司DSC/DTA-TG STA 409 PC同步热分析仪,采用高纯铟进行能量、温度校正。校正及试验分析过程均在40 mL/min流速高纯氮气气氛条件下进行,参比物为α-Al2O3。
试验过程中,取匀质代表性TANPyO样品2.0 mg放入铝样品皿中,封闭样品,将样品放入天平支架。采用程序升温过程,自室温起以5℃/min升温至110℃保持15 min,去除样品中可能残余的水分。再以不同升温速率升温至600℃,同步采集升温过程中的热重、差热反应数据,进行动力学计算机模型拟合。
2 结果与讨论
2.1 TANPyO的分解过程
依据“成核”分解反应过程机理,在含能材料的热分解过程中,最早生成的诱导产物中晶格特殊点被称为“核”,并依据其相对于某一临界值大小分为“萌芽核”“生长核”[4-6],从固态物质局部位置开始引发全面的分解反应。含能物质在成核、核生长过程中一般活化能较低,在较低温度下即可发生,某些中间产物尤其是热稳定性中间产物对分解过程有较大影响,其扩散、晶体表面吸附及解吸过程均会改变物质分解过程 [7-8]。试验考察样品粒径大小对于TANPyO分解过程的影响,选择100~120 µm粒径及2 µm粒径,在15℃/min升温条件下进行试验,结果如图2所示。从图中可以看出,同小粒径TANPyO相比,大粒径TANPyO的受热分解过程呈阶段性变化,第一阶段样品失重约11%;而较小粒径TANPyO样品的DSC分析曲线未呈现明显的两阶段变化过程,仅存在类似于大粒径样品第二阶段分解曲线的单阶段分解曲线。
粒径对于TANPyO的热分解存在较大影响,第一阶段分解是在TANPyO的晶体表面局部位置进行,符合“局部化学”效应, TANPyO大粒度晶体表面存在缺陷、裂纹等力场不饱和点,随着反应的进行,新的晶体表面稳定成核之前,需经过无序到有序转变并最终转化成“生长核”,其中经典的“成核理论”显示,成核过程涉及多一级能垒。相对于大颗粒晶体,在小颗粒晶体条件下第二步能垒所需活化能更低、反应更易于诱发,大颗粒晶体由于单独相结构影响,导致成核相对困难,不能对成核率提供较高贡献,以及趋于玻璃态的形成,影响成核率的提升和“核成长”阶段的发展。从分子内应力及张力能分析,大晶体内部存在着比小晶体更高的张力内应力,会促使晶体破裂生成较小的晶体,产生张力能。对于本征动力学的研究,应在排除动力学过程以外的其他动力学控制步骤的基础上进行,因此TANPyO的本征动力学研究应在形成的更大比表面晶体上进行。本研究选择小粒径样品(2 µm)TANPyO进行热分解动力学过程研究。
2.2 TANPyO的热分解动力学分析
基于TG/DSC分析技术方法的非等温动力学研究,通过在程序控温条件下,测量目标样品与参比值之间的热效应差,通过差热放大电路与补偿性差热,当试样热反应时产生的热量变化被输入功率补偿达到样品/参比平衡。通过测量升温过程中物质受热产生的物理、化学性质变化,进而对物质进行定性、定量分析,同时为新高密度能量材料的研究和开发,提供热性能数据、反应性数据、安定性数据以及结构信息数据。
对于小粒径晶体TANPyO的分解过程,依据非等温动力学理论,在受控线性升温条件下,目标物质的热分解动力学方程可表达为微分形式或积分形式[9-13]:
(1)
(2)
式中,α为转化率,E为活化能,A为指前因子,R为气体常数,T为热力学温度,与升温速率β满足T=T0+βt,依据Ozawa积分法:
(3)
其中,当转化率相同时,lgβ与温度1/T呈线性相关关系,通过计算可获得反应活化能。在升温速率10~25℃/min反应条件下,TANPyO的TG-DSC曲线如图3所示,分别测定转化率达5%、10%、15%、20%。25%时的温度,对获取的数据进行拟合,计算活化能E、相关度系数r2,结果如表1所示。
表1 Ozawa法拟合反应活化能
Table 1 Value of E fitting by Ozawa method
转化率α (%) | 升温速率β(℃·min-1) | 计算结果 | ||||
10 | 15 | 20 | 25 | E (kJ·mol-1) | 相关度系数r2 | |
5 | 229.14 | 233.69 | 242.31 | 246.01 | 103.49 | 0.9638 |
10 | 252.67 | 257.7 | 261.85 | 267.16 | 143.01 | 0.9804 |
15 | 260.41 | 268.18 | 271.33 | 277.93 | 124.86 | 0.9833 |
20 | 282.45 | 292.11 | 296.91 | 297.33 | 137.56 | 0.9854 |
25 | 306.21 | 309.15 | 314.66 | 317.89 | 199.12 | 0.9611 |
结果显示,在反应开始阶段(α=5%),活化能较低,分析其中原因可能由于TANPyO分子表面存在不规则晶格缺陷,处于初始反应阶段,未达到相对稳定反应期,不同条件下试验中数据采集偏差较大。随着反应的进行,当转化率达到10%~20%的中间进程阶段时,拟合回归所得活化能结果接近。反应进程的后阶段(α=25%)则由于内部晶格的进一步碎裂,引起活化能回归数据偏高。基于TG-DSC基础数据的活化能计算,可采用的方法包括Kissinger法、Coats-Redfern法、Ozawa法。有研究显示含能材料的热裂解动力学模拟中,Kissinger法、Coats-Redfern法进行机理线性拟合计算过程中,反应级数代入对线性影响较大,导致曲线拟合度偏低,Ozawa法拟合过程中,通过初始阶段核生长速率参数的引入,拟合温度区间内基本吻合,可排除反应机理函数预赋值引入的误差,在含能材料热裂解动力学模拟中应用最为广泛,本研究采用Ozawa法计算TANPyO热裂解活化能[9]。
2.3 TANPyO的热分解机理函数
以升温速率15℃/min条件下TANPyO热分析数据,开展TANPyO热分解过程模拟的机理函数计算基础数据,结果如表2所示。
表2 TANPyO热分析数据拟合结果(β=15 ℃/min)
Table 2 Fitting result from the thermal analysis data of TANPyO(β=15 ℃/min)
T/K | α | dα/dT |
505.53 | 0.045 | 0.0983 |
530.51 | 0.116 | 0.3002 |
550.58 | 0.173 | 0.2976 |
570.50 | 0.217 | 0.3715 |
590.23 | 0.280 | 0.2721 |
605.32 | 0.339 | 0.3180 |
625.61 | 0.407 | 0.1916 |
将表2中数据代入动力学微分方程、积分方程中,进行线性回归,当方程回归结果满足:同一反应机理条件下,微分、积分方程所得活化能、指前因子结果相近,且与Ozawa法所得结果相一致;方程线性回归相关度系数r2>0.98时,可认为相应的热力学分解机理函数为TANPyO最可能的热分解机理方程。
Archar微分方程:
(4)
Coats-Redfen积分方程:
(5)
对不同类型机理函数分别进行计算,活化能拟合结论与Ozawa方法比对,结果显示,采用Avrami-Erofeev反应机理方程,反应级数为3级时,以随机成核与核生长理论进行数据回归,相关度系数r2>0.98。
表3 Avrami-Erofeev反应TANPyO热分解动力学计算结果
Table 3 Calculated kinetic parameters of thermal decomposition of TANPyO by Avrami-Erofeev equation
计算结果 | E (kJ·mol-1) | A | r2 |
Archar法 | 153.1 | 5.774×1018 | 0.9806 |
Coats-Redfen法 | 166.8 | 3.467×1022 | 0.9811 |
平均值 | 160.0 | 4.474×1020 | - |
其热分解机理函数为:
(6)
(7)
将式(6)、(7)分别代入(1)、(2)式中,所得TANPyO热分解动力学方程为:
微分方程:
(8)
积分方程:
(9)
3 结论
利用TG-DSC分析技术方法,在程序升温条件下,研究了TANPyO受热非等温条件下分解过程,获得了TG、DSC曲线。依据TANPyO热分解曲线分析,其分解过程符合成核、核生长过程。以不同粒径样品进行分析,结果显示大粒径样品受表面边界效应影响,呈现两段式分解反应,影响对于本征动力学试验研究;小粒径样品试验过程未见明显的两段式过程,可反应TANPyO分解的本征动力学过程。采用非等温动力学分析方法,进行动力学数据模拟计算。不同机理函数拟合结果显示,TANPyO热反应动力学过程符合Avrami-Erofeev方程(n=3)。基础数据拟合Archar、Coats-Redfen结果显示,目的样品TANPyO热分解平均活化能为160.0 kJ·mol-1、动力学参数指前因子A=4.474×1020。
大粒径样品(100~120 µm) 小粒径样品(2 µm)
图2 不同粒径大小TANPyO的TG-DTG曲线(升温速率:15℃/min)
Fig.2 TG-DSC curves of TANPyO with different particle size (heating rate: 15℃/min)
图3 10~25℃/min升温条件下TANPyO的TG-DSC曲线
Fig.3 TG-DSC curves of TANPyO with heating rate of 10-25℃/min
参考文献
[1]朱科学,周慧明. 差示扫描量热法研究寡糖链对糖蛋白的热力学性质的影响[J]. 分析测试学报, 2004, 23(2): 38-40.
[2] Irvine J., Solomon R., Robert K., et. al. Proton magnetic resonance data fro some intermediates and products of nitrolysis of hexamethylenetetramine[J]. Journal of Chemical & Engineering Data, 1973, 18(3): 335-337.
[3] Hollins R, Merwin L, Nissan R, et al. Aminonitropyridines and their N-Oxides[J]. Heterocycl Chem, 1996, 33: 895-904
[4] George D., Frank S. Neutron scattering in materials science: small-angle neutron scattering studies of polymers[J]. MRS Bulletin, 1990, 15: 73-77.
[5] Matthews J., Rivero R. Base-promoted solid-phase synthesis of substituted hydantoins and thiohydantoins[J]. Journal of Organic Chemistry, 1997, 62(7): 6090-6092.
[6] Muthurajan H., Sivabalan R., Talawar M B., et al. Computer simulation for prediction of performance and thermodynamic parameters of high energy materials[J]. Journal of Hazardous Materials, 2004, 112: 17-33.
[7] Zhang T., Zhang J M., Jiang H H., et al. A DFT study on the stable structures and dissociation mechanism of C3O6 cluster[J]. CHINESE JOURNAL OF STRUCTURAL CHEMISTRY, 2011, 30(3): 443-447.
[8] Muthurajan H., Sivabalan R., Talawar M B., et al. Prediction of heat of formation and related parameters of high energy materials[J]. Journal of Hazardous Materials, 2006, 133: 30-45.
[9]李吉祯, 张国防,樊学忠, 等. 3,5-(硝铵基)-1,2,4-三唑肼盐的热行为研究[J]. 固体火箭技术, 2016, 4: 529-537
[10]宋花玉, 张海, 胡荣祖,等. 用非等温DSC估算硝化棉Bna自催化分解反应热爆炸的临界升温速率[J]. 火炸药学报, 2015, 5: 87-89.
[11]胡荣祖, 姚二岗, 张海,等. 自催化反应速率方程的导出途径及其在含能材料热行为研究中心的应用[J]. 含能材料, 2015, 9: 818-830.
[12] Talawar M B., Sivabalan R., Sentiilkumar N., et al. Synthesis, characterization and thermal studies on furazan- and tetrazine-based high energy materials[J]. Journal of Hazardous Materials, 2004, 113: 11-25.
[13] Eaton P., Gilardi R., Zhang M. Polynitrocubanes: advanced high-density, high-energy materials[J]. Advanced Materials, 2000, 12: 1143-1148.
(文章类别:CPST-B)
第3卷 第9期
2021年9月
Applied Research / 应用研究







