CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
基于牛白血病病毒gp51蛋白建立间接ELISA检测方法
作者:曹丙蕾1 刘 敏1 张 群1 王 飞1 王 群2
曹丙蕾1 刘 敏1 张 群1 王 飞1 王 群2
牛白血病又称牛地方流行性白血病(Enzootic bovine leukosis,EBL),是由牛白血病病毒( Bovine leukemia virus,BLV)引起的一种慢性肿瘤性疾病[1],该病最早于1878年在德国发现,1974年我国首次在上海发现该病,此后逐渐扩散到全国其他省市[2]。EBL是OIE的B类动物传染病,也是我国的二类动物传染病[3-4]。
BLV是一种RNA病毒,以前病毒cDNA的形式存在于细胞染色体中,与细胞DNA同步复制[5]。该病毒的结构蛋白有多种,大多数都可作为免疫原,其中gp51具有较强的免疫原性,能在感染动物体内产生引起强烈的免疫反应,是一种理想的诊断抗原[6]。
近几年来,我国从澳大利亚、新西兰、乌拉圭等国家引进种牛数量急剧增多,进境种牛疫病检测国际上常用ELISA方法作为通用检测方法,目前在口岸动物疫病筛查中常用的ELISA试剂盒主要还是依靠国外进口,价格昂贵,使用成本高。为解决EBL抗体检测的“卡脖子”技术,本研究选取BLV的gp51蛋白基因为研究对象,构建该蛋白基因的原核表达载体,并进行重组gp51蛋白的表达纯化,利用重组蛋白建立间接ELISA抗体检测方法,并与国外进口同类试剂盒进行比对,验证所建立的ELISA方法的有效性及实用性。
1 实验部分
1.1 材料
1.1.1 生物材料
试验中所用到的血清样本(牛白血病、牛病毒性腹泻-黏膜病、牛副结核分枝杆菌、赤羽病等阳性血清及阴性血清)均来自2020—2021年从新西兰、澳大利亚和乌拉圭等国家经东营和滨州口岸进境隔离的种牛,经本实验室血清分离后进行疫病检测筛查并保存备用。BLV羊胎肾细胞培养物由本实验室保存备用。牛白血病标准阳性血清和阴性血清由西班牙INGENASA(批号200420)提供。
1.1.2 主要试剂
Premix Taq™ Mix、限制性内切酶EcoRⅠ和HindⅢ等试剂购自TaKaRa公司;HRP-兔抗牛IgG、显色液等购自北京博奥森公司;磁珠法核酸提取试剂盒购自天根生化;进口牛白血病EBL抗体检测试剂盒购自法国ID VET、美国IDEXX、西班牙INGENASA。其他试剂配制按照常规方法获得。
1.1.3 主要仪器
基因扩增仪(TC-96/G/H)、凝胶成像系统(GenoSens 2100)、酶标仪(Bio-Rad 680)等。
1.2 方法
1.2.1 编码gp51蛋白基因的扩增分析
从GenBank中已公布的BLV全基因序列中筛选保守性较强的编码gp51蛋白的基因序列,利用Primer Premier 5.0软件设计引物,引物gp51-F1:5'- CGGAATTCTGGAGATGCTCCCTGTCC-3',下划线处为酶切位点EcoRⅠ;gp51-R1:5'- GCAAGCTTACGTCTGACCCGGGTAGG-3',下划线处为酶切位点HindⅢ,预期片段长度约为819 bp,引物由上海生工生物工程有限公司合成。
利用磁珠法核酸提取试剂盒从BLV细胞培养物中提取BLV核酸,以提取BLV的cDNA为模板,利用gp51-F1和gp51-R1引物进行PCR扩增[7]。反应体系和反应程序按照Premix Taq™ Mix反应试剂盒进行,扩增产物经1%琼脂糖凝胶电泳分析后进行测序分析。
1.2.2 重组表达载体的构建、表达及纯化
PCR产物与载体pET-32a进行连接,连接产物转化至E.coli Rosetta感受态细胞中,经PCR和酶切鉴定获得重组表达质粒pET-32a-BLV-gp51。挑选单个阳性菌落至2ⅹYT液体培养基中,在1%IPTG的作用下进行诱导表达,离心收集表达菌进行SDS-PAGE分析[8-9]。重组表达菌通过Ni-NTA亲和层析获得纯化重组BLV-gp51蛋白,经Bradford测定蛋白浓度并进行SDS-PAGE分析和Western blot分析[8-9]。
1.2.3 间接ELISA检测方法的建立及优化
碳酸盐缓冲液(pH9.6)稀释纯化BLV-gp51蛋白抗原至酶标板中,100 μL/孔,4℃过夜包被;洗涤,缓冲液37℃封闭;洗涤,加入稀释的待检血清,100 μL/孔,37℃孵育1 h;洗涤,加入稀释的HRP-兔抗牛IgG,100 μL/孔,37℃孵育30 min;洗涤后加入TMB底物显色液,100 μL/孔,室温避光显色,加入2 mol/L H2SO4终止反应,ELISA板置于酶标仪中读取OD450 nm值[9]。
(1)酶标二抗最佳稀释比例的确定
对BLV阳性对照及阴性对照进行1:100稀释,加入酶标板中进行包被(100 μL/孔),洗涤后将HRP-兔抗牛IgG按1:500、1:1000、1:2000和1:5000进行系列稀释,设立复孔,进行ELISA检测,酶标仪读取OD450 nm,以阳性OD450 nm/阴性OD450 nm(P/N比值)的比值最大作为优化依据。
(2)抗原抗体最佳稀释比例的确定
利用方阵滴定法确定抗原抗体最佳稀释浓度。按照2 μg/mL、4 μg/mL、8 μg/mL、10 μg/mL的比例对gp51蛋白进行稀释,加入酶标板中包被(100 μL/孔),洗涤后将BLV阳性对照及阴性对照分别按1:20、1:50、1:100的比例进行稀释,二抗采用所确定的稀释比例进行ELISA检测,设立复孔,酶标仪读取结果后,以P/N比值作为优化依据。
(3)封闭缓冲液的确定
以含5%脱脂奶粉、1% BSA、10%胎牛血清的PBST缓冲液分别作为封闭液,在37℃恒温下,封闭时间分别设为15 min、30 min、60 min,ELISA检测读取结果后,筛选最优封闭缓冲液及作用时间。
(4)底物最佳作用时间的确定
在已确定的反应条件下进行ELISA检测,加入底物溶液后分别在反应时间5 min、10 min和15 min时终止反应,酶标仪读取结果后,以P/N比值作为优化依据。
(5)阴阳性判定标准的确立
对20份已知的BLV标准阴性对照和10份BLV标准阳性对照进行ELISA检测,分析ELISA试验成立有效条件,设置阴阳性判定标准:以待检样本OD450 nm值/阴性样本OD450 nm平均值的比值作为Cut-off值(以S/N表示),若S/N≥2.1为阳性,则1.5<S/N<2.1为可疑,S/N≤1.5为阴性。
(6)重复性试验
选取已知的5份BLV阳性对照和2份BLV阴性对照,每份血清设置5个平行孔,分别在3个不同的检测时间(0 d、1 d、2 d)下进行ELISA检测,进行批内与批间重复性分析。
(7)灵敏性试验
阳性血清按1:100、1:200、1:400、1:800、1:1600、1:3200、1:6400、1:12800等进行倍比稀释,进行ELISA检测,确定方法的检测低限即灵敏度。
(8)特异性试验
对BLV阳性血清、BVDV阳性血清、牛副结核分枝杆菌阳性血清和赤羽病阳性血清等样本进行ELISA检测,并设阴阳性对照,分析该ELISA方法检测特异性。
1.2.4 ELISA检测应用
按上述确定的ELISA方法对12份待检血清进行检测,同时设阴阳性对照,设立复孔,分析ELISA在实际应用中的检测情况。
1.2.5 与进口同类检测试剂盒的验证比对
从来自新西兰、澳大利亚和乌克兰等的进境种牛血清中,选取具有代表性的180份血清,采用1.2.3中确定的方法进行抗体检测,同时采用法国ID VET、美国IDEXX和西班牙INGENASA这3家公司的EBL抗体检测试剂盒进行同步检测,对检测结果进行验证比对,验证本方案检测方法的适用性及应用性。
2 结果
2.1 gp51基因的PCR扩增及序列分析
gp51基因经PCR扩增后获得819 bp的条带,与预期片段大小一致,如图1所示,测序结果表明,该扩增序列与预期目的片段核苷酸同源性为100%。
利用MegAlign软件对gp51基因序列与GenBank已公布的15株国内外毒株的gp51序列进行比较分析,BLV-gp51蛋白基因序列高度保守,核苷酸同源性达到98.1%~100%,氨基酸同源性达到97.9%~99.7%。
2.2 重组表达载体pET-32a-BLV-gp51的鉴定分析
重组质粒PCR鉴定(图略)和双酶切鉴定,如图2所示,均证实成功构建了重组表达载体pET-32a-BLV-gp51。

a: gp51蛋白基因; M: GeneRuler DNA Ladder Mix
图1 BLV-gp51蛋白基因的PCR扩增结果
Fig.1 The results of PCR of the gene of gp51 protein of BLV
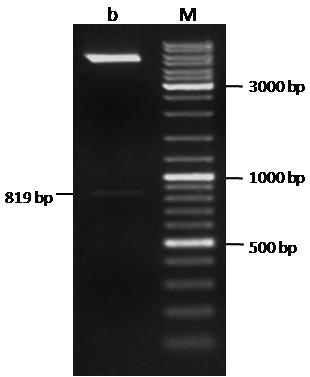
b: 双酶切结果; M: GeneRuler DNA Ladder Mix
图2 重组质粒pET-32a-BLV-gp51的双酶切鉴定结果
Fig.2 The results of the double enzyme digestion of the recombinant plasmid pET-32a-BLV-gp51
2.3 重组gp51蛋白的鉴定分析
SDS-PAGE电泳分析(图3)表明,重组表达菌获得了分子量大小约为47kDa的重组蛋白,以融合蛋白的形式存在,经亲和层析纯化后获得纯化蛋白(浓度约为196 μg/mL)。
Western blot分析(图4)表明,重组gp51蛋白与BLV阳性血清在约47kDa处发生免疫反应,与其他无关血清样本(如BVDV、M.pt、AKAV,图略)不发生免疫反应,说明重组gp51蛋白具有良好的反应原性和特异性。

M: 蛋白质分子量标准; 1: 重组表达菌; 2~4: 纯化gp51蛋白
图3 重组表达蛋白SDS-PAGE分析
Fig.3 SDS-PAGE analysis of recombinant protein
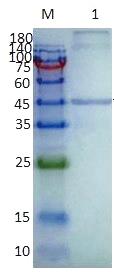
M: 蛋白质分子量标准; 1: 纯化gp51蛋白印迹
图4 重组gp51蛋白的Western blot分析
Fig.4 Western blot analysis of recombinant gp51 protein
2.4 ELISA检测方法的建立
2.4.1 酶标二抗优化条件的确定
酶标二抗优化结果如表1所示,在1:5000的稀释比例下,P/N比值为9.38,均高于其他稀释比例下的P/N比值,可作为酶标二抗的最佳稀释比例。
2.4.2 抗原抗体优化条件的确定
通过方阵滴定法确定了ELISA检测中抗原抗体的优化反应条件,如表2所示,在抗原包被浓度2 μg/mL,血清稀释比例为1:100时,P/N比值为13.58,均高于其他稀释比例下的P/N比值,可作为抗原抗体优化的最佳稀释比例。
表1 HRP标记兔抗牛IgG稀释比例的优化
Table 1 Optimization of dilution ratio of HRP labeled rabbit anti-bovine IgG
稀释比例 (HRP-IgG dilution) | ||||
1:500 | 1:1000 | 1:2000 | 1:5000 | |
阳性血清1:102 (+) | 2.411 | 1.701 | 1.403 | 1.079 |
阴性血清1:102 (-) | 0.551 | 0.352 | 0.211 | 0.115 |
表2 抗原抗体稀释比例的优化
Table 2 Optimization of dilution ratio of the antigen and antibody
(sera) | 纯化的BLV-gp51蛋白 (μg/mL) | ||||
2 | 4 | 8 | 10 | ||
1:20 | (+) | 2.079 | 2.541 | 2.414 | 2.578 |
(-) | 0.384 | 0.339 | 0.373 | 0.488 | |
1:50 | (+) | 1.712 | 1.877 | 1.911 | 1.979 |
(-) | 0.211 | 0.273 | 0.301 | 0.377 | |
1:100 | (+) | 1.507 | 1.747 | 1.188 | 1.921 |
(-) | 0.111 | 0.180 | 0.178 | 0.207 | |
2.4.3 封闭缓冲液的确定
结果表明,在使用含5%脱脂奶粉和1% BSA的PBST缓冲液时,P/N比值分别为9.66和9.55,两者差异不明显,考虑到使用成本问题,以含5%脱脂奶粉的PBST缓冲液来作为封闭液使用最为理想,作为样品稀释液使用效果也较好。
2.4.4 底物作用时间的确定
优化结果如表3所示,在底物显色15 min时,可获得P/N最大比值,此时的信号/背景比较高,显色效果最为理想。
2.4.5 阴阳性判定标准
经检测,20份阴性对照的OD450 nm为0.120,10份阳性对照的OD450 nm为1.567,每份阳性对照S/N值均>2.1,判定为阳性,每份阴性对照S/N值均<2.1,判定为阴性,阴阳性判定标准与已知既定结果保持一致,且每次检测时需同时加入阴阳性对照作为质控,试验成立有效。
表3 底物显色的最佳作用时间
Table 3 The optimal time of the substrate reaction
底物作用时间 (min) | |||
5 | 10 | 15 | |
(+) 1:100 | 1.055 | 1.512 | 1.833 |
(-) 1:100 | 0.086 | 0.099 | 0.115 |
2.4.6 重复性结果
如表4和表5所示,批内重复性结果变异系数在3.5%~9.0%之间。不同时间的同一批样品批间重复性结果变异系数在1.3%~6.2%之间,均小于10%,所建立的ELISA方法重复性较好。
表4 批内重复性试验
Table 4 Intra-batch repeatability test
编号 | 平行孔均值 | (CV, %) | ||||
1 | 2 | 3 | 4 | 5 | ||
1号阳性血清 | 1.608 | 1.733 | 1.579 | 1.811 | 1.622 | 5.9 |
2号阳性血清 | 1.866 | 1.744 | 1.902 | 1.521 | 1.655 | 9.0 |
3号阳性血清 | 1.266 | 1.521 | 1.311 | 1.112 | 1.135 | 8.0 |
4号阳性血清 | 1.311 | 1.117 | 1.225 | 1.109 | 1.192 | 7.0 |
5号阳性血清 | 2.036 | 1.991 | 1.877 | 1.903 | 2.010 | 3.5 |
1号阴性血清 | 0.112 | 0.097 | 0.115 | 0.102 | 0.116 | 7.8 |
2号阴性血清 | 0.099 | 0.099 | 0.089 | 0.100 | 0.081 | 8.9 |
表5 批间重复性试验
Table 5 Inter-batch repeatability test
血清编号 | 不同检测时间 | (CV, %) | ||
0 d | 1 d | 2 d | ||
1号阳性血清 | 1.641 | 1.615 | 1.599 | 1.3 |
2号阳性血清 | 1.799 | 1.745 | 1.726 | 2.2 |
3号阳性血清 | 1.311 | 1.249 | 1.187 | 5.0 |
4号阳性血清 | 1.288 | 1.229 | 1.189 | 4.0 |
5号阳性血清 | 1.988 | 1.960 | 1.829 | 4.4 |
1号阴性血清 | 0.111 | 0.102 | 0.100 | 5.6 |
2号阴性血清 | 0.102 | 0.097 | 0.090 | 6.2 |
2.4.7 灵敏性试验
结果表明,当血清稀释倍数达到1:3200、1:6400、1:12800时,S/N值分别为2.43、2.01、1.77,分别判定为阳性、阴性、阴性,故血清效价测定为1:3200,检测方法灵敏性较好。
2.4.8 特异性结果
结果表明,阳性血清OD值为1.125,阴性OD值为0.119,S/N为9.45>2.1,判为阳性,而其他无关血清样本OD值平均为0.159,结果均为阴性,所建立的ELISA方法对BLV的检测具有较好的特异性。
2.5 ELISA检测应用结果
对12份待检血清检测结果分析如表6所示,结果表明有8份样品是阳性,有4份无关血清样品是阴性,所建立的ELISA方法灵敏度较高,特异性好,免疫反应较好。
表6 间接ELISA方法测定BLV血清抗体结果
Table 6 The results of indirect ELISA for BLV antibody
待检血清 | OD450值 | S/N比值 | 结果判定 |
01号 | 2.136 | 18.10 | + |
02号 | 2.962 | 25.10 | + |
03号 | 0.200 | 1.69 | - |
04号 | 0.155 | 1.31 | - |
05号 | 1.119 | 9.48 | + |
06号 | 0.914 | 7.75 | + |
07号 | 0.665 | 5.64 | + |
08号 | 0.201 | 1.70 | - |
09号 | 1.332 | 11.29 | + |
10号 | 2.043 | 17.31 | + |
11号 | 0.099 | 0.84 | - |
12号 | 0.553 | 4.69 | + |
阴性 | 0.118 | / | / |
阳性 | 1.044 | / | / |
注:“+”表示阳性,“-”表示阴性。 | |||
2.6 不同试剂盒的验证比对结果
从表7中的结果可知,本研究ELISA抗体检测结果与商品化试剂盒检测结果符合率较高,达到97.8%以上,变异较小,检测结果等效于同类型商品化BLV抗体检测试剂盒,且阳性检出情况较为稳定可靠,特异性较好,灵敏性较好,具有较好的应用效果。
表7 同类型BLV抗体检测试剂盒结果比对
Table 7 Comparison of results of the same type of BLV antibody detection kit
不同品牌方法 | 阳性 (份) | 阴性 (份) | 总符合率 (%) |
本方案ELISA方法 | 24 | 156 | / |
IDVET | 20 | 160 | 97.8 |
IDEXX | 22 | 158 | 98.9 |
INGENASA | 26 | 154 | 98.9 |
3 讨论
目前,牛白血病已成为进境种牛疫病检测的重要传染病之一,属于国门生物安全重点监测疫病之一,且在国内奶牛及种牛养殖场中也成为引起牛病的主要疾病之一。随着我国进境种牛数量的逐渐增加,牛白血病给我国进境动物疫病防控带来了极大挑战,严格遵循预防为主的动物疫病防控理念,及时对具有潜在跨境传播风险的动物进行疫病检测是控制EBL流行的前提,而血清学诊断方法是诊断EBL的常用检测方法,是国际贸易中进境大宗动物公认的通用检测方法[10]。
由于BLV病毒是以前病毒cDNA的形式存在于细胞染色体中,本研究以含有持续性感染EBL的羊胎肾细胞提取核酸DNA为模板,以gp51蛋白为诊断抗原进行研究,建立了间接ELISA检测方法用于BLV抗体检测,并在进境种牛血清检测中获得了较好的应用,与同类型商品化检测试剂盒在检测结果上符合率较高,特异性好,灵敏度较高,不同品牌的检测试剂盒之间结果差异较小,之所以阳性结果会有一些差别,是由于不同品牌的方法和结果判定标准有所差异而造成的。
4 结论
本研究从根源出发,建立行之有效的检测技术平台,及时有效地进行疾病筛查,给进境种牛的隔离检疫提供准确可靠的数据支持,为下一步其他动物疫病检测技术的建立及应用提供技术储备,可以有效防控外来动物疫病的扩散,保障国门生物安全,而且节省了检测成本,具有较好的推广应用价值。
kDa
参考文献
[1]龙塔, 潘耀谦. 流行性牛白血病的病原及传播途径研究进展[J]. 动物医学进展, 2004, 25(6): 65-68.
[2] Bartlett P C, Ruggiero V J, Hutchinson H C, et al. Current Developments in the Epidemiology and Control of Enzootic Bovine Leukosis as Caused by Bovine Leukemia Virus[J]. PathogensVolume, 2020, 9(12): 1058.
[3]林立, 孔繁德. 牛地方流行性白血病诊断技术的研究进展[J]. 中国畜牧兽医文摘, 2012, 28(1): 23-24.
[4] Corredor-Figueroa A P, Salas S, Olaya-Galán N N, et al. Prevalence and molecular epidemiology of bovine leukemia virus in Colombian cattle[J]. Infection, Genetics and Evolution, 2020, 80(5): 1-8.
[5] Nishimori A, Andoh K, Matsuura Y, et al. Establishment of a simplified inverse polymerase chain reaction method for diagnosis of enzootic bovine leukosis[J]. Archives of Virology, 2021, 166(3): 841-851.
[6]周毅, 吴玉石, 段宏安, 等. 牛白血病病毒env(gp51)基因的克隆和原核表达及间接ELISA抗体检测方法的建立[J]. 畜牧兽医学报, 2009, 40(4): 538-543.
[7]王雨, 吉艺宽, 程艺, 等. 伪狂犬病病毒gB基因的原核表达及间接ELISA方法的建立[J]. 动物医学进展, 2015, 36(6): 19-23.
[8] Sambrook J., Russell D., W. 分子克隆实验指南(第三版)[M].科学出版社, 2002(9): 1217-1231.
[9]曹丙蕾, 张群, 凌宗帅, 等. 猪繁殖与呼吸综合征病毒山东分离株N蛋白基因的原核表达及其单克隆抗体的制备与鉴定[J]. 西南农业学报, 2014, 27(4): 1772-1776.
[10]谢立兰, 方六荣, 方华为, 等. 免疫学和分子生物学技术在牛地方流行性白血病诊断中的应用进展[J]. 中国兽药杂志, 2016, 50(2): 56-62.
(文章类别:CPST-C)







