CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
基于ITS序列的DNA条形码技术鉴定罂粟科种子
作者:刘玮琦1 梁 靓2 李 兰3 陈 超1 张 鹏1 孙利东1 耿俊东1 郑 敏1
刘玮琦1 梁 靓2 李 兰3 陈 超1 张 鹏1 孙利东1 耿俊东1 郑 敏1
关键词 罂粟科种子; DNA 条形码;种子形态学;地理分布
Identification of Papaveraceae seeds by DNA Barcoding
Based on ITS Sequence
LIU Wei-Qi1 LIANG Liang2 LI Lan3 CHEN Chao1 ZHANG Peng1
SUN Li-Dong1 GENG Jun-Dong1 ZHENG Min1
Abstract Using DNA barcoding molecular biology technology based on ITS4/ITS5 sequence, combined with morphological and geographical distribution analysis, two unknown seeds detected in Russian grain at Manzhouli Port were quarantined and identified. The results showed that the two unknown seeds were Roemeria refracta (Stev.) DC. and Papaver dubium L. This method is fast, simple and accurate, which effectively makes up for the shortcomings of traditional morphological classification and identification, and is suitable for the quarantine and identification of plant fruits or seeds in imported products.
Keywords papaveraceae seeds; DNA barcoding; seed morphology; geo-graphical distribution
满洲里地处中、俄、蒙三国交界,是我国最大的陆路口岸,承担着中俄之间近70%的陆路运输任务,也是我国“一带一路”通往欧洲的重要节点城市。2014年满洲里成为国家首批进境粮食指定口岸。随着进境俄罗斯粮食种类和数量的逐年增加,外来有害生物的检出率也呈上升趋势。杂草果实或种子作为粮食中携带的主要有害生物,占到检出外来有害生物总批次的85%以上[1]。杂草种类的检疫鉴定已成为口岸粮食检疫中最关注的项目。目前,口岸截获杂草果实或种子的检疫鉴定仍以形态学为主,但有关杂草果实或种子的研究资料较少,形态学特征数据十分匮乏。此外,传统的杂草鉴定手段要求鉴定人员具有较高的植物分类专业知识和技能,也使得杂草的准确鉴定具有一定的局限性。为保护我国农业生产安全,有效防止外来有害生物入侵,加强进境杂草快速检疫鉴定技术的研究具有重要意义。
DNA条形码技术是利用基因组中一段公认的、相对较短的DNA序列进行物种鉴定的一种分子生物学技术,该项技术几乎不受物种形态学特征和发育阶段的限制,很好地弥补了传统分类学形状相似且不稳定、易受外界因素影响等缺点[2]。随着DNA条形码技术的快速发展,其在毒品鉴定、医药、生态、环境、食品、进出境检验检疫等领域均有广泛应用[3-5]。本研究采用DNA条形码技术,结合种子形态学和地理分布信息的研究,对进境俄罗斯粮食中携带的2种未知种子进行了检疫鉴定,以期为口岸外来有害生物检疫鉴定提供参考。
1 材料与方法
1.1 供试材料
满洲里口岸在进境俄罗斯粮食中检出的2种未知杂草种子。
1.2 供试试剂和主要仪器设备
植物基因组DNA提取试剂盒(天根)、10×PCR缓冲液(上海生工)、5 U/μL Taq DNA聚合酶(上海生工)、DL1200 DNA Marker、琼脂糖、GoldViewⅡ型核酸染色剂(5000×)等。TADVANCED 定性梯度PCR仪(德国Biometra)、Mini-subcell GT电泳仪(美国伯乐)、Gel Doc XR+凝胶成像分析仪(美国伯乐)。
1.3 实验方法
1.3.1 种子基因组DNA的提取
取2种未知植物种子各30粒,利用植物基因组DNA提取试剂盒(天根)提取基因组DNA。
1.3.2 常规 PCR扩增及测序
选用ITS4和ITS5引物[6]扩增的 DNA条形码序列用于分析研究,引物序列分别为ITS4(5'-TCCTCCGCTTATTGATATGC-3')和ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')。扩增片段大小约700 bp。PCR反应在定性梯度PCR仪上进行,反应体系:10×PCR缓冲液2.5 µL,氯化镁(50 mmol/L)2.0 µL,dNTP(10 mmol/L)2.0 µL,引物(10 μmol/L)各1 µL,5 U/μL Taq DNA聚合酶0.5 µL,(10~100 ng/μL)模板DNA 2.0 µL,加ddH2O补至25 µL。反应条件为:95℃ 3 min;95℃ 15 s,56℃ 1 min,72℃ 30 s,30个循环;72℃ 10 min,4℃保存。反应结束后,分别将5 μL PCR产物在含GoldViewⅡ型核酸染色剂的1.5%的琼脂糖凝胶电泳仪上电泳30 min (120 V),利用凝胶成像系统检测是否扩增出预期大小的目标条带,将所得DNA的扩增产物进行双向测序,测序反应送北京中美泰和生物技术有限公司完成。
1.3.3 序列比对和构建系统发育树
将供试种子测序得到的基因序列及来自GenBank登录的疆罂粟属(Roemeria)、罂粟属(Papaver)、绿绒蒿属(Meconopsis)、海罂粟属(Glaucium)和蓟罂粟属(Argemone)的45条ITS序列、18S rDNA和5.8S rDNA序列用CondonCode Aligner进行比对和拼接,使用MEG6.0进行多重比对,并采用邻接法(Neighhor Joining)构建系统发育树(boostrap1000 次重复)。
2 结果分析
2.1 ITS4/ITS5 序列扩增结果
利用引物ITS4/ITS5 对未知种子(MZLYS-A和MZLYS-B)提取的DNA模板进行PCR扩增,结果表明,未知种子(MZLYS-A和MZLYS-B)DNA均能扩增出单一且清晰、长度约700 bp的 目标条带(图1)。
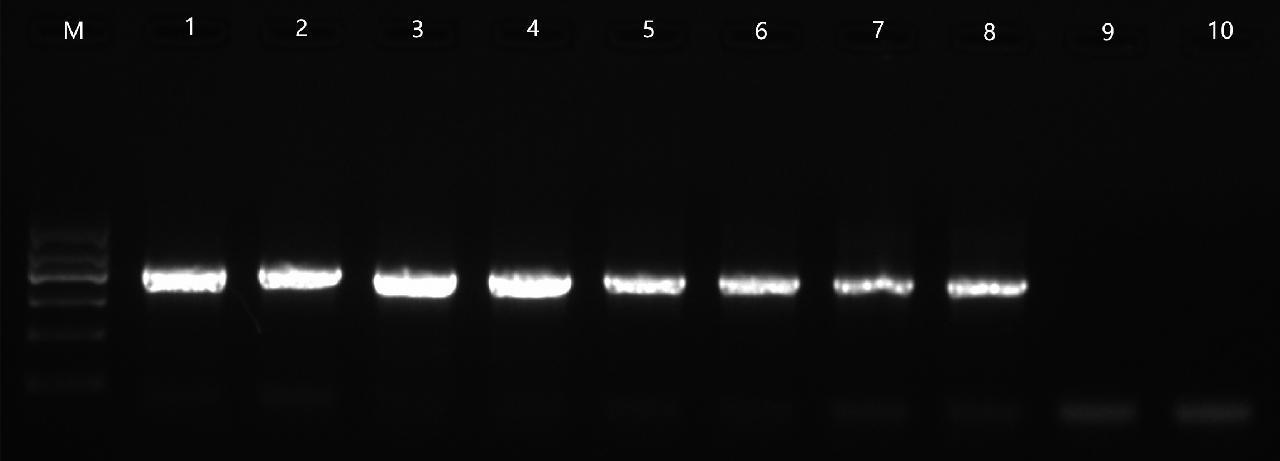
M: DL1200 DNA marker; 1~4: 未知种子(MZLYS-A); 5~8: 未知种子(MZLYS-B); 9~10: ddH2O
图1 ITS4/ITS5基因序列扩增产物电泳图
Fig.1 Electrophoretogram of ITS4/ITS5 gene sequence amplification products
2.2 序列比对结果分析
将测序所得未知种子的ITS段基因序列在NCBI数据库中进行BLAST比对,并建立系统发育树(图2),发现未知种子MZLYS-A与疆罂粟属红花疆罂粟[Roemeria refracta(Stev.)DC.]聚类在一起(自展支持率100%)。未知种子MZLYS-B与罂粟属长荚罂粟(Papaver dubium L.)聚类在一起(自展支持率99.8%)。
2.3 形态学分析结果
通过构建系统发育树可以看出,未知种子MZLYS-A与红花疆罂粟聚为一枝, 未知种子MZLYS-B与长荚罂粟聚为一枝。 根据以上结果初步判定,未知种子MZLYS-A为红花疆罂粟;未知种子MZLYS-B长荚罂粟。为进一步确定种子种类,观察发现2种未知种子均与罂粟科(Papaveraceae )植物瘦果特征相吻合。未知种子MZLYS-A形态特征:种子肾型,表面蜂窝状,长约1.2 ~1.4 mm,宽约0.9~1.0 mm,黑褐色,表面密布排列网纹,网孔呈四角形至六角形,网孔边缘鱼鳞状突起;种脐位于腹面凹陷内,长椭圆形,胚乳丰富,黄色油脂(图3)。未知种子MZLYS-B形态特征:种子肾型,长约0.6~0.9 mm,宽约0.4 ~0.6 mm,红褐色,表面具有明显突起的网纹,网纹呈四角形至六角形,背面圆隆,腹面内凹;种脐位于腹面的内凹处,黄褐色,种皮薄,种子横切面椭圆形,内含丰富的油脂胚乳(图4)。通过种质资源信息网(GRIN,http://www. ars-grin. gov/)进行种子形态比对,发现未知种子MZLYS-A与红花疆罂粟形态特征相吻合,未知种子MZLYS-B与长荚罂粟形态特征相吻合。
3 结论
DNA条形码是利用生物体DNA中一段保守序列对物种进行快速准确鉴定的新兴技术。2005年DNA条形码技术被首次应用于植物鉴定领域,随后在物种分类、鉴定和系统发育分析[7-8]等方面发挥了重要作用。目前植物DNA条形码分子鉴定主要基于核基因(ITS),叶绿体基因编码区(rbcL,matK,rpoB,rpoC1,ycf1b,ndhJ,accD等)和间隔区(psbA-trnH,trnV-atpE,rnL-trnF,trnK-rps16,atpB-rbcL等)[9-12],其中,核DNA(rDNA)ITS序列因其种间变异足够大、种内变异足够小、引物具有保守性、条形码较短和聚合酶链式反应(PCR)扩增结果稳定等优点,是鉴别植物种属水平最常用的条形码。刘红梅等[13]首次运用DNA条形码进行石斛属植物的分类研究,认为ITS2二级结构量化分析方法具有很高的分类潜能。徐晗等[14]利用核基因ITS4/ITS5,叶绿体基因atpF-H,psbK-I 3段植物DNA条形码成功鉴定原产于西亚的蔷薇属植物犬蔷薇。
罂粟科300多种植物广泛分布在温带和亚热带地区[15]。目前,我国学者针对罂粟科植物的DNA条形码研究较少,该类研究主要集中在涉及毒品原植物鉴定等的罂粟属植物的鉴定。宋炳轲等[3]认为可以利用DNA ITS2 条形码序列鉴别毒品原植物大麻、罂粟和其混伪品。张爽等[16]研究表明trnL-trnF可以较好地区分不同种类的罂粟属植物。张哲等[15]通过比较发现,rbcL序列的长度较短,变异位点少,信息位点比例较低,保守程度高,通过构建系统发育树发现,该序列不能将鳞果海罂粟及伊犁秃疮花区分开,但ITS序列可将两种类很好地区分开。
罂粟的鉴定除了茎、叶、花、果实等常规的表型依据外,种子是其分类属性的重要判别依据[17]。相比于其他植物形态器官,种子在封闭环境中发育形成后,其表型特征趋于稳定,尤其是种皮表面的纹饰,可以作为物种鉴定和植物分类的一个重要依据[18-19]。但有关罂粟科植物果实和种子的文献不多,口岸一线人员对该类种子较难准确鉴定。本研究利用核基因ITS4和ITS5 引物序列对进境俄罗斯粮食中截获的2种未知种子进行DNA条形码研究,并从GenBank中下载了罂粟科植物的ITS序列、18S rDNA和5.8S rDNA序列共同构建系统发育树。ITS序列为核糖体rDNA中度保守序列,18S rDNA、5.8S rDNA和26S rDNA序列均为高度保守的核糖体rDNA序列[20],上述序列常用于原核生物、高等植物及真菌分子系统学研究[21-22]。系统发育分析结果表明,2种未知种子分别与红花疆罂粟[Roemeria refracta (Stev.) DC.]和长荚罂粟(Papaver dubium L.)聚类在一起,该结果与种子形态学鉴定结果相吻合,证明ITS序列在鉴定罂粟科植物方面是一种有效的分子标记。
从地理分布信息来看,红花疆罂粟主要分布于亚洲的伊朗和中国新疆地区。该种类是我国新疆重点保护植物之一[15]。其果实为蒴果,狭圆柱形,向上渐狭,长4.0~5.0 cm,无毛,柱头每2个裂片间具1个刚毛状附属物,附属物内弯并超出柱头,成熟时4瓣自顶端向基部开裂,内含多粒种子。长荚罂粟分布于欧洲的英国威尔士地区。蒴果球形,无毛,直径4.0~6.0 cm,顶孔开裂,内含多粒种子。可见,2种未知种子的地理分布均与出口粮食国家俄罗斯的地理位置相吻合。
满洲里口岸截获的上述2种杂草种子,经专家复核确认鉴定结果与本研究一致,且均为全国口岸首次截获。本研究可建立快速、简便、准确,适合于进境产品中植物果实和种子的检疫鉴定方法,有效弥补了传统形态学分类鉴定的不足。
参考文献
[1]刘玮琦, 袁淑珍, 陈超, 等. 内蒙古口岸农业“走出去”俄罗斯返销粮食疫情分析及建议[J]. 植物检疫, 2018, 32(2): 69-73.
[2]张彩云, 黄珊珊, 颜海飞. DNA条形码技术在中药鉴定中的应用进展[J]. 中草药, 2017, 48(11): 2306-2312.
[3]宋炳轲, 杨雪莹, 倪萍娅, 等. DNA 条形码技术在毒品原植物大麻鉴定中的应用[J]. 广西植物, 2014, 34(4): 552-556.
[4]朱英杰, 陈士林, 姚辉, 等. 重楼属药用植物DNA 条形码鉴定研究[J]. 药学学报, 2010, 45(3): 376.
[5]刘宇婧, 刘越, 黄耀江, 等. 植物DNA 条形码技术的发展及应用[J]. 植物资源与环境学报, 2011, 20(1): 74.
[6]苏畅, 窦骁,叶新, 等. 基于ITS4/5 rRNA区序列对不同时期大曲中霉菌的分离与鉴定[J]. 现代食品科技, 2018, 34(3): 54-58.
[7] Mari K, Hebert D N. DNA barcode-based delineation of putative species:efficient start for taxonomic workflow[J]. Mol Ecol Resour, 2014, 14(4): 706-715.
[8] Ren F M, Wang Y W, Xu Z C, et al. DNA barcoding of Corydalis, the most taxonomically complicated genus of Papaveraceae[J]. Ecol Evol, 2019, 9(4): 1934-1945.
[9] Kress W J, Wurdack K J, Zimmer E A, et al. Use of DNA barcodes to identify flowering plants[J]. Proceedings of National Academy of Sciences of United States of America, 2005, 102(23): 8369-8374.
[10] Lahaye R, Van der Bank M, Bogarin D, et al. DNA barcoding the floras of biodiversity hotspots[J]. Proc Natl Acad Sci USA, 2008, 105(8): 2923.
[11]李井干, 吴晶, 刘晓宇, 等. 濒危龙树科植物DNA条形码鉴定方法[J]. 江苏农业科学, 2021, 49(17): 63-66.
[12]许丹芸, 张辉菊, 李可心, 等. 22种樟科植物DNA条形码分子鉴定[J]. 中国实验方剂学杂志, 2021, 27(16): 159-166.
[13]刘红梅, 张存艳, 叶强等. 基于DNA条形码技术对喉红石斛的植物学分类研究[J]. 中草药, 2021, 52(21): 6656-6662.
[14]徐晗, 孙旻旻, 吴品珊, 等. DNA条形码、形态学与地理分布相结合的植物果实(种子)鉴定方法——以口岸截获的外来入侵植物犬蔷薇(Rosa canina L.)为例[J]. 杂草科学, 2015, 33(2): 26-31.
[15]张哲, 孔艳, 李岩, 等. 基于DNA条形码技术对新疆罂粟科部分植物系统发生分析[J]. 干旱区研究, 2014, 31(2): 322-328.
[16]张爽, 刘宇婧, 吴沿胜,等. 罂粟属植物核心DNA条形码的筛选[J]. 中国中药杂志, 2015, 40(15): 2964-2969.
[17]刘大伟, 应耿迪, 赵静怡, 等. 涉案罂粟种子微形态及其活力特征研究[J]. 种子, 2021, 40(8): 106-115.
[18]韩彪, 陆璐, 咸洋, 等. 山东珍稀濒危树种种子形态特征研究[J].山东林业科技, 2020, 50(2): 34-38.
[19]张梅, 刘旭, 周惠龙, 等. 绣球属29种植物的种子微形态研究[J]. 园艺学报, 2018, 45(6): 1147-1159.
[20]史全良, 吴均章. 植物系统学研究中常用基因分子标记特点分析[J]. 生物学通报, 2000, 35(12): 4-6.
[21]施慧, 谢建军, 王庚申, 等. 血卵涡鞭虫核糖体18S rDNA和ITS1-5.8S rDNA-ITS2序列测定与系统发育分析[J]. 水生生物学报, 2013, 37(3): 560-565.
[22]高静, 卢萍, 王金妞, 等. 基于5.8S rDNA/ITS序列的几种内蒙古棘豆属植物分子系统学研究[J]. 华北农学报, 2009, 24(6): 168-173.
基金项目:海关总署科研项目(2017IK148)
第一作者:刘玮琦(1981—),女,汉族,内蒙古赤峰人,硕士,高级农艺师,主要从事植物检疫,E-mail: liuweiqi10124@126.com
1. 满洲里海关技术中心 满洲里 021400
2. 西安海关技术中心 西安 710000
3. 阿拉山口海关技术中心 阿拉山口 833418
1. Manzhouli Customs Technical Center, Manzhouli 021400
2. Xi'an Customs Technical Center, Xi'an 710000
3. Alashankou Customs Technical Center, Alashankou 833418







