CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
双表达系统制备新型冠状病毒N基因装甲RNA颗粒的研究
作者:高志强1 汪 琳1* 朱忠武2 任 彤1 蒲 静1 赵相鹏1 尹 羿1 张 伟1
高志强1 汪 琳1* 朱忠武2 任 彤1 蒲 静1 赵相鹏1 尹 羿1 张 伟1
关键词 双表达系统;新型冠状病毒; N 基因;装甲 RNA 颗粒
Opportunities and Challenges of Travel Medicine during
the COVID-19 Pandemic
SONG Yue-Qian1 HAN Hui1*
Abstract The complete N gene sequence (1260 bp) of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) reference strain Wuhan/WIV04/2019 and the MS2 phage genome mature protein and capsid protein gene sequence (1682 bp) were cloned into two different multiple cloning sites of the prokaryotic dual expression plasmid pACYCDuet-1 respectively. The recombinant expression plasmid pACYC-MS2-CoV2 N obtained was transformed into E.coli strain BL21(DE3). After expression and purification, the resulting armored RNA particles were shown to contain complete N gene of SARS-CoV-2 without DNA residue and be resistant to RNase digestion. The N gene nucleic acid controls for testing of SARS-CoV-2 were prepared based on the quantitation of armored RNA particles by real-time RT-PCR. The nucleic acid controls were uniform and stable, and could be stored at 2~8℃ for 180 days. It could be used for quality control of nucleic acid testing of SARS-CoV-2 with good repeatability.
Keywords dual expression system; severe acute respiratory syndrome coronavirus 2; N gene; armored RNA particles
新型冠状病毒(SARS-CoV-2)可通过飞沫和接触引起人际传播,引起新型冠状病毒肺炎(COVID-19),无症状感染者不表现出任何症状,轻症感染者可表现发热、咳嗽,重症患者发病后出现呼吸困难,进而发展为急性呼吸窘迫综合征,可导致多器官功能衰竭[1]。
由于 SARS-CoV-2传染性强,因此使用快捷、精准的方法及时检出传染源并采取措施切断传播链是疫情防控的关键。核酸扩增检测技术是目前用于SARS-CoV-2快检的主要技术手段。国内外针对SARS-CoV-2的保守基因建立了多种核酸检测方法,其中应用最多的是荧光RT-PCR方法。目前常见的靶标序列包括非结构基因ORF1和结构基因,其中非结构基因一般选择nsp-12(RdRp)、nsp-13(Helicase)以及ORF1的其他基因区域,而结构基因常选择E基因和N 基因。对于SARS-CoV-2,N基因兼具特异性和保守性,因此几乎所有商品化检测试剂的检测靶标均包含N基因[2-4]。使用核酸扩增技术进行病毒检测时,安全、稳定的质控品是保证检测结果准确可靠的关键因素。
本文使用装甲RNA技术,并采用了增加pac位点的数量和亲和力的策略[5-6],利用单质粒双表达系统将MS2噬菌体衣壳蛋白和成熟酶的序列以及SARS-CoV-2完整N基因(首尾均添加C-突变体 pac 位点序列)分别克隆到载体的2个多克隆位点,经诱导表达研制出包裹SARS-CoV-2完整N基因的装甲RNA颗粒。该病毒颗粒稳定性好,可抵抗核酸酶的降解作用,且无生物危害性,可作为SARS-CoV-2核酸检测的阳性对照和质控品,对SARS-CoV-2核酸检测进行质量控制和质量评估。
1 材料和方法
1.1 供试表达载体、菌株、包含新型冠状病毒(SARS-CoV-2)标准参考毒株SARS-CoV-2/Wuhan/WIV04/2019完整N基因序列和MS2噬菌体成熟酶蛋白、衣壳蛋白基因序列的克隆载体
表达载体pACYCDuet-1由本实验室保存;Top10、BL21(DE3)感受态细胞购自北京天根生化有限公司。新型冠状病毒(SARS-CoV-2)标准参考毒株SARS-CoV-2/Wuhan/WIV04/2019完整N基因(1260 bp),包含MS2噬菌体基因组成熟酶蛋白、衣壳蛋白基因序列(1682 bp)均由上海生工合成,并克隆于pBluscriptⅡ SK (+)载体,分别命名为pBSK-CoV-2 N和pBSK-MS2。
1.2 主要试剂
M-MLV反转录酶、RNase抑制剂、Ribo MAXTM Large Scale RNA Production System-T7试剂盒购自Promega公司;DNA片段纯化试剂盒、HS Taq DNA聚合酶、T4 DNA连接酶、DNase I、RNase A、限制性内切酶均购自TaKaRa公司;Sephacryl S-200 购自Sigma公司;Trizol试剂购自Invitrogen公司。
1.3 引物设计合成
根据GenBank中登录的pMS27噬菌体基因序列和新型冠状病毒(SARS-CoV-2)标准参考毒株SARS-CoV-2/Wuhan/WIV04/2019序列重新设计引物,从合成质粒pBSK-MS2和pBSK-CoV-2 N扩增目的基因并分别克隆于pACYCDuet-1的2个多克隆位点。其中,编码 MS2成熟酶和衣壳蛋白基因的片段扩增长度为1682 bp;编码SARS-CoV-2完整N基因扩增片段为1321 bp(含C-突变体 pac 位点序列)。同时合成针对SARS-CoV-2 N基因的实时荧光RT-PCR引物和探针。所有引物及探针序列和PCR 扩增片段大小,见表1。
1.4 表达载体pACYC-MS2的构建
以合成质粒pBSK-MS2作为模板扩增噬菌体MS2编码成熟酶和外壳蛋白基因的片段。PCR反应条件为:95℃ 5 min;94℃ 30 s、62℃ 30 s、72℃ 150 s,33个循环;72℃ 10 min。PCR扩增产物胶回收纯化后,经Bam HⅠ/Not Ⅰ双酶切消化,克隆于pACYCDuet-1多克隆位点1,构建重组质粒pACYC-MS2,重组质粒经测序进行鉴定。
1.5 双表达载体pACYC-MS2-CoV-2 N的构建
以合成质粒pBSK-CoV-2 N作为模板,扩增含有SARS-CoV-2完整N基因的序列,并通过在上下游引物添加C-突变体pac位点序列,将其加入N基因的首末端。PCR反应条件为:95℃ 5 min;94℃ 30 s、61℃ 30 s、72℃ 90 s,35个循环;72℃ 10 min。PCR扩增产物胶回收纯化后,经Fse Ⅰ/Pac Ⅰ双酶切,克隆于pACYCDuet-1多克隆位点2,构建出重组质粒pACYC-MS2-CoV-2 N,并经测序进行鉴定。
1.6 装甲RNA颗粒的诱导表达及纯化
将重组质粒pACYC-MS2-CoV-2 N转化BL21(DE3)感受态细胞,在氯霉素抗性的LB中37℃、200 r/min转速摇床上振荡培养,在OD600 nm值约为0.6 h,加IPTG至终浓度1 mmol/L进行诱导表达,3 h后离心收集菌体并重悬于裂解缓冲液(50 mmol/L Tris,pH 8.0,5 mmol/L MgSO4,0.1 mmol/L NaCl)中进行超声裂解,然后离心收集上清液,加入终浓度为50 U/μL和10 U/μL的RNase A和DNase I,37℃作用40 min去除大肠杆菌核酸。最后,使用Sephacryl S-200层析柱对装甲RNA颗粒进行纯化,保存于4℃。
1.7 装甲RNA颗粒的鉴定
为验证制备的装甲RNA是否含有全长SARS-CoV-2 N基因,将装甲RNA颗粒使用磁珠法提取总核酸,再使用引物CoV-2-NR 42℃反转录1 h。对反转录产物,未进行反转录的核酸以及未提取核酸的RNA颗粒按照1.5条件进行PCR鉴定,同时设定阴性对照。PCR扩增产物经2.0%琼脂糖凝胶电泳检测结果,并将目的扩增产物克隆于pGEM-T载体后进行测序鉴定。
1.8 装甲RNA颗粒耐核酸酶试验
将制备的装甲RNA颗粒和从装甲颗粒中提取的核酸,分别使用核糖核酸酶A(5 U/μL)和DNA酶I(0.1 U/μL)37℃消化60 min。消化后,提取RNA进行实时荧光RT-PCR检测,比较检测结果。
1.9 装甲RNA颗粒的定量
1.9.1 体外转录RNA(IVT-RNA)外标准品的制备
将提纯的pBSK-CoV-2 N质粒用限制性内切酶Sma I 消化处理后纯化回收,之后将其作为模板按照Ribo MAXTM Large Scale RNA Production System-T7试剂盒说明书进行体外转录。转录产物经DNase消化除去其中的DNA模板后,用TRIZOL按照说明书重新提取RNA,获得高纯度的SARS-CoV-2完整N基因 IVT-RNA溶液。通过测定IVT-RNA 260 nm吸光度值,计算其拷贝数,再10倍系列稀释制备成IVT-RNA外标品。
1.9.2 装甲RNA颗粒质控品的定量
采用针对SARS-CoV-2 N基因的荧光RT-PCR方法,对制备的已知浓度的IVT-RNA和装甲RNA颗粒提取的RNA进行检测。经线性回归,获得回归方程,通过公式计算出装甲RNA核酸拷贝数。依据计算结果,用Hank's液将对装甲RNA病毒样颗粒进行稀释,混匀后分装入冻存管中,每支1 mL,置于 -80℃保存。
1.10 均匀性检验
随机抽取10管制备的装甲RNA颗粒质控品,提取RNA,使用针对SARS-CoV-2 N基因的荧光RT-PCR方法在一次试验中进行检测。对Ct值进行统计,计算相对标准偏差。
1.11 稳定性检验
随机抽取制备的装甲RNA颗粒质控品,分别在室温37℃,冷藏温度2~8℃,-20℃及-80℃保存(对照),每隔7 d取样置于-80℃。6个月后使用针对SARS-CoV-2 N基因的荧光RT-PCR方法进行外标法拷贝数定量检测,分析装甲RNA颗粒的稳定性。
2 结果
2.1 装甲RNA颗粒pACYC-MS2的构建
PCR扩增MS2噬菌体编码成熟酶和外壳蛋白基因片段,定向克隆于pACYCDuet-1多克隆位点1,构建重组质粒pACYC-MS2,重组质粒经测序进行鉴定。琼脂糖凝胶电泳结果显示PCR扩增片段约为1.7 kb,与预期大小相符,见图1。测序结果显示编码成熟酶和外壳蛋白基因片段正确克隆到载体pACYCDuet-1中。
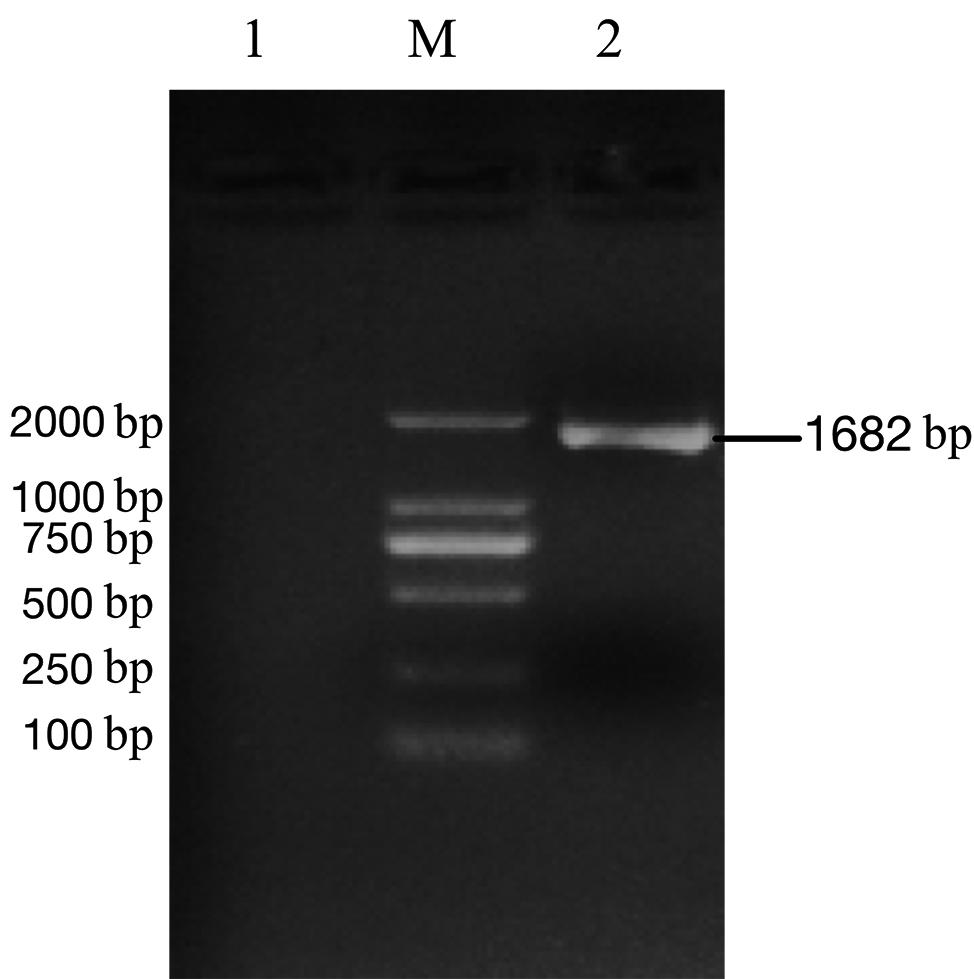
M: DL2000 DNA 分子量标准; 1: 阴性对照;2: MS2基因PCR扩增片段
图1 MS2噬菌体基因扩增结果
Fig.1 Amplification of MS2 phage gene
2.2 双表达载体pACYC-MS2-CoV-2 N的构建
PCR扩增出得到SARS-CoV-2完整N基因,并通过在上下游引物添加C-突变pac位点序列,将其加入N基因的首末端。PCR扩增产物约1.3 kb,与预期目的片段大小相符,见图2。将扩增基因目的片段定向克隆于pACYC-MS2的多克隆位点2中,获得重组质粒pACYC-MS2-CoV-2 N,测序结果表明SARS-CoV-2完整N基因正确克隆到载体中。
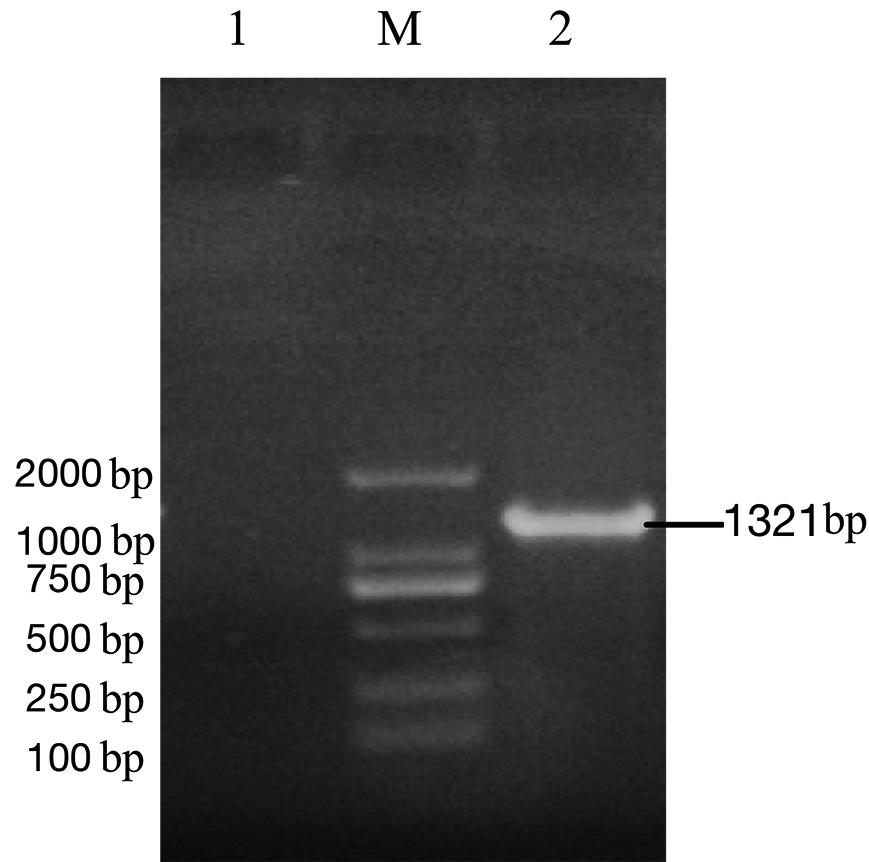
M: DL2000 DNA 分子量标准; 1: 阴性对照;2: SARS-CoV-2 N基因PCR扩增片段
图2 SARS-CoV-2完整N基因PCR扩增
Fig.2 Amplification of complete N gene of SARS-CoV-2
2.3 装甲RNA颗粒的表达纯化及鉴定
将载体pACYC-MS2-CoV-2 N转化BL21(DE3)感受态细胞,加入IPTG诱导表达后获得表达重组菌。裂解菌体,并使用较高浓度RNase A和DNase I充分去除其中的大肠杆菌核酸。然后使用Sephacryl S-200层析柱对装甲RNA颗粒进行纯化,获得含SARS-CoV-2完整N基因的装甲RNA颗粒。使用引物CoV-2-NR对提取的核酸 42℃反转录后,对反转录产物、未进行反转录的核酸以及未提取核酸的RNA颗粒进行PCR鉴定,结果显示,仅反转录产物PCR扩增出现目的条带,见图3。扩增产物克隆测序结果与预期结果一致,表明所制备的装甲RNA颗粒包裹了目的RNA片段,且没有残存的D NA 。
2.4 病毒样颗粒耐核酸酶试验
将装甲RNA颗粒和从其中提取的核酸经核酸酶消化后,提取RNA进行实时荧光RT-PCR检测。结果显示,装甲RNA颗粒处理前后提取的核酸检测结果的Ct值无显著差异,而提取的RNA经处理后检测为无扩增曲线,表明制备的装甲RNA颗粒能够抵抗2种核酸酶的作用。
2.5 装甲RNA颗粒作为核酸检测质控品的制备
用10倍系列稀释的IVT-RNA溶液(10~106 copies/μL)作为外标准品经荧光RT-PCR检测,将Ct值与浓度对数进行线性回归,获得方程y=-3.427x+36.479,R2=0.999,PCR扩增效率为95.802%,见图4和图5。将装甲RNA颗粒检测的Ct值代入方程,结果显示纯化获得的装甲RNA颗粒中包含的RNA拷贝数约为1.11×105 copies/μL。用Hank's液稀释至约106 copies/mL,按照每支1 mL分装保存于-80℃。
2.6 均匀性检验
对随机抽取的质控品,在一次试验中进行检测。采用单因子方差分析对Ct值进行统计分析,结果相对标准偏差为2.32%,小于5%,表明样品中病毒样颗粒分布较为均匀。
2.7 稳定性检验
随机抽取制备的质控品,分别在室温37℃,冷藏温度2~8℃,-20℃及-80℃保存(对照),每隔7 d取样置于-80℃。6个月后应用针对N基因的SARS-CoV-2荧光RT-PCR方法进行检测,分析装甲RNA颗粒的稳定性。结果显示,装甲RNA颗粒在冷藏温度2~8℃,-20℃保存6个月与-80℃保存条件下相比,浓度无显著变化。在37℃条件下可稳定保存12周(84 d),见图6。其核酸浓度定量结果在0.95×106~1.06×106 copies/mL之间。以上结果表明制备的装甲RNA 质控品稳定性好。
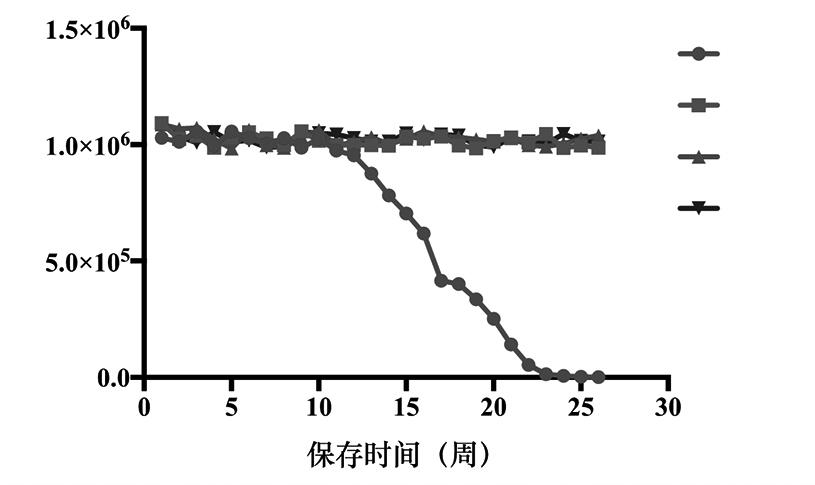
图6 装甲RNA质控品稳定性检验结果
Fig.6 Stability testing of armored RNA quality controls
3 讨论
MS2噬菌体包含约3.6 kb的RNA基因组,编码4个蛋白,即成熟酶、衣壳蛋白、裂解蛋白和复制酶。衣壳蛋白和成熟酶为噬菌体结构蛋白,衣壳由180个14 kD的衣壳蛋白分子组成,成熟酶可保护RNA基因组免于核酸酶降解,同时也是噬菌体侵染大肠杆菌的受体结合蛋白。利用MS2噬菌体主要结构蛋白可制备含有靶向外源RNA的非感染性重组类病毒颗粒(VLP),具有抗核酸酶、稳定、非感染性、可定量等优点,是目前检测RNA病毒最合适的阳性质控品,已经在诊断试剂外标品方面得到广泛应用[7-10]。
生产装甲RNA的首选策略是通过MS2的自组装机制将外源RNA包装到MS2外壳蛋白中。MS2自组装机制是由外壳蛋白和位于复制酶基因5'端的19个碱基的单茎环结构(pac位点)之间的高度特异性相互作用启动的。理论上,MS2至少可包装1900 bp的外源RNA,然而,当外源RNA大小超过500 bp时,包装效率迅速降低[5-6]。研究表明,pac位点在装甲RNA的包装中起着极其重要的作用。已经证实,当pac位点-5位置处的尿嘧啶被胞嘧啶(C突变体)取代后,pac位点与外壳蛋白之间的亲和力会显著增加,此外,增加pac位点的数量也可以提高外壳蛋白和外源RNA之间的亲和力。通过增加pac位点的亲和力(用C-突变体 pac 位点取代野生型pac位点)可以提高包装容量的机制目前尚不清楚。有学者认为,尿嘧啶被胞嘧啶取代后会形成额外的氢键,这将显著提高组装起始复合物的稳定性,从而提高了包装容量。而且通过增加pac站点的数量衣壳蛋白和RNA复合物能够更快地形成且更稳定,从而更有效地触发包装[6-7]。本研究为达到将SARS-CoV-2完整N基因高效包装到MS2衣壳蛋白中的目的,使用了单质粒双基因原核表达载体,即将MS2成熟酶和衣壳蛋白基因克隆于pACYCDuet-1多克隆位点1,而将首尾添加了C-突变体 pac 位点的完整N基因克隆于载体的多克隆位点2。重组载体经诱导表达,实现了将SARS-CoV-2完整N基因高效包装到MS2噬菌体衣壳中,制备出目标装甲RNA颗粒。
N基因在SARS-CoV-2病毒中兼具特异性和保守性,目前几乎所有的检测方法与商品化试剂均将N基因作为检测靶标之一[2-4]。本研究对制备的装甲RNA颗粒经外标方法定量后稀释制备成SARS-CoV-2 N基因检测的核酸质控品,可用于SARS-CoV-2 RNA检测的质量控制。为保证质控品的均匀性,对随机抽取的10管样品进行检测和Ct值分析,其变异系数均在5%以内,表明样品中目的RNA含量均匀。此外,在不同保存条件下对装甲RNA的稳定性进行了测定,结果显示制备的类病毒颗粒不仅在常规温度下具有良好的稳定性,在较为极端的37℃条件下也可稳定保存84 d,稳定性检验结果充分表明该质控品在多种条件下均可稳定保存,能够满足核酸检测的质控需求。
4 结论
本研究利用单质粒双基因表达系统,通过在目的基因上增加C-突变体 pac 位点数量的策略,构建了分别含MS2外壳蛋白和成熟酶基因以及SARS-CoV-2完整N基因的双表达载体pACYC-MS2-CoV-2 N,经诱导表达研制出包裹SARS-CoV-2完整N基因的装甲RNA颗粒,此类病毒颗粒可抵抗核酸酶的降解作用,且无生物危害性。对装甲RNA颗粒进行定值后,经稀释分装制备出了用于SARS-CoV-2 N基因检测的核酸质控品。均匀性检验结果显示其相对标准偏差为2.32%;稳定性检验结果显示,在冷藏温度2~8℃和-20℃保存6个月后,其浓度无显著变化,在37℃条件下可稳定保存12周(84 d)。充分表明制备的装甲RNA颗粒质控品均匀、稳定,可作为SARS-CoV-2 N基因检测的标准阳性对照或质控品,可用于SARS-CoV-2核酸检测的质量控制和评估。
参考文献
[1]周娟, 李丹, 龙云铸.新型冠状病毒(2019-nCoV)相关研究进展[J].中国感染控制杂志, 2020, 19(3): 1-5.
[2]张礼堃,邹秉杰,宋沁馨,等. PCR技术在新冠病毒核酸检测中的应用[J].医学研究生学报, 2021, 34(5): 539-544.
[3] Corman V M, Landt O, Kaiser M, et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR[J]. Eurosurveillance, 2020, 25(3): 1-8.
[4] Konrad R, Eberle U, Dangel A, et al. Rapid establishment of laboratory diagnostics for the novel coronavirus SARS-CoV-2 in Bavaria[J]. Eurosurveillance, 2020, 25(9): 1-5.
[5] Johansson H E, Dertinger D, Lecuyer K A, et al. A thermodynamic analysis of the sequence-specific binding of RNA by bacteriophage MS2 coat protein[J]. Proc. Natl. Acad. Sci. USA, 1998, 95: 9244-9249.
[6] Sien Zhan, Jinming Li, Ruihuan Xu, et al. Armored long RNA controls or standards for branched DNA assay for detection of human immunodeficiency virus type 1[J]. Journal of clinical microbiology, 2009, 47(8): 2571-2576.
[7] Guigao Lin, Kuo Zhang, Dong Zhang, et al. Fast preparation of a long chimeric armored RNA as controls for external quality assessment for molecular detection of Zika virus[J]. Clinica Chimica Acta, 2017, 466: 138-144.
[8] 宋士利,李明强,孙亚萍. GⅡ型诺如病毒装甲RNA质控品研制[J]. 预防医学, 2021, 33(5): 536-540.
[9] Donia D, Divizia M, A Pana'. Use of armored RNA as a standard to construct a calibration curve for real-time RT-PCR[J]. Journal of Virological Methods, 2005, 126(1-2): 157-163.
[10] Pasloske B L, Dubois D B, Brown D M, et al. Methods of quantifying viral load in an animal with a ribonuclease resistant RNA preparation[J]. US, 2002.
项目编号:北京市科技计划课题 (Z201100008920008)
第一作者:高志强(1974—),男,汉族,内蒙古人,博士,研究员,研究方向为动物医学,E-mail: gaozhiqiang02@163.com
通讯作者:汪琳(1974—),女,汉族,湖北人,博士,研究员,研究方向为动物医学,E-mail: 15301090661@139.com
1. 中国海关科学技术研究中心 北京 100026
2. 长沙海关 长沙 410000
1. China Customs Science and Technology Research Center, Beijing 100026
2. Changsha Customs, Changsha 410000







