CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
出口当归药材中挥发油检测方法的优化及比较研究
作者:张欢 解迎双 李晓蓉 刘阿静 李忠婷 白兴斌 王波
张欢 解迎双 李晓蓉 刘阿静 李忠婷 白兴斌 王波
当归为伞形科植物当归的干燥根,具有补血活血[1]、润肠通便、调经止痛、改善肺部功能、预防肿瘤的功效,在临床被誉为“妇科要药”[2]。随着人们对当归功效的认知程度越来越高,当归的国内种植量以及出口量日益增加。2020年,我国当归出口数量4174.69 t,比2019年增加7%;种植面积从2014年约20万亩扩增至2018年的50万亩,当归鲜货产量约25万t。然而,目前国内道地药材市场混乱,究其原因主要是市场经营人员缺乏专业药学知识,对于中药的质量等次不能准确判别,道地药材市场混乱,难以得到改善[3],以至于假冒伪劣道地中药材屡见不鲜,如天麻中掺入各种伪品天麻,以其他杂木浸泡松香冒充沉香,面粉模制冬虫夏草,红纸条冒充红花,贮存不当导致药材霉变、虫蛀;药材混用如五加皮与香加皮、地骨皮混合,川木香与木香混合等[4],甚至出现某些药材二次回收流通的情况,这直接影响了优质中药材的市场份额,最终造成中药材市场畸形发展的恶性循环,因此对当归品质的鉴定是道地当归药材市场平稳良好运行的关键之一。
挥发油是中药材实现生理活性的主要药用成分[5-8],尤其是当归中挥发油,具有降血压、抑制子宫平滑肌的收缩、抑制血小板聚集及镇静等作用[9-13]。挥发油含量受贮存条件的影响很大,研究表明,当归挥发油在室温避光和室温不避光情况下,含量下降10%。此外,中药材中挥发油的含量因药材品种不同,差异也很大[14];而不同产地当归中挥发油的含量也存在差异,何元等[15]通过HPLC方法对不同产地当归挥发油中主要成分含量(藁本内酯)的分析,得出藁本内酯的含量为11.77~31.20 mg/g,这也间接反映了挥发油的含量。所以,通过道地当归中挥发油的含量,继而确定当归贮存条件是否得当、掺伪掺假情况是否存在,将其作为鉴定道地当归的重要指标。目前关于当归中挥发油的检测方法有很多,如有机溶剂萃取法、超临界萃取法和水蒸气蒸馏法[1,15]等。相较于其他两种提取方法来说,水蒸气蒸馏法具有成本较低、对环境污染小、设备简单等优点,应用最为广泛。目前现有的水蒸气蒸馏法测定挥发油含量有GB/T 30385-2013、2020年版《中华人民共和国药典》两种方法,但是国标方法仅适用于香辛料和调味品,不适用于中药材挥发油的测定,而《中华人民共和国药典》(2020年版)没有明确该方法的适用范围,并且尚未有研究对水蒸气蒸馏法提取当归中挥发油的前期样品处理进行优化,以达到更优的提取率。因此,本研究参照《中华人民共和国药典》(2020版)挥发油测定的装置,并通过单因素实验及正交试验优化当归中挥发油的提取工艺,建立一种新的中药材挥发油含量的测定方法,旨在加强对道地当归的筛查技术,完善道地当归出口质量管理体系,建立道地当归产地快速溯源体系,保证通关时效,促进贸易便利化,提高出口当归的质量品质,杜绝以次充好,改变在国外市场处于低端这一现状,促进我国当归产业健康持续有效发展。
1 材料与方法
1.1 仪器装置
蒸馏装置(参照2020年版《中华人民共和国药典:四部》挥发油的提取装置),SCHOTT NG600A型红外加热电磁炉,蜀牛500 mL圆底烧瓶,sartorius BCE224i-1CCN万分之一电子天平,Millipore-ELIX可再生超纯水仪。
1.2 样品来源
18批道地陇南当归由甘肃省农业科学院提供,来源于甘肃省陇南市武都区的3个当归主产片区,涉及7个乡镇39个村,为新鲜采摘后阴干样品,编号S1-S39,详见表1。
1.3 试验方法
1.3.1 当归中挥发油提取方法
试样由CRINOER HM100刀式混合研磨仪进行粉碎,过2~3号筛,用分析天平精确称定当归粉10.00 g于烧杯中,加入本实验设计的水量,浸泡实验设计时长后,置圆底烧瓶中,加水适量,与玻璃珠数粒,振摇混合后,连接挥发油测定器与回流冷凝管。自冷凝管上端加水使其充满挥发油测定器的刻度部分,并溢满流入烧瓶时为止。置电热套中或用其他适宜方法缓缓加热至沸,加热时长为本实验设计时长,加热完成后放置片刻,开启测定器下端的活塞,将水缓缓放出,至油层上端到达刻度0线上面5 mm处为止。放置1 h以上,再开启活塞使油层下降至其上端恰与刻度0线平齐,读取挥发油量,并计算供试品中挥发油的含量得率。
1.3.2 单因素实验设计
准确称取10.00 g当归粉末样品4 份,分别置于4个小烧杯中,中间条件控制为当归浸泡3 h(A),提取水量8 倍(B),提取时间5 h(C)。分别考查当归浸泡时间为 2 h、3 h、4 h、5 h,提取水量为 6倍、8倍、10倍、12倍,提取时间为 4 h、5 h、6 h、7 h的3个单因素水平对当归中挥发油得率的影响。
1.3.3 正交试验设计
挥发油的测定主要受浸泡时间(A)、提取水量(B)、提取时间(C)3个因素影响。本研究采用 L9( 34) 正交试验法进行优化[16],选取A、B、C 3个因素为单因素变量,每个因素选择4个水平,对当归中挥发油提取工艺进行优化,各因素水平见表2。最后以挥发油提取效率作为衡量指标,优化出最佳工艺。
挥发油提取率(%) =当归中挥发油含量(mL)/当归质量(g) ×100%。
表2 影响挥发油得率的因素水平表
Table 2 Level table of factors affecting the yield of volatile oil
水平 | 因素A (h) | 因素B (倍) | 因素C (h) |
1 | 2 | 6 | 4 |
2 | 3 | 8 | 5 |
3 | 4 | 10 | 6 |
4 | 5 | 12 | 7 |
2 结果与分析
2.1 单因素实验结果
2.1.1 当归浸泡时间的影响
图1为当归提取水量倍数10倍、提取时间为6 h时,按照单因素变量浸泡时间分别为2 h、3 h、4 h、5 h对当归挥发油得率的影响曲线图。由图1可知,浸泡时间在2~4 h时,当归挥发油得率呈现出逐渐上升的趋势,在浸泡时间为4 h时,当归中挥发油得率达到最高值,为0.51%,此后随着浸泡时间的增加,当归中挥发油的得率没有明显变化。

图1 当归浸泡时间对挥发油得率的影响
Fig.1 Effects of immersion time of angelica sinensis on volatile oil yields
在我们日常使用的干品中药材中,其有效成分以结晶、无定型沉淀存在于药物细胞内[17],直接加热提取其某一功效成分会使药材表面所含的蛋白质凝固,所以在经过一定时间的浸泡后,药材变得膨胀疏松,有效成分更容易被蒸馏出;而出现浸泡时间到4 h后,随着浸泡时间的增加挥发油得率无明显变化的原因可能是由于浸泡时间已经达到了峰值,其挥发油含量不会再随着浸泡时间的增加而增加导致的。
2.1.2 提取水量对当归挥发油得率的影响
图2为当归浸泡时间4 h、提取时间为6 h时,按照单因素变量提取水量倍数分别为6倍、8倍、10倍、12倍对当归挥发油得率的影响曲线图。由图2可知,随着提取水量倍数的增大,当归中挥发油的得率也随之增大。分析原因可能是因为随着提取水量倍数的增加,当归粉末与提取液的接触面增大,而部分挥发油成分就更加容易渗透进提取液中;当提取水量倍数增大到10倍后,由于当归中挥发油含量有限,得率无明显增加。考虑到圆底烧瓶容量一定,提取水量倍数的继续增加会在蒸馏过程中液体沸腾容易喷溅反而会增大提取难度的情况,因此确定选择提取水量倍数为10倍。

图2 当归提取水量倍数对挥发油得率的影响
Fig.2 Effects of extraction liquid ratio of angelica sinensis on volatile oil yields
2.1.3 提取时间对当归挥发油得率的影响
图3为当归浸泡时间4 h、提取水量10倍时,按照单因素变量提取时间分别为4 h、5 h、6 h、7 h对当归挥发油得率的影响曲线图。由图3可知,随着提取时间不断增加,当归挥发油提取率也在逐渐增大。当提取时间达到6 h后,挥发油得率上升平缓,故综合得率和经济成本考虑,提取时间以6 h为宜。
2.2 正交试验结果
按照表1要求,计算当归挥发油提取率,实验结果见表3。
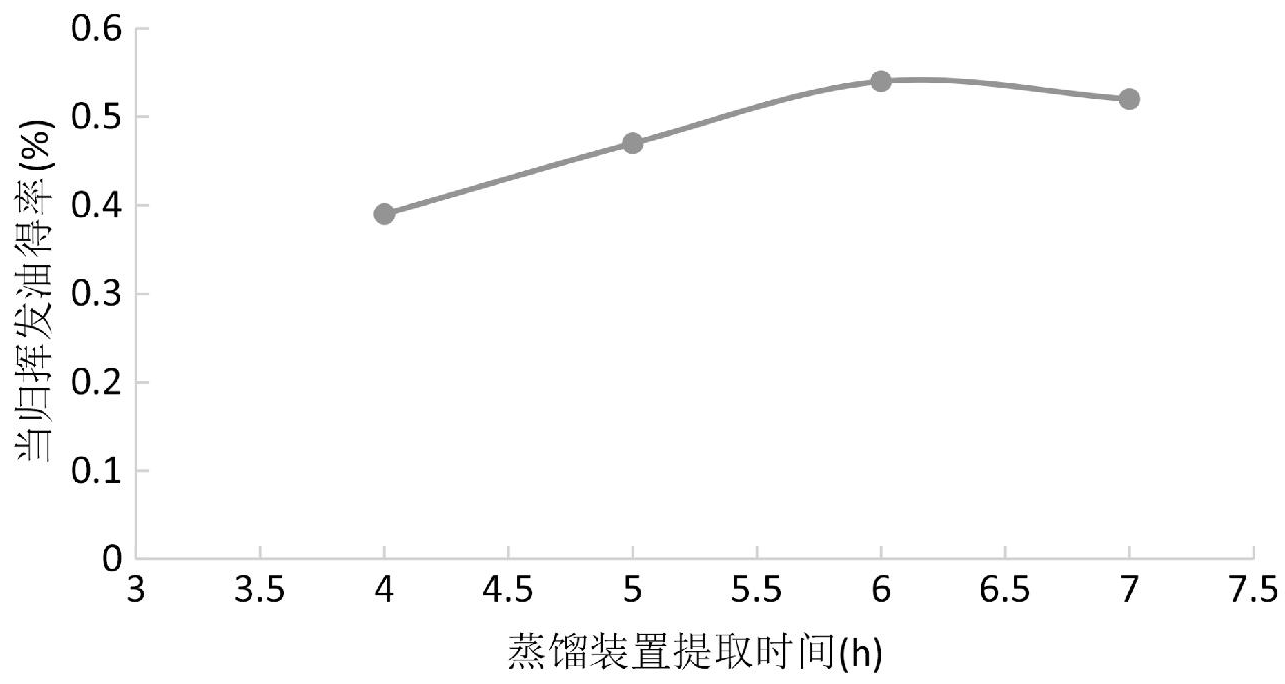
图3 当归提取时间对挥发油得率的影响
Fig.3 Effects of extraction time of angelica sinensis on volatile oil yields
表3 当归挥发油工艺正交试验结果
Table 3 Results of orthogonal test for extraction technique of volatile oil from angelica sinensis
试验号 | 因素 | (mL) | ||
A (h) | B (倍) | C (h) | ||
1 | 1 | 1 | 1 | 0.17 |
2 | 1 | 2 | 2 | 0.31 |
3 | 1 | 3 | 3 | 0.35 |
4 | 2 | 1 | 2 | 0.45 |
5 | 2 | 2 | 3 | 0.49 |
6 | 2 | 3 | 1 | 0.44 |
7 | 3 | 1 | 3 | 0.49 |
8 | 3 | 2 | 1 | 0.42 |
9 | 3 | 3 | 2 | 0.52 |
M1 | 0.83 | 1.11 | 1.14 | |
M2 | 1.38 | 1.22 | 1.28 | |
M3 | 1.43 | 1.31 | 1.33 | |
mn1 | 0.28 | 0.37 | 0.38 | |
mn2 | 0.46 | 0.41 | 0.43 | |
mn3 | 0.48 | 0.44 | 0.44 | |
极差R | 0.20 | 0.07 | 0.06 | |
优化后结果 | ||||
主次顺序 | A>B>C | |||
优组合 | A3B3C3 | |||
图4为运用优化方法进行分析的试验指标与平均值mn的变化趋势图。由因素与指标趋势图可以更直观地看出试验指标随因素水平的变化而变化的趋势。

图4 因素与指标趋势图
Fig.4 Trend chart of factors and indicators
从曲线中可以看出,A因素(浸泡时间)与指标平均值的变化呈现正相关趋势,在4 h时达到峰值,所以在3个因素水平中,浸泡4 h提取效率最佳;B因素(提取水量)与指标平均值的变化呈现正相关趋势,10 h达到最大点,所以在3个因素水平中,提取水量10倍提取效率最佳;C因素(提取时间)与指标平均值的变化呈现正相关趋势,在6 h时达到峰值,所以在3个因素水平中,提取时间6 h时提取效率最佳。对挥发油含量的优化实验方差及显著性分析见表4 。
表4 方差分析及显著性分析
Table 4 Analysis of variance and significance test
方差溯源 | 平方和 | 自由度 | 均方差 | 显著性 |
A | 0.07 | 2 | 0.04 | P<0.05 |
B | 0.02 | 2 | 0.007 | P<0.05 |
C | 0.02 | 2 | 0.008 | P>0.05 |
通过方差分析可知,比较3个因素极差 A>B>C,影响因素的大小顺序为浸泡时间>提取水量>提取时间,其中,因素A、B对提取效果有显著性差异(P<0.05),为主要影响因素,而因素C无显著性差异。结合正交实验极差分析结果,因素A最好选择水平A3;因素B最好选择水平B3;因素C最好选择水平C3,因此可以确定当归挥发油测定的最佳工艺为A3B3C3,即水中浸泡4 h,提取水量倍数为10倍,提取时间为6 h时为最佳工艺。
3 验证试验
将筛选得到的最佳条件A3B3C3(浸泡4 h,提取水量倍数为10倍,提取时间为6 h)进行7次重复验证(表5),RSD为0.01%,在5%以内,表明该优化后的方法提取工艺稳定可行。
表5 提取工艺验证试验
Table 5 Validation test of extraction technique
各次试验挥发油提取量 (mL) | (mL) | (%) | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
0.50 | 0.51 | 0.52 | 0.52 | 0.49 | 0.48 | 0.50 | 0.50 | 0.01 |
将39批当归样品分别通过优化后的方法和传统药典方法进行挥发油的测定,结果如图5所示。

图5 不同方法下挥发油得率柱状图
Fig.5 Histogram of volatile oil yields under different methods
由图5可知,通过优化后的方法与传统药典方法对于本次39批样品的挥发油进行分析得出,优化后方法较传统药典方法挥发油得率上升15%~25%,这与本实验拟解决的优化当归中挥发油得率的目的一致,证明针对本实验中样品的研究有效可行,能够提高当归中挥发油的得率。
4 结论
本实验以陇南道地当归为研究对象,探讨了浸泡时间、提取水量倍数和提取时间对当归挥发油提取率的影响,并结合正交试验设计以及方差分析可知,3个因素极差 A>B>C,影响因素的大小顺序为浸泡时间>提取水量>提取时间,其中因素A、B对提取效果有显著性差异(P<0.05),为主要影响因素,而因素C无显著性差异,与极差分析结果一致。对多因素试验结果的直观分析得知,当归挥发油提取的最佳工艺条件为A3B3C3,即浸泡时间4 h、提取水量倍数10倍、提取时间6 h,在此条件下,当归中挥发油的得率为0.5%。
通过验证试验结果(表5)以及优化后和药典两种方法对比测定39批样品中挥发油得率(表6,图5)可以看出,7批样品的挥发油得率变化为0.5%±0.01%,这说明该优化后的方法提取工艺稳定可行,并且优化后方法挥发油得率能够达到参照药典方法测定挥发油的含量。该工艺操作简单,对设备要求低,科学性强,能够为进出口道地药材的品质控制提供科学的理论依据,不过虽然通过方法优化得到的挥发油含量比参照药典方法进行测定的含量高,但是现有的不足之处是样本量不够大,只是针对采集到的39批样品而言测定结果较为稳定,所以后续还需要更大的样本量来验证该方法的普适性。
参考文献
[1]国家药典委员会. 中华人民共和国药典:四部[M]. 北京: 中国医药科技出版社, 2020: 233.
[2]王娟, 刘汉清. 不同提取方法对莪术油提取的影响[J]. 安徽医药, 2007, 11(2): 114-115.
[3]李超群. 中药材专业市场质量监管创新机制构建研究[J]. 科教导刊: 中刊, 2018, (9): 19-20.
[4]黄锐, 游欣月, 蒲清荣. 我国中药材监管的问题及其对策[J]. 医学与法学, 2020, 12(3): 56-58.
[5] LIU J L, DENG S F, SUN Y J, et al. Comparison of chemical constituents of the essential oil from different parts of Angelica sinensis by GC-MS[J]. Chem World, 2020, 61(6): 426-432.
[6] LI R H. Analysis of volatile oil ingredients in wild Angelica sinensis from different origin[J]. Chin J Ethnomedicine Ethnopharmacy, 2019, 28(23): 41-44.
[7] LU G H, CHAN K, LIANG Y Z, et al. Development of high-performance liquid chromatographic fingerprints for distinguishing Chinese Angelica from related Umbelliferae herbs[J]. J Chromatogr A, 2005, 1073(1/2): 383-392.
[8]张淑丹, 宋萍, 刘雄, 等. 酶辅助提取当归挥发油的工艺优化及其气相色谱-质谱比较分析[J]. 时珍国医国药, 2021, 32(10): 2408-2412.
[9] ZHU Y, ZHANG Y, HUANG X, et al. Z-Ligustilide protects vascular endothelial cells from oxidative stress and rescues high fat diet-induced atherosclerosis by activating multiple NRF2 downstream genes[J]. Atherosclerosis, 2019(284): 110-120.
[10] YAO N, WANG Z W, FU X Y, et al. Advances in research on effects of the essential oil of Angelicae Sinensis Radix and its phthalide constituents on smooth muscle[J]. Chin J Mod Appl Pharm, 2019, 36(21): 2738-2742.
[11] YAO S Y, ZHANG K X, MA Q, et al. Preclinical research progress of ligustilide[J]. Pharm Care Res, 2019, 19(2): 106-110.
[12] QU Q, JI L F, YI L. Effect of Angelica naphtha on lipid metabolism related to Tnfaip8l2, Ahsg gene in spontaneously hypertensive rats[J]. Chin J Gerontol, 2019, 39(11): 2709-2713.
[13]XING D M, LIU J L, DENG S F, et al. Spectrum-effect relationships on antioxidant activities of essential oil from Angelica sinenis[J]. Chem World, 2020, 61(4): 280-286.
[14]朱林, 彭国平, 李存玉, 等. 川芎挥发油中内酯类成分的稳定性考察[J]. 中国实验方剂学杂志, 2013, 19(20): 14-17.
[15]何元, 顾崇梅, 郭华荣. 不同产地当归药材HPLC指纹图谱的建立及2种主成分含量测定[J]. 医药杂志, 2019, 38(6): 30-35.
[16]李凤丽, 李进, 陈涛, 等. 正交法优选野菊花挥发油提取工艺[J]. 天津中医药大学学报, 2007, 26(2): 77-78.
[17]罗风清. 中药煎煮前浸泡对有效成分的影响[J]. 上海医药, 2019, 40(9): 63-64.
表1 39批当归产地、来源及采收时间表
Table 1 The origin, source and harvest schedule of 39 batches of angelica sinensis
编号 | 名称 | 产地 | 来源 | 收集方式 | 采收时间 |
S1 | 当归 | 麻子川镇 | 上沟村 | 向农户收购 | 2021.4 |
S2 | 当归 | 吴纳村 | 向农户收购 | 2021.4 | |
S3 | 当归 | 岭峰村 | 向农户收购 | 2021.4 | |
S4 | 当归 | 大草滩村 | 向农户收购 | 2021.4 | |
S5 | 当归 | 旋窩村 | 向农户收购 | 2021.4 | |
S6 | 当归 | 绿叶村 | 向农户收购 | 2021.4 | |
S7 | 当归 | 下窖沟村 | 向农户收购 | 2021.4 | |
S8 | 当归 | 岭峰村 | 向农户收购 | 2021.4 | |
S9 | 当归 | 茶埠镇 | 沟门村 | 向农户收购 | 2021.4 |
S10 | 当归 | 半沟村 | 向农户收购 | 2021.4 | |
S11 | 当归 | 耳阳村 | 向农户收购 | 2021.4 | |
S12 | 当归 | 碳山村 | 向农户收购 | 2021.4 | |
S13 | 当归 | 谈河村 | 向农户收购 | 2021.4 | |
S14 | 当归 | 尹家村 | 向农户收购 | 2021.4 | |
S15 | 当归 | 哈扎村 | 向农户收购 | 2021.4 | |
S16 | 当归 | 耳阳村 | 向农户收购 | 2021.4 | |
S17 | 当归 | 梅川镇 | 车路村 | 向农户收购 | 2021.4 |
S18 | 当归 | 红水村 | 向农户收购 | 2021.4 | |
S19 | 当归 | 永光村 | 向农户收购 | 2021.4 | |
S20 | 当归 | 红水村 | 向农户收购 | 2021.4 | |
编号 | 名称 | 产地 | 来源 | 收集方式 | 采收时间 |
S21 | 当归 | 梅川镇 | 梅城村 | 向农户收购 | 2021.4 |
S22 | 当归 | 杏林村 | 向农户收购 | 2021.4 | |
S23 | 当归 | 板桥村 | 向农户收购 | 2021.4 | |
S24 | 当归 | 永星村 | 向农户收购 | 2021.4 | |
S25 | 当归 | 西江镇 | 团结村 | 向农户收购 | 2021.4 |
S26 | 当归 | 中山村 | 向农户收购 | 2021.4 | |
S27 | 当归 | 唐家川村 | 向农户收购 | 2021.4 | |
S28 | 当归 | 铁尺村 | 向农户收购 | 2021.4 | |
S29 | 当归 | 扎马村 | 向农户收购 | 2021.4 | |
S30 | 当归 | 青山村 | 向农户收购 | 2021.4 | |
S31 | 当归 | 王仑村 | 向农户收购 | 2021.4 | |
S32 | 当归 | 草滩村 | 向农户收购 | 2021.4 | |
S33 | 当归 | 八力镇 | 山庄村 | 向农户收购 | 2021.6 |
S34 | 当归 | 上拉村 | 向农户收购 | 2021.6 | |
S35 | 当归 | 木耳乡 | 瓦拉村 | 向农户收购 | 2021.6 |
S36 | 当归 | 马莲村 | 向农户收购 | 2021.6 | |
S37 | 当归 | 西坞村 | 向农户收购 | 2021.6 | |
S38 | 当归 | 庞家乡 | 许家村 | 向农户收购 | 2021.6 |
S39 | 当归 | 小石门村 | 向农户收购 | 2021.6 | |
基金项目:国家重点研发计划项目(2017YFF0211102)
第一作者:邹强(1981—),男,汉族,山东威海人,硕士,主要从事海关进出口贸易监管,E-mail: 26944892@qq.com
通信作者:王海涛(1982—),男,汉族,山东烟台人,硕士,高级工程师,主要从事重金属检测,E-mail: htwang08@163.com
1. 烟台海关 烟台 264000
2. 万华化学集团股份有限公司中央研究院分析测试中心 烟台 264000
3. 烟台海关技术中心 烟台 264000
1. Yantai Customs, Yantai 264000
2. Wanhua Chemical Group Co., Ltd. Analysis Test Center, Yantai 264000
3. Yantai Customs Technology Center, Yantai 264000








