CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
荧光定量PCR对进口人发的归类化验研究
作者:高志强 汪琳 蒲静 陈立国 万鹏 赵相鹏 杜思乐 黄今
高志强 汪琳 蒲静 陈立国 万鹏 赵相鹏 杜思乐 黄今
20世纪80年代,我国实施限制性允许进口可用作原料的固体废物措施,当时在一定程度上缓解了经济快速增长带来的原料供应不足问题。但进境固体废物在储存、分拣、处置、回收等环节会导致严重的环境污染,并可能损害人民身体健康。为了国家生态安全和人民群众身体健康,禁止“洋垃圾”进口是一项重要举措。2020年11月,我国四部委联合发布公告,自2021年1月1日起,我国禁止以任何方式进口固体废物[1]。
人发作为人体皮肤的附属物,如果未经梳理、修饰、加工等程序,往往伴有难闻的气味,而且可能携带病原微生物,一旦大量进入我国,不仅可能会影响人民身体健康,而且在处理过程中会对我国环境造成污染,因而存在较大安全隐患。因此我国将未经加工的人发列入《禁止进口固体废物目录》,将“未经加工的人发;废人发”简称“废人发”,商品编码为0501.0000,根据《固体废物进口管理办法》,我国禁止以任何形式进口“废人发”。如果走私的人发被认定为废物,即构成走私废物罪。但经过梳理、修饰、漂白或其他加工程序处理的人发,其商品编码6703000000,则不属于固体废物,是允许正常进口的货物,关税为8%、增值税13%,综合税率为22.04%。但现实情况中,对于外观相对整齐的人发,通过眼观很难判定其是否经过合理的加工程序。由于光学显微镜分辨率不足而难以观察到加工工艺对人发表面结构的改变,有研究表明从显微形态上鉴别加工或未加工人发,需要借助具有更高分辨率的电子显微镜或原子力显微镜[2]。但这两种显微镜均属于精密设备,样品制备程序复杂,不适于常规、快速地检测鉴定,不利于口岸货物快速通关。因此需要研究准确、快速的鉴定方法对其进行准确归类化验。
完整人发一般包括发根和发干,其中发根部分距离毛囊较近,往往携带较多的人体细胞,因此往往含有数量相对较多的人体DNA,而发干由角质层、皮质层和中央髓质层组成,主要由角化的细胞组成[3]。尽管其结构组成主要为角化的纤维蛋白,但仍然含有少量DNA,并可采取合适的方法提取到核基因DNA和线粒体DNA,目前认为发干中的DNA主要来自于角质层[4-6]。目前在法医学领域,采用无根人发成功鉴定DNA的案例多有报道[7-9]。考虑到经过加工的人发和未经加工的人发可能在DNA含量上具有显著差异,因此本研究通过针对人和动物通用内参基因以及人特异基因设计,建立了检测人发的双重实时荧光定量PCR检测方法,在对方法灵敏度、特异性等性能进行评价的基础上用于人发样品的归类化验检测。本研究为口岸对加工和未加工人发的归类化验提供了新的方法。
1 材料和方法
1.1 核酸及被检样品
人源DNA,提取自人口腔拭子;含人TH基因pBSK-TH、含β-actin基因的标准质粒pBSK-BA,牛DNA、猪DNA、羊DNA、鸡DNA以及鸭DNA,均为本实验室保存;未加工无根原发20份,加工后无根人发20份(长度均超过5 cm),本实验室收集保存。
1.2 主要试剂
微量样品基因组DNA提取试剂盒(DP316),蛋白酶K(20 mg/mL,RT403)购自天根生化科技有限公司;HS Taq DNA聚合酶、dNTP等,购自TaKaRa公司;引物及双标记探针,均委托上海生工合成。
1.3 主要设备
ABI 7500及QuantStudio 5荧光定量PCR仪(Thermo Fisher 公司);毛细管电泳仪QIAxcel(QIAGEN公司);全自动研磨仪MM400(德国Retsch公司)。
1.4 引物和探针的合成
对于人源性核酸检测,根据S. Kanthaswamy 等报道的针对酪氨酸羟化酶基因的引物探针序列进行合成[10]。同时,根据β-actin基因设计合成一套可扩增哺乳动物和禽类的引物探针用于内参检测,引物探针名称、序列及扩增长度见表1。
1.5 双重定量荧光PCR反应体系与参数优化
用荧光PCR仪按照Taguchi方法对反应体系的各个组分浓度进行优化,并通过改变不同扩增条件筛选最优反应参数。
1.6 标准曲线建立与最低检测限测定
将已知拷贝数的质粒DNA pBSK-TH和pBSK-BA均以1.15×107 copies/μL作为起始浓度开始做10倍梯度稀释。然后使用优化后的双重定量荧光PCR方法进行检测,选其中6个稀释度模板,以Ct值为纵轴,将上样拷贝数为横轴,进行线性回归分析并作标准曲线,计算回归系数(R2)和PCR扩增效率。为测定方法的最低检测限,对0.5~20拷贝的pBSK-TH进行每梯度8个重复检测,采用概率回归确定对人DNA的检测下限。
1.7 特异性试验
应用建立的反应体系对人源DNA、牛DNA、猪DNA、羊DNA、鸡DNA以及鸭DNA,每个样品设置2个重复。并对PCR产物进行电泳检测,以验证方法的特异性。
1.8 对未加工无根原发以及经加工的无根人发DNA含量的定量检测
保存的未加工原发和加工后人发,均为无根人发,每份均从中间截取5 cm各10根,分别剪成3~5 mm长,放入2.0 mL离心管中,加入1.0 mL pH 7.2 0.01 mol/L PBS缓冲液,加海砂以及钢珠于研磨仪进行充分研磨,加入SDS至终浓度0.2%,加入20 mg/mL蛋白酶K 50 μL 在56°C消化6 h后,在37°C过夜消化。然后取0.2 mL按照微量样品基因组DNA提取试剂盒说明书提取DNA。应用建立的双重荧光PCR方法对提取的DNA进行检测,同时建立标准曲线,进行定量检测,并对定量结果进行显著性检验,并确定判定临界值。
2 结果
2.1 双重定量荧光PCR优化结果
经反复优化确立检测体系:1×PCR Buffer,4.0 mmol/L MgCl2,400 nmol/L dNTP,0.8 μmol/L的HuTH-F/HuTH-R引物,0.2 μmol/L的HuTH-P检测探针;0.3 μmol/L的IAC-F/IAC-R引物,0.1 μmol/L的IAC-P检测探针。反应参数为95°C/3 min;94°C/15 s,56°C/10 s ,70°C/35 s,42个循环,每个循环70°C时收集荧光信号。
2.2 标准曲线建立于PCR效率测定结果
以10倍系列稀释的已知拷贝数质粒pBSK-TH和pBSK-BA作为模板进行双重荧光PCR检测,得到扩增曲线及标准曲线。其中质粒拷贝数在57.5~5.75×106 copies范围内,Ct值与上样拷贝数呈线性关系。扩增曲线见图1,标准曲线见图2。对于Hu-TH基因,回归斜率为-3.26,Y轴截距为41.31,R2=0.998,扩增效率为102.74%;对于β-actin内参基因,回归斜率为-3.47,Y轴截距为43.36,R2=0.999,扩增效率为94.17%。
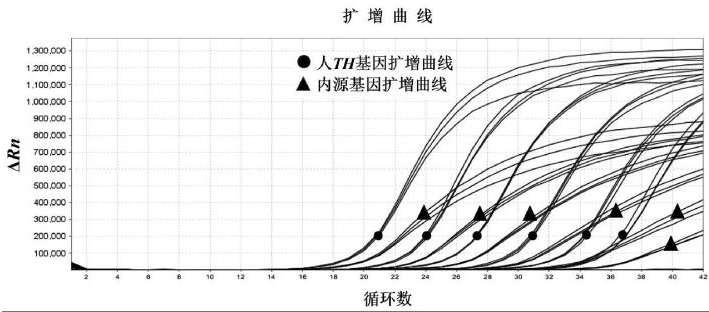
图1 TH基因和内源基因扩增曲线
Fig.1 Amplification curves of TH gene and endogenous gene
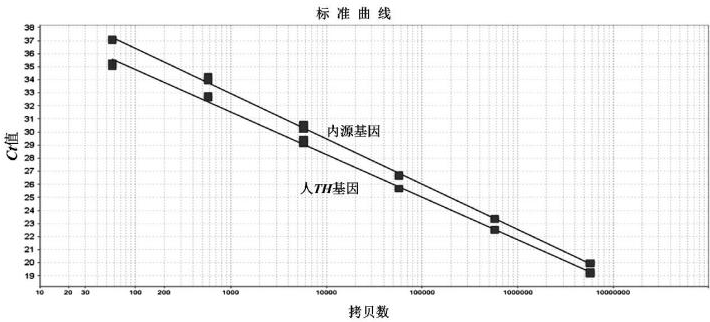
图2 TH基因和内源基因标准回归曲线
Fig.2 Standard regression curves of TH gene and endogenous gene
2.3 最低检测限测定结果
为进一步确定方法对人TH基因的检测下限,对0.5~20拷贝的pBSK-TH基因进行每个梯度8管的重复检测,采用概率回归确定在95%置信区间的分析灵敏度,结果显示建立方法对人TH基因的检测极限为4.48拷贝,95%置信上限和下限分别为4.87拷贝和9.03拷贝,结果见图3。
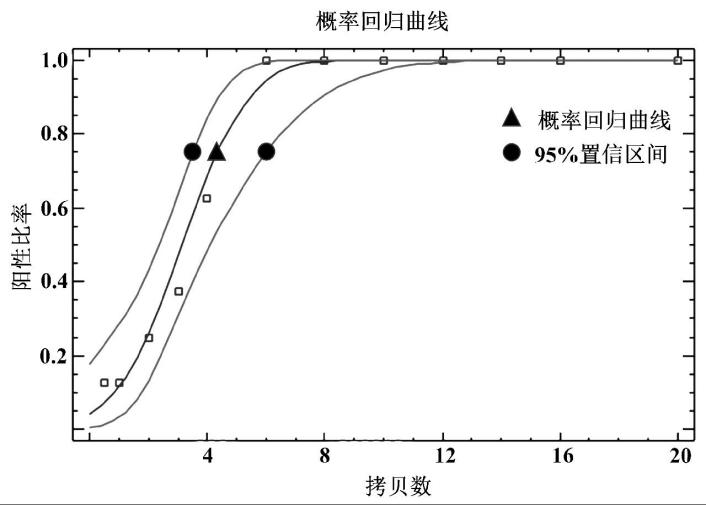
图3 检测人TH基因检测限测定概率回归结果
Fig.3 Probability regression analysis of multiplex fluorescence quantitative PCR for human TH gene
2.4 特异性试验结果
应用建立的方法对人源DNA、牛DNA、猪DNA、羊DNA、鸡DNA以及鸭DNA,进行检测,以验证方法的特异性。结果显示所有样品DNA内参基因均能检出,但仅人源DNA TH基因通道呈现阳性,PCR产物经毛细管电泳显示,人源DNA出现2条预期大小目标条带,而其他物种DNA仅出现1条预期目标条带,见图4。表明建立的方法与其他物种无交叉反应。
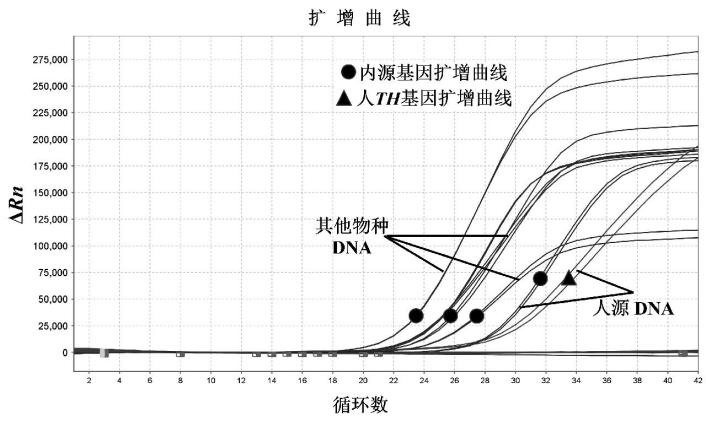
(a)对于人源DNA,内源基因和人TH基因均出现扩增曲线;对于其他物种DNA,仅内源基因有扩增曲线。

(b) M: DNA Marker; 1~2:人源DNA; 3~4:牛DNA; 5~6:猪DNA; 7~8:羊DNA; 9~10:鸡DNA; 11~12:鸭DNA; 13~14:阴性对照。
图4 特异性试验结果
Fig.4 Results of specificity tests
2.5 对无根原发、清洗人发以及经加工的进口人发DNA含量的定量检测
应用建立的双重荧光PCR方法分别对20份无根原发和20份经加工的无根人发进行检测,各份人发测得的Ct值散点图见图5,利用标准方程计算所得DNA拷贝数测定结果见表2。从样品Ct值可以看出,未加工原发荧光PCR测得的Ct值均明显小于加工后人发的Ct值,初步说明加工处理可造成人发中的DNA显著减少。
进一步使用t检验对加工前后人发DNA检测Ct进行分析,结果显示t值远大于t临界值,表明加工过程可造成人发DNA含量的显著变化,使用标准回归方程计算发现,加工前不同人发DNA拷贝数含量差异较大,但均在300以上;而加工后均低于40,平均值加3倍标准差为70(对应Ct值35.29)。因此可以初步确定,对于人发TH基因,将本方法检测拷贝数70作为加工处理后DNA测定的一个指标。
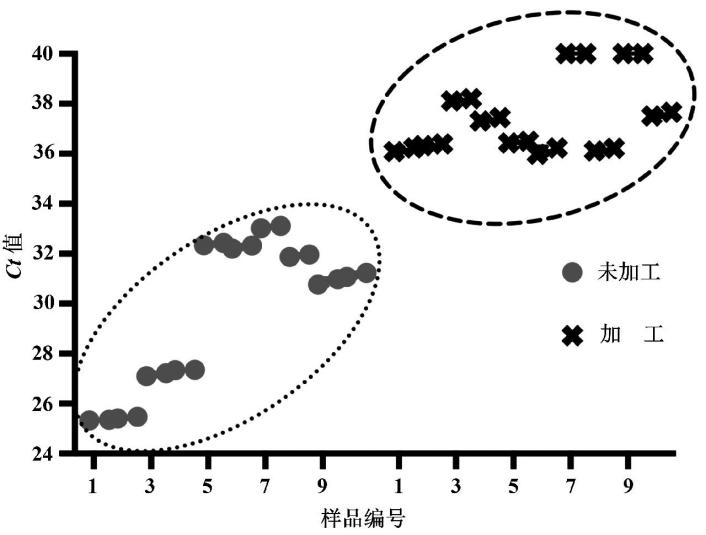
图5 加工及未加工人发检测Ct值散点图
Fig.5 Scatter plot of Ct values for processed and unprocessed human hair
表2 加工及未加工人发DNA的荧光PCR定量结果
Table 2 Quantification of DNA of processed and unprocessed human hair by flurescence quantitative PCR
人发类别 | 数量 | Ct值范围 | 拷贝数范围 | 平均数 | t 值 | t0.05临界值 |
原发 | 20 | 25.34~33.11 | 338~79209 | 19927 | 7.22 | 2.16 |
加工人发 | 20 | ≥36.11 | 0~40 | 22 |
3 讨论
在进出口货物查验中,确定商品归类极其重要,对于海关保护合法贸易,打击非法走私具有重要作用。商品归类不同,海关的监管处置也不同。人发走私可能构成走私普通货物罪,也可能构成走私废物罪,这取决于归类化验的结果。经过加工的人发不同于固体废物,是我国允许进口的货物,但要求经过多道工序加工处理成为假发原料,以避免其携带病原,或者在国内加工造成环境污染。
目前口岸对于人发是否进行加工的归类判定主要依据进口商申报和现场货物的查验情况,对于“团状乱发”通过现场眼观查验即可进行判定。但对于只经过简单顺发的人发,目前缺乏较为精准的甄别手段。常规光学显微镜不足以观察到加工工艺对表面结构的微小改变,尽管有报道表明借助更高分辨率的电子显微镜或原子力显微镜可进行人发的亚显微结构观察,从而做出准确判定。但这两种镜检方法均需要价格高昂的设备和复杂的样品制备程序,不适于作为常规化验手段[2]。考虑到人发加工工程中的一系列工艺会导致人发DNA含量变化,因此本研究从DNA含量变化方面入手,进行化验方法研究。
本研究首先针对人酪氨酸羟化酶基因(TH基因)以及β-actin基因,建立了一套含内参靶标的可快速定量人源DNA的荧光PCR方法,并对方法的最低检测限、特异性进行了测定和验证,结果显示建立的荧光PCR方法检测灵敏度高、特异性强,可用于人源DNA的核基因定量检测。为确定其是否可用于人发的归类化验,我们对实验室收集的加工和未加工人发各20份进行了荧光PCR定量检测。结果显示未加工原发样品间DNA含量参差不齐,有些可达8万拷贝左右,有些仅有几百拷贝,可能与头发表面残留的细胞DNA数量不同有关[8]。但加工后头发的DNA含量却显著下降,推测由于人发加工过程中有数道工序,顺发、清洗消毒以及去杂质等工艺可能清除其表面的绝大部分DNA,从而造成DNA含量的显著下降。我们的测定结果也显示加工后人发的核基因拷贝数显著降低,部分人发样品甚至无法有效扩增至其核DNA。由于核酸扩增方法可能被核酸样品中的物质抑制,反应体系中抑制物的存在会导致靶标扩增失败而出现假阴性。因此,在建立方法时,我们设计了一套通用性强、可扩增多物种β-actin基因的引物探针,将其加入反应体系用于检测过程的质量控制,这样对于特异靶标无扩增的人发样品就可以添加其他物种DNA模板来验证和质控扩增过程。对收集到的有限的加工和未加工的人发DNA定量测定结果经t检验分析,差异显著,初步表明本方法的测定结果可作为进口人发归类化验的一个参考指标,可有效、便捷地对进口人发进行归类,为海关技术执法工作提供依据。
4 结论
本研究针对人源酪氨酸羟化酶基因(TH基因)以及β-actin基因合成引物探针,经体系优化建立了含内参基因,可快速检测人源DNA的双重荧光PCR方法。经概率回归分析显示本方法的检测下限为4.48拷贝(95%置信度),特异性试验显示不与常见其他物种DNA发生交叉反应。应用本方法分别对未加工原发和加工处理后的人发样品进行定量分析检测,结果显示原发与加工后人发样品DNA含量存在显著差异,初步表明可以将人发DNA定量结果作为加工和未加工的人发的鉴别指标,用于对进口人发的归类化验。
参考文献
[1] 生态环境部、商务部、国家发展和改革委员会、海关总署.关于全面禁止进口固体废物有关事项的公告: 公告[2020]53号. 2020 [EB/OL]. https://www.mee.gov.cn/xxgk2018/xxgk/xxgk01/202011/t20201125_809835.html.
[2] Humphry R, Wang N, Durkan C. Site-specific variations in surface structure and Young’s modulus of human hair surfaces at the nanometer scale as induced through bleach treatment[J]. journal of the mechanical behavior of biomedical materials, 2022, 126: 1-8.
[3] Kalbe J, Kuropka R, Meyer-Stork L S, et al. Isolation and Characterization of High-Molecular Mass DNA from Hair Shafts[J]. Biological Chemistry Hoppe-Seyler, 1988, 369(1): 413-416.
[4] Almeida M, Betancor E, Fregel R, et al. Efficient DNA extraction from hair shafts[J]. Forensic Science International Genetics Supplement, 2011, 3:319-320.
[5] Takayanagi K, Asamura H, Tsukada K, et al. Investigation of DNA extraction from hair shafts[J]. International Congress Series, 2003, 1239(2): 759-764.
[6] Wilson M R, Polanskey D, Butler J M, et al. Extraction, PCR amplification and sequencing of mitochondrial DNA from human hair shafts[J]. Biotechniques, 1995, 18(4): 662-669.
[7] 黄娅琳. 一种简便的DNA提取方法在动物毛发检验中的应用[J]. 中国司法鉴定, 2008(2): 29-31.
[8] Lawas M, Otterstatter L M, Forger L V, et al. A quantitative method for selecting a hair for nulear DNA analysis[J]. Forensic Science International: Genetics, 2020, 48: 1-11.
[9] Damaso N, Ashe E C, Meiklejohn K A, et al. Comparison of Polymerases used for Amplification of Mitochondrial DNA from Challenging Hairs and Hairs of Various Treatments[J]. Forensic Science International: Genetics, 2021, 52(1): 1-7.
[10] Kanthaswamy S, Premasuthan A, Ng J, et al. Quantitative real-time PCR (qPCR) assay for human-dog-cat species identification and nuclear DNA quantification[J]. Forensic Science International Genetics, 2012, 6(2): 290-295.
基金项目:“十四五”国家重点研发计划项目(2021YFC2401005)
第一作者:高志强(1974—),男,汉族,内蒙古乌兰察布人,博士,研究员,主要研究方向为动物检疫,E-mail: gaozhiqiang02@163.com
1. 中国海关科学技术研究中心 北京 100026
1. China Customs Science and Technology Research Center, Beijing 100026







