CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
QuEChERS-液质联用法测定柑橘中浸果保鲜剂残留
作者:黄科 林健 张建莹 吴卫东 邓慧芬 李凯
黄科 林健 张建莹 吴卫东 邓慧芬 李凯
中国是世界种植柑橘面积最大的国家,也是柑橘出口量最大的国家[1]。柑橘在种植、采摘、运输过程中会用到一些农药,其中采摘后使用的浸果保鲜剂对人体的危害最为直接。2021年媒体报道部分沃柑果农滥用浸果保鲜剂,忽视安全间隔期直接上市,引起社会广泛关注[2] 。我国登记用于柑橘采后浸果的保鲜剂产品涉及7种有效成分[3],较为常用的包括咪鲜胺、抑霉唑、噻菌灵、甲基硫菌灵、2,4-滴,甲基硫菌灵经相关代谢转化为多菌灵[4]。GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》规定甲基硫菌灵的残留物为甲基硫菌灵和多菌灵,以多菌灵计[5]。为了保护消费者的食品安全,我国制定了严格的农药最大残留限量(MRL),其中规定柑橘中咪鲜胺、抑霉唑、噻菌灵、甲基硫菌灵、多菌灵、2,4-滴MRL分别为5 mg/kg、5 mg/kg、10 mg/kg、5 mg/kg、5 mg/kg、0.1 mg/kg [5]。国际食品法典委员会(CAC)规定柑橘中咪鲜胺、抑霉唑、噻菌灵、2,4-滴的MRL分别为10 mg/kg、5 mg/kg、7 mg/kg、1 mg/kg [6]。我国使用较广的噻菌灵限量高于CAC,为避免出口技术性贸易壁垒,对上述常用的浸果保鲜剂进行快速测定具有重要意义。
目前针对柑橘中保鲜剂残留的测定方法主要有液相色谱法[7]、气相色谱法[8]、气相色谱-质谱联用法[9]和液相色谱-质谱联用法[10]。其中,液相色谱-质谱联用法具有高特异性和高灵敏度,是目前广泛应用的农药残留检测方法。相关文献介绍的前处理分散固相萃取剂通常为C18/PSA混合物[10-11],PSA的加入使得2,4-滴回收率不佳,该净化剂组合的净化能力不足,导致上机液静置后常伴有较多杂质颗粒析出,严重影响精密仪器的使用。本试验采用C18/GCB混合物作为分散固相萃取剂,通过优化C18/GCB的加入量,既保证净化效果,又减少吸附具有平面结构的噻菌灵和多菌灵,结合液质联用法测定柑橘中咪鲜胺、抑霉唑、噻菌灵、甲基硫菌灵、多菌灵、2,4-滴,适用于柑橘中保鲜剂的快速筛查和测定。
1 实验部分
1.1 仪器与设备
AB SCIEX Triple Quad™ 5500+型串联质谱仪配电喷雾离子源(美国AB公司)和岛津30A型高效液相色谱仪(日本Shimadzu公司);多管旋涡振荡器(深圳逗点公司);高速低温离心机(德国Sigma公司);超纯水系统(美国Millipore公司);0.22 µm有机滤膜(上海安普公司)。
1.2 试剂与材料
甲醇、乙腈、甲酸均为色谱纯(德国Merck公司);水为自制超纯水;无水硫酸镁、乙酸铵均为分析纯(成都市科龙化工试剂厂);萃取盐包(4 g MgSO4、1 g NaCl、1 g柠檬酸钠、0.5 g柠檬酸氢二钠)(上海安普公司);硅胶键合碳十八及氧化锆(Z-Sep+)、十八烷基键合硅胶(C18)、石墨化炭黑(GCB)、N-丙基乙二胺(PSA)、多壁纳米管(MWCNTs)(美国Supelco公司)。
标准品,纯度≥95 %(德国Dr.E公司)。用甲醇配制成浓度为200 mg/L的农药标准储备液,移取适量单标储备液,使用甲醇配制成10 mg/L的混合标准溶液,-30°C避光存放。
1.3 实验方法
1.3.1 样品前处理
称取10.0 g(精确至0.01 g)柑橘试样于50 mL具塞离心管中,加入10 mL乙腈,振荡提取3 min,加入萃取盐包,加盖迅速摇匀,振荡混匀3 min,以9500 r/min离心5 min,待净化。
取6 mL上清液,移入含100 mg C18、25 mg GCB、900 mg MgSO4的15 mL具塞离心管中,加盖迅速摇匀,振荡混匀3 min,以9500 r/min 离心5 min,取上清液1 mL,经0.22 µm有机滤膜过滤后,LC-MS/MS测定。
1.3.2 色谱条件
色谱柱:Shim-pack Velox C18(2.7 µm,2.1 mm×100 mm,日本Shimadzu公司)。流动相A为5 mmol/L乙酸铵溶液(0.1%甲酸),流动相B为甲醇。梯度洗脱程序:0~2.0 min,5% B;2.0~5.00 min,5%~90% B;5.0~7.0 min,90% B;7.0~8.0 min,90%~5% B。流速:0.3 mL/min。柱温40°C。进样量1 µL。
1.3.3 质谱条件
离子源:ESI;扫描方式:MRM模式,正/负离子扫描;离子源温度:300°C;离子源电压:5500 V/-4500 V;气帘气压力:241.325 kPa;雾化气压力:344.750 kPa;辅助气压力:344.750 kPa。
2 结果与讨论
2.1 色谱条件优化
以6种化合物的混合标准溶液(0.1 mg/L)直接进样,分别考察水-甲醇、水-乙腈的流动相,发现6种化合物都有较好的色谱分离和质谱响应强度,故本试验选择更便宜的水-甲醇体系作为流动相体系,通过加入适量的甲酸和乙酸铵改变流动相的pH值和离子强度[12],从而优化各项参数。流动相体系中未添加乙酸铵时,多菌灵、噻菌灵的峰形较差,故对比含乙酸铵的3种常用流动相:甲醇-5 mmol/L乙酸铵溶液(0.1%甲酸)(Ⅰ)、甲醇(0.1%甲酸)-5 mmol/L乙酸铵溶液(0.1%甲酸)(Ⅱ)、甲醇-5 mmol/L乙酸铵溶液(Ⅲ),6种化合物(0.1 mg/L)的MRM总离子流图如图1所示。若选择Ⅰ或Ⅱ,6种化合物的峰形、分离度、响应强度都较好且接近。若选择Ⅲ,响应强度较好,但6种化合物的分离度较差。本试验综合考虑选择Ⅰ,此流动相完全满足试验需要,梯度洗脱程序控制在8 min,与彭芳等[11]的研究比较,检测时间缩短10 min,有效地提高了检测效率。
2.2 质谱参数优化
ESI源正/负离子模式下,分别对各化合物的单标准溶液进行全扫描(Q1),获得稳定的母离子(Precursor ion),Q1模式下优化去簇电压(DP),再进行子离子扫描(Q3),每个化合物选取2个响应值高的特征子离子(Product ion),与母离子组成2对离子对作为定量和定性离子对,进一步优化碰撞电压(CE)。各化合物质谱参数的优化结果见表1。
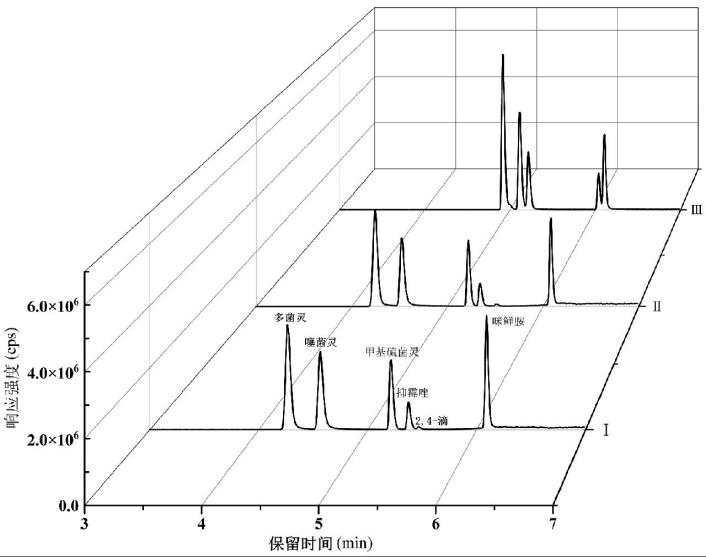
图1 6种化合物的MRM总离子流图
Fig.1 Total ion chromatogram of 6 compounds in MRM mode
表1 6种化合物的保留时间和质谱参数
Table 1 Retention time and mass spectrometric parameters of 6 compounds
化合物 | (min) | (m/z) | (m/z) | (eV) | (eV) |
咪鲜胺 | 6.09 | 376.2 | 308.0*/266.0 | 20 | 15/22 |
抑霉唑 | 5.37 | 297.1 | 159.0*/201.0 | 100 | 31/23 |
噻菌灵 | 4.59 | 202.0 | 175.0*/131.0 | 100 | 34/43 |
甲基硫菌灵 | 5.21 | 343.0 | 151.0*/311.0 | 60 | 26/15 |
多菌灵 | 4.25 | 192.0 | 160.0*/132.0 | 80 | 25/41 |
2,4-滴 | 5.48 | 219.0 | 161.1*/125.0 | -29 | -23/-34 |
注: *是指定量离子
2.3 前处理方法的优化
2.3.1 提取溶剂的选择
农药残留检测中提取溶剂最常用的是乙腈,乙酸乙腈能调节萃取溶液的pH值,适用于更多极性不同的化合物,是农药多残留检测中较好的提取溶剂[13]。本试验分别考察了纯乙腈、1%甲酸乙腈、2%甲酸乙腈3种提取溶剂,添加水平为0.1 mg/kg,其他条件与“1.3”一致。3种不同溶剂的回收率情况如图2所示。
结果表明,纯乙腈、1%甲酸乙腈、2%甲酸乙腈都具有良好的提取效果,回收率都在满意范围。考虑到柑橘基质本身的低pH值属性,甲酸的加入对萃取溶液pH值的改变不大,本试验采用纯乙腈作为提取溶剂。
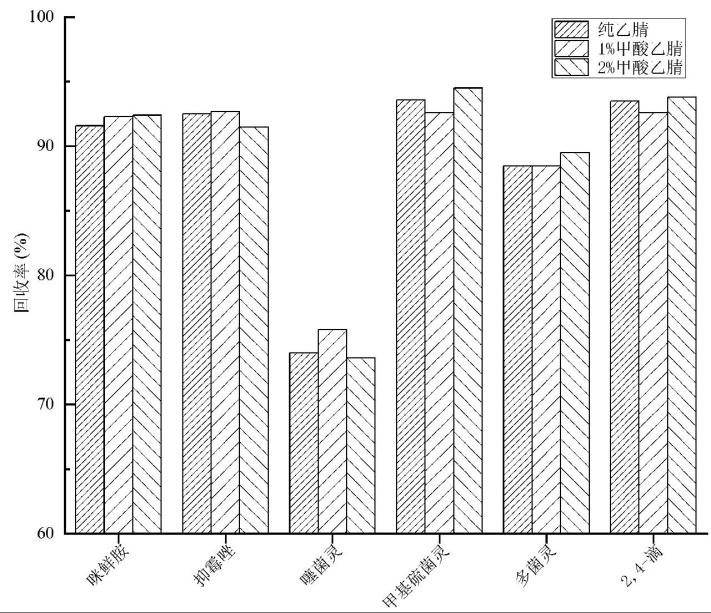
图2 不同提取溶剂对回收率的影响
Fig.2 Effect of different extraction solvents on recovery
2.3.2 分散固相萃取吸附剂的选择
农药残留分析中最常用的分散固相萃取净化剂有PSA、GCB、C18、Z-Sep+、MWCNTs等。PSA保留提取液中的糖类、有机酸等极性化合物。GCB保留提取液中叶绿素、类胡萝卜素等色素,但会吸附一些平面及对称结构的农药。C18保留提取液中脂类、胆固醇等疏水化合物。Sep+是在硅胶表面双重键合了ZrO2和C18的新型填料,ZrO2是一种两性化合物,保留提取液中酸性和碱性化合物[14]。MWCNTs是一种高比表面积的碳纳米材料,保留提取液中叶绿素、类胡萝卜素等色素能力强[15]。本试验通过使用不同净化剂净化2 mL混合标准乙腈溶液(0.1 mg/L),比较各化合物的回收率来考察净化剂的吸附能力,结果见表2。
结果表明:PSA对2,4-滴有强烈的吸附;C18对2,4-滴部分吸附;Z-SEP+对除甲基硫菌灵的其他化合物都有很强的吸附;GCB对化合物有中等强的吸附;MWCNTs对除抑霉唑、甲基硫菌灵的其他化合物有强烈的吸附。选择对目标化合物吸附较弱的C18和GCB作为本试验的备选吸附剂。若单独使用C18净化,萃取液颜色较深,静置数小时后有小颗粒杂质析出,说明净化效果不够。若单独使用GCB净化,过量的GCB会吸附具有平面结构的噻菌灵和多菌灵[16],导致回收率欠佳。故本试验采用GCB和C18组合吸附剂方案。
本试验使用900 mg MgSO4去除残留水分,考察4种吸附剂方案的净化效果,方案如下: 150 mg C18、25 mg GCB、900 mg MgSO4(Ⅰ);150 mg C18、45 mg GCB、900 mg MgSO4(Ⅱ);100 mg C18、25 mg GCB、900 mg MgSO4(Ⅲ);100 mg C18、45 mg GCB、900 mg MgSO4(Ⅳ)。添加水平为0.1 mg/kg,其他条件如“1.3”所述,6种化合物的回收率如图3所示。
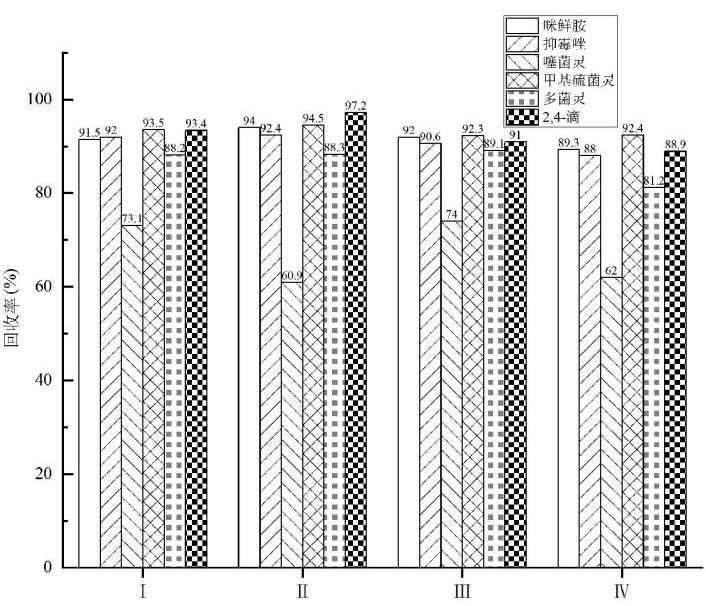
图 3 不同吸附剂组合下的回收率
Fig.3 Recovery rate using different adsorbent combinations
结果表明,Ⅱ和Ⅳ方案的净化液接近乙腈,由于过量的GCB吸附,导致噻菌灵的回收率偏低。Ⅰ和Ⅲ方案的净化液接近澄清,所有化合物回收率都满意,本试验选择C18使用量更少的Ⅲ方案。
3 方法学评价
3.1 线性范围、定量限、基质效应
配制了0.005 mg/L、0.010 mg/L、0.020 mg/L、0.050 mg/L、0.100 mg/L、0.200 mg/L空白基质混合标准工作曲线,6种化合物在0.005~0.200 mg/L 的范围内线性关系良好,相关系数在0.9919~0.9996之间,见表3。
以MRM 定量离子的色谱峰面积(y)对待测物质量浓度(x,mg/L)建立标准曲线,取柑橘空白基质进行定量限的考察,以≥10倍信噪比(S/N)计算定量限(LOQs),6种化合物的定量限确定为0.010 mg/kg,能够满足柑橘中保鲜剂残留量的测定要求。
基质效应(ME)常以空白基质匹配标准曲线斜率与纯溶剂标准曲线斜率比值进行评估。ME在0.8~1.2之间,不存在明显的基质效应[17]。ME≥1.2时,为基质增强效应;ME≥0.8时,为基质抑制效应。结果显示,咪鲜胺和2,4-滴为无明显的基质效应,其他化合物均为基质抑制效应[17-18]。故本试验采用基质匹配标准曲线进行定量,减小测定误差。
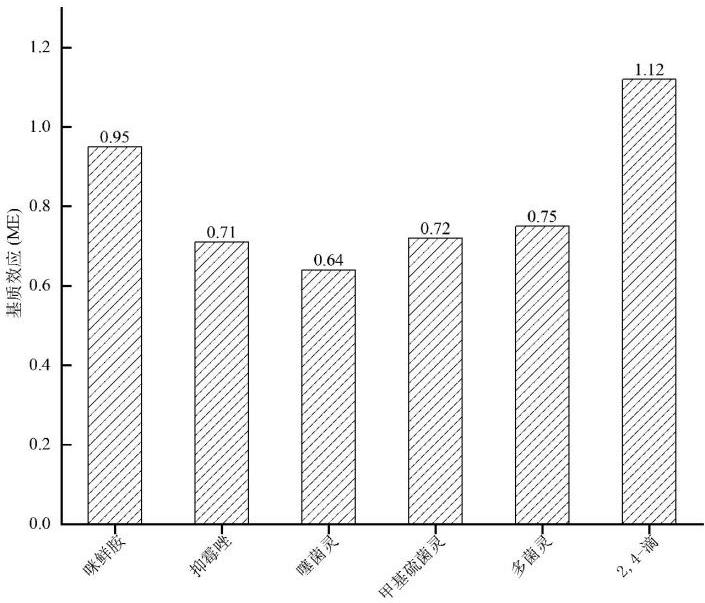
图 4 6 种化合物的基质效应
Fig.4 ME of 6 compounds
3.2 准确度与精确度
用沃柑、丑柑、皇帝柑的空白样品分别做0.050 mg/kg、0.100 mg/kg、0.200 mg/kg水平添加回收试验,每个水平重复5次。结果表明,平均回收率在70.6%~94.0%之间,相对标准偏差在0.3%~5.6%之间,见表4。方法的准确度和精密度均符合农药残留分析要求。
3.3 实际样品检测
应用本试验方法对深圳市场采购的30批次柑橘进行测定。25批次检出咪鲜胺,最大检出2.5 mg/kg;10批次检出抑霉唑,最大检出0.4 mg/kg;26批次检出噻菌灵,最大检出0.6 mg/kg;15批次检测甲基硫菌灵,最大检出0.2 mg/kg;30批次检出多菌灵,最大检出0.08 mg/kg;22批次检出2,4-滴,最大检出0.7 mg/kg。
4 结论
本试验通过优化色谱条件和质谱条件,考察了不同提取溶剂和净化剂组合,建立了纯乙腈提取,C18/GCB组合为吸附剂的QuEChERS-LC-MS/MS法,同时测定柑橘中6种常用保鲜剂残留量。该方法操作简单,灵敏度高,准确性强,满足定量检测要求,为口岸监管柑橘类农产品提供了一种有效检测手段。
参考文献
[1]唐继微, 王全永, 韦艳菊. 中国和泰国柑橘产品标准比对研究[J]. 中国标准化, 2022(5): 206-211.
[2]乔勇进. 理性看待沃柑采后“泡药”[J]. 食品与生活, 2021(4): 26-27.
[3]孟华岳, 朱富伟, 廖林瀚, 等. 柑橘防腐保鲜剂使用与残留监管研究[J]. 农产品质量与安全, 2022(1): 73-78.
[4]李福琴, 石丽红 ,王飞 , 等. QuEChERS-液相色谱-串联质谱法同时检测土壤和柑橘中吡唑醚菌酯、甲基硫菌灵及其代谢物多菌灵的残留[J]. 色谱, 2017, 35(6): 620-626..
[5] GB 2763-2021. 食品安全国家标准 食品中农药最大残留限量[S]. 北京: 中国农业出版社, 2021.
[6]国际食品法典委员会. 法典在线数据库农药数据库[DB/OL]. https://www.fao.org/fao-who-codexalimentarius/codex-texts/dbs/pestres/pesticides . [2021-07-01].
[7]林江丽, 张丽静, 张旭龙, 等. 高效液相色谱法同时测定甲基托布津和扑海因[J]. 分析化学, 2001, 29(8): 933-935.
[8]徐国锋, 聂继云, 李静, 等. 气相色谱法同时测定水果中毒死蜱、苯醚甲环唑和哒螨灵的残留[J]. 农药学学报, 2014(3): 307-312.
[9]彭淑女, 王秋泉, 方兰兰, 等. 气相色谱-质谱法同时测定水果中9种保鲜剂的残留量[J]. 色谱, 2014, 32(1): 69-73.
[10]曹雪琴, 杨飞 ,陈国通 ,等. 超高效液相色谱-串联质谱法同时测定水果中10种保鲜剂残留量[J]. 食品科学, 2020, 41(4): 319-324.
[11]彭芳, 雷美康, 徐佳文, 等. QuEChERS 净化-超高效液相色谱-串联质谱法测定柑橘中7种保鲜剂的残留量[J]. 理化检验 (化学分册), 2016, 52(9): 1007-1010.
[12]姚恬恬, 刘翻, 金鑫, 等. QuEChERS-超高效液相色谱-串联四极杆飞行时间质谱法同时测定果蔬中19种植物生长调节剂残留[J]. 分析科学学报, 2019, 35(5): 543-550.
[13] WANG J, LEUNG D, CHOW W, et al. UHPLC/ESI Q-Orbitrap Quantitation of 655 Pesticide Residues in Fruits and Vegetables—A Companion to an nDATA Working Flow[J]. AOAC International, 2020, 103(6): 1547-1559.
[14] Jung Y S,Song N, Choi J Y, et al. Evaluation of various clean-up sorbents in kale followed by LC-MS/MS analysis of pesticides[J]. Food Science and Biotechnology, 2022, 31(7): 787-796.
[15]赵暮雨, 韩芳, 孙锦文, 等. 多壁碳纳米管作为吸附剂的QuEChERS-气相色谱-四极杆飞行时间质谱快速筛查淡水产品中145种农药残留[J]. 分析测试学报, 2016, 35(12): 1513-1520.
[16]杨丽芬, 杨忠平, 邵林, 等. QuEChERS-高效液相色谱法测定苹果中多菌灵和噻菌灵[J]. 食品安全质量检测学报, 2020, 11(7): 2257-2262.
[17] 陈汝, 王金政, 王贵平, 等. QuEChERS-UPLC-MS/MS法检测苹果中5种农药残留[J]. 分析试验室, 2021, 40(2): 163-168.
[18]秦姗姗. 农产品中农药残留分析方法研究及基质效应探讨[D]. 河南: 郑州大学, 2015.
表2 不同吸附剂对化合物的吸附能力
Table 2 Adsorption capacity of different adsorbents for compounds
净化剂 | 添加量 (mg) | 回收率 (%) | |||||
咪鲜胺 | 抑霉唑 | 噻菌灵 | 甲基硫菌灵 | 多菌灵 | 2,4-滴 | ||
PSA | 25.0 | 100.4 | 98.8 | 97.8 | 98.0 | 95.8 | 0 |
50.0 | 101.4 | 100.0 | 95.6 | 97.2 | 90.4 | 0 | |
75.0 | 100.8 | 98.0 | 93.6 | 92.8 | 86.2 | 0 | |
C18 | 25.0 | 83.4 | 83.2 | 85.6 | 103.2 | 95.8 | 54.6 |
50.0 | 77.6 | 75.8 | 79.4 | 101.4 | 92.6 | 51.6 | |
75.0 | 73.8 | 70.3 | 79.2 | 100.4 | 94.4 | 50.6 | |
Z-SEP+ | 25.0 | 18.2 | 3.6 | 0 | 94.2 | 4.8 | 0 |
50.0 | 8.6 | 0 | 0 | 90.8 | 0 | 0 | |
75.0 | 6.2 | 0 | 0 | 90.0 | 0 | 0 | |
GCB | 7.5 | 58.6 | 87.4 | 34.4 | 88.4 | 38.6 | 17.4 |
15.0 | 43.5 | 79.8 | 21.6 | 82.2 | 27.2 | 12.4 | |
22.5 | 30.4 | 70.1 | 13.4 | 74.8 | 18.4 | 16.8 | |
MWCNTs | 7.5 | 0 | 77.2 | 0 | 34.6 | 0 | 0 |
15.0 | 0 | 49.4 | 0 | 18.6 | 0 | 0 | |
22.5 | 0 | 36.6 | 0 | 13.4 | 0 | 0 |
表3 6种化合物的线性范围、线性方程、相关系数和定量限(柑橘)
Table 3 Linear ranges, linear equations, correlation coefficients and LOQs of 6 pesticides (citrus)
化合物 | 线性范围 (mg/L) | 线性方程 | 相关系数 | 定量限 (mg/kg) |
咪鲜胺 | 0.050~0.200 | y=52185.4x+84299.6 | 0.9978 | 0.010 |
抑霉唑 | 0.050~0.200 | y=13722.7x+13071.5 | 0.9995 | 0.010 |
噻菌灵 | 0.050~0.200 | y=53739.9x+54910.4 | 0.9995 | 0.010 |
甲基硫菌灵 | 0.050~0.200 | y=52547.7x+62578.5 | 0.9984 | 0.010 |
多菌灵 | 0.050~0.200 | y=93141.5x+161068.0 | 0.9980 | 0.010 |
2,4-滴 | 0.050~0.200 | y=1734.2x+122.3 | 0.9995 | 0.010 |
表4 6种农药的添加水平、回收率、相对标准偏差(n=5)
Table 4 Addition level, recovery rate and relative standard deviation of 6 pesticides (n=5)
化合物 | (mg/kg) | 沃柑 | 丑柑 | 皇帝柑 | |||||
回收率 (%) | 相对标准偏差 (%) | 回收率 (%) | 相对标准偏差 (%) | 回收率 (%) | 相对标准偏差 (%) | ||||
咪鲜胺 | 0.050 | 90.1 | 2.3 | 89.0 | 5.1 | 88.3 | 1.3 | ||
0.100 | 92.0 | 2.0 | 94.0 | 2.9 | 92.4 | 4.2 | |||
0.200 | 93.6 | 1.0 | 90.6 | 0.8 | 92.6 | 0.3 | |||
抑霉唑 | 0.050 | 90.3 | 5.6 | 92.5 | 3.5 | 90.1 | 1.2 | ||
0.100 | 92.3 | 1.6 | 92.0 | 2.8 | 90.5 | 2.3 | |||
0.200 | 92.0 | 1.2 | 93.6 | 1.1 | 90.6 | 0.5 | |||
噻菌灵 | 0.050 | 72.0 | 4.6 | 72.0 | 3.6 | 70.6 | 1.2 | ||
0.100 | 73.6 | 1.2 | 75.0 | 2.8 | 71.9 | 2.6 | |||
0.200 | 74.6 | 0.9 | 74.9 | 2.0 | 72.3 | 0.3 | |||
甲基硫菌灵 | 0.050 | 90.6 | 2.6 | 91.5 | 3.7 | 90.2 | 3.6 | ||
0.100 | 93.6 | 4.9 | 92.8 | 3.0 | 92.6 | 2.0 | |||
0.200 | 92.4 | 1.6 | 93.0 | 1.2 | 90.4 | 0.7 | |||
多菌灵 | 0.050 | 88.0 | 0.9 | 87.5 | 2.6 | 89.0 | 5.0 | ||
0.100 | 88.4 | 2.3 | 86.3 | 2.0 | 88.6 | 2.3 | |||
0.200 | 88.5 | 1.0 | 88.6 | 0.8 | 88.0 | 0.6 | |||
2,4-滴 | 0.050 | 90.0 | 0.9 | 88.2 | 2.0 | 88.5 | 2.6 | ||
0.100 | 93.4 | 2.1 | 90.5 | 2.5 | 90.7 | 1.5 | |||
0.200 | 93.0 | 0.3 | 91.5 | 1.8 | 92.0 | 1.6 | |||







