CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
基于DES-MSPD技术的高效液相色谱法测定粮谷中10种氨基甲酸酯类农药残留含量
作者:张鑫鑫 杨燕强 花锦 武曦
张鑫鑫 杨燕强 花锦 武曦
摘 要 本文建立了基于低共熔溶剂-基质分散固相萃取技术的高效液相色谱法,同时测定粮谷中10种氨基甲酸酯类(涕灭威亚砜、涕灭威砜、灭多威、3-羟基克百威、涕灭威、速灭威、克百威、甲萘威、异丙威、仲丁威)农药残留的含量。以正己醇作为氢键供体,四丁基氯化铵作为氢键受体合成低共熔溶剂,样品经低共熔溶剂-中性氧化铝进行基质分散,研磨萃取后用乙腈萃取洗脱农残目标物,以甲醇-0.1%甲酸溶液为流动相进行梯度洗脱,在ODS-C18(4.6 mm×250 mm,2.5 μm)色谱柱上分离,设置波长可变程序,采用液相色谱紫外检测器实现10种农药一次性完全分离。结果表明:10种目标物分离效果良好,对应线性范围内的相关系数r≥0.9991,方法检出限范围为0.005~0.023 mg/kg,定量限范围为0.015~0.069 mg/kg,在0.1~1.0 mg/kg浓度范围内回收率为83.6%~103.9%,相对标准偏差为0.9%~4.8%。
关键词 低共熔溶剂;基质分散固相萃取;氨基甲酸酯类农药;高效液相色谱;粮谷
Determination of Ten Kinds of Carbamate Pesticide Residues in Grain by Deep Eutectic Solvent Green Microextraction
ZHANG Xin-Xin1 YANG Yan-Qiang1 HUA Jin1 WU Xi2
Abstract A method was developed for the determination of ten carbamate pesticide residues (aldicarb sulfoxide, aldicarb sulfone, methomyl, 3-hydroxycobudweiser, aldicarb, metolcarb, carbofuran, carbaryl, isoprocarb, fenobucarb) by high performance liquid chromatography with deep eutectic solvent as extraction in matrix dispersion solid phase microextraction. N-hexyl alcohol was used as hydrogen bond donor and tetrabutylammonium chloride as hydrogen bond acceptor to form hypoeutectic solvents. The samples were dispersed by deep eutectic solvents-neutral alumina as substrate, and then extracted by acetonitrile with gradient elution in methanol-0.1% formic acid solution as mobile phase, and optimized at ODS-C18(4.6 mm×250 mm, 2.5 μm) on a column. Variable wavelength program was set and liquid chromatography UV detector was used to achieve the complete separation of 10 kinds of pesticides at one time. The results showed that the separation effect of the 10 kinds of targets was good, and the corresponding correlation coefficient was ≥0.9991 in the linear range. The detection limit of the method was 0.005-0.023 mg/kg, the limit of quantification 0.015-0.069 mg/kg, the recoveries from 83.6% to 103.9% in the concentration range of 0.1-1.0 mg/kg, and the relative standard deviations from 0.9% to 4.8%.
Keywords deep eutectic solvents; solid phase microextraction; carbamate; high performance liquid chromatography; cereal grains
基金项目:海关总署科研项目(2020HK217),国家自然科学基金项目(21905030)
第一作者:张鑫鑫(1983—),女,汉族,山西高平人,硕士,高级工程师,主要从事进出口食品、农产品等检验工作,E-mail: 449315829@qq.com
1. 太原海关技术中心 太原 030000
2. 长治学院 长治 046000
1. Taiyuan Customs Technical Center, Taiyuan 030000
2. Changzhi College, Changzhi 046000
氨基甲酸酯类农药是一种新型有机合成农药,不仅药效高、作用快,且毒性较低、选择性强、易于分解,是农业、牧业和林业领域常用的农药制剂,可作为杀虫、杀螨、除草剂使用,还可有效弥补部分有机氯和有机磷农药毒性大且不易降解的不足[1]。目前农业上使用量较大的主要有速灭威、甲萘威、涕灭威、克百威、异丙威等农药,其降解后产生氨基甲酸会自动分解为二氧化碳和氨,相对比较环保[2]。然而,氨基甲酸酯农药如若使用不规范或过量使用,一旦通过呼吸道、消化道或皮肤吸收进入人体,则会引起中毒,对环境也会造成污染[3],因此加强对该类农药的监测很有必要。由于氨基甲酸酯类农药极不稳定,一般不采用气相色谱法进行检测。近几年,液相色谱-质谱联用技术比较成熟[4-6],尤其对同一类型农药检测时能达到一次性高效分离、定性定量。但随着质谱技术应用的广泛推广,也渐渐显现出诸多弊端,例如:样品种类繁多,前处理技术难于通用;质谱信号灵敏,基质效应严重;仪器造价高,耗材成本高;前处理步骤繁琐、有机试剂损耗较多等。
绿色分析技术是近年来逐渐兴起的一种检测技术[7],主要是在传统分析技术基础上,应用新型合成材料绿色环保、节能高效的特性对样品前处理方法进行优化。目前,分子印迹聚合物[8]、金属有机骨架化合物[9]、离子液体[10]、磁性材料[11]等新型材料逐渐被人们认知和研究,但也存在材料合成成本较高,开发研究投入较大,对实验室人员、环境要求较高等问题,因此难以达到广泛应用。比较而言,低共熔溶剂(deep eutectic solvents,DESs)作为绿色溶剂的一种,其物理化学性质与离子液体类似,具有制备简单、环境友好、成本低廉、可生物降解、损失较小等优点,可将其应用于对样品中目标物的萃取分离。Guízar等 [12]开发了一种天然低共熔溶剂(NADES)用于从香草豆荚中提取香兰素,不仅提取效率高于乙醇等有机物,同时无毒、无挥发且用量少。Deng等[13]利用低共熔溶剂作为萃取剂,开发了可调液相微萃取(DT-LPME)系统,从液体和固体食品中提取多环芳烃(PAHs)并定量分析,结果满足应用要求。Nisaa等[14]建立了基于DES溶剂的乳化液液微萃取(ELLME)法测定环境水样中苯氧酸类除草剂。朱清等[15]利用低共熔溶剂萃取豆奶中三嗪类和苯脲类除草剂,效果良好。上述研究大多是对样品前处理方法的绿色改进,可进一步扩展萃取技术的应用范围。
本文将绿色溶剂-低共熔溶剂应用于基质分散固相萃取技术(matrix dispersion solid phase extraction,MSPD),对粮谷样品进行前处理,通过改变液相色谱紫外检测波长,设置梯度洗脱程序,在不配置荧光检测器和柱后衍生装置的条件下,实现10种农药一次性分离并定性定量分析,建立一种低共熔溶剂绿色微萃取技术测定粮谷中氨基甲酸酯类农药残留的方法。
1 实验部分
1.1 仪器与试剂
试剂及药品:甲醇、乙酸乙酯、正己烷、二氯甲烷、丙酮、乙腈(均为色谱纯,上海安谱实验科技股份有限公司);四丁基氯化铵(Tetrabutylammonium bromide,TBAC)、正己醇、正辛酸、正辛醇、正辛酸、十二醇、正葵酸(均为分析纯,上海阿拉丁生化科技股份有限公司);弗罗里硅土[60~100目,分析纯,西亚化学(科技)山东有限公司];中性氧化铝(100~200目,分析纯,天津市风船化学试剂科技有限公司);薄层层析硅胶(化学纯,青岛海洋化工厂分厂);C18键合硅胶、PSA填料[均为分析纯,Varian技术中国(北京)有限公司];10种农药标准溶液(涕灭威亚砜、涕灭威砜、灭多威、3-羟基克百威、涕灭威、速灭威、克百威、甲萘威、异丙威、仲丁威,浓度均为100 μg/mL,坛墨质检科技股份有限公司);实验用水为超纯水。
仪器:MS-TS电子天平(瑞士梅特勒-托利多公司);LC-20A液相色谱仪(配紫外可变波长检测器,日本岛津公司);Caution VM12固相萃取仪(天津博纳艾杰尔科技有限公司);N-EVAP112;氮吹仪(美国Organomation公司);Vortex-Genie 2型涡旋混合器(美国Scientific industrie公司);Options7超纯水机(英国LEGA公司)。
1.2 标准溶液配置
单标储备液:移取10种100 µg/mL农药标准溶液各10 mL,分别置于100 mL棕色容量瓶中,用甲醇稀释至刻度,定容,得到10种农药的浓度均为10.0 µg/mL的单标储备液,置于4℃冰箱中避光保存。
系列标准工作溶液配置:分别移取适量浓度为10.0 µg/mL的10种单标储备液置于100 mL容量瓶中,用流动相稀释至刻度,配置成浓度分别为0.02 µg/mL、0.05 µg/mL、0.10 µg/mL、0.20 µg/mL、0.50 µg/mL、1.00 µg/mL、2.00 µg/mL的混合标准工作溶液。
1.3 低共熔溶剂 DESs的制备
按照表1所示摩尔比,将氢键受体分别与不同的氢键供体混合于50 mL锥形瓶中充分混匀,然后置于60℃加热磁力搅拌器上不断搅拌至澄清透明的液体后,冷却,制备成6种不同的DESs试剂,避光保存待用。
表1 低共熔溶剂 DESs的合成
Table 1 Synthesis of deep eutectic solvent (DESs)
编号 | 氢键受体 | 氢键供体 | 摩尔比 |
DES-1 | 四丁基氯化铵 | 正己醇 | 1∶1 |
DES-2 | 四丁基氯化铵 | 正辛醇 | 1∶1 |
DES-3 | 四丁基氯化铵 | 十二醇 | 1∶1 |
DES-4 | 四丁基氯化铵 | 正己酸 | 1∶1 |
DES-5 | 四丁基氯化铵 | 正辛酸 | 1∶1 |
DES-6 | 四丁基氯化铵 | 正葵酸 | 1∶1 |
1.4 样品预处理
1.4.1 分散萃取
准确称取1.00 g样品于洁净的玻璃研钵中,加入2.00 g分散剂后研磨混匀至样品均匀分散,加入200 µL制备好的DESs试剂,继续研磨至均匀的半干状混合物,形成低共熔溶剂-基质分散固相萃取体系(DES-MSPD)。
1.4.2 净化洗脱
将上述半干状混合物全部转移至带筛板的固相萃取(SPE)小柱中,压实压平,选择合适的洗脱剂2 mL加入清洗研钵一并转入SPE小柱,再加入6 mL洗脱剂,收集全部洗脱液,氮吹仪吹干后,用流动相定容到0.5 mL,过0.22 µm有机相滤膜,滤液供高效液相色谱仪-紫外可变波长检测器(high performance liquid chromatography-UV variable wavelength detection,HPLC-UV)测定。
1.5 色谱条件
色谱柱:ODS-C18(250 mm×4.6 mm,5 µm);柱温:40℃;进样量:20 µL;流动相A:0.1%甲酸水溶液(v/v);流动相B:甲醇;流速:1.0 mL/min;梯度洗脱:0~7 min,由10% B线性增加至70% B;7~12 min,由70% B线性递增至90% B;12~20 min,70% B保持8 min;在0.01 min内降至10% B;20~30 min,10% B保持10 min。紫外可变波长检测器:波长可变程序,见表2。
表2 波长可变程序
Table 2 Wavelength variable program
时间 (min) | 波长 (nm) | 农药名称 |
0.01 | 245 | 涕灭威亚砜、涕灭威砜、灭多威 |
9.50 | 280 | 3-羟基克百威 |
10.61 | 245 | 涕灭威 |
11.41 | 254 | 速灭威 |
11.76 | 280 | 克百威、甲萘威 |
12.45 | 265 | 异丙威、仲丁威 |
13.51 | 245 | — |
2 结果和讨论
2.1 色谱条件优化
2.1.1 流动相选择
由相关文献及检测标准可知,氨基甲酸酯类农药检测可采用甲醇-水[16]、甲醇-乙腈-水[17]、乙腈-水[18]、甲醇-乙酸铵溶液[19]、乙腈-甲酸[20]等体系作为流动相。考虑到氨基甲酸酯类农药属于弱极性类物质,当选择极性较强的含有乙腈的流动相时,在紫外检测条件下,目标物不经过衍生会比较容易洗脱出来,导致出峰时间过早、分离效果较差;当选择甲醇-水作为流动相时,虽然出峰时间有所延迟,但由于甲醇活性较高,且在低波长区有紫外吸收,又可能会造成杂峰较多、峰形较差,灵敏度下降等问题。通过试验考察优化发现,当流动相为甲醇-0.1%甲酸水溶液(v/v)时,通过改变流动相的pH值,有效改善了峰形,解决了以上问题,具体出峰情况如图1所示。
2.1.2 检测器的选择与优化
大多数研究[21-22]选择柱后衍生-荧光检测器对氨基甲酸酯类农药残留进行液相色谱检测,这主要源于氨基甲酸酯类物质易分解,且其代谢产物衍生化后荧光性能更强的特性。然而在较多的粮谷企业实验室,液相色谱仪的配置大多仅有适用范围较广的紫外检测器,缺乏荧光检测器和配套的衍生装置。为更好地解决这一问题,已有一些研究采用紫外检测器-液相色谱法对氨基甲酸酯进行检测[23-24]。本研究通过对10种农残标准溶液进行最佳吸收波长的选择,确定每种目标物的检测波长,并设置如表2所示紫外可变波长程序,来满足紫外检测器同时测定多种农药的要求。
2.2 前处理过程优化
选择玉米粉作为空白基质样品,向不含目标物的样品中加入10种氨基甲酸酯类农药残留混合标准溶液,配置成浓度为1.0 mg/kg水平的加标样品,对本方法的前处理条件进行逐一优化。优化后所得色谱图如图2、图3所示。
2.2.1 绿色溶剂DESs的选择及用量
根据“选择性分子间作用力”的基本观点,选择具有较强氢键作用力的低共熔溶剂对氨基甲酸酯类农药进行选择性萃取分离。考察表1中6种DESs试剂的萃取效率,结果表明:与DES-1、DES-2、DES-3相比,DES-4、DES-5、DES-6出峰较多且分离效果不佳,还会造成目标物假阳性,这可能是由于酸类物质含羰基(-COOH),可产生n-可共轭效应,使其在低波长区有较多的紫外吸收,从而造成多峰现象[25]。如选择醇类物质作为氢键供体合成DESs试剂进行萃取试验,其目标物色谱图基线平稳,杂峰较少,还可有效改善目标物峰1(涕灭威亚砜)的峰分裂现象,具体如图4所示。
考察DES-1、DES-2、DES-3 3种不同低共熔溶剂的萃取效率,如图5所示。以正辛醇为氢键供体,四丁基氯化铵为氢键受体而组成的DES-2,与DES-1、DES-3相比,目标物峰面积较大,且基线平稳,分离良好,可作为DESs试剂用于下一步试验。另外,由于DESs本身黏度较一般溶剂大,若用量过多会影响进样量的准确性。通过逐级增加方式进行DESs用量考察试验,发现将DESs用量增至200 µL时,即可在不影响进样的情况下达到较好的萃取效果。
2.2.2 分散剂的选择及用量
在基质分散固相萃取技术中,选择合适的分散剂可实现对样品结构的完全破坏和高度分散,从而增强萃取剂与目标分子的接触面积,达到快速固相萃取的目的[26]。考察中性氧化铝(Al2O3)、弗洛里硅土(Florisi)、薄层硅胶与所选DESs试剂组成的3种不同的DES-MSPD体系,结果见表3。
表3 不同萃取体系对10种农药残留的萃取效率
Table 3 Extraction efficiency of 10 pesticide residues with different extraction systems
目标物 | 回收率 (%) | ||
DES-Al2O3 | DES-Florisi | DES-薄层硅胶 | |
涕灭威亚砜 | 98.9 | 97.9 | 90.2 |
涕灭威砜 | 84.7 | 84.9 | 80.6 |
灭多威 | 95.9 | 96.7 | 92.7 |
3-羟基克百威 | 96.8 | 97.4 | 86.1 |
涕灭威 | 95.4 | 94.9 | 84.3 |
速灭威 | 92.0 | 91.6 | 81.5 |
克百威 | 96.8 | 95.9 | 85.9 |
甲萘威 | 96.7 | 97.5 | 87.6 |
异丙威 | 90.6 | 93.0 | 81.4 |
仲丁威 | 89.5 | 90.6 | 80.5 |
结果表明:3种体系对目标物的分散萃取回收率均可达80%以上,但中性氧化铝、弗洛里硅土略优于薄层硅胶,这可能是因为硅胶本身键合特性易受基质酸碱度影响所致;中性氧化铝可有效吸附粮谷样品所富含的小分子物质,可更有效地除去试样中杂质,因此选择中性氧化铝为本方法分散剂[27]。为防止其吸附能力太强,农残组分的不易淋洗分离,试验前要对中性氧化铝进行加水去活化处理,3种分散剂与低共熔溶剂相结合的MSPD方法回收率见表3。
一般来说,样品与分散剂的比例对MSPD的影响不大,通常按照样品与分散剂质量比为1:4进行试验,但若分散剂用量过大,加入DESs试剂后分散面积较大,也会影响到萃取效率。考察样品与分散剂质量之比为1:1、1:2、1:3时的萃取效率,发现当样品与分散剂之比为1:2时即可获得较高回收率,继续加大分散剂用量时,回收率反而降低。因此,选择样品与分散剂质量之比为1:2。
2.2.3 洗脱剂的选择及用量
依据相关文献,对比乙腈[28]、丙酮-二氯甲烷(1:1)[16]、甲醇-二氯甲烷(5:95)[17]3种不同洗脱剂,对固相萃取体系进行洗脱,回收率结果对比如图6所示。
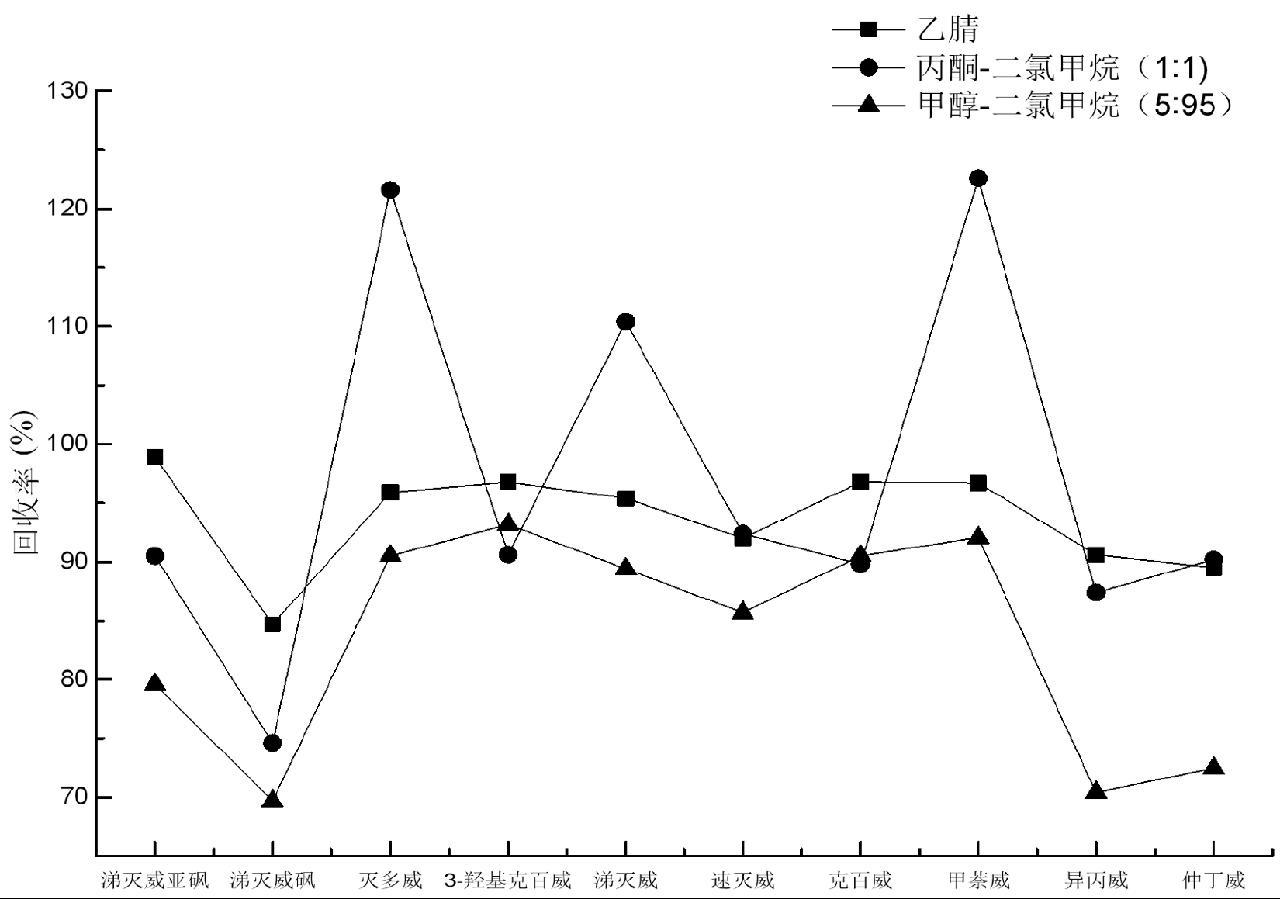
图6 不同洗脱剂的洗脱效率对比
Fig.6 Comparison of elution efficiency of different eluents
结果表明:丙酮-二氯甲烷(1:1)洗脱能力最强,但灭多威、涕灭威、甲萘威3种目标物存在一定假阳性,影响农药的准确定量;乙腈洗脱能力次之;甲醇-二氯甲烷(5:95)洗脱能力最弱,尤其是滴灭威砜、异丙威、仲丁威3种目标物回收率低至70%左右。因此,选择乙腈作为本方法洗脱剂。另外,考察乙腈洗脱体积为2 mL、4 mL、6 mL、8 mL时目标物的洗脱效率,发现当洗脱体积为6 mL时,各目标物的回收率达最高点且继续增加将不再改变,因此选择洗脱剂乙腈的体积为6 mL。
2.3 方法的线性范围和检出限
以目标物峰面积为纵坐标,以对应目标物浓度为横坐标,绘制标准工作曲线,得出线性回归方程、线性相关系数、检出限(以信号与噪声比值S/N≥3计算)、定量限(以信号与噪声比值S/N≥10计算),结果见表4。
由表4可知,10种氨基甲酸酯农药残留的峰面积与质量浓度在各自浓度范围内线性关系良好,相关系数均在0.9991~0.9998之间,检出限在0.005~0.023 mg/kg范围之内,定量限在0.015~0.069 mg/kg之间。
2.4 方法的回收率和精密度
选择不含氨基甲酸酯农药的玉米粉样品,加入混合标准溶液配置成各目标物质量浓度分别为0.10 mg/L、0.20 mg/L、1.00 mg/L的加标样品,按方法“1.5”所述进行前处理后,测定其平均回收率和精密度,结果见表5。
由表5可知:10种氨基甲酸酯类农药的回收率均在83.6%~103.9%之间,相对标准偏差(RSD)均小于5.0%,表明优化后的检测方法结果稳定、准确,重现性良好。
2.5 实际样品方法对比
国内外研究表明[29],对粮谷中氨基甲酸酯类农药进行基质分散固相萃取(MSPD)时,一般采用C18、PSA等作为填料的商业化小柱,实现分散净化的一次性进行。本方法将低共熔溶剂与无键合基团的分散剂相结合,利用氢键作用实现对目标物的分散净化。为保证其可行性,选择长治地区特色粮谷样品(小米、玉米面、小麦粉)制成质量浓度为1.0 mg/kg的加标样品,采用本方法与2种功能性分散剂(C18、PSA)进行回收率试验对比,结果发现:经PSA处理后的试样色谱峰在涕灭威目标物出峰时有较严重的杂质干扰,会造成假阳性现象,影响目标物的准确定量;而经C18处理后试样色谱峰与本方法色谱峰基本相似,回收率均达到90%以上,说明该方法不仅定量准确,且成本环保节约,可应用于一般粮谷中氨基甲酸酯类农药的快速检测。
3 结论
将新型绿色溶剂-低共熔溶剂与基质分散固相萃取技术相结合,采用紫外可变波长检测程序,建立绿色溶剂微萃取-高效液相色谱检测技术测定粮谷中的10种氨基甲酸酯类农药残留的方法。该方法所需设备较易满足,耗材较为普遍,前处理简单、快速、环保、节能,可最大程度减少有机试剂的使用,且能实现10种农药残留的一次性定性定量检测。经方法验证,在0.1~1.0 mg/kg范围内进行回收试验,添加回收率在83.6%~103.9%之间,相对标准偏差在0.9%~4.8%之间,方法检出限在0.005~0.023 mg/kg之间,定量限在0.015~0.069 mg/kg之间,能满足实际检测工作中氨基甲酸酯类农药残留的限量及其他要求,可用于日常检测。
参考文献
[1]曾凡夫, 段燕英. 氨基甲酸酯类农药生殖毒性及其机制研究进展[J]. 卫生研究, 2016, 45(1): 159-162.
[2] 黄会, 刘慧慧, 王共明, 等. 氨基甲酸酯类杀虫剂的毒性、检测方法及其在水环境中残留研究进展[J]. 中国渔业质量与标准, 2016, 6(4): 23-30.
[3] 尹晓明, 李学林. 环境样品氨基甲酸酯类农药的分离和检测技术研究进展[J]. 土壤, 2020, 52(5): 901-910.
[4] 张振山, 乐渊, 黎舒怀, 等. QuEChERS-超高效液相色谱-串联质谱法检测中药砂仁中10种氨基甲酸酯类农药残留[J]. 安徽农业科学, 2021, 49(1): 199-202+206.
[5] 洪晓峰. 超高效液相色谱串联质谱法测定白茶中6种氨基甲酸酯类农药残留[J]. 现代农机, 2020(6): 24-26.
[6] 薛荣旋, 黄诚, 温伊蕾, 等. QuEChERS-高效液相色谱-串联质谱法测定牛奶中氨基甲酸酯类农药残留量[J]. 食品安全质量检测学报, 2021, 12(1): 187-191.
[7] 王欢, 韩硕, 吴享文. 绿色分析检测技术在食品检验中的应用研究[J]. 现代食品, 2020(7): 123-125.
[8] 何建雄, 潘浣钰,闵曼. 分子印迹聚合物用于检测黄曲霉毒素的研究进展[J].山东化工, 2021, 50(23): 68-70+73.
[9] 袁泉, 王亚伦, 顾田瑜, 等. 金属有机骨架化合物吸附水中重金属研究进展[J]. 山东化工, 2021, 50(11): 58-59+61.
[10] Xiaoping Yu, Jinjie Cui, Chenglong Liu, et al. Separation of magnesium from high Mg/Li ratio brine by extraction with an organic system containing ionic liquid[J]. Chemical Engineering Science, 2021, 229: 116019.
[11] 巩一潮. 功能化磁性材料的制备及其对环境水和食品中双酚类内分泌干扰物的吸附研究[D]. 保定: 河北大学, 2021.
[12] González Cecilia Guízar, Mustafa Natali Rianika,Wilson Erica Georgina, et al. Application of natural deep eutectic solvents for the “green” extraction of vanillin from vanilla pods[J]. Flavour and Fragrance Journal, 2017, 33(1): 91-96.
[13] Deng Wenwen, Huang Anqi, Zheng Qutong, et al. A density-tunable liquid-phase microextraction system based on deep eutectic solvents for the determination of polycyclic aromatic hydrocarbons in tea, medicinal herbs and liquid foods[J]. Food Chemistry, 2021, 352: 129331.
[14] Mohamad Yusoff Nur ‘An Nisaa, Rahim Nurul Yani, Mohammad Rania Edrees Adam. Deep eutectic solvent-based emulsification liquid-liquid microextraction for the analysis of phenoxy acid herbicides in paddy field water samples[J]. Royal Society Open Science, 2021, 8(3): 202061.
[15] 朱清, 龙冰华, 陈星航, 等. 疏水性低共熔溶剂液液微萃取/高效液相色谱法测定豆奶中三嗪类和苯脲类除草剂[J]. 分析测试学报, 2021, 40(10): 1467-1473.
[16] 王敏, 李广益, 宋丰江, 等. 高效液相色谱法测定蔬菜中氨基甲酸酯类农药[J]. 食品研究与开发, 2018, 39(1): 122-125.
[17] 何家国, 杜鑫, 易珊珊, 等. 高效液相色谱-柱后衍生荧光法同时检测粮食中8种氨基甲酸酯类农药[J]. 云南师范大学学报(自然科学版), 2021, 41(3): 50-56.
[18] 郭新颖, 顾俊, 陈峰, 等. 高效液相色谱法测定中药材氨基甲酸酯类农药残留[J]. 农药, 2019, 58(5): 353-355.
[19] 李娜, 刘磊, 邵辉, 等. 超高效液相色谱-串联质谱法测定中草药中氨基甲酸酯类农药残留量[J]. 药物分析杂志, 2011, 31(12): 2266-2272.
[20] 张艳, 陈国, 吴银良. 固相萃取-液相色谱串联质谱法测定鸡蛋中16种氨基甲酸酯类杀虫剂残留量[J]. 食品安全质量检测学报, 2020, 11(6): 1728-1735.
[21] 魏良胜. 高效液相色谱-柱后衍生荧光光谱法测定蔬菜和水果中6种N-甲基氨基甲酸酯类农药[J]. 现代农业科技, 2018(14): 121+128.
[22] 王晓亮, 毛卫中, 汪新华, 等. QuEchERs-高效液相色谱柱后衍生法测定茶叶中10种氨基甲酸酯类农药残留[J] . 食品工业科技, 2018, 39(14): 190-193.
[23] 董祥芝, 张慧芬, 同帜. 基质分散固相萃取-高效液相色谱检测黄瓜中涕灭威和异丙威的农药残留[J]. 食品工业科技, 2013, 34(11): 310-312.
[24] 文君, 孙成均, 缪红, 等. 高效液相色谱法同时测定蔬菜中5种氨基甲酸酯类农药[J]. 中国卫生检验杂志, 2007(6): 964-965+985.
[25] 武晓霞. π-共轭结构增强紫外吸收和荧光及其分析应用研究[D]. 北京: 北京化工大学, 2019.
[26] 张倩. 基质固相分散技术在蔬菜农药多残留分析中的应用研究[D]. 泰安: 山东农业大学, 2007.
[27] 王榕树, 李海明, 冯为. 活性氧化铝/硅胶吸附剂对环境水体的脱氟行为研究及应用初探[J]. 环境科学学报, 1992(3): 333-340.
[28] 郭新颖, 顾俊, 陈峰, 等.高效液相色谱法测定中药材氨基甲酸酯类农药残留[J]. 农药, 2019, 58(5): 353-355.
[29] Muccio A D, Barbini D A, Generali T, et al. Clean-up of aqueous acetone vegetable extracts by solid matrix partition for pyrethroid residue determination by gas chromatography electroncapture detection[J]. Chromatography A, 1997, 765: 39-49.







