CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
DART-MS/MS快速筛查畜肉中氯霉素残留的应用研究
作者:解迎双 王新潮 刘兰霞 张欢 白兴斌 寇宗红 王波
解迎双 王新潮 刘兰霞 张欢 白兴斌 寇宗红 王波
Abstract A combined method of multi-plug filtration cleanup and real-time direct analysis-tandem mass spectrometry (DART-MS/MS) was developed to determinate chloramphenicol in livestock meat. With the method, the livestock meat samples were purified by multiplug filtration clean-up pretreatment technology with helium as the carrier gas and nitrogen as the auxiliary gas. The ionization temperature was 350℃ and the sample injection speed was 0.6 mm/s. The sample was directly injected and analyzed in the negative ion mode using a triple quadrupole mass spectrometer. The results showed that the method could be used for the rapid determination of chloramphenicol in pork, mutton and beef, with the detection limit of 0.1 μg/kg and the recovery of 85%-108%. The experiment compared DART-MS/MS method with the national standard GB 31658.2-2021 in the determination of actual samples. It turned out that not only the test results of DART-MS/MS were basically consistent with those of the national standard, but also the whole detection time was shortened by nearly 40%. Therefore, the method has the advantages of fast detection speed, low solvent consumption and accurate detection data, which can meet the requirements of rapid screening and analysis of chloramphenicol residues in pork, mutton and beef.
Keywords real-time direct analysis (DART); chloramphenicol (CAP); rapid screening; application
畜肉营养丰富,富含优质的蛋白质、氨基酸等人体需要的重要营养物质。我国人口基数较大,对畜肉的需求量高。据2022年1—6月海关总署数据统计,在我国进出口贸易中,占比较大的畜肉产品主要有猪肉、羊肉、牛肉。其中猪肉的进出口量为62万t、羊肉的进出口量为81万t、牛肉的进出口量为197万t。氯霉素作为一类广谱性抗生素,因其是治疗厌氧菌感染的特效药物之一且价格便宜,因此成为兽药分析中最常见的残留类别[1-2]。长期食用含有氯霉素残留的畜肉会使人体产生耐药菌株,降低人体免疫力,从而给消费者带来较大的健康隐患[3-4]。世界各国已相继出台一系列法规条例,禁止在动物源性食品中检出氯霉素,我国在农业农村部第250号公告中规定了动物源性食品中禁止使用氯霉素及其盐、酯类化合物。近几年间,氯霉素也一直被海关列为风险监控计划中的重点监测项目,随着畜肉进出口量的增加,实验室的检测样品量也逐年增加。因此,建立氯霉素残留的快速检测分析方法有利于减少检测样本量,提高日常检测分析通量,提升风险监测的效能,完善畜肉产品质量安全控制的技术支持体系。
随着国内外检测技术的不断发展,目前氯霉素残留的样品预处理和仪器检测手段越来越多,前处理手段除了传统的液液萃取(Liquid-liquid extraction)、固相萃取(Solid phase extraction)外,近几年出现了许多新的前处理方法,如多壁碳纳米管法(Multi-wall carbon nanotubes method)、超声辅助分散液液微萃取法(Ultrasonic-assisted dispersive liquid-liquid microextraction)、QuEChERS法、快速滤过柱净化法等[5]。其中,滤过型净化技术因其操作简便、重现性好、试剂消耗量少,逐步成为样品预处理过程的发展趋势[6]。
实时直接分析离子源以其原位、快速、无损、绿色等特点,广泛应用于药物研发与监管[7]、食品分析[8]、天然产物解析[9]、环境监测[10]、化妆品监测[11]等领域。本实验充分利用实时直接分析离子源可在大气压和开放式实验环境中,无需对目标化合物进行冗长的色谱分离且无需消耗流动相等试剂就可以进行检测的优势[12-14],拟将实时直接分析离子源与三重四级杆质谱仪联用,快速检测畜肉中氯霉素残留,并对分析条件进行优化,以期建立氯霉素残留的快速检测方法。
1 实验部分
1.1 仪器与装置
实时直接分析(DART)离子源:美国Ion Sense公司;分析天平,德国Sartorius公司;涡旋混匀仪,广东逗点公司;低温冷冻高速离心机,美国Sigma公司;移液枪,德国Eppendorf公司。
1.2 材料与试剂
氯霉素标准品(纯度98%),德国Dr.Ehrenstorfer公司;乙腈(色谱纯),德国默克公司;甲酸(色谱纯),德国默克公司;无水硫酸镁(分析纯),上海国药集团化学试剂有限公司;无水氯化钠(分析纯),上海国药集团化学试剂有限公司;HLB固相萃取柱(500 mg、3 mL),沃特世上海有限责任公司;Sin-QuEChERS Nano快速滤过柱,北京绿绵公司;考核盲样(P35027C,7.20 μg/kg,P35028C,3.20 μg/kg),广州谱恩科学仪器有限公司。
1.3 样品、来源及其制备
畜肉样品(本实验的畜肉样品包括猪肉、牛肉、羊肉)来源于兰州市各大综超、市场、客户送检样品以及考核盲样。
本研究将猪肉、牛肉、羊肉样品经样品粉碎机粉碎后,保存于-18℃环境下备用。
1.4 标准溶液配制
1.4.1 标准储备液的配制
称取氯霉素标准品0.0102 g(精确至0.0001 g)于100 mL容量瓶中,用乙腈溶解并定容,得到浓度为100 μg/mL的标准储备液,-18℃可保存6个月。
1.4.2 标准工作溶液的配制
移取1.4.1的标准储备液1.00 mL于100 mL容量瓶中,用乙腈定容,得到浓度为1 μg/mL的标准工作溶液,-18℃可保存1个月。
1.5 实验条件
1.5.1 DART离子源条件
离子源模式:负离子模式;离子化气体:氦气;离子化温度:350℃;进样速度:4 mm/s;进样模块:筛网模块;真空泵压力:-70 kPa。
1.5.2 质谱条件
采样模式:多反应动态监测模式(MRM);锥孔电压:30 V;脱溶剂气温度:110℃;脱溶剂气压力:0 Psi;碰撞气:氩气。氯霉素的质谱参数见表1。
1.5.3 样品预处理方法
称取制备好的猪肉、羊肉、牛肉样品各2.00 g(±0.01 g)分别置于50 mL离心管中,加4 mL水溶解,涡旋1 min。加入1%乙酸乙腈(V/V,1:100)10 mL,涡旋振荡3 min,加入3.00 g无水硫酸镁和1.50 g无水氯化钠,超声提取10 min,以13000 r/min离心5 min,移取全部上清液置于另一50 mL离心管中,将Sin-QuEChERS Nano快速滤过柱垂直放入带有样液的离心管中向下按压,液体透过防水隔膜向上溶出,取出滤液浓缩净干后,用1 mL乙腈-水溶(V/V,8:2)定容,待测。
表1 氯霉素特征碎片离子及其质谱参数
Table 1 Characteristic fragment ions and mass spectrum parameters of CAP
化合物名称 | (m/z) | (m/z) | (eV) | (V) |
氯霉素 | 320.8 | 151.9 | 30 | 15 |
256.9 | 21 |
1.5.4 样液测定
准确吸取10 μL待测液,将其点样置于筛网模块的点样孔中间位置,待样液晾干后将其垂直固定于DART离子源和三重四级杆质谱仪之间的进样轨道上进行检测。
2 结果与讨论
2.1 样品净化效果的比较
本实验采用HLB固相萃取柱、Sin-QuEChERS Nano快速滤过柱两种净化方式,对添加量为10 μg/kg的添加回收样品平行6次净化试验,以回收率、操作步骤、溶剂消耗量、净化时间4个指标对净化效果进行考察。由表2可知:采用HLB固相萃取柱进行净化时,平均回收率为92%,净化过程包括4个步骤,试剂消耗量为17 mL;采用Sin-QuEChERS Nano快速滤过柱进行净化时,平均回收率为103%,净化过程只有一步且无试剂消耗。综合分析,本研究选择Sin-QuEChERS Nano快速滤过柱进行净化。
2.2 离子化气体的选择
高纯度的氮气、氩气、氦气是DART离子源在进行离子化过程中的常用离子化气体,氦气的激发态离子能量为19.8(eV),高于氮气、氩气,采用氦气时离子化能量高、灵敏度较高,可较好地用于氯霉素的检测(图1),因此本实验选择氦气作为载气。但是由于氦气价格比较昂贵,DART离子源的样品采集速度较快,待机时间较长,因此选用氮气为待机时的使用载气。

图1 不同气体类型作为离子化气体时氯霉素的响应图
Fig.1 Response diagram of CAP with different types of gas as ionized gas
2.3 离子化温度的选择
在DART离子源进行离子化过程中,离子化温度是影响检测灵敏度的主要参数之一,离子化温度过高或过低都会影响目标化合物的离子化效果,从而影响检测灵敏度。本实验选用8 μg/L的氯霉素标准溶液分别对250℃、300℃、350℃、400℃、450℃共5个温度梯度进行优化。每个温度点平行进样6次,以6次TIC谱图的峰面积平均值作为优化判定指标。由图2可以看出,氯霉素标准溶液在离子化温度为350℃和400℃时响应较好,综合设备的节约利用考虑,最终选择最优的实验条件为350℃。
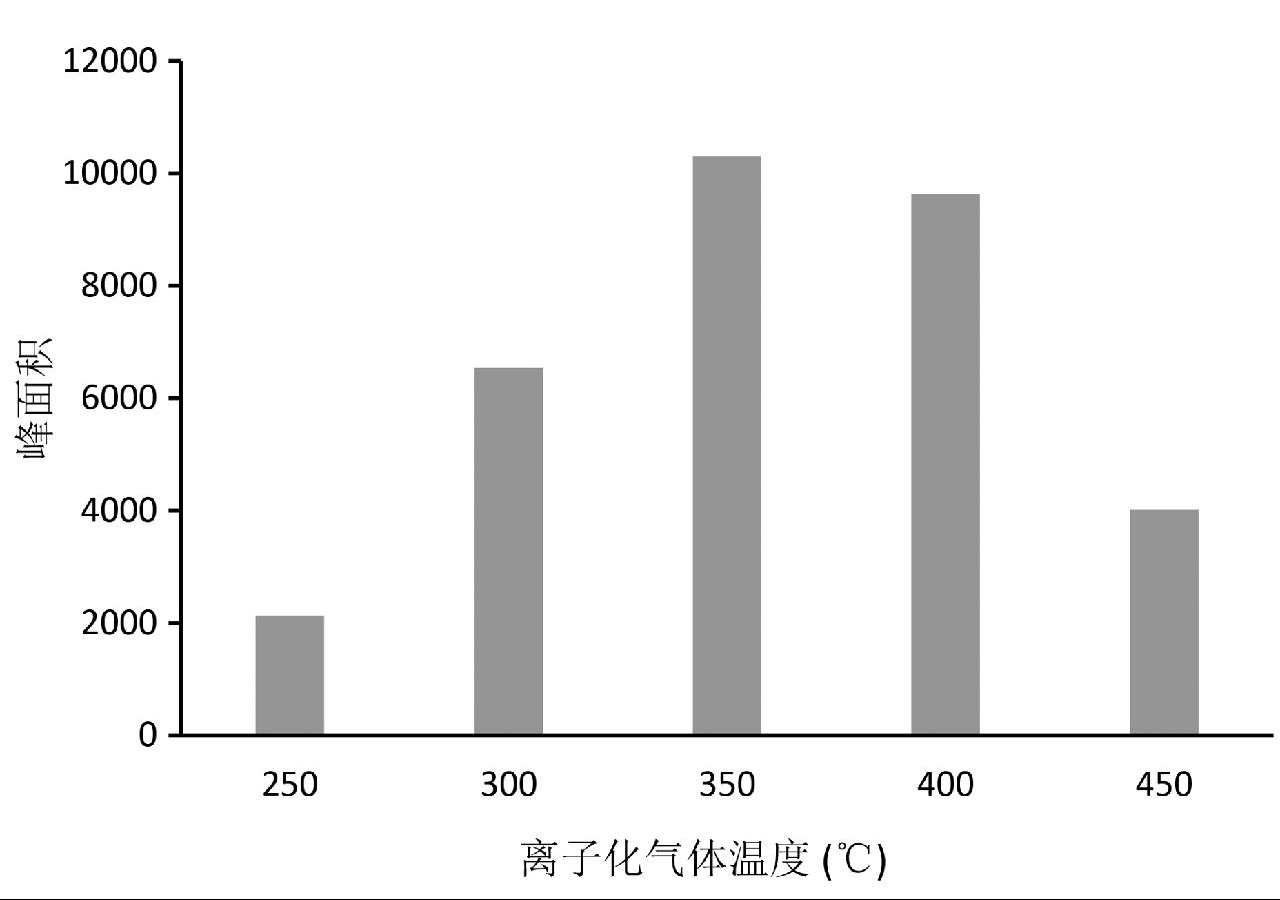
图2 不同离子化温度条件下氯霉素峰面积响应示意图
Fig.2 Sketch of peak area response of CAP at different ionization temperatures
2.4 进样模块及进样速度的选择
DART离子源的进样模块有多种,其中适合液体检测的采样模块有TIP头模块和筛网模块。相比TIP头采样模块,筛网模块的重复性和稳定性更好,定量更准确,因此本研究选择筛网模块作为进样模块。
进样速度的快慢影响目标化合物的离子化时间,离子化时间过长或过短都会影响目标化合物的灵敏度。本实验选用1 μg/L的氯霉素标准溶液分别考察了进样速度为0.2 mm/s、0.4 mm/s、0.6 mm/s、0.8 mm/s、1.0 mm/s时的离子化效果。通过对1 μg/L的氯霉素标准溶液总离子流图峰面积分析可知,进样速度过快时,目标化合物在离子化区域的停留时间过短,影响检测灵敏度,如图3所示。当进样速度过慢时,目标化合物的质谱峰的峰型会出现不同程度的拖尾、双峰、多峰情况。本实验通过优化,最终选择0.6 mm/s为最优进样速度。
3 方法学验证
3.1 方法检出限和定量限
将100 μg/L氯霉素标准溶液100 μL准确加入粉碎后的空白猪肉、牛肉、羊肉样品中,然后进行均质,按照1.5 实验条件的方法进行处理并分析。以定量离子色谱峰的信噪比S/N>3来确定方法的检出限,S/N>10时确定方法的定量限,结果显示(图4),本实验的猪肉、牛肉、羊肉样品的方法检出限均为0.1 μg/kg,定量限均为0.4 μg/kg。
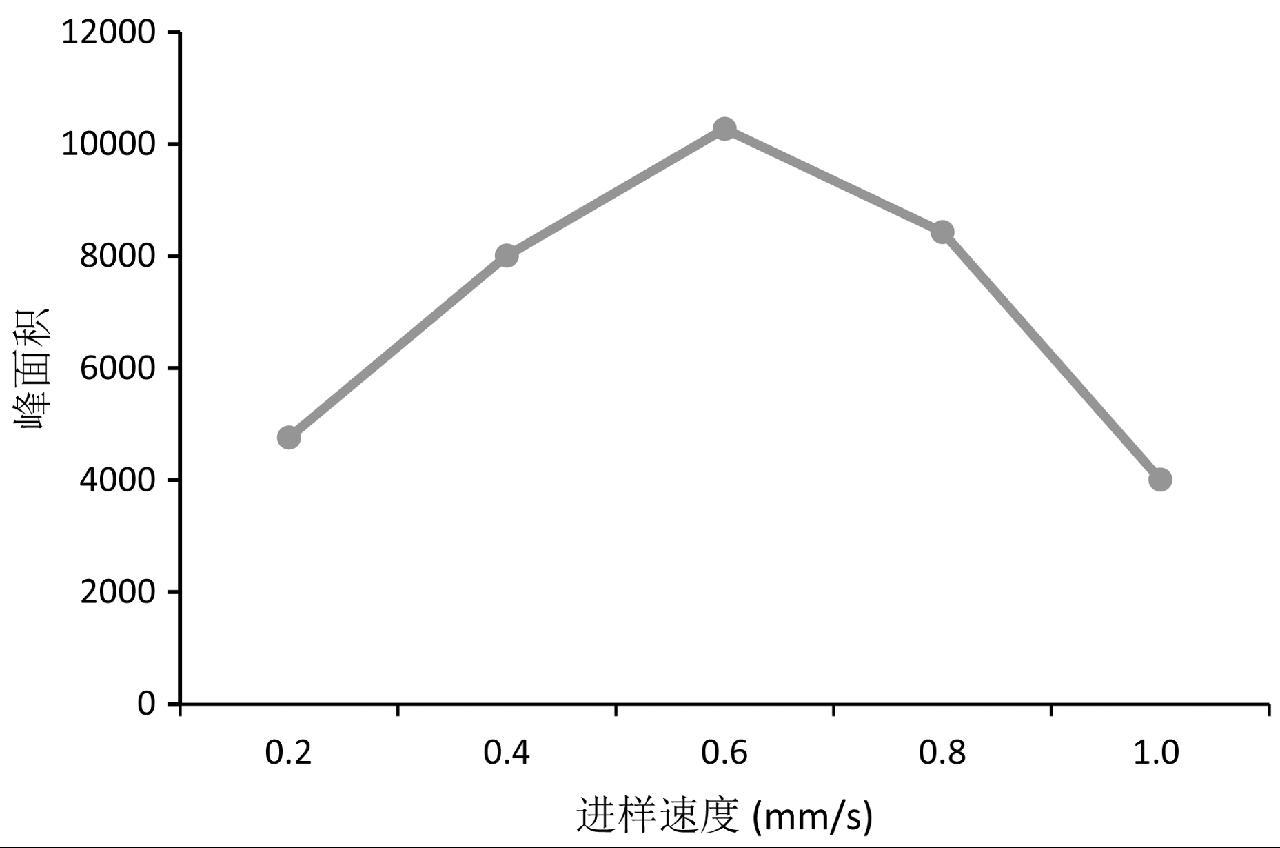
图3 不同进样速度条件下氯霉素峰面积响应示意图
Fig.3 Sketch of peak area response of CAP at different injection rates
3.2 方法的线性实验
将1.4.2中的标准工作液,用乙腈水溶液(V/V,8:2)稀释至浓度为0.4 μg/L、1.0 μg/L、5.0 μg/L、8.0 μg/L、10.0 μg/L的标准溶液梯度,每个浓度平行进样6针,以氯霉素的质量浓度(x,μg/L)为横坐标、氯霉素的定量离子峰面积(y)为纵坐标,线性回归方程及相关系数见表3。由表3可知,本实验的氯霉素在0.4~10 μg/L范围内线性良好。
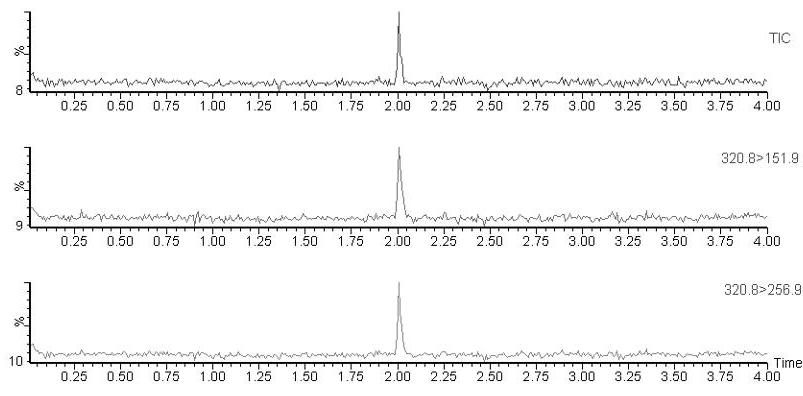
图4 DART-MS/MS条件下氯霉素最小检出限(0.1 μg/kg)MRM谱图
Fig.4 MRM spectrum of LOD CAP (0.1 μg/kg) by DART-MS/MS
3.3 回收率实验与相对标准偏差实验
选取空白猪肉、牛肉、羊肉样品,针对3个基质的样品进行加标回收实验,加标水平分别为0.4 μg/kg、1.0 μg/kg、5.0 μg/kg、8.0 μg/kg、10.0 μg/kg,每个样品平行测定6次,得到本实验的添加回收率和相对标准偏差(RSD),见表3。由表3可知,猪肉、牛肉、羊肉样品的回收率在85%~102%之间,相对标准偏差(RSD)在1.20%~6.32%之间,符合方法学考察的要求。
3.4 稳定性实验
选取猪肉、羊肉、牛肉的空白样品,添加氯霉素浓度为10 μg/kg,按照1.5实验条件进行样品处理。将供试液分别在0 h、2 h、4 h、8 h、16 h、24 h按照1.5.1 DART离子源条件、1.5.2 质谱条件进样分析,每一样品每一时间段平行采集6次。不同基质中氯霉素定量离子的峰面积RSD为3.30%~4.29%,符合方法学考查的要求,见表4。
表4 氯霉素稳定性实验
Table 4 Stability test of CAP
样品名称 | 检测时间 (h) | 峰面积 | RSD (%) |
猪肉 | 0 | 99642 | 3.80 |
2 | 105240 | ||
4 | 98992 | ||
8 | 97620 | ||
16 | 106670 | ||
24 | 98443 | ||
羊肉 | 0 | 98452 | 4.29 |
2 | 98776 | ||
4 | 108820 | ||
8 | 96998 | ||
16 | 99712 | ||
24 | 98632 | ||
牛肉 | 0 | 103250 | 3.30 |
2 | 104460 | ||
4 | 108820 | ||
8 | 99864 | ||
16 | 102280 | ||
24 | 99788 |
3.5 定性分析指标
本实验以氯霉素的准分子离子峰和两个碎片离子作为定性离子,以标准物质的碎片离子的丰度比作为定性分析指标,通过对浓度为1 μg/L的标准溶液平行采集6次,计算其丰度比,结果显示符合表5对定性确证时相对离子丰度最大允许值的要求。
表5 定性确证时相对离子丰度的最大偏差
Table 5 Maximum deviation of relative ion abundance for qualitative confirmation
相对离子丰度 (K) | 允许最大偏差 |
±20 | |
20<K<50 | ±25 |
10<K<20 | ±30 |
K<10 | ±50 |
3.6 基质效应
将粉碎并均质后的空白猪肉、牛肉、羊肉样品,按照1.5.3样品预处理方法进行处理制备样液。采用样液配置浓度梯度为0.4 μg/L、1.0 μg/L、5.0 μg/L、8.0 μg/L、10.0 μg/L的基质标准溶液,按照1.5 实验条件中的仪器条件进行检测,并根据浓度和峰面积绘制猪肉、牛肉、羊肉基质的线性曲线。按照基质效应的计算公式ME=(基质匹配标准溶液曲线斜率/无基质标准溶液曲线斜率-1)×100%计算本实验的基质效应,其中ME绝对值越大表明基质效应越强。结果显示:本实验氯霉素在猪肉样品中的基质效应为3.2%~6.2%;在牛肉样品中的基质效应为4.8%~7.2%;在羊肉样品中的基质效应为5.4%~6.8%。本实验在猪肉样品、牛肉样品、羊肉样品中的基质效应较小,可采用外标法定量。
4 实际样品测定
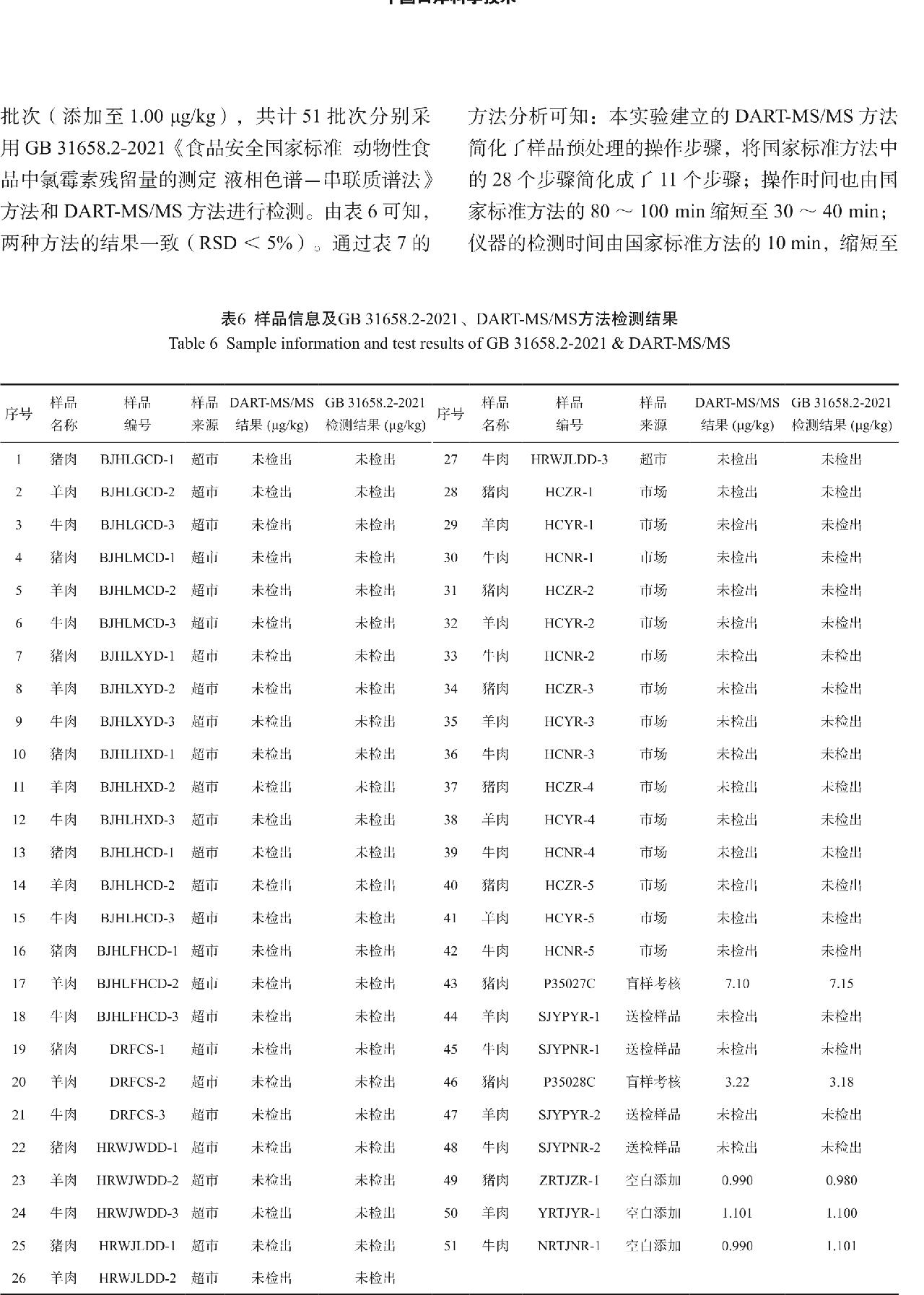
本实验选择从各大综超、市场购买以及客户送样的畜肉样品46批次,考核盲样2批次(P35027C:7.20 μg/kg;P35028C:3.20 μg/kg),空白添加3批次(添加至1.00 μg/kg),共计51批次分别采用GB 31658.2-2021《食品安全国家标准 动物性食品中氯霉素残留量的测定 液相色谱-串联质谱法》方法和DART-MS/MS方法进行检测。由表6可知,两种方法的结果一致(RSD<5%)。通过表7的方法分析可知:本实验建立的DART-MS/MS方法简化了样品预处理的操作步骤,将国家标准方法中的28个步骤简化成了11个步骤;操作时间也由国家标准方法的80~100 min缩短至30~40 min;仪器的检测时间由国家标准方法的10 min,缩短至1 min,因此本实验建立的DART-MS/MS方法具有提取过程简单、净化过程便捷、检测过程快速、实际消耗量小等特点。
5 结论
本实验建立了敞开式常压离子化技术-实时直接分析离子源结合三重四级杆质谱仪快速检测猪肉、羊肉、牛肉样品中氯霉素,通过优化实时直接分析离子源参数,结合Sin-QuEChERS快速滤过技术,有效实现了猪肉、羊肉、牛肉中氯霉素的快速、高通量检测。
本实验通过对方法学进行考察,证明该实验的方法检测、线性、精密度、回收率等关键指标能够满足快速检测分析要求。实际样品检测结果表明,该方法可有效完成猪肉、羊肉、牛肉中相关残留的风险监测分析。通过采用国家标准方法与本研究建立的检测方法对比发现,该方法具有提取过程简单、净化过程便捷、检测过程快速、试剂消耗量小等优点,可为风险监测实验室和相关行业机构提供一种快速可靠的检测分析手段。
参考文献
[1]王东鹏, 叶诚, 李小莎. Captiva EMR-Lipid固相萃取结合高效液相色谱-串联质谱法同时测定猪肉中氯霉素类药物残留量[J]. 食品安全质量检测学报, 2021, 12(19): 7660-7666.
[2]雷美康, 候建波, 彭芳, 等. 固相萃取-高效液相色谱-串联质谱法同时测定蜂蜡中氯霉素、甲砜氯霉素、氟苯尼考和其代谢产物氟苯尼考胺残留[J]. 食品工业科技, 2021, 42(17): 241-246.
[3]杨黎, 刘星, 廖夏云, 等. 高效液相色谱-串联质谱法同时测定蜂胶、蜂胶原料保健食品中的氯霉素、甲砜霉素与氟甲砜霉素[J]. 分析测试学报, 2020, 39(7): 887-893.
[4]许小炫, 苏晓娜, 谭庶, 等. 间接竞争化学发光酶联免疫分析方法检测禽肉中金刚烷胺和氯霉素残留[J]. 食品科学, 2021, 42(4): 305-312.
[5]高俊峰, 陈梦莹, 邵瑞, 等. 液质联用内标法测定饲料中氯霉素残留量的不确定度评估[J]. 粮食与饲料工业, 2022(2): 64-67.
[6]冯惠, 唐一秋. 不同前处理方法对鱼肉中氯霉素残留检测研究[J]. 食品安全导刊, 2022(9): 72-74.
[7]韩顺林. 高效液相色谱-串联质谱法测定猪肉中氯霉素残留量[J]. 食品安全导刊, 2022(6): 50-52.
[8]齐春艳, 黎欣欣, 张静, 等. 实时直接分析质谱法快速检测保健酒中非法添加的12种PDE5抑制剂[J]. 食品安全导刊, 2021(34): 83-86+90.
[9]齐春艳, 曾雪芳, 叶靖怡, 等. 实时直接分析-高分辨质谱法快速筛查凉茶中非法添加的21种解热镇痛类药物[J]. 食品安全质量检测学报, 2021, 12(21): 8451-8457.
[10]耿欣, 王新新, 李红丽. 实时直接分析质谱结合固相微萃取分析卷烟主流烟气粒相物[J]. 质谱学报, 2021, 42(4): 503-513.
[11]杨帆, 张璐琪, 张鸿伟, 等. 实时直接分析-高分辨质谱法快速筛查乳粉中抗生素残留[J]. 质谱学报, 2021, 42(6): 1014-1024.
[12]李先强, 闫志, 张玲, 等. 原位电离实时直接分析串联质谱法鉴别中药泽泻化学成分[J]. 化学分析计量, 2021, 30(3): 14-17.
[13]胡谦, 张九凯, 邢冉冉, 等. 实时直接分析-四极杆飞行时间质谱法快速鉴别油茶籽油真伪[J]. 分析测试学报, 2021, 40(2): 282-287+294.
[14]宫小明, 孔彩霞, 王炳军, 等. QuEChERS结合实时直接分析串联质谱法检测茶叶中的农药残留[J]. 食品安全质量检测学报, 2020, 11(23): 8775-8783.
表2 不同净化方式比较
Table 2 Comparison of different purification methods
净化方式 | 平均回收率 (%, n=6) | 净化步骤 | 平均净化时间 (min, n=6) | 试剂消耗量 (mL) |
固相萃取技术 | 92 | 活化、上样、淋洗、洗脱 | 30 | 17 |
快速滤过技术 | 103 | 将快速滤过柱向下按压完成净化 | 2 | 0 |
表3 氯霉素的检出限、定量限、回收率、精密度、线性回归方程(n=6)
Table 3 The LOQ, LDQ, recovery, precision and linear regression equation of CAP (n=6)
目标物 | 样品名称 | 检出限/定量限 (μg/kg) | 添加值 (μg/L) | 平均回收率 (%) | 线性回归方程 | 相关系数 | 精密度 (%) |
氯霉素 | 猪肉 | 0.1/0.4 | 0.4 | 85 | y=893.04x-111.81 | 0.9997 | 6.32 |
1.0 | 87 | 2.58 | |||||
5.0 | 102 | 2.21 | |||||
8.0 | 92 | 1.20 | |||||
10.0 | 96 | 4.66 | |||||
羊肉 | 0.1/0.4 | 0.4 | 86 | y=1294.6x+414.43 | 0.9992 | 5.23 | |
1.0 | 92 | 3.22 | |||||
5.0 | 98 | 2.68 | |||||
8.0 | 92 | 1.55 | |||||
10.0 | 96 | 4.63 | |||||
牛肉 | 0.1/0.4 | 0.4 | 101 | y=1261.5x+233.07 | 0.9993 | 3.11 | |
1.0 | 89 | 2.06 | |||||
5.0 | 101 | 2.71 | |||||
8.0 | 96 | 4.22 | |||||
10.0 | 94 | 4.23 |
表6 样品信息及GB 31658.2-2021、DART-MS/MS方法检测结果
Table 6 Sample information and test results of GB 31658.2-2021 & DART-MS/MS
序号 | 名称 | 编号 | 来源 | 结果 (μg/kg) | 检测结果 (μg/kg) | 序号 | 名称 | 编号 | 来源 | 结果 (μg/kg) | 检测结果 (μg/kg) |
1 | 猪肉 | BJHLGCD-1 | 超市 | 未检出 | 未检出 | 27 | 牛肉 | HRWJLDD-3 | 超市 | 未检出 | 未检出 |
2 | 羊肉 | BJHLGCD-2 | 超市 | 未检出 | 未检出 | 28 | 猪肉 | HCZR-1 | 市场 | 未检出 | 未检出 |
3 | 牛肉 | BJHLGCD-3 | 超市 | 未检出 | 未检出 | 29 | 羊肉 | HCYR-1 | 市场 | 未检出 | 未检出 |
4 | 猪肉 | BJHLMCD-1 | 超市 | 未检出 | 未检出 | 30 | 牛肉 | HCNR-1 | 市场 | 未检出 | 未检出 |
5 | 羊肉 | BJHLMCD-2 | 超市 | 未检出 | 未检出 | 31 | 猪肉 | HCZR-2 | 市场 | 未检出 | 未检出 |
6 | 牛肉 | BJHLMCD-3 | 超市 | 未检出 | 未检出 | 32 | 羊肉 | HCYR-2 | 市场 | 未检出 | 未检出 |
7 | 猪肉 | BJHLXYD-1 | 超市 | 未检出 | 未检出 | 33 | 牛肉 | HCNR-2 | 市场 | 未检出 | 未检出 |
8 | 羊肉 | BJHLXYD-2 | 超市 | 未检出 | 未检出 | 34 | 猪肉 | HCZR-3 | 市场 | 未检出 | 未检出 |
9 | 牛肉 | BJHLXYD-3 | 超市 | 未检出 | 未检出 | 35 | 羊肉 | HCYR-3 | 市场 | 未检出 | 未检出 |
10 | 猪肉 | BJHLHXD-1 | 超市 | 未检出 | 未检出 | 36 | 牛肉 | HCNR-3 | 市场 | 未检出 | 未检出 |
11 | 羊肉 | BJHLHXD-2 | 超市 | 未检出 | 未检出 | 37 | 猪肉 | HCZR-4 | 市场 | 未检出 | 未检出 |
12 | 牛肉 | BJHLHXD-3 | 超市 | 未检出 | 未检出 | 38 | 羊肉 | HCYR-4 | 市场 | 未检出 | 未检出 |
13 | 猪肉 | BJHLHCD-1 | 超市 | 未检出 | 未检出 | 39 | 牛肉 | HCNR-4 | 市场 | 未检出 | 未检出 |
14 | 羊肉 | BJHLHCD-2 | 超市 | 未检出 | 未检出 | 40 | 猪肉 | HCZR-5 | 市场 | 未检出 | 未检出 |
15 | 牛肉 | BJHLHCD-3 | 超市 | 未检出 | 未检出 | 41 | 羊肉 | HCYR-5 | 市场 | 未检出 | 未检出 |
16 | 猪肉 | BJHLFHCD-1 | 超市 | 未检出 | 未检出 | 42 | 牛肉 | HCNR-5 | 市场 | 未检出 | 未检出 |
17 | 羊肉 | BJHLFHCD-2 | 超市 | 未检出 | 未检出 | 43 | 猪肉 | P35027C | 盲样考核 | 7.10 | 7.15 |
18 | 牛肉 | BJHLFHCD-3 | 超市 | 未检出 | 未检出 | 44 | 羊肉 | SJYPYR-1 | 送检样品 | 未检出 | 未检出 |
19 | 猪肉 | DRFCS-1 | 超市 | 未检出 | 未检出 | 45 | 牛肉 | SJYPNR-1 | 送检样品 | 未检出 | 未检出 |
20 | 羊肉 | DRFCS-2 | 超市 | 未检出 | 未检出 | 46 | 猪肉 | P35028C | 盲样考核 | 3.22 | 3.18 |
21 | 牛肉 | DRFCS-3 | 超市 | 未检出 | 未检出 | 47 | 羊肉 | SJYPYR-2 | 送检样品 | 未检出 | 未检出 |
22 | 猪肉 | HRWJWDD-1 | 超市 | 未检出 | 未检出 | 48 | 牛肉 | SJYPNR-2 | 送检样品 | 未检出 | 未检出 |
23 | 羊肉 | HRWJWDD-2 | 超市 | 未检出 | 未检出 | 49 | 猪肉 | ZRTJZR-1 | 空白添加 | 0.990 | 0.980 |
24 | 牛肉 | HRWJWDD-3 | 超市 | 未检出 | 未检出 | 50 | 羊肉 | YRTJYR-1 | 空白添加 | 1.101 | 1.100 |
25 | 猪肉 | HRWJLDD-1 | 超市 | 未检出 | 未检出 | 51 | 牛肉 | NRTJNR-1 | 空白添加 | 0.990 | 1.101 |
26 | 羊肉 | HRWJLDD-2 | 超市 | 未检出 | 未检出 |
表7 GB 31658.2-2021、DART-MS/MS方法检测过程比对
Table 7 Detection process comparison of GB 31658.2-2021 & DART-MS/MS method
方法名称 | 提取过程 | 净化过程 | 仪器检测时间 (min) | 试剂消耗量 (mL) | 试验时间 (min) |
GB 31658.2-2021 | 称样、提取、涡旋、去油、脱脂、离心、氮吹、复溶等22个步骤 | 活化、上样、淋洗、洗脱 | 10 | 128 | 80~100 |
DART-MS/MS | 称样、提取、涡旋、盐析、超声、离心等7个步骤 | 滤过柱下压 | 1 | 15 | 30~40 |
基金项目:宁波市创新团队重点专项(2015C110018),浙江省公益性基金(LGF21B050003)
第一作者:贾江钢(1994—),男,浙江台州人,本科,助理工程师,主要从事食品安全检测,E-mail: 619270757@qq.com
通信作者:湛嘉(1977—),男,湖南平江人,博士,研究员,主要从事食品、化妆品安全检测与研究,E-mail: zhanjia2000@163.com
1. 宁波中盛产品检测有限公司 宁波 315012
2. 宁波检验检疫科学技术研究院 宁波 315012
3. 湖南省平江县梅县镇政府 岳阳 410412
1. Ningbo Zhongsheng Product Testing Co., LTD., Ningbo 315012
2. Ningbo Institute of Inspection and Quarantine Science and Technology, Ningbo 315012
3. Municipal Government of Meixian Town, Pingjiang County, Hunan Province, Yueyang 410412