CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
含内参靶标的禽败血支原体和滑液支原体多重荧光PCR检测方法研究
作者:高志强 汪琳 张红梅 蒲静 赵相鹏 任彤 张伟 赖平安
高志强 汪琳 张红梅 蒲静 赵相鹏 任彤 张伟 赖平安
Abstract Based on sequence alignment analysis, three pairs of primers and three probes were designed for the lipoprotein gene of Mycoplasma gallisepticum, 16S rRNA of Mycoplasma synoviae and β-actin (Internal amplification control, IAC). By optimizing the reaction system, a multiplex fluorescence PCR was established for rapid identification and detection of the two most important poultry mycoplasmas (M. gallisepticum and M. synoviae). Probit analysis showed that this method could detect target DNA with 4.48 and 4.89 copies respectively, and had no cross-reaction with other avian pathogens. The established fluorescence PCR detection method was used to detect 358 swabs, with 6 positive samples for M. gallisepticum and 2 positive samples for M. synoviae, which was consistent with results obtained from the conventional PCR method recommended by OIE. The multiplex fluorescence PCR with IAC established in this study was not only specific and sensitive, but also can control the whole process of sampling and detection. It can be used for rapid screening of M. gallisepticum and M. synoviae.
Keywords internal amplification control; Mycoplasma gallisepticum; Mycoplasma synoviae; multiplex fluorescence PCR
败血支原体( Mycoplasma gallisepticum,MG)和滑液支原体(Mycoplasma synoviae,MS)均归属于柔膜菌纲(Class Mollicutes)支原体科(family Mycoplasmataceae )支原体属(Genus Mycoplasma),为无细胞壁的原核生物。MG和MS呈世界性分布,是引起家禽呼吸系统疾病、滑膜炎和气囊炎的重要病原体。其中,MG致病性更强,对鸡和火鸡的影响尤为明显,可导致呼吸道疾病和肉蛋产量显著下降。MG也可引发猎禽上呼吸道疾病和结膜炎,从而影响野生鸟类的觅食进而致其死亡[1]。最近研究表明,MG对鹅的致病性也较强,可引起鹅群较高的发病率和死亡率[2]。MS组织嗜性与MG明显不同,可引起家禽的传染性滑膜炎,主要感染症状为跛行、关节肿胀和生长迟缓。MG和MS可通过受感染的鸡胚进行垂直传播,也可通过密切接触而水平传播[1]。最近研究发现,禽类养殖环境中可检出MG和MS核酸,并且MG和MS可在合成纤维和毛发中存活数天,表明MG和MS可附着于物体表面进行传播[3]。由于MG和MS在禽群中呈持续性感染,可导致家禽产蛋数量、饲料报酬和禽肉品质显著下降,且容易对抗生素产生耐药性,因此在家禽生产链的各个阶段实施监测和控制措施对于减少经济损失非常重要。我国也在2021年将MG和MS列为进境禽鸟疫病的一般监测项目。目前国内主要通过疫苗免疫和药物预防来控制该病的发生和传播[1,4]。因此控制该病的最佳策略就是进行不断监测和净化,同时培养健康禽群,并通过实施综合防治措施使禽群长期保持在无疫状态[5]。
用于MG和MS监测的最常见方法是快速平板凝集试验,但该方法的准确性、敏感性和特异性较差。病原分离鉴定一般被认为是诊断支原体感染的“金标准”方法,然而支原体生长缓慢、营养需求高,而且在标准的分离程序中,还需要对同属的其他共生非致病支原体进行鉴别,难以满足疫病控制对快速准确检测的需求[1,4]。因此,目前核酸检测方法越来越多地作为样品中MG和MS的直接检测的替代方法,目前文献中报道了多种不同的核酸检测方法,其中主要包括针对不同靶标的常规PCR方法[6],基于SYBR green的荧光PCR方法[7-8]和TaqMan荧光定量PCR方法[9-12]。但目前报道的荧光PCR方法均不包含内参靶标,不能对采样及检测过程进行有效质控。
荧光PCR检测结果的准确性受多种因素影响,样品采集不到位、核酸提取失败、提取的核酸存在PCR抑制物等因素都可能导致假阴性结果的出现。设置内参靶标可对检测全过程进行监控,能提高检测结果的准确性和可信度。本研究通过序列比对,分别针对禽类通用内参基因、MG和MS特异基因片段设计引物和探针,建立了检测MG/MS的三重实时荧光PCR检测方法,对灵敏度、特异性等性能进行了评价,并用于进境禽类样品的检测。本方法的研究为口岸进境禽鸟MG/MS的精准监测提供了新方法。
1 材料和方法
1.1 病原核酸及被检样品
MG和MS核酸提取自平板凝集抗原,购自中国兽医药品监察所;含MG脂蛋白基因pBSK-MG、MS 16S rRNA基因的标准质粒pBSK-MS,新城疫病毒Lasota、禽流感病毒H5N1亚型、鸡传染性支气管炎H52、鸭肝炎病毒I型cDNA以及鸭病毒性肠炎病毒核酸均为本实验室保存;鸡咽喉/泄殖腔拭子358份,本实验室收集保存。
1.2 主要试剂
微量样品基因组DNA提取试剂盒(DP316),购自天根生化科技有限公司;HS Taq DNA聚合酶、dNTP等,购自TaKaRa公司;引物及双标记探针,均委托上海生工合成。
1.3 主要设备
QuantStudio 5型荧光定量PCR仪(A28134,Thermo Fisher 公司);QIAxcel型毛细管电泳仪(9001941,QIAGEN公司)。
1.4 引物和探针的设计合成
对于败血支原体(MG),随机选取不同地域的脂蛋白(Lp)基因进行序列比对,选取保守位置设计引物探针(图1);对于滑液支原体(MS),根据Lauerman报道[13]的普通PCR引物序列,在对16S rRNA进行序列比对基础上(图2)对引物序列做适度修改,再设计一条探针,作为滑液支原体检测的引物探针。同时,根据β-actin基因设计一套可扩增禽类组织的引物探针用于内参检测,引物探针名称、序列及扩增长度见表1。
1.5 多重荧光PCR反应条件优化
使用QuantStudio 5荧光定量PCR仪按照Taguchi方法[14]对反应体系的各个组分浓度进行优化,筛选最佳反应参数。
1.6 检测标准曲线的建立
将已知拷贝数的质粒DNA pBSK-MG和pBSK-MS均以1.2×107 copies/mL作为起始检测浓度开始做10倍系列稀释,鸡肉总DNA 则以2.5×105 ng/mL作为起始检测浓度开始做10倍系列稀释。然后使用优化后的多重荧光PCR方法进行检测,选其中5个稀释度模板,以Ct值为纵轴,以上样拷贝数或pg数为横轴,进行线性回归分析并作标准曲线,计算回归系数(R2)和PCR扩增效率。
1.7 最低检测限测定
为进一步确定方法的检测下限,进一步对0.5~16拷贝的pBSK-MG和pBSK-MS进行每个梯度8管的重复检测,采用概率回归确定在95%置信区间的分析灵敏度。
1.8 特异性试验
应用建立的反应体系,对MG和MS病原核酸(提取自平板凝集抗原)、新城疫病毒Lasota、禽流感病毒H5N1亚型、鸡传染性支气管炎H52、鸭肝炎病毒Ⅰ型cDNA以及鸭病毒性肠炎病毒核酸进行检测,以验证方法的特异性。
1.9 样品检测
应用建立的多重荧光PCR方法对实验室保存的358份鸡咽喉/泄殖腔拭子进行实际应用检测,并与世界动物卫生组织(WOAH)推荐的常规PCR方法[1]进行比较。
2 结果与讨论
2.1 多重荧光PCR优化
经优化确立反应体系:每个反应体系均包含1×PCR Buffer,4.5 mmol/L MgCl2,0.15% BSA,400 nmol/L dNTP,0.3 μmol/L的MG-F/MG-R引物,0.1 μmol/L的MG-P检测探针;0.4 μmol/L的MS-F/MS-R引物,0.1 μmol/L的MS-P检测探针;0.3 μmol/L的IAC-F/IAC-R引物,0.1 μmol/L的IAC-P检测探针。反应参数为95°C/3 min;94°C/15 s,55°C/10 s,60°C/30 s,42个循环,每个循环在60°C时收集荧光信号。
2.2 标准曲线建立与PCR效率测定
将10倍系列稀释的已知拷贝数的质粒pBSK-MG、pBSK-MS以及已知质量浓度的鸡肉DNA作为模板,选取5个稀释度,通过建立的多重荧光PCR进行检测,得到扩增曲线和标准曲线。其中质粒拷贝数浓度在1.2×103~1.2×107 copies/mL范围内,鸡肉总DNA浓度在2.5×10~2.5×105 ng/mL范围内,Ct值于上样拷贝数或pg数呈现良好的线性关系。多重反应扩增曲线见图3,多重标准曲线见图4。对于MG,回归斜率为-3.323,Y轴截距为36.321,R2=0.999,扩增效率为99.96%;对于MS,回归斜率为-3.287,Y轴截距为36.891,R2=0.997,扩增效率为101.48%;对于鸡肉DNA,回归斜率为-3.390,Y轴截距为41.150,R2=0.999,扩增效率为97.23%。
2.3 最低检测限测定
为进一步确定方法的检测下限,进一步对0.5~16拷贝的pBSK-MG和pBSK-MS进行每个梯度8管的重复检测,采用概率回归确定在95%置信区间的分析灵敏度。结果显示,对于MG,95%概率下,建立方法的检测极限为4.48拷贝,95%置信上限和下限分别为3.44拷贝和7.60拷贝;对于MS,95%概率下,建立方法的检测极限为4.89拷贝,95%置信上限和下限分别为4.11拷贝和7.18拷贝。结果见图5。
2.4 特异性试验
应用建立的多重荧光PCR对MG和MS病原核酸(提取自平板凝集抗原)、新城疫病毒Lasota、禽流感病毒H5N1亚型、鸡传染性支气管炎H52、鸭肝炎病毒Ⅰ型cDNA以及鸭病毒性肠炎病毒核酸进行检测,以验证方法的特异性。实验结果如图6所示,建立的检测方法与上述病原核酸无交叉反应。
2.5 实际送检样品检测
应用建立的多重荧光PCR方法对实验室保存的鸡咽喉/泄殖腔拭子358份进行实际应用检测,检出败血支原体阳性6份,滑液支原体阳性2份。与WOAH推荐的常规PCR方法进行比较,结果一致,见图7和图8。
3 讨论
目前国内外针对MG和MS已经建立了多种检测技术,包括病原分离鉴定、血清学检测方法和核酸检测方法[3]。其中实时荧光PCR方法具有敏感、特异、可定量的优点,被OIE推荐为开展MG/MS个体检测、群体监测以及临床病例确证的首选方法[1]。但由于核酸扩增诊断试验可能被生物标本中的各种物质所抑制。用于检测MG/MS的临床送检样品,包括口咽、气管、泄殖腔拭子,以及气囊、框下窦、关节腔内液体等,其化学成分复杂,在一些特殊疾病状态下成分往往变化较大,一旦存在抑制物,有时会产生假阴性结果,单纯的阴、阳性对照并不能发现这种抑制。因此在对临床样品检测MG/MS时,实验含内参靶标的反应体系不仅可发现模板DNA中是否存在抑制物,还可在一定程度上评估样品采集的质量,因此,可显著提升检测结果的可信度。另一方面,样品中内参对照丰度过高,可能会竞争性抑制低拷贝数的目标基因的扩增,因此一般选择单拷贝看家基因。本研究针对MG脂蛋白基因、MS 16S rRNA基因以及禽鸟β-actin基因,建立了一套含内参靶标的可快速检测2种禽支原体的多重荧光PCR方法,对方法的有效性、特异性进行了评价和验证,并采用概率回归分析法测定了该方法的检测下限。结果显示,建立的多重荧光PCR方法灵敏度高、特异性强,与其他禽病病原核酸无交叉反应。研究表明,β-actin为单拷贝基因,因此本研究针对禽类β-actin设计引物探针,建立含内参靶标的多重荧光PCR方法,在临床样品检测中发挥了良好的质控作用。
4 结论
本研究经序列比对分析,分别针对禽败血支原体脂蛋白基因、滑液支原体16S rRNA基因以及β-actin设计引物探针,经体系优化建立了含内参靶标的快速检测禽败血支原体和滑液支原体的三重荧光PCR检测方法。经概率回归分析显示方法的最低检测限分别为4.48和4.89基因拷贝,特异性试验显示不与其他禽病病原发生交叉反应。应用本方法从送检的358份拭子中检出禽败血支原体阳性6份,滑液支原体阳性2份,与OIE推荐的常规PCR方法的检测结果一致。本研究建立的方法可对采样和检测全过程进行质控,可用于禽类败血支原体和滑液支原体的快速检测筛查。
参考文献
[1] Office International des Epizooties. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals[S]. Paris: Office International des Epizooties. https://www.oie.int/fileadmin/Home/eng/Health_standards, 2021: 1-18.
[2]刘英慧, 陈亦杏, 李仕楷, 等. 鹅源鸡毒支原体分离鉴定与致病性研究[J]. 中国家禽, 2022, 44(2): 106-111.
[3] Abolnik Celia, Gouws Johan. Extended survival times of Mycoplasma gallisepticum and Mycoplasma synoviae on kanekalon synthetic hair fibres[J]. Poultry Science, 2014, 93(1): 8-11.
[4] 向勇, 曹伟胜. 禽支原体检测技术进展[J]. 养禽与禽病防治, 2018, 8(4): 2-9.
[5] Kleven S H. Control of Avian Mycoplasma Infections in Commercial Poultry[J]. Avian Dis, 2008, 52(3): 367-374.
[6] Garcia M, Ikuta N, Levisohn S, et al. Evaluation and comparison of various PCR methods for detection of Mycoplasma gallisepticum infection in chickens[J]. Avian Dis, 2005, 49(1): 125-132.
[7] Jarquin R, Schultz J, Hanning I, et al. Development of a real-time polymerase chain reaction assay for the simultaneous detection of Mycoplasma gallisepticum and Mycoplasma synoviae under industry conditions[J]. Avian Dis, 2009, 53(1): 73-77.
[8] Dijkman R, Feberwee A, Landman W J M. Development, validation and field evaluation of a quantitative real-time PCR able to differentiate between field Mycoplasma synoviae and the MS-H live vaccine strain[J]. Avian Pathology, 2017, 46(4): 1-38.
[9] Ziv Raviv, Stanley H K. The development of diagnostic real-time TaqMan PCRs for the four pathogenic avian mycoplasmas[J]. Avian diseases, 2009, 53(1): 103-107.
[10] Padilha F A, De V T, Nilo I, et al. A Multiplex real-time PCR for detection of Mycoplasma gallisepticum and Mycoplasma synoviae in clinical samples from Brazilian commercial poultry flocks[J]. Brazilian Journal of Microbiology, 2013, 44(2): 505-510.
[11] 杨美, 程振涛, 周怡, 等. 鸡毒支原体和鸡滑液囊支原体双重PCR检测方法的建立[J]. 动物医学进展, 2020, 41(6): 27-31.
[12] Callison S A, Riblet S M, Sun S, et al. Development and validation of a real-time Taqman polymerase chain reaction assay for the detection of Mycoplasma gallisepticum in naturally infected birds[J]. Avian Dis, 2006, 50(4): 537-544.
[13] Lauerman L H. Mycoplasma PCR Assays. In: Nucleic Amplification Assays for Diagnosis of Animal Diseases[R]. Auburn: American Association of Veterinary Laboratory Diagnosticians, 1998: 41-52.
[14] Thanakiatkrai P, Welch L. Using the Taguchi method for rapid quantitative PCR optimization with SYBR Green I[J]. International journal of legal medicine, 2012, 126(1): 161-165.
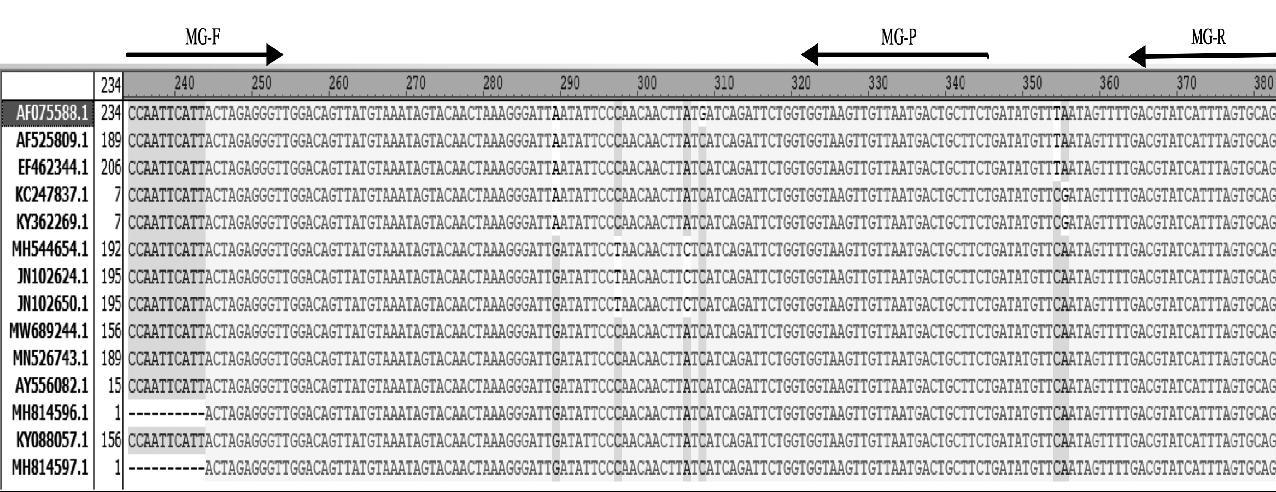
图1 败血支原体引物探针设计区域的序列比对
Fig.1 Sequence alignment of primers and probes for M. gallisepticum

图2 滑液支原体引物探针设计区域的序列比对
Fig.2 Sequence alignment of primers and probes for M. synoviae
表1 多重荧光PCR检测的引物和探针
Table 1 Primers and probes used in multiplex fluorescence PCR
基因名称 | 引物名称和序'列 (5'~3' ) | 扩增长度 (bp) |
Lp | MG-F: CCAATTCATTACTAGAGGGT | 149 |
MG-R: CTGCACTAAATGATACGTC | ||
MG-P: [FAM]-AGAAGCAGTCATTAACAACTTACCA-[BHQ1] | ||
16S rRNA | MS-F: CAAAGAGAAGCAAAATAGTGATATCA | 213 |
MS-P: [CY5]-AAGACCCGAGAACGTATTCACC-[BHQ2] | ||
IAC (β-actin) | IAC-P:[ROX]-CYGTGCTGTCYCTGTAYGCCTCT-[BHQ2] | 86 |
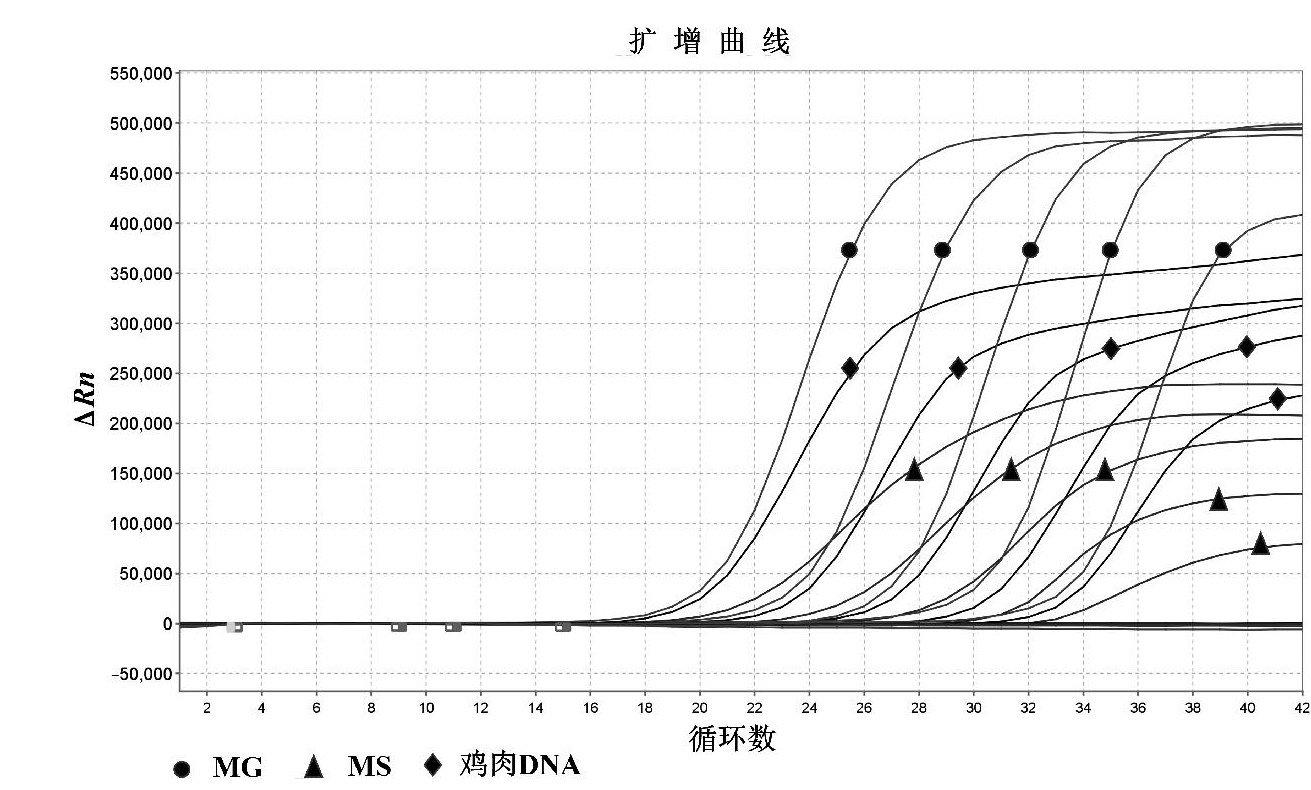
图3 败血支原体、滑液支原体以及鸡肉DNA多重扩增曲线
Fig.3 Multiplex amplification curves of M. gallisepticum, M. synoviae and chicken DNA
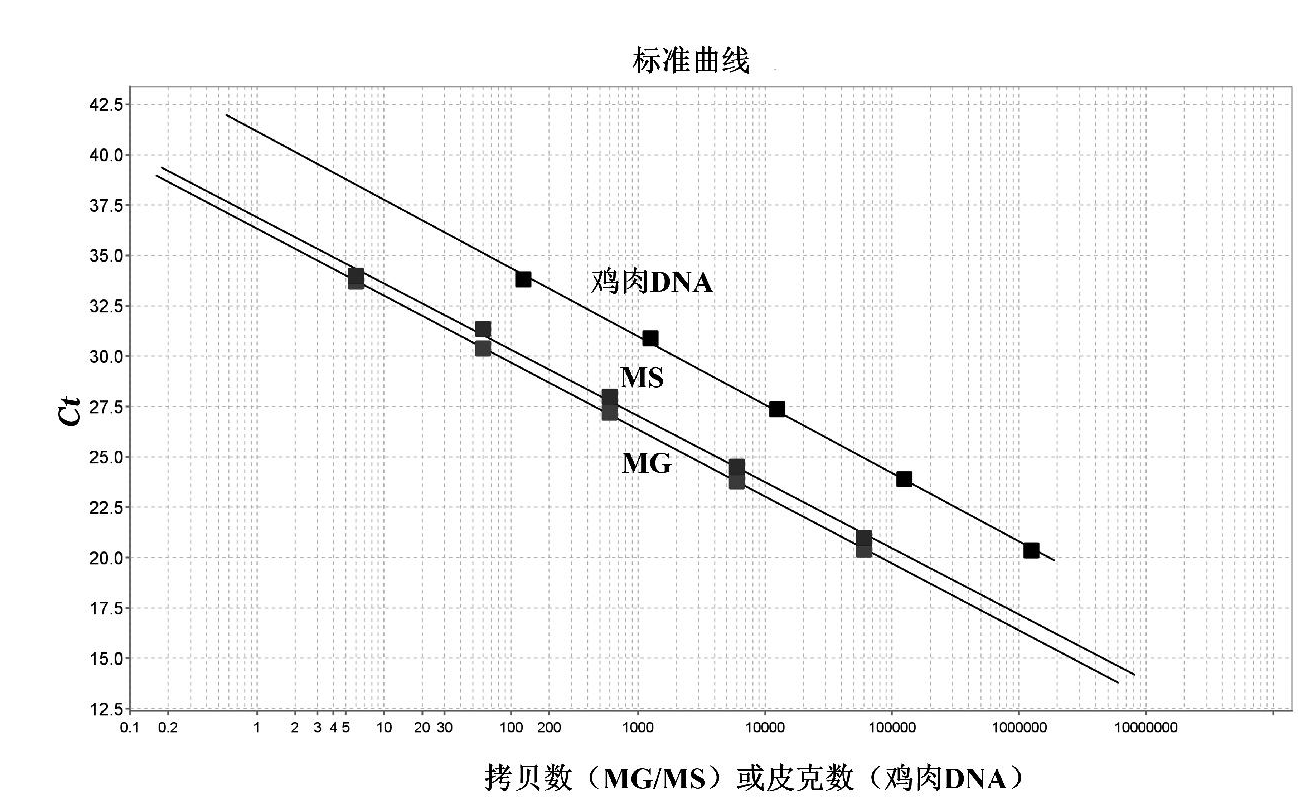
图4 败血支原体、滑液支原体以及鸡肉DNA多重标准回归曲线
Fig.4 Multiplex standard regression curve of M. gallisepticum, M. synoviae and chicken DNA
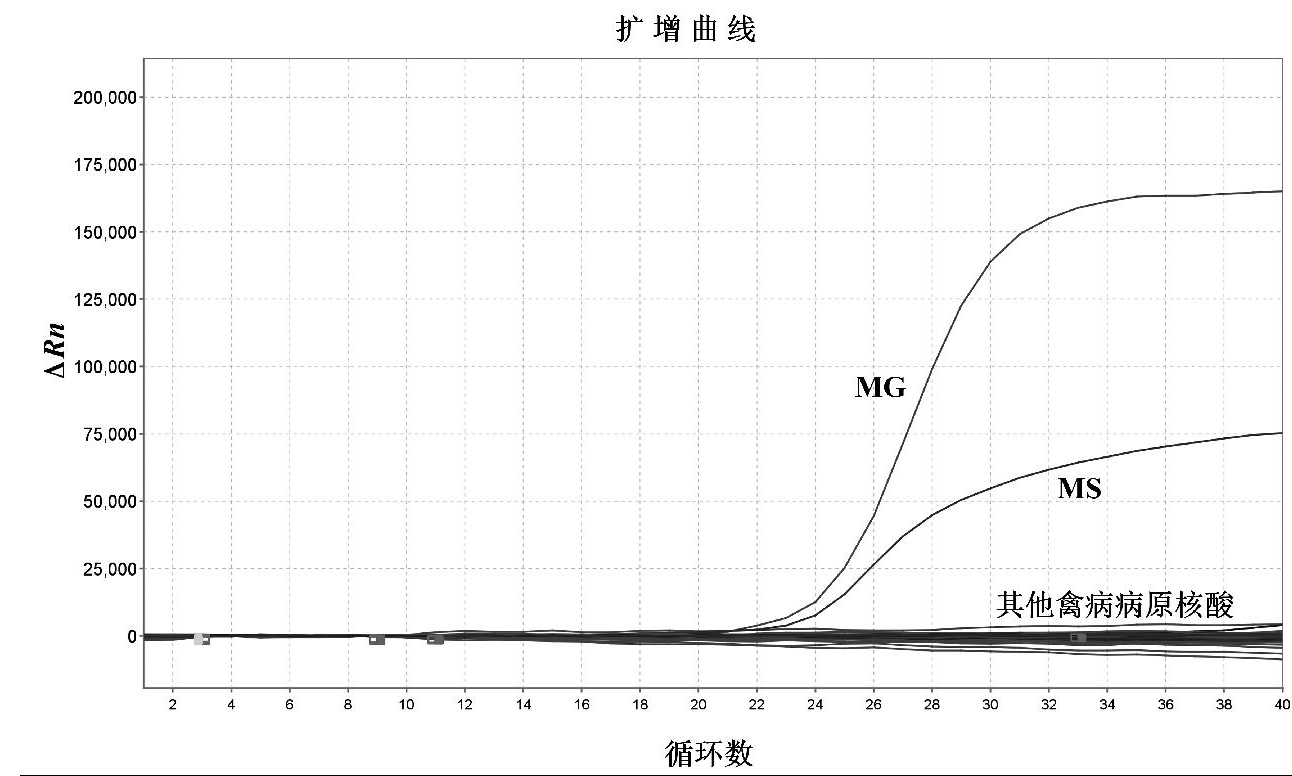
图6 特异性试验结果
Fig.6 Results of specificity tests
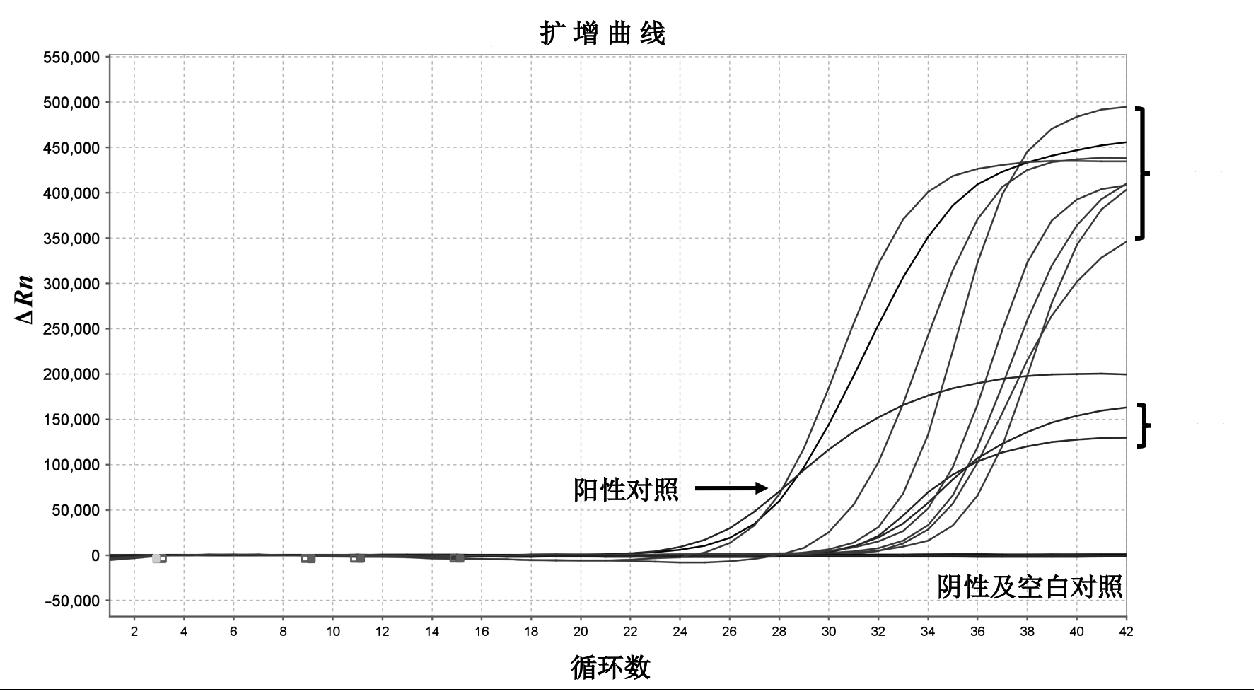
图7 送检阳性样品的多重荧光PCR检测结果
Fig.7 Multiple fluorescence PCR detection results of delivered positive samples
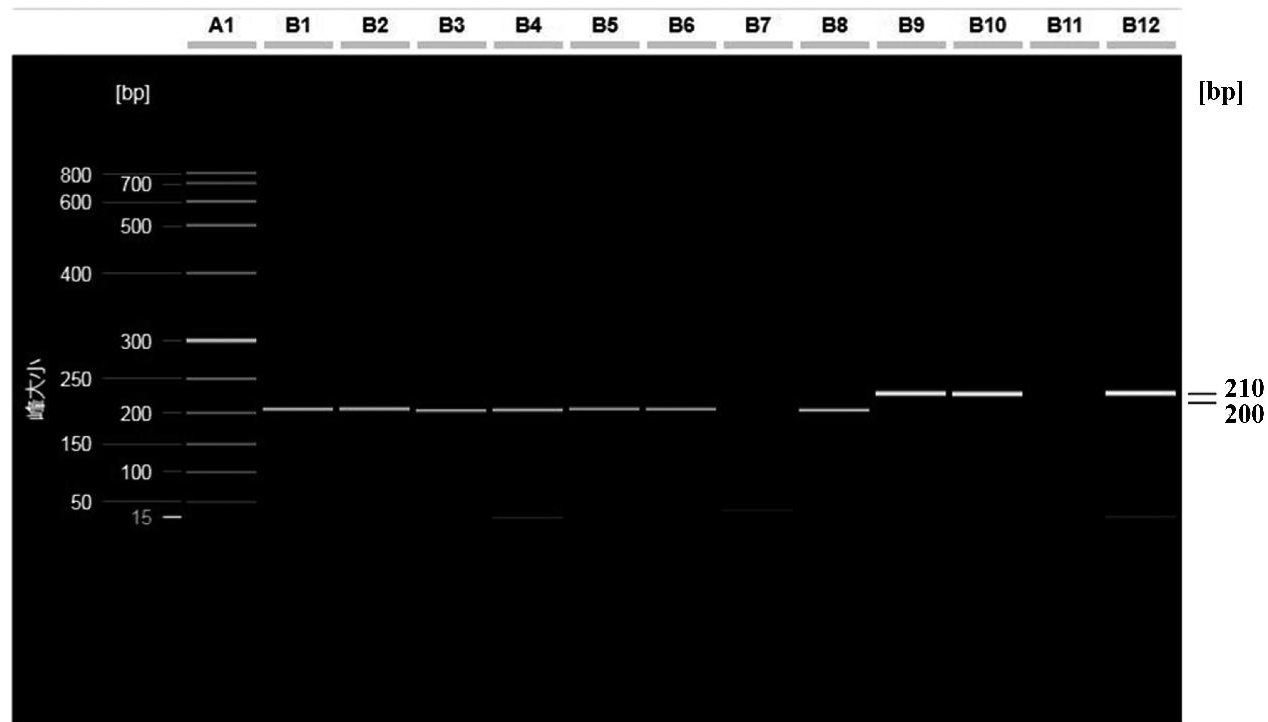
A1: DNA分子量标准; B1~B6: MG阳性样品检测结果; B7: MG阴性对照; B8: MG阳性对照; B9~B10: MS阳性样品检测结果; B11: MS阴性对照; B12: MS阳性对照
图8 送检阳性样品的常规PCR检测结果
Fig.8 Detection results of delivered positive samples by the conventional PCR
项目基金:安徽省科技重大专项基金(202003a06020001)
第一作者:汪文俊(1975—),男,汉族,安徽桐城人,硕士,高级农艺师,主要从事茶叶植保及茶树分子育种研究,E-mail: 389984996@qq.com
通信作者:余晓峰(1967—),男,汉族,安徽合肥人,本科,研究员,主要从事茶叶加工与品质研究,E-mail: amyxf@126.com
1. 黄山市茶产业促进中心 黄山 245499
2. 黄山小罐茶业有限公司 黄山 245000
3. 合肥海关技术中心 合肥 230022
1. Huangshan Tea Industry Promotion Center, Huangshan 245499
2. Huangshan Xiaoguan Tea Co., Ltd, Huangshan 245000
3. Technology Centers of Hefei Customs, Hefei 230022








