CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
固相萃取-气相色谱质谱联用法测定养殖鱼中乙氧基喹啉残留量
作者:易碧华 王世东 李文敏 陆柳君 岑金莺 蒋小良
易碧华 王世东 李文敏 陆柳君 岑金莺 蒋小良
基金项目:江门市基础与理论科技计划项目(江科[2021]183号)
第一作者:易碧华(1983—),女,汉族,本科,工程师,主要从事食品、消费品等理化检测,E-mail: 173705669@qq.com
通信作者:蒋小良(1979—),男,汉族,硕士,高级工程师,主要从事进出口商品分析检测,E-mail: liang96@yeah.net
1. 江门海关技术中心 江门 529000
1. Technology Center of Jiangmen Customs, Jiangmen 529000
Abstract A method for the determination of ethoxyquin residues in farmed fish by solid phase extraction (SPE) and gas chromatography-mass spectrometry (GC-MS) was established. Under weak alkalinity and dehydrating conditions, samples were extracted with n-hexane, purified by alumina N and eluted by methanol. The concentrated and filtered samples were tested by GC-MS and quantified by the external standard method. Under the optimized experimental conditions, the ethoxyquin had good linear relationship ranging from 10.0 to 200 μg/L, and the correlation coefficient was above 0.999. The limit of detection (LOD) was 0.003 mg/kg, and the limit of quantitation (LOQ) was 0.010 mg/kg, The recoveries of negative samples at 3 spiked levels of 0.01 mg/kg, 0.02 mg/kg and 0.05 mg/kg ranged from 88.4% to 105.2%, with relative standard deviations from 2.05% to 4.88% (n=6). The proposed method is convenient, efficient, reproducible, stable and suitable for the determination of ethoxyquin residues in farmed fish.
Keywords solid phase extraction (SPE); gas chromatography-mass spectrometry (GC-MS); farmed fish; ethoxyquin
饲料的腐败变质容易影响养殖鱼的生长性能和免疫系统。乙氧基喹啉具有较好的抗氧化作用,能够有效地防止饲料中油脂和蛋白质的变性或氧化,也能够有效地防止维生素、胡萝卜素等的氧化变质,因此它被广泛应用于饲料当中[1-4]。乙氧基喹啉随着饲料被动物摄食后,经过肠道被吸收,绝大部分在体内进行代谢转化,最后经肾脏排出体外。由于其具有低廉的价格、优异的抗氧化效果,不少饲料商家在实际生产过程中会使用或者滥用。目前,除欧盟外的其他国家并没有明令禁止使用乙氧基喹啉,摄入过量乙氧基喹啉的养殖鱼,其残留会在人体引起很多毒副作用,对人体造成难以预估的损害[5-7]。中国、美国、日本、韩国等国家和欧盟地区均制定了乙氧基喹啉在食品和农产品的最大残留量标准。
目前,乙氧基喹啉的检测手段主要有高效液相色谱法[8-9]、气相色谱法[10-11]、液相色谱串联质谱法[12-13]、气相色谱-质谱联用法[14-15]等。大多数研究是针对植物源性产品中乙氧基喹啉的测定研究,对养殖鱼中乙氧基喹啉测定方法报道较少。乙氧基喹啉具有脂溶性特点,如果鱼饲料中添加了该物质,被养殖鱼摄入后,体内即使有少量残留也能被检测出来。由于液相色谱串联质谱法、气相色谱-质谱联用法具有灵敏度高、选择性和重现性好等优点,广泛应用于实际批量检测中[16-18]。目前,国外对于养殖鱼中乙氧基喹啉的测试大多在QuEChERS快速处理法的研究[19-20]。快速处理法对仪器精度的要求比较高,基质影响比较大,而且QuEChERS净化包配料的选择以及配比会直接影响目标物测定的精确度。现行的SN/T 3856-2014中乙氧基喹啉的测定主要通过调节酸碱度溶液来反复提取,有一定的损失,人为操作引入的误差较大,过程不容易控制。因此,有效提取样品中的目标物对结果的影响至关重要。本研究拟从优化萃取条件、中性氧化铝固相萃取等方面进行研究,建立气相色谱质谱联用法测定养殖鱼中乙氧基喹啉残留量的分析方法。
1 实验部分
1.1 仪器与设备
Trace ISQ 250气相色谱-质谱联用仪(配电子轰击源(EI源),美国热电公司);CP124S电子天平(精度为0.0001g,德国Sartorius公司);QT-1涡旋混匀器(上海琪特分析仪器有限公司);N1全自动氮吹仪(可控温,上海PreeKem公司);3K15高速离心机(10000 r/min,德国Sigma公司);MM400型混合球磨仪(德国Retsch公司);Milli-Reference超纯水机(电阻率15.8 MΩ·cm,美国Millipore公司)。
1.2 材料与试剂
养殖鱼:主要为罗非鱼、泥锰鱼、鳙鱼、鳗鱼等,来源于实验室日常监管抽样。十八烷基键合硅胶柱(C18)、佛罗里硅土柱(Florisil)、中性氧化铝柱(Alumina-N,Cleannert® SPE柱,Agela Technologies公司);
乙氧基喹啉标准溶液(浓度1000 mg/mL,坛墨质检标准物质中心);正己烷、甲醇(色谱纯,Bcr international trading. inc);无水硫酸钠、无水碳酸钠(分析纯,广州化学试剂厂);试验用水为超纯水。
乙氧基喹啉标准储备液:精确移取一定体积的乙氧基喹啉标准品溶液,用正己烷溶解并配成浓度为1 mg/mL的标准储备液,于4℃下避光保存。
乙氧基喹啉标准工作溶液:分别精确移取一定体积的乙氧基喹啉标准储备液,用正己烷定容为10.0~200.0 μg/L的系列标准工作溶液。
1.3 仪器条件
色谱柱:DB-5 MS,30.0 m×0.25 mm×0.25 μm;进样口温度:280℃;离子源温度:250℃;接口温度:280℃;四级杆温度:150℃;程序升温:60℃保持1 min,以20℃/min升至260℃,保持1 min,以40℃/min升至280℃,保持5 min;进样量:1 μL;不分流进样;扫描方式:选择离子检测(SIM);定性离子(m/z):174、145、217;定量离子(m/z):202。
1.4 样品前处理
1.4.1 样品提取
养殖鱼样品经过均质处理后,称取样品2.0 g(精确至0.001 g)于50 mL具塞离心管中,加入10 mL正己烷,涡旋混合1 min后,再加入1 g无水碳酸钠和1 g无水硫酸钠,经混合球磨仪混合提取5 min,在高速离心机中以10000 r/min离心5 min后,取上清液在40℃条件下氮吹至近干,然后再加入4 mL甲醇分两次复溶,涡旋混匀,待净化。
1.4.2 样品净化
安装固相萃取装置,在Alumina-N小柱加入1 g无水硫酸钠,用2 mL甲醇活化小柱,待净化液过柱后,再用2 mL甲醇洗脱,控制流速为1.0 mL/min,洗脱液一并收集到玻璃管中。洗脱液在40℃下氮吹至近干,加入1 mL正己烷和0.5 mL去离子水复溶,离心分层取上层清液,过0.22 μm有机滤膜,上机待测,同时做样品空白。
2 结果与分析
2.1 提取条件优化
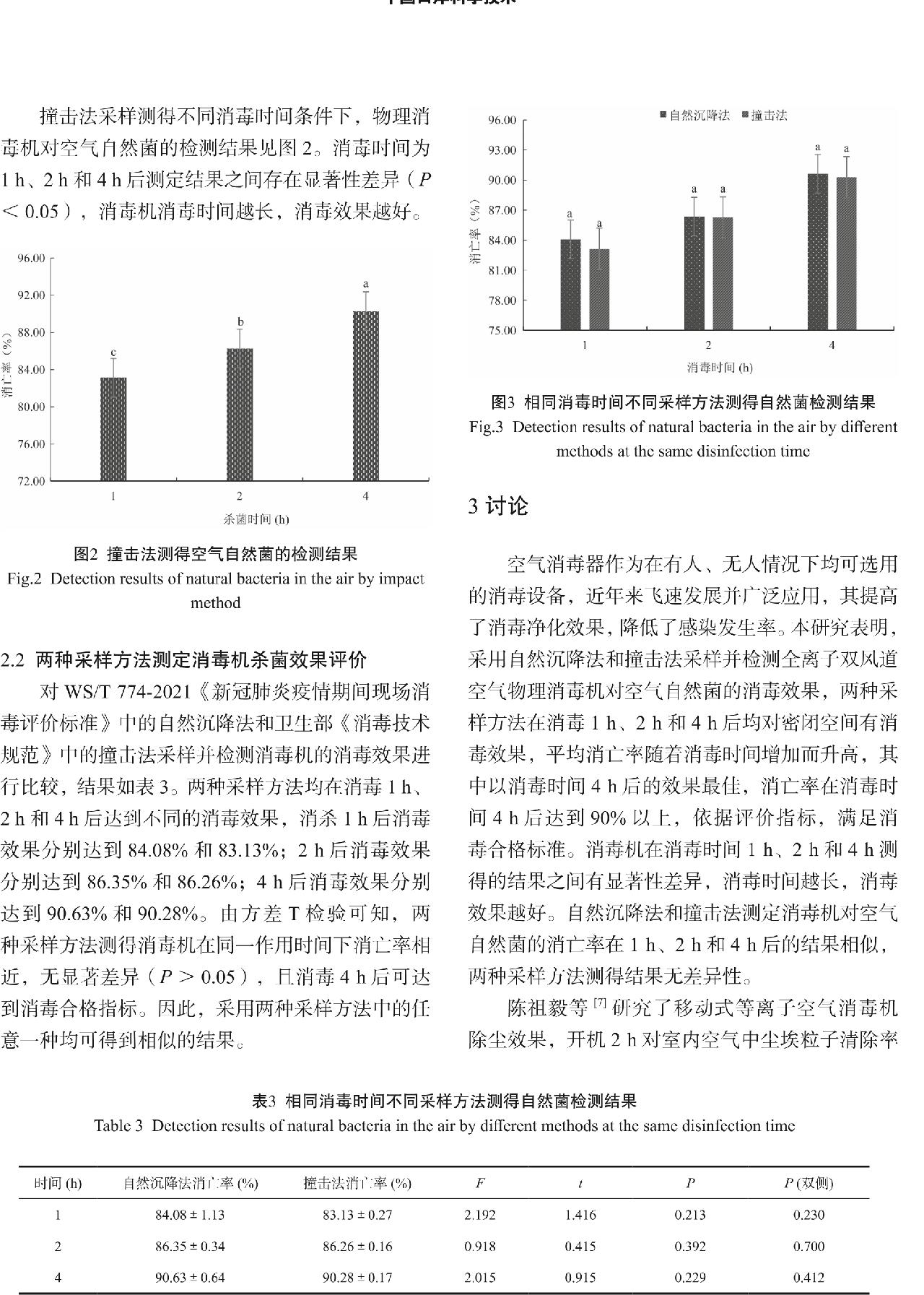
乙氧基喹啉不溶于水,易溶于丙酮、异丙醇、乙醚、正己烷等有机溶剂,本实验中参照标准SN/T 3856-2014中以10 mL正己烷作为提取液。研究表明,在弱碱性条件下,可以抑制乙氧基喹啉的离子化;通过去除样品的水分,乙氧基喹啉提取的效率会进一步提高。因此,本实验采用向正己烷添加不同比例的无水碳酸钠和无水硫酸钠,以达到弱碱性和脱水剂的目的进行提取,按照本实验步骤进行乙氧基喹啉加标回收实验,每个比例进行4次重复测定,以平均回收率进行比较。结果表明,添加1 g无水碳酸钠和1 g无水硫酸钠的10 mL正己烷进行提取回收率最高,见图1。
图1 不同比例提取液下乙氧基喹啉平均回收率(n=4)
Fig.1 The average recovery of ethoxyquin in different extraction solutions (n=4)
同时,通过不同的提取时间1~15 min对乙氧基喹啉加标回收率进行比较,发现回收率在混合球磨仪提取时间5 min后基本上达到了稳定,详见图2。
图2 不同提取时间下乙氧基喹啉回收率(n=4)
Fig.2 The average recovery of ethoxyquin at different
extraction time (n=4)
2.2 净化条件优化
通过对相同量不同固相萃取柱C18、Florisil和Alumina-N进行回收率的对比。分别对每个用量水平进行4次重复测定,以平均回收率来比较。实验结果表明,当用Alumina-N净化时,乙氧基喹啉的回收率最高,而且可有效去除样品中较多的油脂,降低仪器的基质效应,因此,最终选择Alumina-N作为固相萃取柱,见图3。
图3 不同固相萃取柱下乙氧基喹啉回收率(n=4)
Fig.3 The average recovery of ethoxyquin with different SPE column (n=4)
样品在二次氮吹后,上机测试前用正己烷和水复溶有两点好处:一是因为乙氧基喹啉不溶于水,目标物几乎在正己烷层;二是水能有效溶解样品中可溶于水的物质,减少上机测试时离子对的干扰。
2.3 线性范围与检出限、定量限
将配制好的乙氧基喹啉系列标准工作溶液按照质量浓度从低到高依次测试,用乙氧基喹啉的峰面积为纵坐标Y,以其浓度为横坐标X建立标准曲线回归方程,得到相关系数以及线性范围,乙氧基喹啉的选择离子色谱图如图4所示。结果表明,乙氧基喹啉浓度与对应的峰面积呈良好的线性关系,线性方程为:Y=435.84+2472.01X,相关系数为0.9995。对阴性样品按本方法处理进行低浓度水平加标,以3倍信噪比(S/N)得出方法的检出限LOD为0.003 mg/kg,以10倍信噪比(S/N)得出方法的定量限(LOQ)为0.010 mg/kg。
2.4 回收率与精密度实验
选取均质后的阴性样品罗非鱼、鳙鱼,定量加入0.01 mg/kg、0.02 mg/kg、0.05 mg/kg 3个浓度水平进行加标试验,每一个添加水平分别重复测定6次,最终测得的回收率为88.4%~105.2%和相对标准偏差为2.05%~4.88%,详见表1。试验结果表明,方法回收率良好,精密度高,可满足实验室检测要求。
图4 乙氧基喹啉的选择离子色谱图
Fig.4 SIM chromatogram of ethoxyquin
2.5 实际样品分析
以日常抽检的养殖鱼样品为例,采用本实验中的预处理方法处理样品和优化的实验条件,与现行标准SN/T 3856-2014预处理方法进行上机测试比较,结果见表2。由表2可知,在20份样品中除了罗非鱼、泥猛鱼、鳙鱼和部分鳗鱼未检出(N.D.)乙氧基喹啉外,有6份鳗鱼样品有检出,但检出的乙氧基喹啉的浓度远远低于对其出口风险筛查的限量,而且两种方法得出的分析结果差别不大。
3 结论
本文基于固相萃取技术,对样品前处理的条件进行优化,建立了固相萃取-气相色谱质谱联用法测定养殖鱼中乙氧基喹啉残留量。实验结果表明,该方法比标准的方法更为简捷,准确度、灵敏度和精密度高,重复性好,能有效检出阳性样品,可作为海关日常监管查验检测养殖鱼中乙氧基喹啉残留量提供参考。
参考文献
[1] Adrianus J. de Koning. The antioxidant ethoxyquin and its analogues: a review[J]. International Journal of Food Properties. 2002, 5(2): 451-461.
[2]张剑伟, 张曦, 陶琳丽, 等. 橡胶籽油基础饲料添加乙氧基喹啉和番茄红素对虹鳟生长及抗氧化能力的影响[J]. 云南农业大学学报, 2018, 33(6): 1081-1088.
[3] Tian J X, Tao Q Y, Li Y, et al. Ethoxyquin attenuate oxidant stress, inflammatory response and apoptosis in liver of Channa argus fed with high-fat dietary[J]. Aquaculture Reports, 2021, 21(10).DOI:10.1016/J.AQREP.2021.100889.
[4] SYLVAIN M, JORGE R, MARC H.G.B, et al. Identification of ethoxyquin and its transformation products in salmon after controlled dietary exposure via fish feed[J]. Food Chemistry, 2019, 289: 259-268.
[5] Rasinger J D, Frenzel F, Braeuning A, et al. Use of (Q)SAR genotoxicity predictions and fuzzy multicriteria decision-making for priority ranking of ethoxyquin transformation products[J]. Environment International, 2022(158): 106875.
[6] BERDIKOVA-BOHNE V J, Lundebye A K, HAMRE K. Accumulation and depuration of the synthetic antioxidant ethoxyquin in the muscle of Atlantic salmon (Salmo salarL.) [J]. Food and Chemical Toxicology, 2008, 46(5): 1834-1843.
[7] Bampidis V, Azimonti G, Bastos M L, et al. Safety and efficacy of a feed additive consisting of ethoxyquin (6-ethoxy-1,2-dihydro-2,2,4-trimethylquinoline) for all animal species (FEFANA asbl) [J]. EFSA Journal, 2022, 20(3): 7166.
[8]余晓琴, 李澍才, 唐昌云. 高效液相色谱-荧光检测法测定水果中乙氧基喹啉[J]. 分析测试学报, 2019, 38(10): 1260-1264.
[9]舒晓梦, 赵素娟, 王羚佳, 等. 高效液相荧光法测定猪肉中抗氧化剂乙氧基喹啉以及代谢产物二聚乙氧基喹啉[J]. 食品与发酵工业, 2018, 44(5): 244-248.
[10]陈集元. 气相色谱法检测水产配合饲料中的合成抗氧化剂[J]. 福建分析测试, 2018, 27(5): 47-53.
[11]孟庆文, 刘再胜, 谢宁. 气相色谱法测定抗氧化剂中乙氧基喹啉及BHT的含量[J]. 饲料工业, 2001(3): 26.
[12] HUANG Z Q, ZHANG Y, WANG L B, et al. Simultaneous determination of 103 pesticide residues in tea samples by LC-MS/MS [J]. Journal of Separation Science, 2009, 32(9): 1294-1301.
[13]丁涛, 沈崇钰, 蒋原, 等. 高效液相液色谱-串联质谱测定水果中乙氧基喹啉残留[J]. 质谱学报, 2009, 30(5): 307-310.
[14]高冰心. 气相色谱-质谱法测定饲料添加剂中乙氧基喹啉的残留量[J]. 广州化工, 2022, 50(11): 85-87.
[15]梁宇, 沈应涛, 梁颖彤, 等. 气相色谱-质谱法同时测定水果中联苯醚、肉桂醛和乙氧基喹残留量[J].现代食品, 2022, 28(12): 203-206+210.
[16] Soo Y C, Nam J K, Hui S K, et al. Residues determination and dietary exposure to ethoxyquin and ethoxyquin dimer in farmed aquatic animals in South Korea[J]. Food Control, 2020, 111(C): 107067.
[17]颜鸿飞, 欧阳振中, 蔡婧怡, 等. 肉类食品中乙氧喹啉残留的液相色谱检测及质谱确证[J]. 食品与机械, 2012, 28(5): 83-86.
[18]衡春民, 韦秀胆, 莫彩娜, 等. LC-MS/MS 测定南美白对虾中乙氧基喹残留[J]. 广州化工, 2012, 40(19): 95-96.
[19] Sanchez Costa Laia, Pujol Boira Judit, Aragó Iglesias Miriam, et al. Analysis of ethoxyquin residues in animal feed using QuEChERS and gas chromatography tandem mass spectrometry and its results from Catalonian production 2018-2019[J]. Analytical Methods, 2020, 12(32): 4080-4088.
[20] Guldberg T S, SandrødM., Øiaas J B, et al, Analysis of synthetic antioxidants in salmon silage using QuEChERS extraction method followed by determination by LC-MS/MS; a single-laboratory validation study[J]. Journal of Chromatography B, 2021,1174(6): 122715.
表1 罗非鱼和鳙鱼的样品加标结果
Table 1 Spiking results of samples of tilapia mossambica and aristichthys nobilis
样品 | (mg/kg) | 回收率 (%) | (RSD, %) | |||||
1 | 2 | 3 | 4 | 5 | 6 | |||
罗非鱼 | 0.01 | 98.2 | 88.4 | 100.3 | 94.6 | 91.6 | 89.1 | 4.88 |
0.02 | 97.7 | 101.2 | 94.7 | 92.1 | 102.4 | 91.4 | 4.63 | |
0.05 | 104.2 | 100.5 | 103.0 | 99.5 | 98.9 | 101.2 | 2.05 | |
鳙鱼 | 0.01 | 101.5 | 92.7 | 90.5 | 94.0 | 91.4 | 88.6 | 4.50 |
0.02 | 100.5 | 96.2 | 102.2 | 94.6 | 101.7 | 92.4 | 4.08 | |
0.05 | 105.2 | 103.5 | 101.0 | 100.5 | 99.9 | 104.2 | 2.19 | |
表2 养殖鱼样品乙氧基喹啉分析结果
Table 2 Analysis results of ethoxyquin residues in farmed fish samples
样品编号 | 含量 (mg/kg) | 样品编号 | 含量 (mg/kg) | ||
本文方法 | SN/T 3856-2014法 | 本文方法 | SN/T 3856-2014法 | ||
鳗鱼1# | N.D. | N.D. | 罗非鱼1# | N.D. | N.D. |
鳗鱼2# | 0.011 | 0.012 | 罗非鱼2# | N.D. | N.D. |
鳗鱼3# | 0.012 | 0.013 | 罗非鱼3# | N.D. | N.D. |
鳗鱼4# | N.D. | N.D. | 罗非鱼4# | N.D. | N.D. |
鳗鱼5# | 0.022 | 0.020 | 鳙鱼1# | N.D. | N.D. |
鳗鱼6# | N.D. | N.D. | 鳙鱼2# | N.D. | N.D. |
鳗鱼7# | 0.026 | 0.025 | 鳙鱼3# | N.D. | N.D. |
鳗鱼8# | 0.020 | 0.022 | 泥锰鱼1# | N.D. | N.D. |
鳗鱼9# | 0.038 | 0.040 | 泥锰鱼2# | N.D. | N.D. |
鳗鱼10# | N.D. | N.D. | 泥锰鱼3# | N.D. | N.D. |
其中: “N.D.”表示“未检出”







