CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
一起犬细小病毒感染动物的无害化处理效果评价
作者:王继文 高志强 谭启东 薛飞 申艳 孙敏丽 张伟 汪琳
王继文 高志强 谭启东 薛飞 申艳 孙敏丽 张伟 汪琳
犬细小病毒(canine parvovirus,CPV)可引起犬的传染性、出血性肠炎。早在1977年,Eugster和Nairn在通过电子显微镜观察发生腹泻犬的粪便时首次发现CPV粒子[1]。1978—1979年,Thomson[2]和Kelly[3]等分别从病犬粪便中分离出该病毒。CPV属于细小病毒科细小病毒属,为DNA病毒,基因组大小约5.3 kb。CPV的结构蛋白由VP1、VP2和VP3组成,其中VP2为主要结构蛋白,可诱导动物机体产生中和抗体。VP2编码基因变异,可引起VP2的抗原变异,从而导致病毒的嗜性和抗原性发生改变。因此,VP2编码基因为CPV分子流行病学调查的主要靶基因。CPV可分为CPV1型和CPV2型。CPV感染主要由CPV2型引起。CPV2在不断进化中,又分为3种基因亚型,即CPV2a、CPV2b和CPV2c[4-5]。
CPV感染的临床症状有2种表现类型,即肠炎型和心肌炎型。幼犬和老年犬对CPV最易感,发病率和死亡率高。病犬可通过粪便、尿液、呕吐物和唾液向外界排出病毒,经污染的食物和环境等进行传播。康复动物和隐型动物的粪便和尿液中可能长期携带病毒,并持续向外排出,均属于病毒的传染源。此外,有研究表明人、蝇及犬的体外寄生虫都能作为CPV的机械携带者和传播者。CPV的实验室检测方法包括病毒分离鉴定、电镜检查、抗原检测以及核酸检测方法,其中试纸条抗原检测方法在宠物医院中应用最为广泛,但该方法灵敏度较低,早期检测中常常出现假阴性结果。核酸检测方法灵敏度高,目前被越来越多地用于CPV的早期检测[6-7]。
细小病毒在自然环境中存活时间久,对低温的耐受性强,低温条件下仍具有感染性,对高温也有一定的承受能力。例如,CPV在室温下可存活3个月,60℃下可存活1 h。一些消毒方法和酒精、乙醚、氯仿等消毒剂不能充分杀灭细小病毒。鉴于细小病毒对理化因素具有较强的抵抗力,因此可通过评价检疫处理措施对细小病毒的杀灭效果进行评价[8-9]。
口岸作为外来动物疫病防控一线,做好阳性、病死动物无害化处理,完成入境动物检疫闭环,对于筑牢口岸动物疫情防护屏障具有重要意义。传统无害化处理手段主要包括深埋和焚烧,但深埋不能全面消灭病毒,还会对周围环境造成威胁;焚烧虽然能够充分杀灭病毒,但对外界环境的污染十分严重。高温生物降解无害化处理技术能有效杀灭细菌和病毒,处理后的废渣可作为肥料循环利用,安全环保,占地面积小、运行成本低,是今后无害化处理的主要发展方向。北京海关动物隔离场于2022年8月对一起进境CPV的感染死亡动物采用高温生物降解法进行了无害化处理,为评估该方法的有效性,采用核酸检测和病毒分离鉴定法进行了病毒核酸去除和杀灭效果评价。目前,还没有关于检疫处理有效性评价的具体方法,本研究以期为今后口岸阳性检出和病死动物的检疫处理有效性评价提供参考方法。
1 材料和方法
1.1 病原核酸及被检样品
含CPV2 VP2基因的标准质粒pBSK-CPV2-VP2为本实验室保存;病死犬十二指肠、小肠、大肠组织各1份,粪液2份;犬尸体经分解、发酵杀菌、干燥而转化为残渣粉体,分别对罐体前、中、后以及入口处采集粉体样品4份,共计9份样品,由北京海关采集后送检。
1.2 主要试剂
磁珠法核酸提取纯化试剂盒(K.BD02S96)购自南京中科拜尔医学技术有限公司;HS Taq DNA聚合酶、dNTP等购自TaKaRa公司;引物及双标记探针均委托上海生工合成。
1.3 主要设备
QuantStudio 5荧光定量PCR仪(Thermo Fisher公司);MM400全自动研磨仪(德国Retsch)。
1.4 样品前处理
使用自动研磨仪将病死犬组织脏器于分别含青霉素和链霉素各2000 IU/mL的0.01 mol/L磷酸缓存盐水(PBS)中进行充分研磨,制成20%(W/V)组织悬液,于4℃过夜处理备用;粪液用0.22 μm除菌滤器除菌后备用;将处理后的样品分别取2.0 g,于10 mL含有双抗各2000 IU/mL的0.01 mol/L磷酸缓存盐水(PBS)混悬后,于4℃过夜处理备用。
1.5 病毒核酸去除效果评价
1.5.1 核酸提取
样品核酸提取参考磁珠法核酸提取纯化试剂盒说明书,取200 μL处理后的悬液进行核酸提取。将提取的核酸洗脱于60 μL无核酸酶水中,-80℃保存备用。
1.5.2 引物和探针及荧光PCR反应条件
根据Decaro等[7]的报道,合成一套用于检测CPV2的引物、探针,引物、探针名称、序列及扩增长度见表1。依据文献建立反应体系:每个反应体系均包含1×PCR Buffer,4.5 mmol/L MgCl2,0.15% BSA,200 nmol/L dNTP,0.6 μmol/L的CPV-F/CPV-R引物,0.2 μmol/L的CPV-P检测探针。反应参数为95℃/3 min,94℃/15 s,52℃/10 s,60℃/30 s,40个循环,每个循环于60℃时收集荧光信号。
1.5.3 检疫处理前后各样品CPV载量测定
将已知拷贝数的质粒pBSK-CPV2-VP2以2.1×109 copies/mL作为起始检测浓度开始做10倍系列稀释,然后使用荧光PCR方法进行检测,每个梯度设3个重复实验,同时使用无核酸水作为空白对照,以健康犬血提取的DNA作为阴性对照,在阴性对照和空白对照成立的情况下,Ct<40均判定为核酸阳性。试验结束后,选其中5个稀释度模板,以Ct值为纵轴,以上样拷贝数为横轴,进行线性回归分析并作标准曲线,计算回归系数(R2)和PCR扩增效率。同时与待测样品一起上机检测,通过绝对定量方法评价各个样品的核酸浓度,评价核酸去除率。
1.6 病毒杀灭效果评价
1.6.1 病毒分离
对所有样品使用敏感细胞MDCK进行病毒分离,将前处理后的上清液按照1/10同步接种于刚消化好的单层细胞,加入生长液,置于37℃,5% CO2培养箱中培养,同时设置阴性对照。24 h后弃去生长液换维持液,每天观察细胞的贴壁生长及细胞病变(CPE)情况。若出现病变,待病变达80%时反复冻融3次,收集病毒,-80℃保存,并连续传代3次,获得稳定增殖的病毒液。如未出现细胞病变,将前代次培养液按照1/10接种量连续传代5次,观察细胞病变。然后,评价检疫处理后病毒杀灭效果。
1.6.2 病毒鉴定
按照1.5.1所述方法提取各代次培养液核酸,使用荧光定量PCR检测,评估病毒分离结果。
1.7 病毒核酸去除和杀灭效果综合评价
对病毒载量测定结果进行统计分析,核酸去除效果按照公式(1)评估病毒核酸去除效率,并对去除效果的显著性进行检验。病毒杀灭效果根据病毒分离结果进行定性判定。
核酸去除效果% (1)
(1)
式(1)中,A为处理前各个样品的病毒拷贝数浓度,B为处理后样品测得的拷贝数浓度。
2 结果
2.1 标准曲线建立与PCR效率测定结果
以10倍系列稀释的已知拷贝数质粒pBSK-CPV2-VP2作为模板,选取5个稀释度(2.1×105~2.1×109 copies/mL),通过荧光PCR进行检测,得到扩增曲线和标准曲线。结果显示,Ct值与拷贝数浓度呈现良好的线性关系。反应扩增曲线如图1所示,标准曲线如图2所示。回归斜率为-3.432,Y轴截距为47.263,R2 = 1,扩增效率为95.58%。
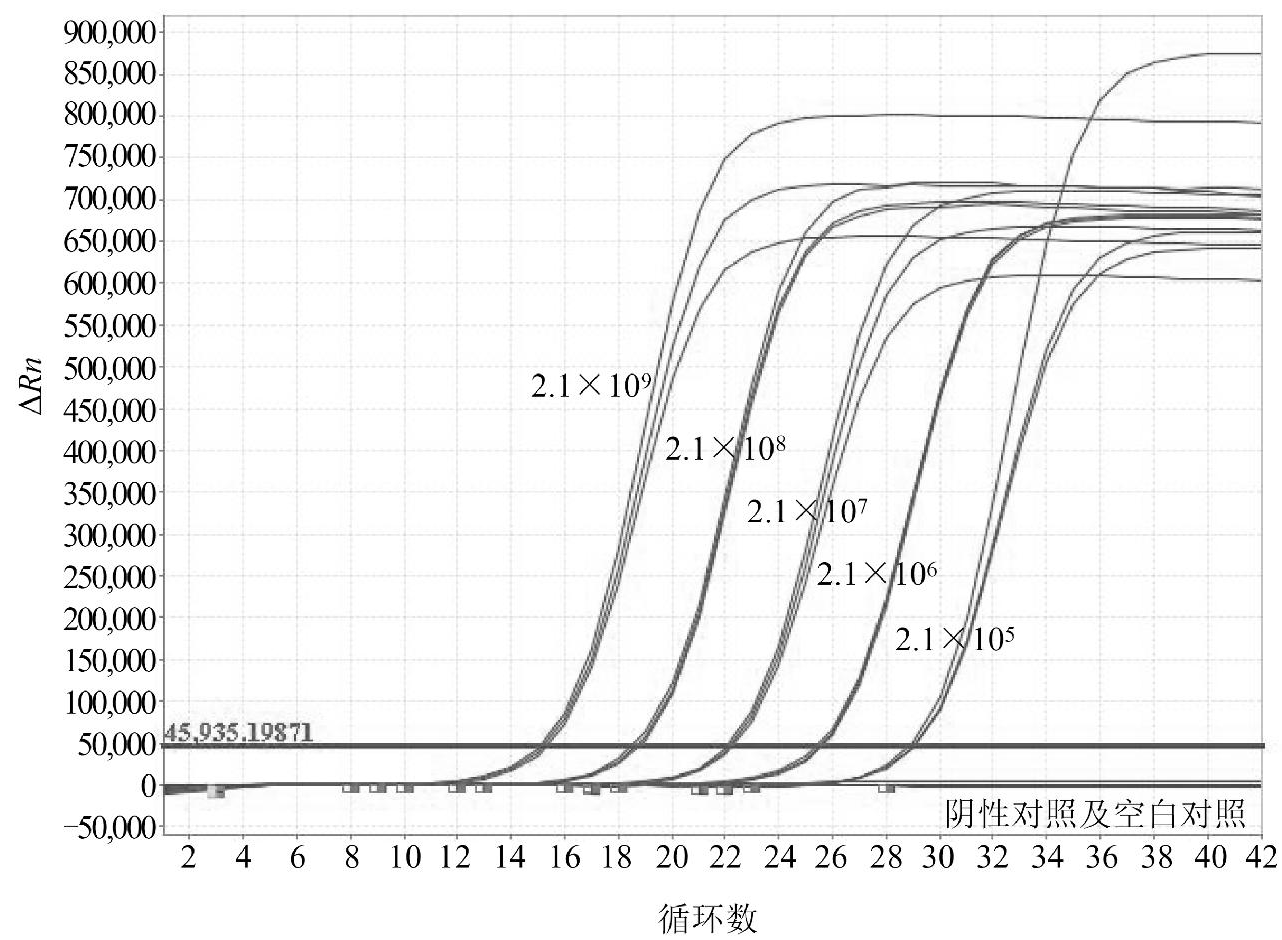
图1 系列稀释质粒pBSK-CPV2-VP2扩增曲线
Fig.1 Amplification curve of serial dilution plasmid
pBSK-CPV2-VP2
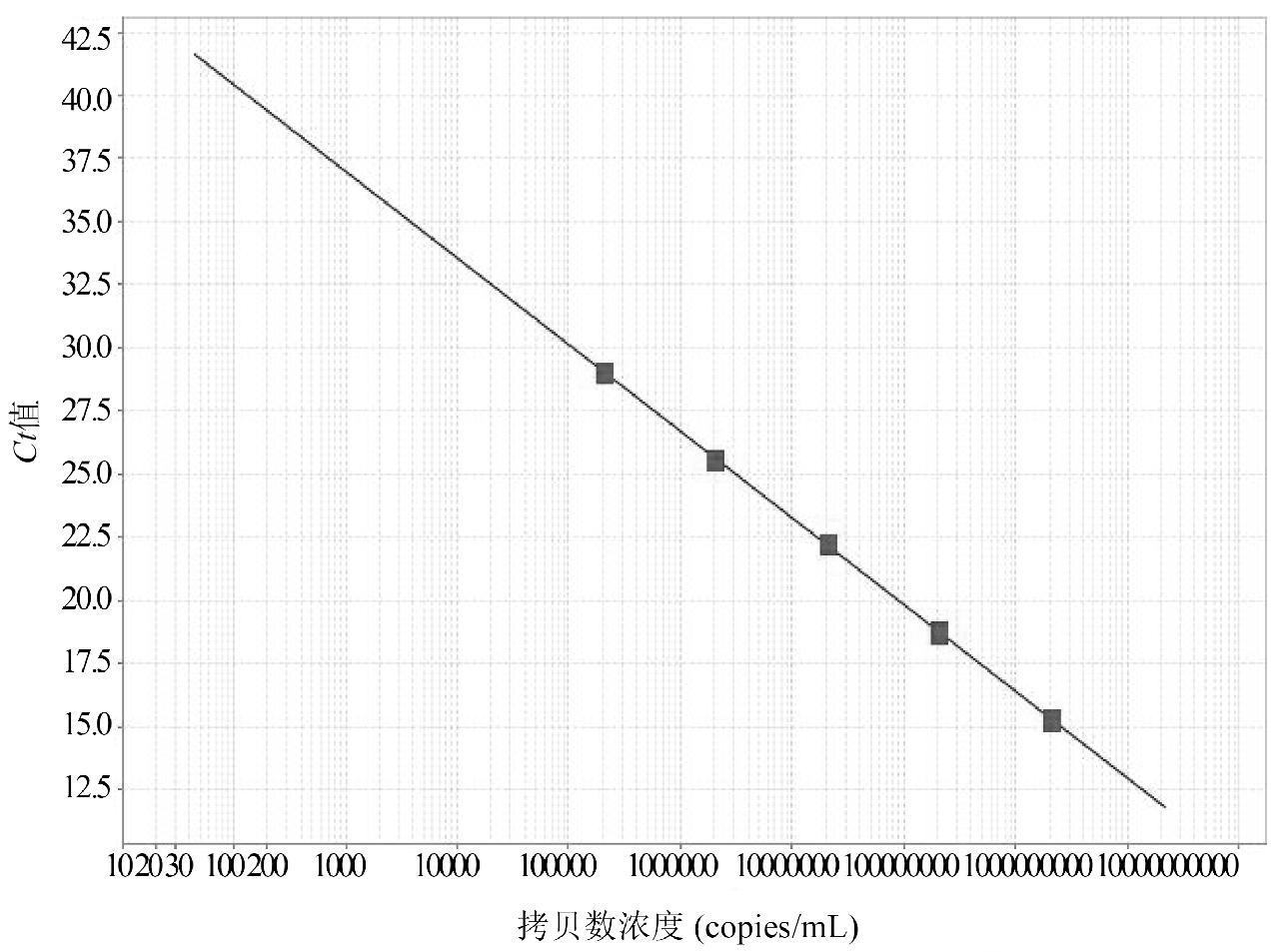
图2 标准回归曲线
Fig.2 Standard regression curve
2.2 检疫处理前后各样品CPV载量测定
处理前后待测样品DNA与已知拷贝数的质粒同时上机检测,每个待测样品做3个重复试验,将各个待测样品测定获得Ct值代入回归方程,通过绝对定量方法评价各个样品的核酸浓度,处理前后各个样品的检测结果如图3所示,定量计算结果见表2。

图3 处理前后采集样品检测结果比较
Fig.3 Comparison of detection results of samples collected before and after treatment
表2 处理前后采集样品定量检测结果
Table 2 Quantitative detection results of samples collected before and after treatment
样品名称 | 检测次数 | Ct平均值 | 定量结果 (copies/mL) | 标准差 |
淋巴结 | 3 | 15.36 | 1.98×109 | 1.16×108 |
大肠组织 | 3 | 16.13 | 1.17×109 | 6.02×106 |
小肠组织 | 3 | 15.40 | 1.92×109 | 1.05×108 |
尿液1 | 3 | 15.41 | 1.91×109 | 6.43×107 |
尿液2 | 3 | 11.83 | 2.11×1010 | 5.33×108 |
处理后S1 | 3 | 35.21 | 3.24×103 | 1.33×102 |
处理后S2 | 3 | 34.11 | 6.82×103 | 7.26×102 |
处理后S3 | 3 | 35.47 | 2.76×103 | 4.98×102 |
处理后S4 | 3 | 33.01 | 1.42×104 | 1.06×103 |
2.3 病毒分离结果
对所有样品使用敏感细胞进行病毒分离,结果显示处理前组织样品连传3代后,均出现稳定细胞病变。而处理后的4份样品经连续盲传5代后均未出现细胞病变,采用荧光PCR对各个代次细胞进行CPV核酸检测,结果与预期一致,检疫处理前的5份样品病毒分离结果均为阳性,而检疫处理后的4份样品病毒分离结果均为阴性。阴、阳性细胞病变结果如图4所示。
图4 病毒分离结果(a)未出现细胞病变的单层细胞; (b)出现典型细胞病变的细胞
Fig.4 Results of canine parvovirus isolation (a) monolayer cells without cytopathic effect; (b) cells with typical cytopathic effect
2.4 病毒核酸去除和杀灭效果综合评价
将处理前后样品病毒载量测定结果取平均值后,计算核酸去除效果,结果显示病毒核酸去除率为99.99988%,表明病毒核酸去除效率较高。对处理前后Ct值进行t检验,结果见表3,结果显示t≫t临界,表明检疫处理对病毒核酸去除作用极显著。
检疫处理前所有样品病毒分离结果均为阳性,处理后所有样品病毒分离检测结果均为阴性,表明检疫处理措施可杀灭感染性病毒。对病毒核酸去除和杀灭效果综合进行评价,表明此次检疫处理是有效的。
表3 处理前后样品Ct值显著性检验
Table 3 Significance test of Ct value of samples before and after treatment
统计量 | 处理前样品 | 处理后样品 |
平均值 | 14.83 | 34.45 |
方差 | 2.91 | 1.27 |
观测值 | 5 | 4 |
df | 7 | |
t Stat | -19.70 | |
t双尾临界 | 2.36 | |
3 讨论
阳性及病死动物无害化处置一直是进境动物检疫处理中的重要一环,是阻断动物疫病传播的有效手段。随着绿色、环保、低碳、协调的发展理念日益深入人心,也给病死动物无害化处理手段指明了发展方向。高效安全、环保的疫病无害化处理原则不仅要求处理方法能有效杀灭病原,杜绝有害生物的传播扩散,而且要把对环境的消极作用降到最低。高温生物降解无害化处理技术安全环保,其处理原理与流程与传统处理方法不同,因此选择合理的试验方法,客观地评价处理方法的杀灭效果,有助于这种环保型处理方法的推广应用和性能改进。
CPV对外界理化因素的抵抗能力非常强,常用的消毒剂碘酒、酒精等和脂溶剂乙醚、氯仿等对其作用不明显。因此对发生该病的场所一定要进行彻底消毒,发病和病死动物要进行无害化处理。消毒及检疫处理后病毒感染力消失的评估包括两个方面:一是病毒囊膜或核衣壳遭到破坏导致病毒丧失感染力,属于活性评估的范畴;二是病毒粒子彻底被清除,属于去除的范畴[10]。目前,验证病毒灭活效果主要通过病毒培养来测定其感染力,主要通过建立病毒易感细胞模型来检测病毒杀灭效果,属于病毒杀灭效果评估的金标准方法,但单纯依靠病毒培养的方法,其准确性往往依赖于培养方法的敏感性,培养方法敏感性不够,或者前处理方法不能有效去除培养抑制物可能出现假阴性结果;而验证病毒去除效率的方法常常依靠分子生物学方法,目前主要通过荧光定量PCR进行,尽管其具有灵敏、快速和特异的优点,但是在某些条件下并不适用于病毒杀灭效果的评价。研究表明,尽管某些病毒杀灭方法的病毒分离结果为阴性,但是采用荧光PCR方法仍然可以在样品中检测到病毒核酸。这是由于很多病毒杀灭方法并不完全破坏病毒的核酸,致使假阳性结果产生。因此,应根据实际情况来选择合适的病毒杀灭或去除效果评价方法,以达到客观评价病毒杀灭效果的目的。在本研究中,为能切实评估口岸检疫处理技术的病毒杀灭效果,针对抵抗力较强的CPV,不仅定量评估了核酸去除作用,还采用敏感细胞培养的方法评估其杀灭效果,从而充分证实了检疫处理方法的有效性。此外,为能快速、高通量解决病毒杀灭效果评价,一些学者已经着手开展感染性病毒分子生物学检测方法,并已经在诺如病毒、甲肝病毒、戊型肝炎病毒的污染和杀灭效果评价中得到应用,该方法将成为病毒杀灭效果评价方法的发展趋势[11-13]。
4 结论
本研究采用针对CPV VP2编码基因的荧光PCR方法,通过建立标准曲线和回归方程测定了病死动物处理前后样品的病毒载量。经分析计算,结果显示病毒核酸去除率接近100%;同时采用病毒分离结果对处理前后的样品进行了检测,结果显示处理后样品病毒分离结果为阴性,表明感染性病毒被充分杀灭。实验充分证实了本次无害化处理的有效性。
参考文献
[1] Eugster A K, Nairn C. Diarrhea in puppies: parvovirus-like particles demonstrated in their feces[J]. Southwestern Veterinarian, 1977, 30(1): 59-60.
[2] Thomson G W, Gagnon A N. Canine gastroenteritis associated with a parvovirus-like agent[J]. Canadian Veterinary Journal La Revue Vétérinaire Canadienne, 1978, 19(12): 346.
[3] Kelly W R, Atwell R B. Diffuse subacute myocarditis of possible viral aetiology: a cause of sudden death in pups[J]. Australian Veterinary Journal, 1979, 55(1): 36-37.
[4]唐井玉. 2014—2015年上海地区犬细小病毒分离鉴定及基因分型[D]. 合肥: 安徽农业大学, 2016.
[5]沈海潇, 李鑫, 杨德全, 等. 上海地区犬细小病毒病流行情况调查与病毒的分离鉴定[J]. 畜牧与兽医, 2020, 52(12): 127-131.
[6]孙华博, 韩雨童, 宫冉冉, 等. 犬细小病毒病的诊断与防控[J]. 中国畜禽种业, 2021, 17(9): 150-151.
[7] Decaro N, Elia G, Martella V, et al. A real-time PCR assay for rapid detection and quantitation of canine parvovirus type 2 in the feces of dogs[J]. Veterinary microbiology, 2005, 105(1): 19-28.
[8] Steinmann J. Surrogate viruses for testing virucidal efficacy of chemical disinfectants[J]. Journal of Hospital Infection, 2004, 56: 49-54.
[9]陈昭斌, 张朝武. 消毒效果评价中指示病毒的应用[J]. 中国消毒学杂志, 2008(5): 528-530.
[10]吴云鼎, 解保生. 消毒对病毒杀灭效果的实验室评价[J]. 海南医学, 2016, 27(4): 613-616.
[11] Lee M, Seo D J, Seo J, et al. Detection of viable murine norovirus using the plaque assay and propidium-monoazide-combined real-time reverse transcription-polymerase chain reaction[J]. Journal of virological methods, 2015, 221: 57-61.
[12] Moreno L, Aznar R, Sánchez G. Application of viability PCR to discriminate the infectivity of hepatitis A virus in food samples[J]. International journal of food microbiology, 2015, 201: 1-6.
[13] Walter, Randazzo, Andrea, et al. Viability RT-qPCR to Distinguish Between HEV and HAV with intact and altered capsids[J]. Frontiers in microbiology, 2018, 9: 1-8.
表1 荧光PCR检测的引物和探针
Table 1 Primers and probes used in real-time PCR
基因名称 | 引物名称和序列(5'-3') | 扩增长度 (bp) |
VP2 | CPV-F: AAACAGGAATTAACTATACTAATATATTTA | 93 |
CPV-R: AAATTTGACCATTTGGATAAACT | ||
CPV-P: [FAM]- TGGTCCTTTAACTGCATTAAATAATGTACC-[BHQ1] |
注: CPV-F、CPV-R为引物, CPV-P为荧光标记探针。
(b)
第一作者:何斌(1975—),男,汉族,四川阆中人,硕士,副主任医师,主要从事传染病防治工作,E-mail: hebin1118@sina.com
通信作者:孙亚敏(1979—),女,汉族,新疆石河子人,硕士,副主任医师,主要从事传染病防治工作,E-mail: 2710028089@qq.com
1. 北京市海淀区疾病预防控制中心 北京 100094
1. Haidian District Center for Disease Control and Prevention, Beijing 100094








