CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
重要蚊虫复合组DNA鉴定芯片靶基因的适用性分析
作者:林诗颖 吴金枝 郭舒乐 余思宸 郑爱萍 黄恩炯
林诗颖 吴金枝 郭舒乐 余思宸 郑爱萍 黄恩炯
Abstract By analyzing the internal transcribed spacer region 2 (ITS2), cytochrome oxidation subunit I (COⅠ) and cytochrome b gene (Cytb) sequences of Aedes albopictus Subgroup, Culex vishnui Complex and Cx. pipiens Complex, the scientific foundation for the development of DNA identification chips for the three mosquitos complex (subgroup) was provided. PCR was used to amplify the sequences of COⅠ, ITS2 and Cytb genes, the applicability of three target genes for DNA identification microarrays of three mosquito complex was analyzed. Results showed that 24 gene sequences of COⅠ, Cytb and ITS2 were obtained from eight tested mosquito species. The A+T contents of COⅠ and Cytb were 74%, which were greater than that of ITS2; the genetic distance revealed that the evolutionary divergence among the three mosquito complex was greater than 0.200; the phylogenetic tree of the 3 genes showed that the mosquito sequences in the complex (subgroup) were clustered in a large branch and the reliability was greater than 98. The mosquito sequences in the Cx. pipiens Complex didn’t cluster with the corresponding sequence. This research showed that COⅠ, ITS2 and Cytb genes could be used in the development of gene chip for the identification of mosquitoes in Cx. vishnui Complex, Ae. albopictus Subgroup and some mosquitoes of Cx. pipiens Complex, which provided a new direction for mosquito identification.
Keywords mosquito complex; cytochrome oxidation subunit I (COⅠ); internal transcribed spacer region 2 (ITS2); cytochrome b gene (Cytb); identification
蚊虫是重要的医学昆虫,不仅吸食血液,还可通过叮咬传播疾病,严重威胁人类健康。蚊虫监测是预防和控制蚊媒病流行的重要工作,而蚊虫种类识别是进行有效防控的必要前提和基础。传统的蚊虫形态学分类主要通过其外部典型的形态特征进行鉴定,耗时费力且易受到遗传可变性和表型可塑性等因素的影响,即使是经验丰富的分类学家,对于外部形态差异细微的蚊虫复合组,也难以通过外部形态进行鉴定。以尖音库蚊复合组为例,需要解剖雄性外生殖器以明确其阳茎侧板中叶形态特征,才能对复合组内的亚种进行准确识别[1]。因此,传统的形态学分类方法已不能满足目前的蚊虫种类识别需求。
近年来,随着分子鉴定技术的不断成熟,DNA芯片技术在昆虫物种[2-4]、植物品种[5]、致病菌[6]及耐药性基因[7]的鉴定与检测领域被广泛应用。由于其体积小、特异性强及高通量等特点,被众多研究者青睐。探针设计是DNA芯片制作的关键步骤,而分子标记物的选择通常在探针设计中起决定性作用,合适的分子标记物是DNA鉴定芯片成功的前提。
COⅠ基因的密码子第三位核苷酸具有较高的碱基替换率,其进化速度约是16S rDNA或12S rDNA的3倍[8],常被用于区分具有密切亲缘关系的物种。Hebert等[9]证实该基因为可作为多数物种鉴定的金标准,并由此建立了DNA条形码技术。随后赵明等[10-11]将DNA条形码与DNA芯片技术相结合,并采用基因块motif技术,建立虚拟DNA条形码芯片,用于鉴定15种常见的蚊虫。WANG 等[12]利用COⅠ基因建立蚊种的DNA条形码数据库,更加完善了蚊虫鉴定系统并将我国主要蚊虫鉴定到种。有学者选用COⅠ基因作为分子标记基因,设计了16条特异性探针,制备出地中海实蝇及其近源种芯片和桔小实蝇复合种芯片两种检测芯片[13]。除此之外,ITS2-rDNA进化速度快,在不同物种之间的变异性相对较高,是物种鉴定和系统发育中使用最为广泛的分类标记[14]。选用ITS2基因对尖音库蚊复合组进行分子鉴定,成功地将淡色库蚊、骚扰库蚊同另外两种库蚊区分开,但该技术无法很好地区分尖音库蚊和骚扰库蚊[15]。王皙等[3]联用COⅠ和ITS2基因研发了可识别9种蚊虫的DNA芯片,但在实际应用中难以准确区分尖音库蚊复合组中的骚扰库蚊和致倦库蚊。除上述2种分子标志物以外,Cytb基因具有合适的长度和变异速率,在不同物种间具有明显的遗传差异,也常被学者们用于种属鉴定。有学者联用COⅠ和Cytb序列初步验证了这两个基因在吸血库蠓(尤其在近似、近源种)种类鉴别和系统发育分析的有效性[16],为后续更多分子标志物的开发奠定了基础。
本研究以白纹伊蚊亚组、杂鳞库蚊复合组和尖音库蚊复合组3个重要蚊虫复合组(亚组)中的常见蚊虫为研究对象,其中,白纹伊蚊亚组中的白纹伊蚊可传播登革病毒[17]、寨卡病毒[18]、尖音库蚊复合组为班氏丝虫[19]、西尼罗河病毒[20]和裂谷热病毒[21]的传播媒介;杂鳞库蚊复合组中的三带喙库蚊为流行性乙型脑炎[22]的传播媒介。通过扩增和基因序列测定,分析COⅠ、ITS2和Cytb基因在蚊虫复合组(亚组)DNA鉴定芯片研制中的适用性,以期为进一步提高蚊虫复合组的鉴定水平提供理论依据。
1 材料与方法
1.1 研究对象
本研究选择白纹伊蚊亚组(Ae. albopictus Subgroup)、杂鳞库蚊复合组(Cx. vishnui Complex)和尖音库蚊复合组(Cx. pipiens Complex)为研究对象。其中,尖音库蚊(Cx. pipiens)采自新疆,三带喙库蚊(Cx. tritaeniorhynchus)、伪杂鳞库蚊(Cx. pseudovishnui)、致倦库蚊(Cx. quinquefasciatus)、白纹伊蚊(Ae. albopictus)和伪白纹伊蚊(Ae. pseudalbopictus)采自福建。骚扰库蚊(Cx. moleslus)和淡色库蚊(Cx. pallens)分别由军事医学研究院微生物流行病研究所和大连国际旅行卫生保健中心惠赠。
1.2 蚊虫采集
1.2.1 捕捞法
在竹筒、水缸及污水池等蚊虫孳生地采集幼虫并做好编号,带回实验室饲养至成蚊后进行种类鉴定。
1.2.2 牛帐诱法
以黄牛为诱饵,将蚊帐四角撑开,分别固定于周边的树枝,蚊帐下缘距离地面30 cm。日落前后1 h,采用电动吸蚊器在帐外吸捕蚊虫,并将捕获的蚊虫用乙醚麻醉处理后带回实验室鉴定。鉴定过的蚊种置于75%酒精,-20℃保存。
1.2.3 CO2灯诱法
CO2诱蚊灯悬挂高度一般距离地面1.5 m左右,悬挂于居民居住地和蚊虫孳生地之间,选择相对僻静的背风处并确保周围无其他光源干扰。
1.3 主要试剂
基因组DNA提取试剂盒QIAGEN DNA、2 Taq PCR Mastermix、4S Red Plus核酸染色剂、DNA marker均购自天根生化科技(北京)有限公司。
Taq PCR Mastermix、4S Red Plus核酸染色剂、DNA marker均购自天根生化科技(北京)有限公司。
1.4 基因组DNA的提取
根据QIAGEN DNA提取试剂盒(货号:69504)说明书,稍加修改进行试验。取完整的蚊虫,用吸水纸吸干,移至1.5 mL离心管中,做好标记并称重。加入80 μL缓冲液Buffer ATL和100 μL PBS,匀浆,每隔5 min进行混匀,将提取的基因组DNA于-20℃保存备用。
1.5 目的基因PCR扩增
采用简并引物分别扩增8种蚊虫的COⅠ、ITS2以及Cytb基因,其中COⅠ及ITS2引物参照文献[23],Cytb引物由本研究小组设计,3对引物序列见表1。
表1 COⅠ、ITS2和Cytb片段扩增引物
Table 1 Fragment amplification primers for COⅠ, ITS2 and Cytb
引物名称 | 引物序列 (5'~3' ) | 目的片段长度 (bp) |
COⅠ-F | CAACAYTTATTYTGATTYTTTGG | 600 |
COⅠ-R | YCCTAARAARTGTTGWGGRAA | |
ITS2-F | CGGYGGATCACTYGGCTC | 400~600 |
ITS2-R | GTTRKTTTCTTTTCCTCCSC | |
Cytb-F | CGAATTTGTCATGCTAAYGGAGC | 800 |
Cytb-R | CATAAGGRTCTTCWACWGGTCGRG |
引物均由生工生物工程(上海)股份有限公司合成,反应体系见表2。反应条件:94℃预变性3 min;94℃变性30 s,50℃(ITS2、COⅠ)或55℃(Cytb)退火30 s,72℃延伸1 min,共30个循环;循环结束后72℃延伸5 min。扩增产物用1%琼脂糖凝胶电泳检测。PCR扩增产物送至专业公司进行体外克隆及双向测序。
表2 目的基因扩增体系
Table 2 Target gene amplification system
试剂名称 | 体积 (μL) |
ddH2O | 17.0 |
上游引物(10 μmol/L) | 1.5 |
下游引物(10 μmol/L) | 1.5 |
2×Taq PCR Mastermix | 25.0 |
Template DNA | 5.0 |
1.6 基因序列的分析
使用Chromas 2软件检查序列的峰图形状和测序质量,判断测序结果的可靠性。通过MEGA 7.0软件中的Clustal功能分别对3个目的基因序列进行多序列比对,并辅以手工校对,将导入的序列对齐到同一个水平。最后,针对比对后的序列分析8种蚊虫的碱基组成成分及遗传距离(Kimura 2-parameter distance)。
1.7 PCR产物序列分析及系统发育树构建
从NCBI数据库中下载与蚊虫目的基因同源性达98%的序列,运用DAMBE对所有的序列进行饱和度分析。若ISS<ISS.C,P<0.05,则序列未达到饱和,可构建系统发育树。同时,计算整体的平均距离判断是否适合Neighbor-Joint(NJ)法建树,若整体平均距离介于0和1之间,适合构建NJ树。
2 结果与分析
2.1 PCR扩增结果
8种蚊虫的扩增结果均符合预期长度。如图1所示,COⅠ基因均在600 bp左右;ITS2基因在400~600 bp之间;Cytb基因长度均为800 bp。
2.2 碱基含量
3个目的基因序列的A、T、C、G及A+T的百分比含量见表3。从碱基含量分析结果来看,3组复合组蚊虫的COⅠ基因序列的A、T、C、G比例范围分别在40.0%~41.0%、31.0%~31.7%、14.7%~15.1%、13.1%~13.4%;Cytb基因序列的A、T、C、G比例范围分别在41.1%~44.1%、30.8%~31.0%、12.7%~13.6%、13.2%~14.3%;ITS2基因序列的A、T、C、G比例范围分别是20.5%~23.6%、23.8%~26.6%、23.6%~27.5%、26.9%~28.4%。
2.3 基因遗传距离
8种蚊虫的遗传距离见表4~6。8种蚊虫之间的ITS2、COⅠ和Cytb核苷酸变异范围分别为 0~0.304、0.005~0.162、0.004~0.146,其中,ITS2的白纹伊蚊亚组内的遗传距离为0,尖音库蚊复合组内的变异范围介于0.002~0.010之间,杂鳞库蚊复合组的遗传距离为0.031;COⅠ的白纹伊蚊亚组内的遗传距离为0.021,尖音库蚊复合组内的变异范围介于0.005~0.01之间,杂鳞库蚊复合组内的遗传距离为0.055;Cytb的白纹伊蚊组内的遗传距离为0.06;尖音库蚊复合组内的变异范围介于0.004~0.006之间,杂鳞库蚊复合组内的遗传距离为0.073。以上3组基因的蚊虫复合组组内基因序列的遗传距离近,变异程度小,具有较高的遗传相似性。此外,不同属的进化以上3个基因的组间的进化分歧数均大于0.200,蚊虫复合组组间的遗传距离较大,表现出较远的亲缘关系。
2.4 系统发育
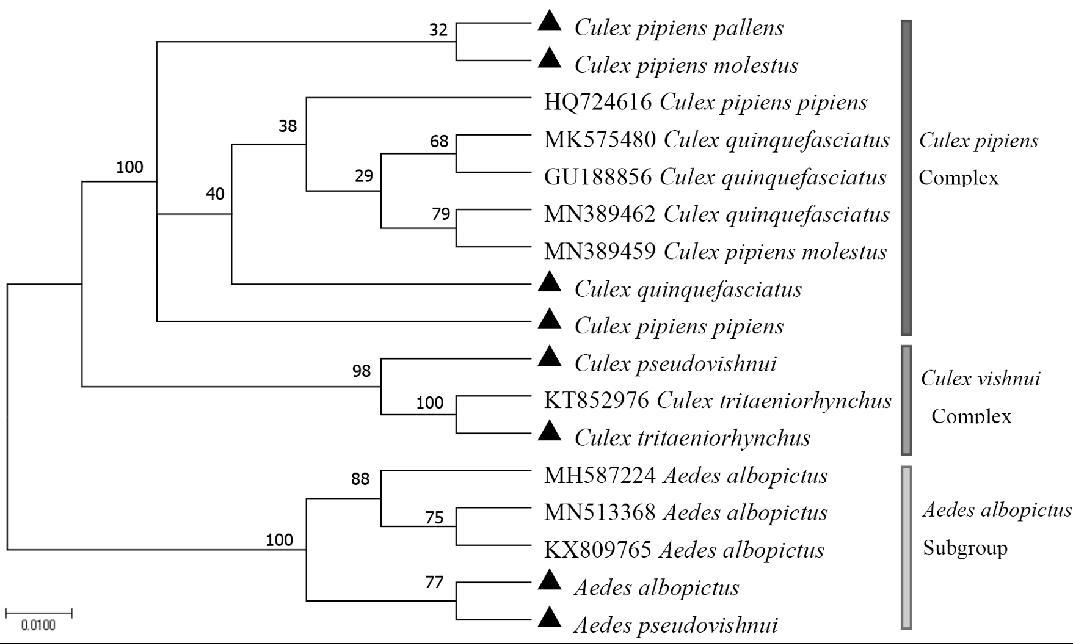
基因的碱基饱和性分析结果显示ISS<ISS.C,P<0.01,提示序列替换饱和度不高,即没有达到饱和,且整体的平均距离介于0~1之间,可采用NJ法建树。依据遗传距离kimura2-parameter双参数法,1000次检验分支树的bootstrap值,构建NJ树。3组基因构建的NJ树如图2~4所示,尖音库蚊复合组、杂鳞库蚊复合组和白纹伊蚊亚组均分别各自聚成一大簇,与形态学鉴定结果一致。
3 讨论
蚊媒传染病是严重的公共卫生问题。据统计,全世界每年约有3.5亿病例和50万人死于蚊媒传染病[24]。根据2019年中国大陆登革热流行趋势报告显示,28个省份登革热病例共22599例,较往年(2015—2018年)呈现明显上升趋势,病例分布范围显著增加[25-26]。另外,2005—2020年报告的流行性乙型脑炎病例为38714例,死亡率高达5.1%,是虫媒传染病中病死率较高的传染病[27]。而如何准确迅速地鉴定蚊种,成为了蚊媒疾病防治的前提。一直以来,复合组蚊虫的鉴定是生物分类上的重点和难点,国内外学者不断寻找合适的分子标志物用于区别复合组蚊虫。
研究结果显示,3组复合组(亚组)蚊虫均扩增得到COⅠ、ITS2及Cytb基因的特异性条带,其中COⅠ片段长度约600 bp;白纹伊蚊亚组ITS2片段长度约600 bp;尖音库蚊复合组ITS2片段长度约540 bp;杂鳞库蚊复合组ITS2片段长度约470 bp;Cytb片段为800 bp,与预期的大小一致。从不同位点的碱基含量来看,3组复合组蚊虫的COⅠ及Cytb基因序列组成在密码子的不同位点表现出较大的差异,尤其是在第2碱基位点,与文献[28]结果一致。从3组蚊虫A+T组成来看,白纹伊蚊亚组A+T平均含量为79%,尖音库蚊复合组为72%;杂鳞库蚊复合组为71%;3组复合组蚊虫Cytb基因序列的A+T平均含量范围约在72.2%~74.1%之间,3组蚊虫ITS2基因序列的A+T平均含量范围在45.4%~49.5%之间,这也与之前的报道[29]结果相近。一般来说,昆虫的线粒体基因富含碱基A和T,从本研究的Cytb、COⅠ基因序列碱基组成结果可以得出有AT碱基偏嗜,与其他昆虫线粒体基因碱基组成的基本特征一致。ITS2建树的结果显示3组复合组蚊虫目的基因的系统发育树主要分成三大支系,其中尖音库蚊复合组支系的淡色库蚊、尖音库蚊和骚扰库蚊、致倦库蚊各自聚成2个分支,而2个分支内的目标蚊虫与NCBI上相应的同源性高达99%以上的蚊虫序列的分支无法聚为一簇。除此之外,从序列的遗传距离来看,尖音库蚊复合组3种目的基因的组内遗传距离均小于1%,提示亲缘关系较近。
从本试验的结果来看,COⅠ、ITS2及Cytb基因能够很好地区分白纹伊蚊亚组、杂鳞库蚊组和尖音库蚊复合组的组间蚊虫,可设计出同时区分3组蚊虫的探针,但针对复合组内蚊虫的准确鉴别仍存在困难,尤其是尖音库蚊复合组。NJ建树结果可看出ITS2和COⅠ基因中的杂鳞库蚊组分为两支,可得出2组基因在识别杂鳞库蚊组存在一定的优越性,可应用于杂鳞库蚊复合组的芯片鉴定。建树结果提示ITS2可区分尖音库蚊复合组中的淡色库蚊、尖音库蚊和骚扰库蚊、致倦库蚊,说明ITS2基因在该复合组上具有潜在的分子鉴别能力。因此,可利用复合组蚊虫ITS2及COⅠ不同位点的碱基差异,联合多种基因,设计出专一性探针,研发可以同时识别以上的8种蚊虫的基因芯片。此外,还可通过增加或探求新的分子标记,如乙酰胆碱酯酶基因(acetylcholinesterase,AChE)[30],提高芯片鉴定的准确性,为复合组蚊虫的鉴定提供新的思路。
参考文献
[1]邢丹, 赵明惠, 张恒端, 等. 我国不同地理株尖音库蚊复合组雄蚊尾器的分类学研究[J]. 寄生虫与医学昆虫学报, 2015(3): 157-162.
[2]李文芬, 余道坚, 颜亨梅, 等. 地中海实蝇及其近缘种基因芯片检测研究[J]. 昆虫学报, 2008, 51(1): 61-67.
[3] WANG X, TU W C, HUANG E J, et al. Identification of Disease-Transmitting Mosquitoes: Development of Species-Specific Probes for DNA Chip Assay Using Mitochondrial COⅠ and ND2 Genes and Ribosomal Internal Transcribed Spacer 2[J]. Journal Medical Entomology, 2017, 54(2): 396-402.
[4]廉国胜, 汪海波, 林加燕, 等. 一种基于基因芯片同时鉴定三种伊蚊的探针及试剂盒[P].中国专利: 201510501427.4, 2018-06-19.
[5]邹枨, 许诚, 徐云碧. 一种DNA芯片及其在玉米品种鉴定和育种中的应用[P]. 中国专利:201610946296.5, 2017-03-29.
[6]李元曦, 夏应菊, 徐璐, 等. 可视化猪瘟病毒基因芯片鉴别检测方法的建立[J]. 中国预防兽医学报, 2021, 43(3): 274-279.
[7]周琴, 杨静, 范凌, 等. HRCA技术联合DNA芯片检测结核分枝杆菌利福平耐药基因突变的初步分析[J]. 标记免疫分析与临床, 2017, 24(7): 803-806.
[8] KNOWLTON N, WEIGT L A. New dates and new rates for divergence across the Isthmus of Panama[J]. Proceedings of the Royal Society B: Biological Sciences, 1998, 265(1412): 2257-2263.
[9] HEBERT P D, PENTON E H, BURNS J M, et al. Ten species in one: DNA barcoding reveals cryptic species in the neotropical skipper butterfly Astraptes fulgerator[J]. Proceeding of the National Academy of Science of Unite States of America, 2004, 101(41): 14812-14817.
[10]赵明, 谭玲, 莫帮辉, 等. DNA条形码识别 Ⅲ.媒介蚊类DNA条形码芯片的初步研究[J]. 中国媒介生物学及控制杂志, 2008(2): 99-103.
[11]赵明, 谭玲, 莫帮辉, 等. DNA条形码识别Ⅴ.有害生物鉴定的利器[J]. 中国卫生检验杂志, 2008, 18(6): 1216-1218.
[12] WANG G, LI C, GUO X, et al. Identifying the main mosquito species in China based on DNA barcoding[J]. PloS one, 2012, 7(10): e47051.
[13] 李文芬, 余道坚, 颜亨梅, 等. 地中海实蝇及其近缘种基因芯片检测研究[J]. 昆虫学报, 2008, 51(1): 61-67.
[14] MISHRA S, SHARMA G, DAS M K, et al. Intragenomic sequence variations in the second internal transcribed spacer (ITS2) ribosomal DNA of the malaria vector Anopheles stephensi[J]. PloS one, 2021, 16(6): e0253173.
[15]王娟, 元正菊, 何于雯, 等. 昆明地区尖音库蚊复合组蚊虫分子鉴定[J]. 云南畜牧兽医, 2021(1): 7-10.
[16]韩晓静. 中国西南地区库蠓属昆虫(双翅目:蠓科)的分类研究[D]. 遵义: 遵义医学院, 2017.
[17] LAMBRECHTS L, SCOTT T W, GUBLER D J. Consequences of the expanding global distribution of Aedes albopictus for dengue virus transmission[J]. PLoS Neglected Tropical Diseases, 2010, 4(5): e646.
[18] KOTSAKIOZI P, RICHARDSON J B, PICHLER V, et al. Population genomics of the Asian tiger mosquito, Aedes albopictus: insights into the recent worldwide invasion[J]. Ecology and Evolution, 2017, 7(23): 10143-10157.
[19] ANOSIKE J C, NWOKE B E, AJAYI E G, et al. Lymphatic filariasis among the Ezza people of Ebonyi State, eastern Nigeria[J]. Annals Agricultural Environmental Medicine, 2005, 12(2): 181-186.
[20] DURAND J P, SIMON F, TOLOU H. West Nile virus: in France again, in humans and horses[J]. La Revue du Praticien, 2004, 54(7): 703-710.
[21] HESSON J C, VERNER-CARLSSON J, LARSSON A, et al. Culex torrentium Mosquito Role as Major Enzootic Vector Defined by Rate of Sindbis Virus Infection, Sweden, 2009[J]. Emerging infectious diseases, 2015, 21(5): 875-878.
[22] ENDY T P, NISALAK A. Japanese encephalitis virus: ecology and epidemiology[J]. Current Topics Microbiology and immunology, 2002, 267: 11-48.
[23] CHEN Y H, LIU L Y, TSAI W H, et al. Using DNA chips for identification of tephritid pest species[J]. Pest Management Science, 2014, 70(8): 1254-1261.
[24] World Health Organization. Global vector control response 2017-2030[J]. Geneva Switzerland Who, 2017.
[25]刘起勇. 我国登革热流行新趋势、防控挑战及策略分析 [J]. 中国媒介生物学及控制杂志, 2020, 31(1): 1-6.
[26]戴安, 舒云, 刘平华, 等. 登革热流行现状及诊疗进展 [J]. 现代临床医学, 2022, 48(1): 69-72.
[27] 刘起勇. 2005—2020年我国媒介生物传染病报告病例:流行趋势、防控挑战及应对策略[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 1-7.
[28] 时伟. 应用线粒体全序列研究鲽形目鱼类的分子系统关系及演化 [D]. 青岛: 中国海洋大学, 2011.
[29]郭玉燕, 罗雷, 宋璋瑶, 等. 我国部分地区28种蚊虫的线粒体CO Ⅰ基因序列分析 [J]. 中国寄生虫学与寄生虫病杂志, 2017, 35(3): 280-287.
[30]邢丹. 中国尖音库蚊复合组分子系统学的研究 [D]. 北京: 中国人民解放军军事医学科学院, 2013.
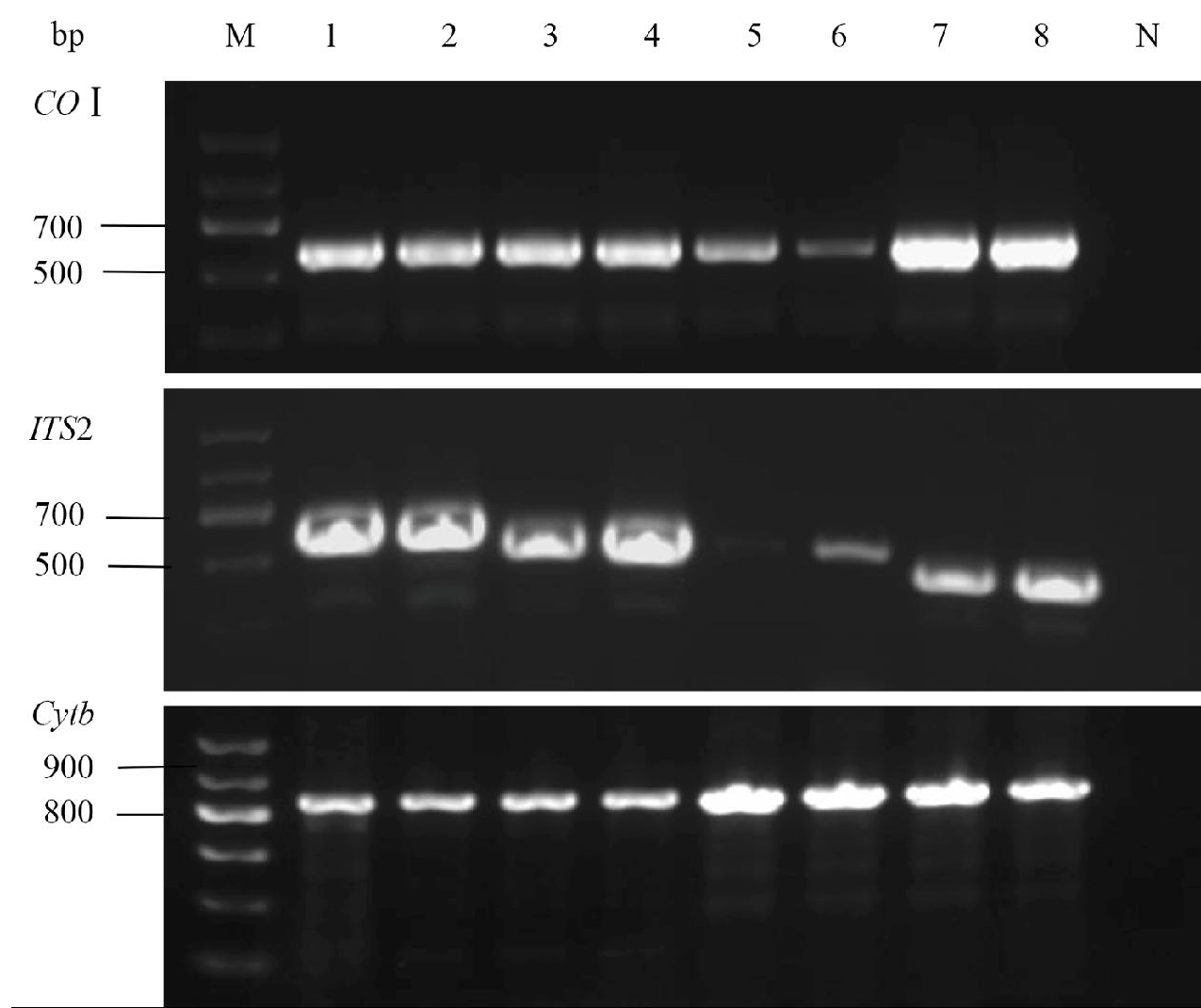
M: DNA标志物; N: 阴性对照; l: 白纹伊蚊; 2: 伪白纹伊蚊; 3: 淡色库蚊; 4: 致倦库蚊; 5: 骚扰库蚊; 6: 尖音库蚊; 7: 三带喙库蚊; 8: 伪杂鳞库蚊
图1 8种蚊虫COⅠ、ITS2和Cytb基因扩增产物电泳图
Fig.1 Electrophoretogram of amplification products of COⅠ, ITS2 and Cytb genes of eight mosquitoes
表3 COⅠ、ITS2及Cytb碱基序列组成分析
Table 3 Base composition of COⅠ, ITS2 and Cytb genes
蚊虫复合组 | 碱基分布 | 蚊虫复合组碱基构成比例 (%) | ||||||||||||||
ITS2 | COⅠ | Cytb | ||||||||||||||
平均含量 | 位点1 | 位点2 | 位点3 | 平均含量 | 位点1 | 位点2 | 位点3 | 平均含量 | 位点1 | 位点2 | 位点3 | |||||
亚组 | T | 23.8 | 25.0 | 22.0 | 24.9 | 31.7 | 30.0 | 46.5 | 19.0 | 31.0 | 20.0 | 28.0 | 41.5 | |||
C | 27.5 | 24.3 | 25.3 | 32.8 | 14.7 | 26.7 | 2.5 | 14.9 | 12.7 | 14.1 | 22.7 | 1.1 | ||||
A | 21.7 | 20.1 | 23.7 | 21.2 | 40.2 | 29.7 | 47.0 | 43.8 | 44.1 | 45.0 | 33.8 | 53.4 | ||||
G | 27.1 | 30.7 | 29.5 | 21.2 | 13.4 | 13.9 | 4.0 | 22.4 | 13.2 | 20.4 | 15.2 | 3.9 | ||||
A+T | 45.4 | 45.1 | 45.7 | 46.0 | 71.9 | 59.7 | 93.5 | 62.8 | 74.2 | 65.0 | 61.8 | 94.9 | ||||
复合组 | T | 26.6 | 47.0 | 25.0 | 28.8 | 31.0 | 29.0 | 45.0 | 19.0 | 31.0 | 21.0 | 27.4 | 45.0 | |||
C | 24.5 | 25.7 | 25.0 | 27.3 | 14.9 | 27.7 | 2.6 | 14.4 | 13.6 | 14.5 | 24.3 | 2.1 | ||||
A | 20.5 | 21.5 | 15.9 | 21.6 | 41.0 | 30.0 | 48.6 | 44.3 | 41.1 | 43.5 | 33.1 | 46.7 | ||||
G | 28.4 | 23.6 | 33.7 | 22.2 | 13.1 | 13.4 | 4.1 | 21.9 | 14.3 | 21.2 | 15.2 | 6.3 | ||||
A+T | 47.0 | 49.3 | 41.1 | 50.0 | 72.0 | 59.7 | 93.6 | 63.6 | 72.1 | 64.5 | 60.5 | 91.7 | ||||
复合组 | T | 25.9 | 22.3 | 26.0 | 29.6 | 31.1 | 28.0 | 45.5 | 19.0 | 30.8 | 21.0 | 27.3 | 44.0 | |||
C | 23.6 | 20.9 | 24.0 | 25.8 | 15.1 | 28.2 | 2.8 | 14.5 | 13.6 | 14.6 | 24.3 | 2.1 | ||||
A | 23.6 | 25.9 | 21.9 | 23.0 | 40.0 | 30.2 | 46.8 | 44.3 | 41.5 | 43.4 | 33.1 | 48.8 | ||||
G | 26.9 | 30.9 | 28.3 | 21.6 | 13.4 | 14.4 | 4.9 | 21.9 | 14.2 | 21.3 | 15.2 | 5.2 | ||||
A+T | 49.5 | 48.2 | 47.7 | 53.0 | 71.1 | 58.2 | 92.3 | 63.3 | 72.3 | 64.4 | 60.4 | 92.8 | ||||
表3(续)
表4 8种蚊虫ITS2基因遗传距离
Table 4 Genetic distance of ITS2 genes of eight mosquitoes
ITS2 | 白纹伊蚊 | 伪白纹伊蚊 | 淡色库蚊 | 致倦库蚊 | 骚扰库蚊 | 尖音库蚊 | 三带喙库蚊 | 伪杂鳞库蚊 |
白纹伊蚊 | — | — | — | — | — | — | — | — |
伪白纹伊蚊 | 0.000 | — | — | — | — | — | — | — |
淡色库蚊 | 0.298 | 0.298 | — | — | — | — | — | — |
致倦库蚊 | 0.304 | 0.304 | 0.006 | — | — | — | — | — |
骚扰库蚊 | 0.299 | 0.299 | 0.004 | 0.010 | — | — | — | — |
尖音库蚊 | 0.299 | 0.299 | 0.002 | 0.004 | 0.008 | — | — | — |
三带喙库蚊 | 0.257 | 0.257 | 0.069 | 0.074 | 0.071 | 0.074 | — | — |
伪杂鳞库蚊 | 0.275 | 0.275 | 0.077 | 0.076 | 0.079 | 0.076 | 0.031 | — |
注: “—”表示内容重复
表5 8种蚊虫COⅠ基因遗传距离
Table 5 Genetic distance of COⅠ genes of eight mosquitoes
COⅠ | 白纹伊蚊 | 伪白纹伊蚊 | 淡色库蚊 | 致倦库蚊 | 骚扰库蚊 | 尖音库蚊 | 三带喙库蚊 | 伪杂鳞库蚊 |
白纹伊蚊 | — | — | — | — | — | — | — | — |
伪白纹伊蚊 | 0.021 | — | — | — | — | — | — | — |
淡色库蚊 | 0.124 | 0.110 | — | — | — | — | — | — |
致倦库蚊 | 0.124 | 0.110 | 0.008 | — | — | — | — | — |
骚扰库蚊 | 0.115 | 0.110 | 0.007 | 0.008 | — | — | — | — |
尖音库蚊 | 0.117 | 0.113 | 0.005 | 0.010 | 0.005 | — | — | — |
三带喙库蚊 | 0.162 | 0.157 | 0.075 | 0.083 | 0.079 | 0.077 | — | — |
伪杂鳞库蚊 | 0.142 | 0.130 | 0.053 | 0.057 | 0.057 | 0.059 | 0.055 | — |
注: “—”表示内容重复
表6 8种蚊虫Cytb基因遗传距离
Table 6 Genetic distance of Cytb genes of eight mosquitoes
Cytb | 白纹伊蚊 | 伪白纹伊蚊 | 淡色库蚊 | 致倦库蚊 | 骚扰库蚊 | 尖音库蚊 | 三带喙库蚊 | 伪杂鳞库蚊 |
白纹伊蚊 | — | — | — | — | — | — | — | — |
伪白纹伊蚊 | 0.06 | — | — | — | — | — | — | — |
淡色库蚊 | 0.132 | 0.134 | — | — | — | — | — | — |
致倦库蚊 | 0.132 | 0.134 | 0.005 | — | — | — | — | — |
骚扰库蚊 | 0.130 | 0.132 | 0.004 | 0.004 | — | — | — | — |
尖音库蚊 | 0.134 | 0.132 | 0.006 | 0.004 | 0.005 | — | — | — |
三带喙库蚊 | 0.143 | 0.143 | 0.107 | 0.011 | 0.106 | 0.106 | — | — |
伪杂鳞库蚊 | 0.145 | 0.146 | 0.097 | 0.099 | 0.098 | 0.094 | 0.073 | — |
注: “—”表示内容重复
▲为试验所用蚊虫
图4 8种蚊虫的Cytb基因NJ系统发育树
Fig.4 NJ phylogenetic tree of Cytb gene of eight mosquitoes

▲为试验所用蚊虫
图2 8种蚊虫的COⅠ基因NJ系统发育树
Fig.2 NJ phylogenetic tree of COⅠgene of eight mosquitoes

▲为试验所用蚊虫
图3 8种蚊虫的ITS2基因NJ系统发育树
Fig.3 NJ phylogenetic tree of ITS2 gene of eight mosquitoes
基金项目:深圳市科技计划项目(JSGG20210901145407021),海关总署科研项目(2021HK167)
第一作者:冯雨宸(1999—),男,汉族,上海金山人,硕士,主要从事生物技术研究,E-mail: 2397098755@qq.com
通信作者:余道坚(1971—),男,汉族,江西上饶人,博士,研究员,主要从事动植物检疫与处理研究,E-mail: 178863850@qq.com
1. 中国计量大学生命科学学院 杭州 310018
2. 深圳海关动植物检验检疫技术中心 深圳 518045
3. 中广核金沃科技有限公司 深圳 518118
1. Life Science College, China Jiliang University, Hangzhou 310018
2. Animal & Plant Inspection and Quarantine Technology Center of Shenzhen Customs, Shenzhen 518045
3. CGN Jinwo Irradiation Technology Co., Ltd., Shenzhen 518118








