CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
4种方法确诊口岸一例疟疾疑似病例应用研究
作者:马千里 胡双双 刘才万 石泉 杨国平 苏小建 胡学锋 杨庆贵
马千里 胡双双 刘才万 石泉 杨国平 苏小建 胡学锋 杨庆贵
Abstract A suspected case of malaria imported at the Nanjing port was diagnosed by four detection methods, including thick and thin blood smear microscopy, RDT malaria antigen detection, real-time fluorescent quantitative PCR and micro-drop digital PCR, and the application scenarios of different detection methods were compared and analyzed to provide technical support for the prevention and control of infectious diseases at the port. Plasmodium falciparum was positive in the four detection methods, and the original concentration of nucleic acid was 157 copies/μL in the micro-drop digital PCR detection. The results showed that the RDT antigen detection was the most rapid and simple with the lowest comprehensive cost among the four detection methods. With a clear epidemiological history and clinical manifestations of the case, RDT malaria antigen detection can be conducted first, and the other three methods can be used as auxiliary detection methods.
Keywords port; malaria; microscopy of Plasmodium; droplet digital PCR; real-time fluorescence quantitative PCR; RDT Plasmodium antigen detection
疟疾是一种以蚊虫叮咬为主要传播方式的虫媒传染病,病原体为疟原虫。疟原虫( Plasmodium)是一类单细胞、寄生性的原生动物类群,属原生动物门顶复亚门(Apicomplexa)孢子纲(Sporozoea)球虫亚纲(Coccidia)真球虫目(Eucoccidiida)血孢子亚目疟原虫科[1]。恶性疟原虫、卵形疟原虫、三日疟原虫、间日疟原虫4种疟原虫是致人类疟疾的主要病原体,其中死亡率最高的是恶性疟[2]。直至今天,疟疾防控形势依然严峻,在非洲等落后地区疟疾依然是威胁生命的一大公共卫生风险。2021年全球估计有2.47亿疟疾病例,疟疾死亡人数估计为61.9万人[3]。我国在2021年6月30日已通过世卫组织无疟疾认证[4],但是每年依然有数千例输入性病例。因此,建立快速准确的疟原虫检测方法对于口岸疟疾的防控具有重要意义。
1 材料与方法
1.1 材料
1.1.1 样本
用EDTA-K2抗凝管采集入境发热病人全血。存储于实验室4℃样本冰箱中。
1.1.2 仪器
Quantistudio 5荧光定量PCR仪(ABI公司);QX200TM Droplet DigitalTM PCR检测系统,包括微滴生成仪和微滴读取仪(Biorad公司);奥林巴斯CX43显微镜。
1.2.3 试剂
贝索瑞氏染色液;香柏油;胶体金法恶性疟原虫/间日疟原虫检测试剂盒(蓝十字生物药业有限公司);凯杰血液核酸提取试剂盒QIAamp DNA Blood Mini Kit (50);ddPCRTM Supermix for Probes(1863023,Biorad公司);疟原虫荧光PCR核酸检测试剂盒,包括通用型和分型试剂盒(广州达安生物科技有限公司);用于ddPCR的疟原虫引物和TaqMan荧光探针:18S rRAN-F 5'-GCTCTTTCTTGATTTCTTGGATG-3',18S rRAN-R 5'-AGCAGGTTAAGATCTCGTTCG-3',18S rRAN-P5'-VIC-ATGGCCGTTTTTAGTTCGTG-TAMRA-3'。
1.2 方法
1.2.1 核酸提取
使用QIAamp DNA Blood Mini Kit试剂盒(凯杰)提取血样中DNA,存储于-20℃样本冰箱备用。
1.2.2 厚薄血膜涂片镜检
薄血膜滴加5~8滴瑞氏染液,染色1~2 min后加5~8滴蒸馏水。将染液和蒸馏水混匀后引到厚血膜上,染色10 min。用清水冲去染液,晾干。
1.2.3 RDT疟原虫抗原检测
在试剂卡样品孔加入5 μL全血,随后加入3~4滴稀释液,15 min后观察结果。判定标准为:在质控线(C)和检测线(T1、T2)处显示红色条带即恶性/间日疟原虫抗原阳性;在质控线(C)和检测线(T1)处显示红色条带即恶性疟原虫抗原阳性;在质控线(C)和检测线(T2)处显示红色条带即间日疟原虫抗原阳性;只有质控线(C)处显示红色条带为阴性;其余结果无效。
1.2.4 实时荧光定量PCR反应体系和反应条件
实时荧光定量PCR反应体系为PCR反应液A 17 μL,PCR反应液B 3 μL,扩增体系20 μL。PCR反应条件见表1。
反应体系中加入5 μL DNA模板,以表1反应条件上机扩增。
1.2.5 ddPCR反应体系及条件
利用微滴生成器,在微滴发生卡样本孔中加入反应液和70 μL微滴发生油制备反应微滴,ddPCR反应体系见表2;在96孔PCR反应板中加入样品的微滴并进行扩增,扩增程序见表3。
表1 实时荧光定量PCR反应条件
Table 1 Real-time fluorescence quantitative PCR reaction condition
阶段 | 循环数 | 温度 (℃) | (时:分:秒) | 荧光信号采集 |
1 | 1 | 50 | 00:02:00 | — |
2 | 1 | 95 | 00:15:00 | — |
3 | 40 | 94 | 00:00:15 | — |
55 | 00:00:45 | √ |
表2 ddPCR反应体系
Table 2 ddPCR reaction system
试剂 | 体积 (μL) |
2×ddPCRTM Supermix for Probes | 10 |
DNA模板 | 2 |
引物 | 1.6 |
探针 | 0.5 |
无菌去离子水 | 补足至20 |
表3 ddPCR扩增程序
Table 3 ddPCR amplification procedure
阶段 | 循环数 | 温度 (℃) | 反应时间 (时:分:秒) |
1 | 1 | 95 | 00:10:00 |
2 | 40 | 94 | 00:30:00 |
55.5 | 00:00:60 | ||
3 | 1 | 98 | 00:10:00 |
反应结束后,采用微滴分析仪进行分析,用Quantasoft 1.7.4 软件自动处理数据。
2 结果
2.1 疟原虫镜检结果
薄血膜涂片可见恶性疟原虫环状体(图1),初步判断为恶性疟原虫感染。
图1 疟原虫薄血膜涂片检测结果
Fig.1 Results of Plasmodium thin blood film smear
2.2 RDT抗原检测结果
依据试剂说明书判断检测结果为恶性疟原虫抗原阳性,如图2所示。

图2 疟原虫抗原检测结果
Fig.2 Results of Plasmodium antigen test
2.3 荧光定量PCR结果
依据4种疟原虫核酸扩增图谱可判断样本恶性疟原虫核酸阳性,其他3种疟原虫核酸检测阴性,PCR扩增图谱如图3~6所示。
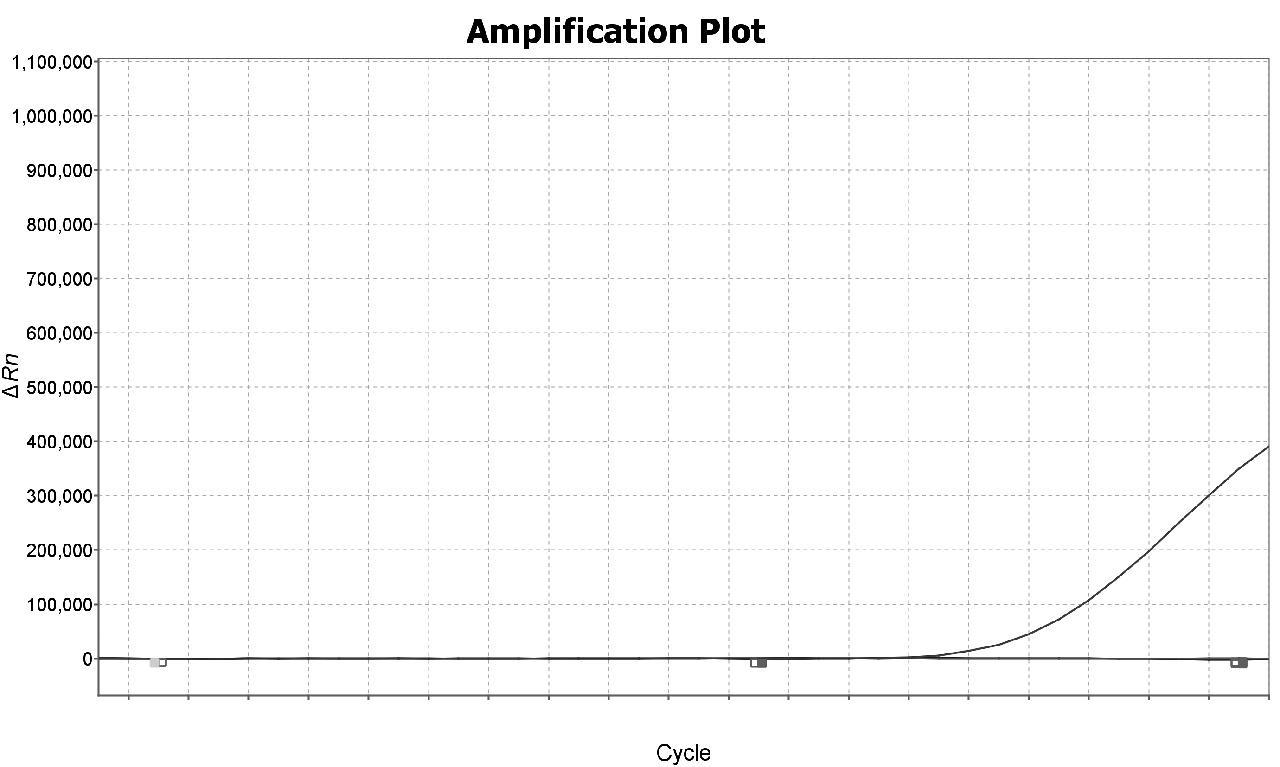
图3 恶性疟原虫PCR扩增图谱
Fig.3 PCR amplification map of Plasmodium falciparum
2.4 ddPCR结果
ddPCR一维荧光振幅图如图7所示,根据软件分析结果计算出恶性疟原虫核酸原始浓度为157 copies/μL。
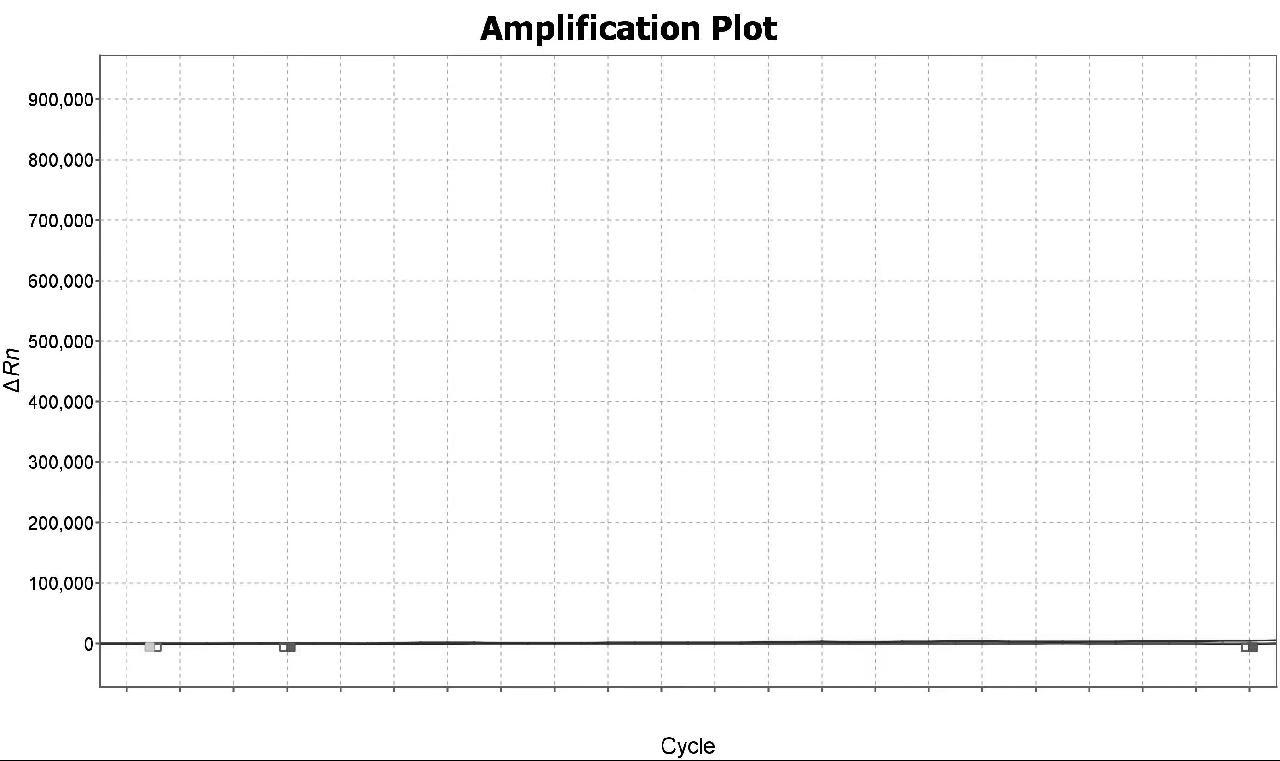
图4 间日疟原虫PCR扩增图谱
Fig.4 PCR amplification map of Plasmodium vivax
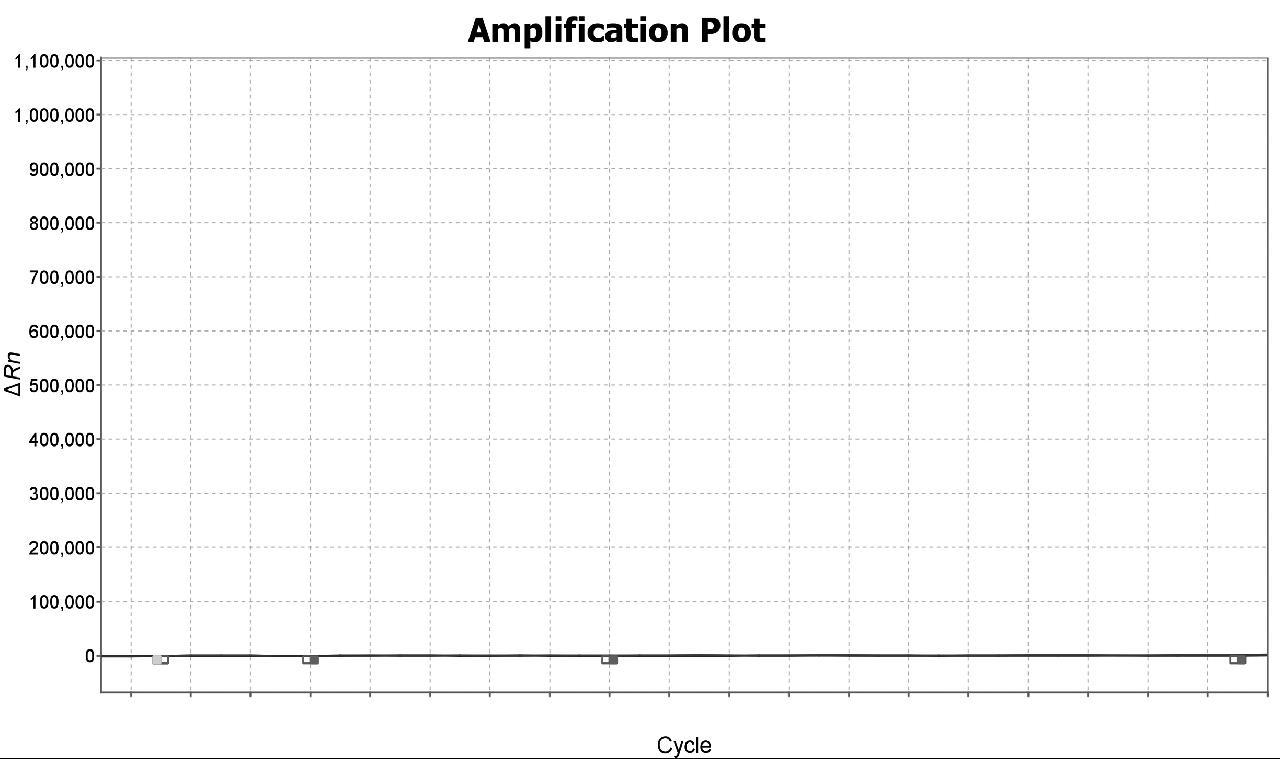
图5 三日疟原虫PCR扩增图谱
Fig.5 PCR amplification map of Plasmodium malariae
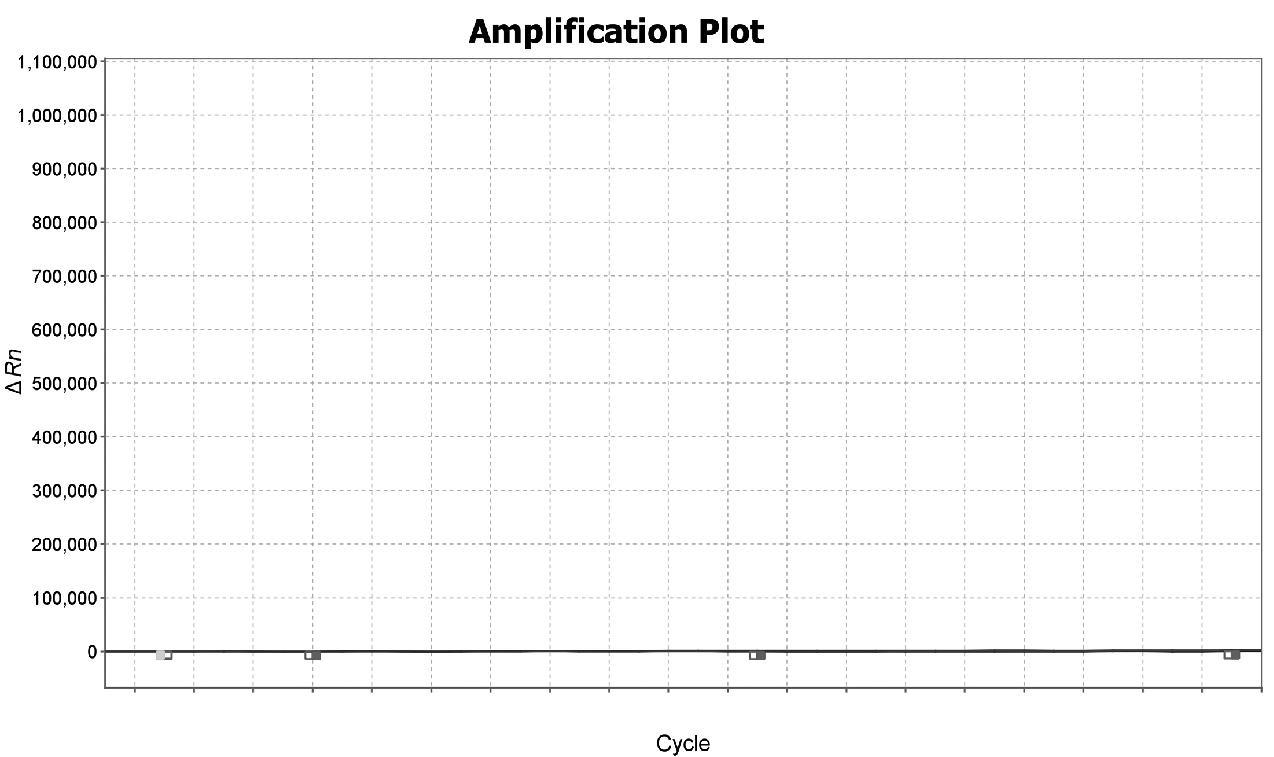
图6 卵形疟原虫PCR扩增图谱
Fig.6 PCR amplification map of Plasmodium ovale
3 讨论
口岸经常有入境旅客出现不明原因发热的情况,此时通常会优先排查流感以及一些常见虫媒传染病,例如寨卡、黄热、疟疾等,通过流行病学调查和观察临床症状可缩小排查范围,再结合实验室病原学检测可进行初步诊断。
疟疾的检测方法通常有厚薄血涂片镜检、RDT(rapid diagnostic test)疟原虫抗原检测、实时荧光定量PCR(real time qPCR)。此3种检测方法呈阳性并结合临床症状及流行病史均可确诊疟疾[5]。其中,血涂片镜检是最为直接的手段,通过显微镜查找疟原虫不同阶段的结构来确认病例是否感染疟疾,优点是快速直接,但是对检测人员要求较高,需要丰富的经验。另外,形态学检查具有较强的主观性,容易造成误判。RDT疟原虫抗原检测是一种简便、快速的检测方法,利用免疫层析式双抗体夹心法,定性检测人全血中间日疟原虫特有的特异性乳酸脱氢酶(pLDH)、恶性疟原虫特有的富组氨酸蛋白(HRPII)[6],具有较强的特异性,对检测人员要求不高,适用于现场、疫区等条件较差的地区,成本低廉,对于疟疾疫情的全球防控具有重要意义,但是灵敏度相对较低。荧光定量PCR检测具有灵敏度高、特异性强等优点,对检测人员培训要求相对不高,但是对硬件设施要求较高,不适于偏远及欠发达地区开展大规模筛查。
微滴式数字PCR(droplet digital polymerase chain reaction,ddPCR)的概念由Kenneth Kinzler和Bert Vogelstein于1999年首次提出[7],其基本原理是将样本中的待检测核酸分子分配至几万甚至几十万份的微滴中,此过程遵循泊松分布(P(X=k)= ),最终使核酸分子在每个微滴中独立扩增产生荧光信号,检测器收集荧光信号并统计出未扩增微滴占总微滴的比例,最后通过泊松分布公式计算出样品中待检测核酸分子的拷贝数,该方法有极低的检测下限,理论上可达到2 copies/μL。
),最终使核酸分子在每个微滴中独立扩增产生荧光信号,检测器收集荧光信号并统计出未扩增微滴占总微滴的比例,最后通过泊松分布公式计算出样品中待检测核酸分子的拷贝数,该方法有极低的检测下限,理论上可达到2 copies/μL。
疟疾的传统检测方式为显微镜检查,通常以厚血膜查找原虫,薄血膜鉴定虫种。镜检查见疟原虫为疟疾感染最为直接的病原学证据,因此镜检在疟疾诊断中占有重要地位。但是与其他检测手段相比,形态学检查不易标准化,不确定因素多,现阶段缺少有经验的镜检人员,这些都限制了其在诊断中的应用。RDT抗原检测灵敏度和特异性较好,具有操作简便、时效性强等优点,对于针对性鉴定恶性疟原虫具有优势,目前是疟疾的诊断标准之一,但是大部分抗原检测试剂只能同时检测恶性疟原虫和间日疟原虫,在虫种鉴定方面存在一定局限性。实时荧光定量PCR相较抗原检测具有更高的灵敏度和特异性,可很好地满足疟疾的诊断需求,但是操作比较烦琐,设备和试剂成本较高。微滴数字PCR(ddPCR)是一种新技术,能够以高分析灵敏度和精密度对核酸进行绝对定量。ddPCR通过微流控芯片将PCR试剂分成数万个纳升或皮升,使每个液滴包含0或1个DNA模板。PCR扩增和荧光检测后,通过泊松统计根据正负液滴数计算目标核酸,与传统的qPCR相比,数字PCR具有更高的灵敏度、特异性和准确性,适用于样本中极微量核酸的检测。
4 结论
通过比较几种方法在实际中的应用,结合当前以输入性病例为主的疟疾防控形势,可以将RDT疟原虫抗原检测作为首选方法,并以疟原虫显微镜检查、微滴式数字PCR、实时荧光定量PCR等方法作为辅助检测方法,有利于缩短检测时间和节约检测成本。
参考文献
[1] Burton Bogitsh, Clint Carter. Thomas Oeltmann, Human Parasitology[M]. Oxford: Elsevier, 2018.
[2] Zhang Q, Lai S, Zheng C, et al. The epidemiology of Plasmodium vivax and Plasmodium falciparum malaria in China, 2004—2012: from intensified control to elimination[J]. Malaria Journal, 2014, 13(1): 1-9.
[3] Zhou X N. China declared malaria-free: a milestone in the world malaria eradication and Chinese public health[J]. Infectious diseases of poverty, 2021, 10(1): 98-99.
[4] Mancusi A, Giordano A, Bosco A, et al. Development of a drop-let digital polymerase chain reaction tool for the detection of Toxoplasma gondii in meat samples[J]. Parasitology Research, 2022, 121(5): 1467-1473.
[5]中华人民共和国国家卫生和计划生育委员会. 疟疾的诊断: WS 259-2015[S].北京: 人民卫生出版社, 2015.
[6] Ricks K M, Adams N M, Scherr TF, et al. Direct transfer of HRPII-magnetic bead complexes to malaria rapid diagnostic tests significantly improves test sensitivity[J]. Malaria journal, 2016(15): 399.
[7] Zhang T, Niu Z, Wu F, et al. Qualitative and quantitative detection of surgical pathogenic microorganisms Escherichia coli and Staphylococcus aureus based on ddPCR system[J]. Scientific Reports, 2021, 11(1): 8771.
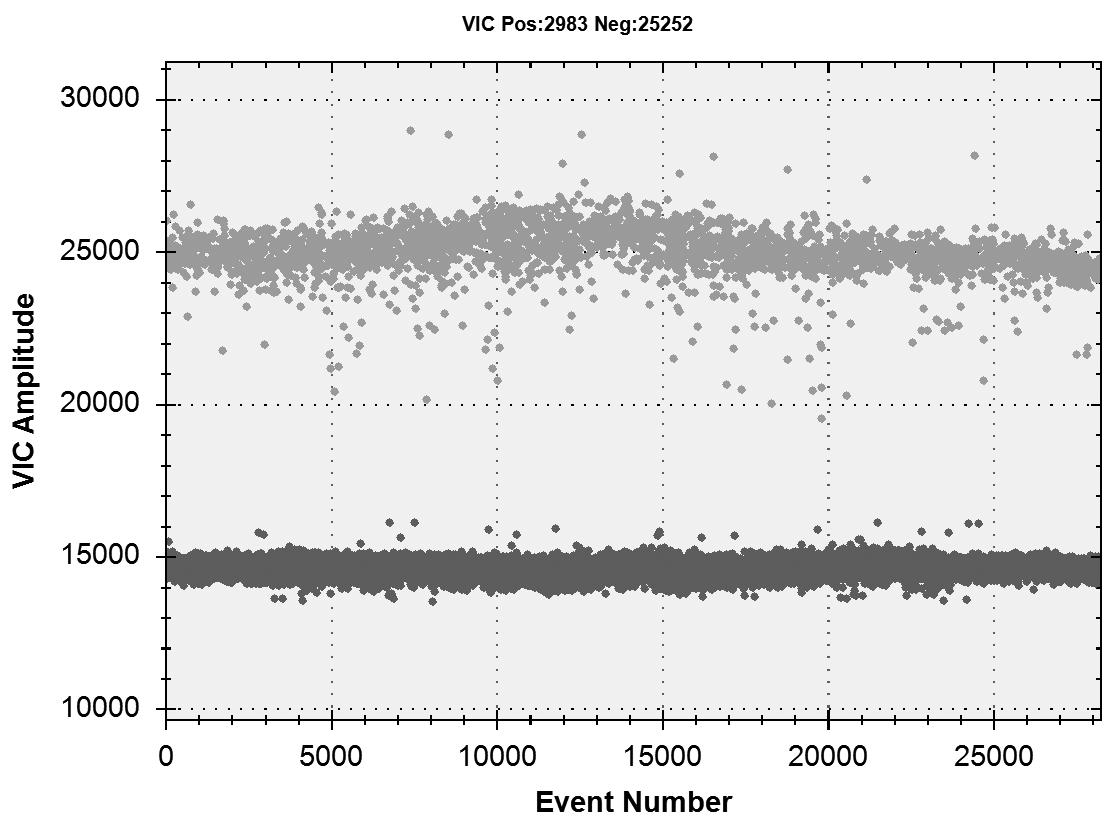
图7 恶性疟原虫ddPCR一维荧光振幅图
Fig.7 ddPCR one-dimensional fluorescence amplitude map of Plasmodium falciparum








