CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
一步法实时荧光RT-PCR在疟原虫检测中的应用
作者:何丽润 曾华颖 郑夔 戴俊 师永霞 孙芳芳 杨可航 蔡扬尧
何丽润 曾华颖 郑夔 戴俊 师永霞 孙芳芳 杨可航 蔡扬尧
疟疾,俗称“打摆子”,是一种广泛流行于热带和亚热带地区的寄生虫疾病,它是通过蚊媒叮咬传播的疾病。在我国属于乙类传染病,分为间日疟、卵形疟、三日疟、恶性疟和诺氏疟,其中恶性疟危害最大。目前我国疟疾病例都来自境外输入,主要输入来源地是非洲和东南亚。我国虽不是疟疾主要流行地,但随着我国与非洲、东南亚国家间的贸易往来和旅游业发展,输入性疟疾病例在我国有不断上升的趋势。
疟疾的诊断方法有疟原虫血膜片形态镜检、抗体血清学检查或胶体金快速诊断试剂,以及PCR检测。但当虫体密度较低时(<50个原虫/μL)[1],传统的镜检法易受血片制作、染色质量、染色时间、显微镜质量和检验人员镜检专业水平等因素影响。当发病初期疟原虫密度较低或因服药原因导致血液中疟原虫形态不典型时,容易发生漏判和误判。血清学抗原检测虽对设备要求低,具备快速敏感的优点,但却不能有效区分混合感染疟原虫。近年来成为主流检测方法的PCR检测技术能在短时间内很好地识别并对疟原虫分型。该技术通过体外扩增,对目标DNA或RNA在短时间内完成成百上千次的扩增,极大地提高了检测的敏感性和特异性。该方法克服了镜检漏判误判的缺陷,提高了疟疾诊断效率,对疟原虫基因进行检测具有独特优势[2]。有文献和资料表明,18S rRNA基因是稳定的基因之一[3],它在细菌、植物、高等脊椎动物的某些器官、不同的发育阶段都较为稳定,因而被推广用作各种生物的体内蛋白编码基因表达水平检测的内参基因[4-9]。目前用于疟原虫PCR检测的特异性片段一般都是检测疟原虫的基因组DNA,用一步实时荧光RT-PCR方法检测疟原虫18SrRNA是基于巢式PCR检测方法[10]而进行的探讨性实验。
1 材料与方法
1.1 血样来源
样品来源于广州白云机场海关在旅检口岸对有发热、寒战、皮肤丘疹症状的旅客进行全血样品采集;2% ETDA-Na2 抗凝。血样送到实验室后,通过镜检为阳性,储存于-80℃超低温冰箱。
1.2 主要试剂和仪器
核酸提取试剂为上海之江生物科技股份有限公司产品,货号Z-ME-0044A;核酸检测试剂为东洋纺(上海)生物科技有限公司生产的THUNDERBIRD Probe qPCR Mix和THUNDERBIRD Probe One-step qPCR Kit。
所用仪器为上海之江生物医药科技有限公司生产的EX3600核酸自动提取仪;荧光定量PCR仪为上海之江生物医药科技有限公司生产的Mic-4实时荧光定量PCR仪;超低温冰箱为三洋公司生产的-80℃冰箱。
1.3 核酸提取
从-80℃冰箱取出全血样本,经室温解冻、混匀离心后,每个样本取300 μL加至提取反应板A行中,按核酸提取程序MVN-3.0提取,用时40 min。提取后放4℃冰箱保存。
1.4 引物与探针的设计
本研究选用的引物和探针是基于疟原虫属的18S rRNA核酸序列而设计。引物扩增的rRNA片段在疟原虫的染色体1、5、7、11和13上均重复出现。正向引物P.spp-FP: 5'-GTTTAAGACAAGAGTAGGATTGACAG-3',反向引物P.spp-RP: 5'-CCAGACAAATCATATTCACGAACTA-3'。探针序列P.spp-Pro: 5' FAM- AACGGCCATGCATCACCATCCAAGAAATC-3' BHQ1。引物和探针由本实验室自行设计,由上海生物工程有限公司合成。
1.5 一步法实时荧光RT-PCR和实时荧光PCR扩增
THUNDERBIRD Probe One-step qPCR Kit试剂盒是通过以高效率逆转录酶ReverTra Ace为逆转录酶和以Tth DNA Polymerase为PCR酶的两酶体系进行一步法荧光定量PCR的试剂盒。主要使用TaqMan分析法进行荧光定量PCR。因为逆转录反应与PCR在同一反应体系中连续进行,反应液的分装操作一次就可以结束,可高灵敏度地检测出各种各样的RNA。
将提取好的核酸加入MIC专用tube中,根据试剂盒说明书进行荧光定量PCR仪器参数设置。一步法实时荧光RT-PCR法步骤如下:逆转录反应温度50℃ 10 min,预变性95℃ 1 min,45个循环(95℃ 15 s,60℃ 45 s),单点荧光检测在60℃,检测通道选择FAM。反应体系为20 μL(RNase water 1 μL、2×Reaction Buffer 10 μL、DNA Polymerase 0.5 μL、RT Enzyme Mix 0.5 μL、Primer 3 μL、RNA 模板 5 μL)上机进行扩增。
实时荧光PCR步骤如下:预变性反应温度95℃ 1 min,45个循环(95℃ 15s,60℃ 45 s),单点荧光检测在60℃,检测通道选择FAM。反应体系为20 μL(灭菌蒸馏水 2 μL、THUNDERBIRD Probe qPCR Minx 10 μL、Primer 3 μL、DNA 模板 5 μL)上机进行扩增。
1.6 重复性实验
选择一份镜检阳性血样用镜检阴性样本进行10倍倍比稀释,稀释成10-0、10-1、10-2、10-3、10-4、10-5、10-6。取稀释度为10-2的阳性样本,用一步法实时荧光RT-PCR和实时荧光PCR对其重复进行7次检测,以检验方法的重复性。
1.7 灵敏度实验
将稀释度为10-0、10-1、10-2、10-3、10-4、10-5、10-6的样本,分别用一步法实时荧光RT-PCR和实时荧光PCR对其进行检测,每个样本重复2次,用以检测灵敏度。
1.8 临床样本检测实验
对20份疟原虫镜检阳性、5份阴性血样分别用2种扩增方法进行检测,并对检测结果进行分析。
1.9 结果判定
根据以下条件进行结果判定,疟原虫FAM通道对应的检验样本无明显扩增曲线,且未检测到Ct值,判断为疟原虫荧光PCR检测阴性;FAM通道对应的检验样本Ct值≤35,并有明显扩增曲线,判断为疟原虫荧光PCR检测阳性,应使用疟原虫种特异性引物和探针进行进一步的疟原虫种类鉴定;FAM通道对应的检验样本为35<Ct值<40时,标本应重做,若重做结果仍然有明显扩增曲线,则判断为疟原虫荧光PCR检测阳性,反之为阴性。
2 结果与分析
2.1 重复性实验
用稀释度为10-2的样本重复7次,用一步法实时荧光RT-PCR方法均在第26个循环时起扩增曲线,曲线一致,重复性较好,如图1所示。实时荧光PCR的7次检测均有扩增曲线,但曲线较为分散,如图2所示。
图1 一步法实时荧光RT-PCR重复性检测曲线
Fig.1 One-step qRT-PCR repeatability detection curve
图2 实时荧光PCR重复性检测曲线
Fig.2 qPCR repeatability detection curve
2.2 灵敏度实验
在一步法实时荧光RT-PCR法中,第18个循环出现稀释度为10-0的扩增曲线,最低可检测出的稀释度为10-5,为曲线6。扩增曲线如图3所示。用实时荧光PCR在第27个循环出现稀释度为10-0的扩增曲线,最低可检测出的稀释度为10-2。扩增曲线如图4所示。
2.3 临床样本检测实验
一步法实时荧光RT-PCR对20份阳性样本检测,所有样本均检出为阳性,出现明显扩增曲线。最早出现扩增曲线的样本,Ct值为9.73。最后出现扩增曲线的样本,Ct值为34.22。其余样本的Ct值均在10~30以内,呈现出明显的S型扩增。5份阴性样本未检出(图5)。
1~6分别为稀释度10-0、10-1、10-2、10-3、10-4、10-5、10-6扩增曲线
图3 一步法实时荧光RT-PCR 灵敏度检测曲线
Fig.3 One-step qRT-PCR sensitivity detection curve
1~3分别为稀释度10-0、10-1、10-2扩增曲线
图4 实时荧光PCR灵敏度检测曲线
Fig.4 qRT-PCR sensitivity detection curve
图5 25个样本的一步法实时荧光RT-PCR检测曲线
Fig.5 One-step qRT-PCR detection curve of 25 samples
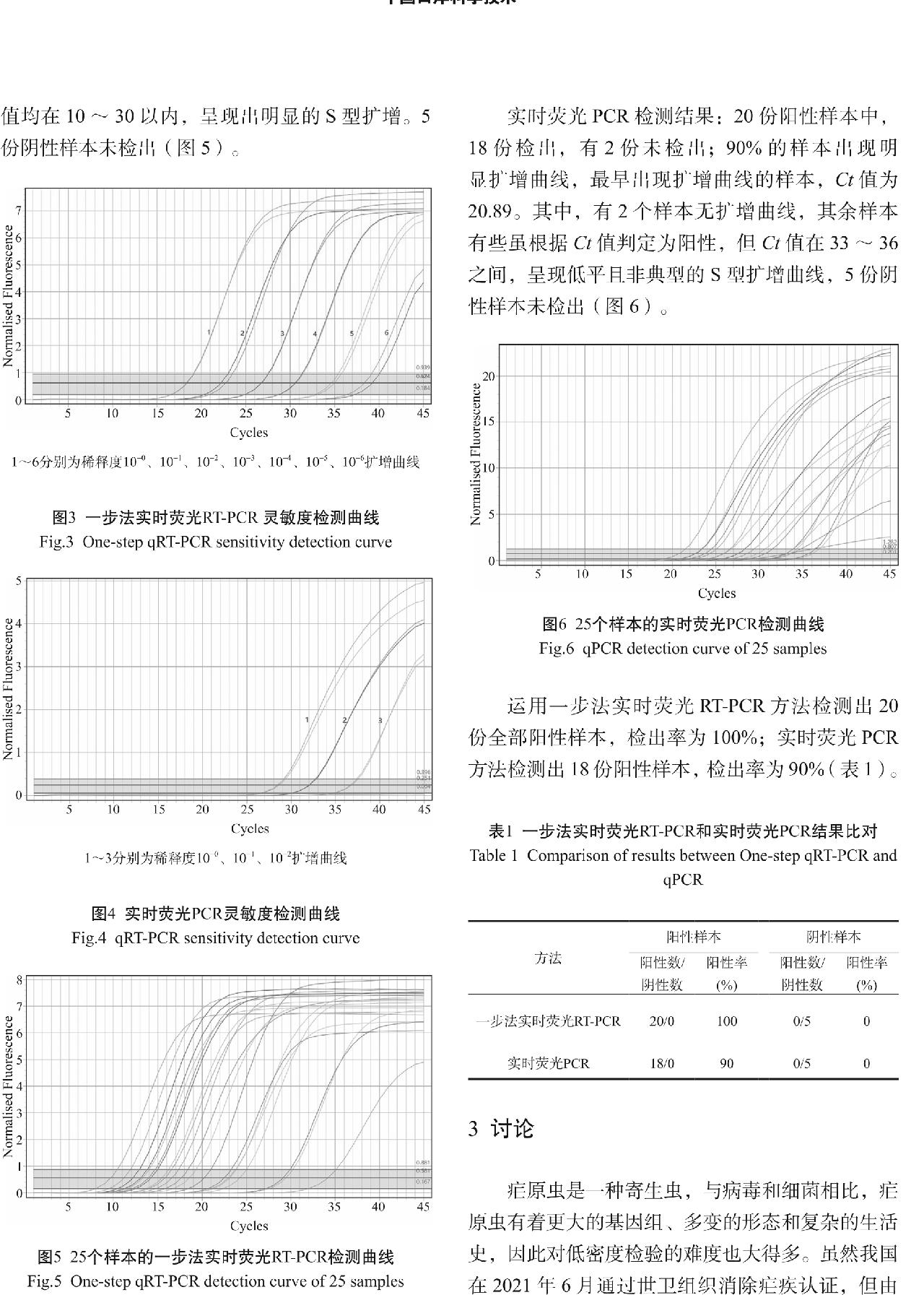
实时荧光PCR检测结果:20份阳性样本中,18份检出,有2份未检出;90%的样本出现明显扩增曲线,最早出现扩增曲线的样本,Ct值为20.89。其中,有2个样本无扩增曲线,其余样本有些虽根据Ct值判定为阳性,但Ct值在33~36之间,呈现低平且非典型的S型扩增曲线,5份阴性样本未检出(图6)。
图6 25个样本的实时荧光PCR检测曲线
Fig.6 qPCR detection curve of 25 samples
运用一步法实时荧光RT-PCR方法检测出20份全部阳性样本,检出率为100%;实时荧光PCR方法检测出18份阳性样本,检出率为90%(表1)。
表1 一步法实时荧光RT-PCR和实时荧光PCR结果比对
Table 1 Comparison of results between One-step qRT-PCR and qPCR
方法 | 阳性样本 | 阴性样本 | |||
阴性数 | (%) | 阴性数 | (%) | ||
一步法实时荧光RT-PCR | 20/0 | 100 | 0/5 | 0 | |
实时荧光PCR | 18/0 | 90 | 0/5 | 0 | |
3 讨论
疟原虫是一种寄生虫,与病毒和细菌相比,疟原虫有着更大的基因组、多变的形态和复杂的生活史,因此对低密度检验的难度也大得多。虽然我国在2021年6月通过世卫组织消除疟疾认证,但由于人员的跨境流动,每年仍有一定数量的疟疾病例输入,并时有重症和死亡病例的发生。伴随新冠病毒感染“乙类乙管”及出入境政策的调整,境外务工、旅游人员归国返乡后,可能会导致输入性疟疾病例数的增加,若出现漏诊或误诊,会危及生命。
本研究结果显示,一步法实时荧光RT-PCR方法的重复性较好,可检出的最低稀释度比实时荧光PCR方法更低,其差值为103。用一步法实时荧光RT-PCR方法检测的Ct值均比实时荧光PCR要小。因Ct值与模版的起始拷贝数的对数存在一定线性关系,Ct值每相差3.3,代表样本中疟原虫的浓度就相差10倍。证明选择检测疟原虫的总RNA和DNA增加了目标基因起始拷贝数。
本研究另增加了用凯杰试剂盒单独提取总RNA和DNA进行两种检测方法对比的补充实验。结果也显示:用一步法实时荧光RT-PCR方法检测RNA比实时荧光PCR方法检测DNA的Ct值更小,同一样品的Ct差别10个循环。在一步法实时荧光RT-PCR方法里添加反转录酶,增加反转录步骤[11],同时检测RNA和DNA,提高了检测的灵敏度,有助于检出低拷贝数的弱阳性样本。因此得出结论:一步法实时荧光RT-PCR方法检测总RNA和基因组DNA比实时荧光PCR方法的敏感性更高。
2023年4月26日是第16个“全国疟疾日”,随着国家疫情防控措施的优化调整,“一带一路”等国际交流合作将促使商业贸易回到疫情前水平,出入境航班会继续增加,疟疾防控也面临越来越大的压力。因此,推广一步法实时荧光RT-PCR这个方法可以提高对于弱阳性的样本初筛诊断准确率,做到对输入性疟疾病例早发现、早处置,尽可能避免出现重症和死亡病例,为防止该病传入国境口岸提供技术保障,确保出入境秩序平稳有序、口岸边境安全稳定[12]。
参考文献
[1]王晗, 谢娜, 耿伟, 等. 3例输入性恶性疟病例的快速检测[J].标记免疫分析与临床, 2014, 22(8): 718-720.
[2]吕少茵. 荧光定量PCR仪检测疟原虫的研究分析[J].中国医疗器械信息, 2016, 22(18): 34-35.
[3] Bejon P, Andrews L, Andersen RF, et al. Calculation of liver-to-blood inocula, parasite growth rates, and preerythrocytic vaccine efficacy, from serial quantitative polymerase chain reaction studies of volunteers challenged with malarias porozoites[J]. The Journal of Infectious Diseases, 2005, 191(4): 619-626.
[4] 刘季, 宋贞柱, 谢润红, 等. 大鼠死后脑组织RNA降解与死亡时间推断大研究[J]. 中国法医学杂志, 2007, 22(4): 226-228+232.
[5]薛承美, 解延娜, 叶素丹, 等. 利用实时荧光定量PCR筛选新蚜虫疬霉内参基因[J]. 农业生物技术学报, 2014, 22(12): 1575-1583.
[6]叶文静, 侯配强, 赵晓民, 等. 荧光定量聚合酶链反应比较标准管家基因3-磷酸甘油醛脱氢酶、β-肌动蛋白、酸性核糖体蛋白PO及18S核糖体RNA在老年大鼠不同组织中的表达[J]. 中国组织工程研究与临床康复, 2008, 12(18): 3515-3518.
[7]罗霞, 文晓鹏. 火龙果UQT和18S rRNA内参基因片段的克隆及表达分析[J].山地农业生物学报, 2015, 34(2): 23-26.
[8]杨磊, 张煜, 赵超建, 等.老年和青年大鼠大脑皮质及肝脏内参基因mRNA表达的对比分析[J]. 现代预防医学, 2013, 40(17): 3250-3252+3255.
[9]张慧琴, 谢鸣, 肖金平, 等. 猕猴桃实时荧光定量PCR分析中内参基因的筛选[J]. 浙江农业学报, 2015, 27(4): 567-573.
[10]邵雷, 朱姗姗, 胡文佳, 等.荧光定量PCR技术检测疟原虫方法初探[J]. 中国输血杂志, 2020, 33(11): 1144-1147.
[11] E Kamau, LS Tolbert, L Kortepeter, et al. Development of a highly sensitive genus-specific quantitative reverse transcriptase real-time PCR assay for detection and quantitation of plasmodium by amplifying RNA and DNA of the 18S rRNA genes[J]. Journal of Clinical Microbiology, 2011(8): 2946–2953.
[12]师永霞, 苏锦坤, 洪烨, 等. 疟疾的实时荧光PCR快速检测方法[J]. 中国卫生检验杂志, 2013, 21(3): 625-627.
第一作者:何丽润(1989—),女,汉族,广东河源人,本科,主管技师,主要从事卫生检验工作,E-mail: 335399950@qq.com
通信作者:郑夔(1969—),男,汉族,广东湛江人,本科,主任技师,主要从事卫生检验工作,E-mail: gdiqtcp@163.com
1. 广州海关技术中心 广州 510000
1. Guangzhou Customs District Techonology Center, Guangzhou 510000

基金项目:海关总署科研项目(2021HK219),福建省科技厅科研项目(2022I0028),福州海关科研项目(FK2020-27)
第一作者:许一鸣(1991—),男,汉族,福建福州人,本科,工程师,主要从事矿产品检测工作,E-mail: crowxym@qq.com
通信作者:戴金兰(1977—),女,土家族,湖北恩施人,硕士,正高级工程师,主要从事工业品检测技术研究,E-mail: 29171239@qq.com
1. 福州海关技术中心 福州 350000
2. 天津海关工业产品安全技术中心 天津 300450
1. Fuzhou Customs Technical Centre, Fuzhou 350000
2. Tianjin Customs Industrial Product Safety Technology Center, Tianjin 300450