CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
HPLC-MS/MS法测定热带水果中新烟碱类杀虫剂哌虫啶和环氧虫啶
作者:庄鹏 纪少凡 谢宏洋 李备
庄鹏 纪少凡 谢宏洋 李备
Abstract An optimized QuEChERS pretreatment method was established to determine the residues of neonicotinoid insecticides paichongding and cycloxaprid in four tropical fruits (Citrus sinensis, Litchi chinensis Sonn., Hylocereus megalanthus and Nephelium lappaceum L.) in Hainan by combining high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). At the same time, the extraction of salts, the optimization of chromatographic mass spectrometry conditions, and matrix effects were also studied. In this method, acetonitrile was used as extraction solvent, primary-secondary amine (PSA), graphitized-carbon blacks (GCB) and C18 dispersive solid phase extraction were used for purification, liquid chromatography-mass spectrometry/mass spectrometry were used for detection, and external standard was prepared with matrix liquid. Under the optimized conditions, the limit of detection (LOD) and limit of quantity (LOQ) of piperidine and cycloxaprid were 0.3 μg/kg and 1.0 μg/kg, respectively. The average recoveries of the four tropical fruits (Citrus sinensis, Litchi chinensis Sonn., Hylocereus megalanthus and Nephelium lappaceum L.) were 80.5%-97.7%, and the relative standard deviation was between 3.7%-17.7%. By methodological verification and sample measurement, this method was simple, accurate, reproducible and low in quantitative limit, and was suitable for the determination of of paichongding and cycloxaprid in tropical fruits of Hainan.
Keywords QuEChERS; HPLC-MS/MS; neonicotinoid insecticides; paichongding; cycloxaprid
新烟碱类杀虫剂具有独特的生物特性,其基本结构由杂环部分、桥链部分、含氮环装或者开环部分和药效基团部分组成[1]。这种分子结构使其具有广谱性,在高效杀灭害虫的同时对哺乳动物具有低毒的特性,这些优势使新烟碱类杀虫剂被广泛运用于热带水果种植。但其不合理使用将对热带水果品质的把关提出挑战,也会成为影响热带水果品质的不安全因素之一[2-3]。有研究表明,葡萄和橘子对于儿童的新烟碱类杀虫剂的残留急性风险较高[4],误服过量新烟碱类杀虫剂会导致呼吸急促、心血管和神经系统紊乱,影响生殖系统[5-6],严重的甚至危及生命[7]。新烟碱杀虫剂的化学性质相对不稳定,具有极性强和易挥发的特性,可选择高效液相色谱法(high performance liquid chromatography,HPLC)[8]进行有效分析检测。水果中新烟碱类杀虫剂检测过程前处理方法主要有分散液液微萃取[9-10]、固相萃取法[11-12]和分子印记法[13-15]等。
哌虫啶和环氧虫啶是我国注册的4种新型新烟碱类杀虫剂中的2种。据文献报道,环氧虫啶可用于柑橘中黄龙病[16-17]防治,哌虫啶可用于哈密瓜中对烟粉虱进行防治[18],但暂时没有对热带水果基质中哌虫啶和环氧虫啶进行分析检测的相关文献报道,因此,亟须建立热带水果中的新烟碱类农药哌虫啶和环氧虫啶的测定方法。随着新的新烟碱类农药化合物的出现,农药结构也越来越复杂。就哌虫啶分子结构而言,哌虫啶分子具有2个手性中心,存在4个立体的异构体,并以2对非对映的异构体形式存在,这导致其液相色谱串联质谱(Liquid Chromatograph Mass/Mass Spectrometer,LC-MS/MS)谱图呈现出2个同分异构体峰[19-20]。对于多种新烟碱类杀虫剂来说,提取的时间越长越复杂,涉及的实验过程越多,对新烟碱类杀虫剂的提取回收率就越差,尤其是对于降解速率相对较快的新烟碱类杀虫剂,检测结果的不准确性也会相对放大[21]。例如分散液液微萃法会产生大量化学试剂消耗,当出现化合物干扰时无法准确分析;固相萃取法的提取和净化过程繁琐、时间长、效率低,耗材费用相对较高,溶剂转换过程会影响回收率的稳定;分子印记法配套的前处理设备价格昂贵、操作可行性低。所以本研究选择QuEChERS法,其具有前处理速度快、净化效果好、回收率损失低等优点,并且被大多数检测分析人员所接受,符合绿色化学的环保理念。
本研究针对海南多种热带水果种植生长过程中可能使用的2种新烟碱类杀虫剂,基于QuEChERS方法建立了热带水果中哌虫啶和环氧虫啶残留的快速检测方法,对提取溶剂、净化方法、仪器条件等进行深入研究。
1 材料与方法
1.1 试剂与设备
乙腈、甲醇、甲酸均为色谱纯,购自安谱公司;N-丙基乙二胺(PSA)粉末购自DIKMA公司;石墨化碳(GCB)粉末、C18粉末购自Agilent公司;相针式滤器(13 mm有机0.22 μm孔径)购自安谱公司。标准品:质量分数≧99.0%、质量浓度为100.0 μg/mL的哌虫啶标准储备液和质量分数≧99.0%、质量浓度为100.0 μg/mL的环氧虫啶标准储备液购自坛墨质检公司,分别用甲醇溶液配制成10.0 μg/mL的液体,-20℃避光保存。
高效液相色谱仪串联质谱仪(Waters公司UPLC系列,美国SCIEX公司 API4000Q四极杆质谱仪);电喷雾离子源;Harvard II注射针泵(美国SCIEX公司);低温高速离心机(KEM Mikro 220R);BS224S 电子天平(Sartorius公司);溶剂蒸发仪(英国Genevac公司)。
本实验选取了海南省典型的热带水果绿橙(Citrus sinensis)、荔枝(Litchi chinensis Sonn.)、燕窝果(Hylocereus megalanthus)和红毛丹(Nephelium lappaceum L.)进行多区域采集分析。
1.2 样品预处理
分别将荔枝和红毛丹样品称重,去果核后用匀浆机组织粉碎;绿橙和燕窝果样品带皮称重,用匀浆机组织粉碎[22],于50 mL聚四氟乙烯具塞离心管中准确称取均质的样品5 g(精确至0.01 g),加入5 mL乙腈、2 g无水硫酸镁、0.5 g氯化钠、0.5 g柠檬酸钠、0.3 g柠檬酸二钠,涡旋3 min,9000 r/min离心5 min;取上清液1 mL,加入0.5 g N-丙基乙二胺(PSA),0.2 g石墨化碳(GCB)和0.2 g C18粉末净化,涡旋混合2 min,离心3 min后过0.22 μm有机滤膜,吸取净化后的上清液500 μL,并加500 μL水,待测[23]。
1.3 色谱条件
色谱柱:CAPCELL PAK C18 MGП 3.0 mm I. D.×150 mm,5 μm;柱温:30℃;流速:1.0 mL/min;进样量:10 μL;流动相洗脱条件见表1。
表1 流动相梯度洗脱条件
Table 1 Gradient elution conditions of mobile phase
时间 (min) | 乙腈 (%) | 5.0 mmol/L乙酸铵甲酸水溶液 (%) |
0.0 | 10.0 | 90.0 |
3.0 | 90.0 | 10.0 |
5.0 | 90.0 | 10.0 |
5.1 | 10.0 | 90.0 |
6.0 | 10.0 | 90.0 |
1.4 质谱条件
离子源:电喷雾离子源(ESI+),正离子扫描;离子源温度:600℃,离子源电压:5000 V;雾化器温度:600℃;多反应监测(MRM)模式;雾化气流速:1000 L/h,锥孔气流速:55 L/h,以高纯氮气作为通用气体应用在雾化气、气帘气、辅助气和碰撞气中。MRM离子扫描参数见表2。
2 结果与讨论
2.1 提取盐种类的选择
在新烟碱类杀虫剂的提取过程中,pH会对目标化合物回收率产生影响,而在前处理过程中利用提取盐调节pH,不同种类的提取盐对目标化合物的提取效率也有所不同。本实验通过比较3种提取盐类的提取效率,确定最优选择。(1)2 g无水硫酸钠、0.5 g氯化钠;(2)2 g无水硫酸镁、0.5 g氯化钠;(3)2 g无水硫酸镁、0.5 g氯化钠、0.5 g柠檬酸钠、0.3 g柠檬酸二钠。经实验比对,采取上述3种盐类提取哌虫啶的回收率分别为80%、83%和87%;环氧虫啶的回收率分别为85%、81%、95%。由于海南热带绿橙、荔枝、燕窝果和红毛丹的pH处于3.0~5.0之间,柠檬酸二钠和柠檬酸钠的提取成分会调节水果中的pH,使得提取过程中的pH处在6.0左右的一个状态,在该范围内能够对哌虫啶和环氧虫啶中的提取效率和回收率起到稳定作用。
2.2 色谱-质谱条件的优化
本实验比较了100 mm的Zorbax Eclipase XDB-C18色谱柱和100 mm的CAPCELL PAK-C18对新烟碱类农药哌虫啶和环氧虫啶的分离效果,明显看出CAPCELL PAK-C18的分离效果较好,在长度相同的情况下,选择了粒径较小、色谱柱填料的粒子较细的CAPCELL PAK-C18色谱柱。由图1可以看出,CAPCELL PAK-C18色谱柱峰形尖锐,相应相对较高,分离度好,对目标化合物哌虫啶和环氧虫啶保留好。由于哌虫啶和环氧虫啶的极性相对较强,CAPCELL PAK-C18色谱柱能够很好的保留目标物,所以该实验选择CAPCELL PAK-C18色谱柱进行分析。金苗等[24]对水中的新烟碱类杀虫剂的分析时用C18色谱柱分析目标化合物时得到良好的分离效果,如图1和图2所示。
考察了水-乙腈和水-甲醇作为流动相分别对哌虫啶和环氧虫啶的影响,对比发现从响应、分离的整体效果和系统的压力方面考虑,水-乙腈体系要优于水-甲醇体系。针对此体系,为了得到更好的流动相,考察了5 mmol/L乙酸铵水溶液-乙腈、5 mmol/L乙酸铵水溶液含(1‰甲酸)-乙腈对分离效果的影响。发现在流动相体系中加入1‰甲酸后,在正离子模式下,甲酸提供了质子供体,质谱离子化程度增加,响应增强,故选择5 mmol/L乙酸铵水溶液含(1‰甲酸)-乙腈作为该分析实验的流动相。

图1 哌虫啶和环氧虫啶在CAPCELL PAK-C18色谱柱上的总离子流图
Fig.1 Total ion chromatogram of paichongding and cycloxaprid on the CAPCELL PAK-C18 column
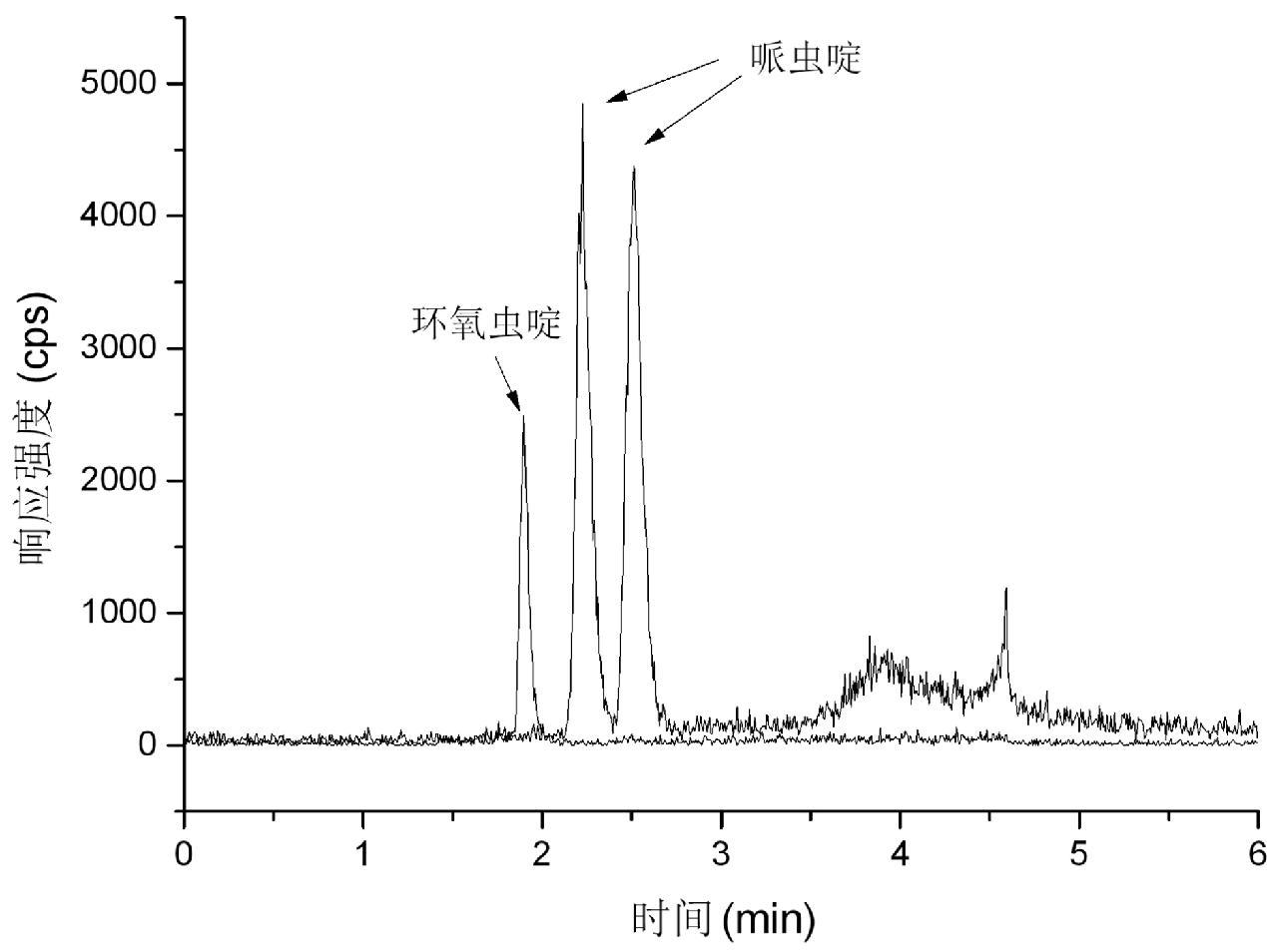
图2 哌虫啶和环氧虫啶在Zorbax Eclipase XDB-C18色谱柱上的总离子流图
Fig.2 Total ion chromatogram of paichongding and cycloxaprid on the Zorbax Eclipase XDB-C18 column
2.3 基质效应评价
采用液质分析方法进行样品检测时往往伴随基质效应的产生,基质效应的大小会对结果分析产生比较大的影响,因此针对热带水果中的哌虫啶和环氧虫啶的分析需要考虑基质效应。基质效应(ME)是用于研究共提取化合物对分析物信号的影响,可通过比较基质和溶剂的响应值峰面积进行计算,其公式为ME=(基质峰面积/溶剂峰面积)×100%[25]。本实验选取热带水果绿橙、荔枝、燕窝果和红毛丹4种阴性基质样品分别进行萃取净化,选取阴性基质提取液配制10 ng/mL的标准点,每种基质做6个平行,将平行样品的平均值结果与乙腈水溶液(按照乙腈∶水=1:1配制)配制的10 ng/mL标准点比较,以此来判断基质效应的强弱。|ME-100%|>50%表明该基质对农药具有强基质效应,20%<|ME-100%|≤50%为中等基质效应,|ME-100%|≤20%为弱基质效应。结果显示,哌虫啶和环氧虫啶在绿橙、荔枝、燕窝果和红毛丹4种阴性基质样品中的基质效应范围在85%~130%之间。其中,荔枝、燕窝果和红毛丹基质样品会产生微弱的基质抑制效应,配置曲线时可以直接考虑纯溶剂定量;绿橙样品会产生中等的基质增强效应,配置曲线需要考虑基质提取液配制曲线定量,降低基质效应对目标物的干扰。
2.4 线性关系及检出限
标准曲线溶液配制采用热带水果提取的基质提取液(按照提取液∶水=1:1配制)定容。因为直接用纯的有机试剂配制会产生溶剂效应,导致峰形分叉、峰形变宽,无法准确定性,回收率低,不利于准确定量。而采用基质提取液配置标准曲线溶液,可以有效减小基质效应,提高灵敏度使峰形正常,减少对回收率的影响。
将新烟碱类杀虫剂哌虫啶的单标储备液(浓度为10.0 μg/mL)和环氧虫啶的单标储备液(浓度为10.0 μg/mL)用乙腈定容,配制成新烟碱类杀虫剂哌虫啶和环氧虫啶的混合标准工作液(浓度为0.1 μg/mL),准确吸取混合标准工作液5.0 μL、10.0 μL、20.0 μL、50.0 μL、100.0 μL、200.0 μL、500.0 μL,分别用基质提取液准确定容至1.0 mL,得到浓度为0.5 ng/mL、1.0 ng/mL、2.0 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL、50.0 ng/mL的新烟碱类杀虫剂哌虫啶和环氧虫啶混合标准工作液曲线,采用外标法定量。以添加10个样品最低浓度计算检出限(limit of detection,LOD),定量限(limit of quantity,LOQ),LOD=标准偏差×3;LOQ=标准偏差×10。表3结果显示,哌虫啶和环氧虫啶的检出限为0.3 μg/kg,定量限为1.0 μg/kg。GB/T 27404—2008《实验室质量控制规范 食品理化检测》中对于确证方法校准曲线的要求为决定系数R2>0.98,结果显示,水果基质提取液中的新烟碱类目标杀虫剂哌虫啶和环氧虫啶呈良好的线性关系,R2>0.99,表明该方法符合检测要求(表3、图3、图4)。
表3 哌虫啶和环氧虫啶农药的线性方程及决定系数
Table 3 The linear equations and coefficient Determination of cycloxaprid and paichongding
化合物 | 线性方程 | R2 | (μg/kg) | (μg/kg) |
哌虫啶 | y=1612.8x+724.18 | 0.9991 | 0.3 | 1.0 |
环氧虫啶 | y=2063.3x-940.44 | 0.9982 | 0.3 | 1.0 |

图3 哌虫啶的线性方程
Fig.3 Linear equations of the paichongding

图4 环氧虫啶的线性方程
Fig.4 Linear equations of the cycloxaprid
2.5 回收率与精密度试验
本方法以海南岛市面上较常见的热带水果绿橙、荔枝、燕窝果和红毛丹作为样品基质进行加标回收率和精密度试验,称取5 g(精确至0.01 g)样品进行3水平加标(0.001 mg/kg、0.05 mg/kg、0.010 mg/kg)、6个平行的加标回收率试验,测定后得到新烟碱类杀虫剂的回收率和相对标准偏差,样品基质的平均回收率为80.5%~97.7%,相对标准偏差在3.7%~17.7%之间,详细结果见表4~7。根据GB/T 27404—2008对相对标准偏差 (RSD)的要求,被测组分含量为0.001 mg/kg时,RSD应小于30%,被测组分含量为0.010 mg/kg时,RSD应小于21%,因此表明该结果符合GB/T 27404—2008的检测要求。
3 结论
本研究以热带水果作为基质原料,乙腈作为提取试剂,N-丙基乙二胺、石墨化碳和C18作为净化原料,采用QuEChERS技术,经过液相色谱串联质谱分析研究,以新烟碱类杀虫剂残留检测方法为研究对象,建立了热带水果中新烟碱类杀虫剂哌虫啶和环氧虫啶的残留含量的分析方法。通过对绿橙、荔枝、燕窝果和红毛丹基质经方法学验证,发现各组分在 0.5~50.0 ng/mL范围内线性良好,平均回收率为80.5%~97.7%,相对标准偏差为3.7%~17.7%,符合GB/T 27404—2008的检测要求。新烟碱类杀虫剂哌虫啶和环氧虫啶的方法检出限为0.3 μg/kg,定量限为1.0 μg/kg,并且在低浓度的条件下能够呈现良好的线性和回收率。本方法不仅操作简单便捷,且提取效率高,色谱分析定量准确,适用于各种热带水果中新烟碱类杀虫剂残留含量检测,同时可以为其他新烟碱类杀虫剂检测提供参考依据。
参考文献
[1]李昌兴, 刘东东, 高一星, 等. 新烟碱类杀虫剂的研究与开发进展[J]. 化学试剂, 2023, 45(3): 29-36.
[2]马杰, 郝莹, 郭礼强, 等. 食品中新烟碱类杀虫剂污染与控制研究进展[J]. 食品安全质量检测报, 2022, 13(1): 278-286.
[3] Zhao Y Y, Yang J W, Ren J B, et al. Exposure level of neonicotinoid insecticides in the food chain and the evaluation of their human health impact and environmental risk: An overview[J]. Sustainability, 2020, 12(18): 7523‒7523.
[4] Cui K, Wu X, Wei D, et al. Health risks to dietary neonicotinoids are low for Chinese residents based on an analysis of 13 daily-consumed foods[J]. Environment International, 2021, 149: 106385.
[5]余晋霞, 吕铖, 汪子夏, 等. 新烟碱类杀虫剂暴露对美国儿童青少年性激素水平的影响[J]. 环境与职业医学, 2021, 38(3): 223-230+237.
[6]潘承谕, 余晋霞, 田英, 等. 新烟碱类杀虫剂人群暴露水平及生殖毒性的研究进展[J]. 环境与职业医学, 2020, 37(11): 1064-1069.
[7] Thompson D A, Lehmler H J, Kolpin D W, et al. A critical review on the potential impacts of neonicotinoid insecticide use: current knowledge of environmental fate, toxicity, and implications for human health[J]. Environmental Science: Processes & Impacts, 2020, 22(6): 1315-1346.
[8] Kachangoon R, Vichapong J, Santaladchaiyakit Y, et al. Cloud-point extraction coupled to in - situ metath-esis reaction of deep eutectic solvents for preconcentration and liquid chromatographic analysis of neonicotinoid insecticide res-idues in water, soil and urine samples[J]. Microchemical Journal, 2020, 152: 104377.
[9] Zhang S, Yang X, Yin X, et al. Dispersive liquid-liquid microextraction combined with sweeping micellar electrokinetic chromatography for the determination of some neonicotinoid insecticides in cucumber samples[J]. Food Chemistry, 2012, 133(2): 544-550.
[10] Senovieski M L, Gegenschatz S A, Chiappini F A, et al. In-syringe dispersive liquid- liquid microextraction vs.solid phase extraction: A comparative analysis for the liquid chromatographic determination of three neonicotinoids in cotyle-dons[J]. Microchemical Journal, 2020, 158: 105181.
[11] Gbylik-Sikorska M, Sniegocki T, Posyniak A. Determination of neonicotinoid insecticides and their metabolites in honey bee and honey by liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B, 2015, 990: 132-140.
[12] Zhang J J, Wei Y L, Li H Z, et al. Application of Box–Behnken design to optimize multi-sorbent solid phase extraction for trace neonicotinoids in water containing high level of matrix substances[J]. Talanta, 2017, 170: 392-398.
[13] Abdulhussein A Q, Jamil A K M, Bakar N K A. Magnetic molecularly imprinted polymer nanoparticles for the extraction and clean-up of thiamethoxam and thiacloprid in light and dark honey[J]. Food Chemisity, 2021, 359: 129936.
[14]杨东冬, 丛路静, 田明明, 等. 分子印迹固相萃取-液相色谱联用法测定3种新烟碱类农药的残留[J]. 分析化学, 2014, 42(6): 872-877.
[15] ARIA M M, SORRIBES-SORIANO A, JAFARI M T, et al. Uptake and translocation monitoring of imidacloprid to chili andtomato plants by molecularly imprinting extraction-ion mobility spectrometry[J]. Microchemical Journal, 2019, 144: 195-202.
[16]王希, 王旭明, 吴仰辉,等. 环氧虫啶对柑橘木虱的田间防效初探[J]. 湖北植保, 2020, 180(3): 20-22+39.
[17]朱俊澍. 柑橘木虱对环氧虫啶的解毒代谢机制及靶标结合力研究[D]. 福州: 福建农林大学, 2022.
[18]毛亮, 潘卫萍, 刘萍, 等. 呋虫胺和哌虫啶对哈密瓜烟粉虱的防治效果[J].蔬菜, 2020(7): 50-53.
[19]李菊英. 三种常用医药及新型手性农药哌虫啶在土壤中的环境行为与归趋研究[D]. 杭州: 浙江大学, 2014.
[20] ZHANG M, ZHAO HT, XIE T J, et al. Molecularly imprinted polymer on graphene surface for selective and sensitive elec-trochemical sensing imidacloprid[J]. Sensors and Actuators B: Chemical, 2017, 252: 991-1002.
[21] Filigenzi M S, Graves E E, Tell L A, et al. Quantitation of neonicotinoid insecticides, plus qualitative screening for other xenobiotics, in small-mass avian tissue samples using UHPLC high-resolution mass spectrometry[J]. Journal of Veterinary Diagnostic Investigation, 2019, 31(3): 399-407.
[22] GB 2763—2021 食品安全国家标准 食品中农药最大残留限量 附录A: 食品类别及测定部位[S]. 北京: 中国农业出版社, 2021.
[23]庄鹏, 吴天良, 戴小丽. 海南热带水果中18种杀菌剂残留测定[J]. 中国口岸科学技术, 2021, 3(5): 16-27.
[24]金苗, 陶泽榕, 赵中华, 等.在线固相萃取-超高效液相色谱/串联质谱法测定水中新烟碱类杀虫剂[J]. 分析试验室, 2021, 40(1): 12-16.
[25] Niessen W M A, Manini P, Andreoli R. Matrix effects in quantitative pesticide analysis using liquid chromatography-mass spectrometry[J]. Mass spectrometry reviews, 2006, 25(6): 881-899.
表2 MRM模式下哌虫啶和环氧虫啶农药的扫描参数
Table 2 Scanning parameters of the neonicotinoid insecticides cycloxaprid and paichongding in MRM mode
化合物 | CAS号 | 结构式 | 相对分子质量 | (m/z) | (m/z) | (V) | (V) |
Paichongding | 948994-16-9 |
| 366.8 | 367.1 | 321.0*, 125.8 | 92.7, 92.7 | 20.5, 52.1 |
Cycloxaprid | 1203791-41-6 |
| 322.5 | 323.0 | 276.9*, 248.0 | 60.0, 60.0 | 20.5, 45.2 |
注: *表示定量离子
表4 绿橙中哌虫啶和环氧虫啶的平均回收率和相对标准偏差(n=6)
Table 4 The average recoveries and RSDs of the cycloxaprid and paichongding in Citrus sinensis (n=6)
化合物 | 添加水平 (mg/kg) | |||||||
0.001 | 0.005 | 0.010 | ||||||
平均回收率 (%) | RSD (%) | 平均回收率 (%) | RSD (%) | 平均回收率 (%) | RSD (%) | |||
哌虫啶 | 80.5 | 7.7 | 86.2 | 11.3 | 89.7 | 5.5 | ||
环氧虫啶 | 81.5 | 9.8 | 84.2 | 10.8 | 85.0 | 8.9 | ||
表5 荔枝中哌虫啶和环氧虫啶的平均回收率和相对标准偏差(n=6)
Table 5 The average recoveries and RSDs of the cycloxaprid and paichongding in Litchi chinensis Sonn. (n=6)
化合物 | 添加水平 (mg/kg) | |||||||
0.001 | 0.005 | 0.010 | ||||||
平均回收率(%) | RSD (%) | 平均回收率 (%) | RSD (%) | 平均回收率 (%) | RSD (%) | |||
哌虫啶 | 81.8 | 9.0 | 81.6 | 4.5 | 82.3 | 9.1 | ||
环氧虫啶 | 82.5 | 12.3 | 85.4 | 11.8 | 91.6 | 6.6 | ||
表6 燕窝果中哌虫啶和环氧虫啶的平均回收率和相对标准偏差(n=6)
Table 6 The average recoveries and RSDs of the cycloxaprid and paichongding in Hylocereus megalanthus (n=6)
化合物 | 添加水平 (mg/kg) | |||||||
0.001 | 0.005 | 0.010 | ||||||
平均回收率 (%) | RSD (%) | 平均回收率 (%) | RSD (%) | 平均回收率 (%) | RSD (%) | |||
哌虫啶 | 89.1 | 3.7 | 81.4 | 5.8 | 91.1 | 10.2 | ||
环氧虫啶 | 90.0 | 6.9 | 92.4 | 16.5 | 88.9 | 17.7 | ||
表7 红毛丹中哌虫啶和环氧虫啶的平均回收率和相对标准偏差(n=6)
Table 7 The average recoveries and RSDs of the cycloxaprid and paichongding in Nephelium lappaceumL. (n=6)
化合物 | 添加水平 (mg/kg) | |||||||
0.001 | 0.005 | 0.010 | ||||||
平均回收率 (%) | RSD (%) | 平均回收率 (%) | RSD (%) | 平均回收率 (%) | RSD (%) | |||
哌虫啶 | 91.7 | 15.2 | 90.5 | 8.8 | 97.7 | 11.1 | ||
环氧虫啶 | 84.6 | 10.4 | 86.4 | 7.1 | 91.1 | 12.3 | ||
基金项目:太原海关科研项目(2017SX01)
第一作者:苑利(1972—),女,汉族,山西怀仁人,本科,高级工程师,主要从事进出口食品、化矿金产品检验工作,E-mail: yli1992@163.com
1. 太原海关技术中心 太原 030021
1. Technical Centre of Taiyuan Customs, Taiyuan 030021










