CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
辽宁口岸淡色库蚊拟除虫菊酯击倒抗性基因的AS-PCR检测和分子进化分析
作者:曲世超 毕秀欣 李晶 程晓兰 麻丽丹 徐文英 齐欣
曲世超 毕秀欣 李晶 程晓兰 麻丽丹 徐文英 齐欣
Abstract This study aims to analyze the knockdown resistance status of Culex pipiens pallens at Dalian, Dandong, and Chaoyang border ports in Liaoning Province, understand their molecular evolutionary relationships, and assess the resistance risk to pyrethroid insecticides. The frequencies of kdr allele mutation in Culex pipiens pallens were determined by AS-PCR, and the specific gene fragments of sensitive and resistant Culex pipiens pallens were analyzed by multiple sequence alignment and molecular evolution analysis. Among the 300 Culex pipiens pallens tested, the kdr allele mutation frequencies in Dalian, Dandong and Chaoyang border ports were 13.00%, 19.50%, and 18.80%. Multiple sequence alignment confirmed that resistant Culex pipiens pallens at ports by the sodium channel gene L1014 was mutated from “A” to “T”. The phylogenetic tree showed a close relationship among Culex pipiens pallens at the three border ports. Culex pipiens pallens from the border ports of Dalian, Dandong, and Chaoyang have developed varying degrees of resistance to pyrethroid insecticides. It is necessary to use pyrethroid insecticides rationally, strengthen the monitoring of vector resistance at border ports, delay the rapid development of resistance, and provide a basis for establishing a database of vector resistance and targeted mosquito vector control at Liaoning border ports.
Keywords Culex pipiens pallens; knockdown resistance; molecular evolution analysis; border ports
淡色库蚊(Culex pipiens pallens)为尖音库蚊复合组(Culex pipiens complex)中4种蚊虫亚种之一,主要分布在我国北方地区(北纬32°以北),是人畜之间的主要传播媒介[1-3]。通过刺叮吸血传播多种蚊媒病,包括流行性乙型脑炎、登革热、疟疾、班氏丝虫病、西尼罗病毒脑炎等传染疾病,给我国人民的健康和社会生产力的发展造成了严重影响[4-9]。
在媒介蚊虫防治中,化学防治方法因见效快、使用方便、操作简单等特点而得到广泛应用[10-11]。目前,拟除虫菊酯类杀虫剂因具有高效率、低毒性及低残留等优点成为最为常用的杀虫剂之一,为媒介蚊虫的治理作出重要贡献。但蚊虫抗药性问题也随之产生,成为世界公共卫生及媒介昆虫治理的重大难题[12]。在抗药性机制研究中,击倒抗性(Knockdown resistance, kdr)体现了拟除虫菊酯类杀虫剂和其靶标(钠离子通道)之间的直接作用,蚊虫因钠通道基因突变对杀虫剂的作用减弱,从而产生抗性。同时采用分子生物学方法鉴别蚊虫抗性的种间差异已成为现在研究昆虫分类的一大热点话题,该方法不仅快速简便而且结论可靠,具有良好的应用前景[13]。
近年来,随着我国进出口贸易的快速增长,辽宁口岸积极推进东北海陆大通道的建设,更是加大了外来媒介生物入侵的概率。媒介生物的卫生监管及防治作为国境口岸的重点工作,为此杀虫剂的使用需求加大。但目前尚未见辽宁口岸病媒生物杀虫剂抗药性系统监测及风险分析的相关研究。大连、丹东口岸作为辽宁地区最主要的港口区域,朝阳口岸则为距离港口较远的内陆区域,本研究以这3个具有代表性的辽宁口岸淡色库蚊为研究对象,采用等位基因特异性PCR方法(AS-PCR),研究各口岸淡色库蚊的kdr片段基因突变情况。针对不同口岸检测为敏感型和突变型淡色库蚊的特异性基因片段进行多序列比对及分子进化分析,旨在了解辽宁口岸淡色库蚊对拟除虫菊酯类杀虫剂的抗性水平以及各口岸蚊种的分布进化情况,为国境口岸蚊虫媒介生物的防治、延长杀虫剂的使用寿命、保护生态安全提供更翔实全面的理论指导。
1 材料与方法
1.1 材料
1.1.1 蚊虫样本采集
大连、丹东国境口岸因地处沿海,更容易在入境船舶、集装箱及货物中截获入境有害生物。朝阳国境口岸靠近内陆,能直接反映出辽宁其他内陆口岸媒介生物的特点。因此,本研究于2020—2021年分别在辽宁大连、丹东和朝阳国境口岸开展淡色库蚊的采集工作,每个口岸各采集100只,共采集300只淡色库蚊,在实验室条件下进行下一代试虫的繁殖。在幼虫养殖盘中加入已放置24 h以上的去氯自来水3500 mL,取卵20块左右放置于养殖盘中,次日开始少量添加饲料(面粉75%、炒豆粉20%、猪肝粉2.5%、酵母2.5%;饲料粉碎后过80目筛)。幼虫一般在第7天开始化蛹,将蛹收集并放置于养蚊笼内,待羽化。成蚊羽化后喂食8%蔗糖水即可存活。
1.1.2 主要试剂及仪器
MiniBEST Universal Genomic DNA Extraction Kit Ver. 5.0购自于宝日医生物技术有限公司;2×San Taq PCR Mix(酶预混液,含蓝染料)和DNA分子量标准Ladder H1(100~1000 bp)购自生工生物工程(上海)股份有限公司;引物由生工生物工程(上海)股份有限公司合成。
高通量组织研磨仪(MM400,德国莱驰);台式高速冷冻离心机(3K15,德国Sigma);高压蒸汽灭菌锅(CL-40M,日本ALP公司);生物安全柜(BSG-4,中国珠江造鑫);阶梯PCR仪(Veriti 96,美国ABI);自动凝胶成像系统(INFINITY 3026,法国Vilber Lourmat)。
1.2 方法
1.2.1 基因组DNA的提取
参照宝日医生物技术有限公司的Takara MiniBEST Universal Genomic DNA Extraction Kit Ver. 5.0提取试剂盒说明书进行基因组DNA的提取。
1.2.2 kdr基因片段PCR反应
参照文献[14]合成引物,包括一对非特异性外引物CD1(5'-GACCTGCCACGGTGGAACT-3')和CD2(5'-TTGGACAAAAGCAAGGCTAAG-3'),片段大小515 bp;两条特异性内引物Cgd3(5'-CCACCGTAGTGATAGGAAATTTA-3')和Cgd4(5'-CCACCGTAGTGATAGGAAATTTT-3'),片段大小380 bp。
AS-PCR反应需采用双管法,包括A反应管和B反应管。A反应管包括:2×San Taq PCR Mix(酶预混液,含蓝染料)12.5 μL,模板DNA 1.0 μL,CD1(200 ng/μL)1.0 μL,CD2(200 ng/μL)1.0 μL,Cgd3(200 ng/μL)1.0 μL,ddH2O 8.5 μL,总体积共计25 μL。B反应管包括:2×San Taq PCR Mix(酶预混液,含蓝染料)12.5 μL,模板DNA 1.0 μL,CD1(200 ng/μL)1.0 μL,CD2(200 ng/μL)1.0 μL,Cgd4(200 ng/μL)1.0 μL,ddH2O 8.5 μL,总体积共计25 μL。
反应条件设置为94℃, 5 min;94℃,30 s,60℃,30 s,72℃,35 s,40 cycles;72℃,10 min。
待扩增反应结束后,将各PCR扩增产物经1.2%琼脂糖凝胶(含1×Gelred染料)电泳检测后,以DNA分子量标准Ladder H1作为参照在凝胶成像系统下观察电泳结果。将3个国境口岸淡色库蚊检测为抗性杂合子和抗性纯合子基因型的特异性PCR产物(380 bp)送至生工生物工程(上海)股份有限公司进行测序。
1.2.3 多序列比对
采用DNA Star软件中Seq Man程序对测序结果进行拼接并去除引物,并且对碱基进行校对处理。将淡色库蚊测序后的序列在GenBank数据库中进行Blast程序检索及比对。应用MEGA X软件对不同的测序结果进行多序列比对,确定敏感品系和抗性品系淡色库蚊在序列上的区别。
1.2.4 分子进化分析
基于Kimura-2-Parameter模型,采用邻接法(Neighbor-joining,NJ)构建钠通道突变基因的系统进化树,Bootstrap自展检测1000次,以确定辽宁地区3个国境口岸淡色库蚊的分子进化关系。
2 结果
2.1 AS-PCR检测kdr基因频率结果
依据AS-PCR反应原理,两个平行的PCR反应体系鉴定同一个体的基因型。检测结果会出现3种情况,成功扩增示意图见图1。如A位置出现非特异性核酸片段和特异性核酸片段,B位置出现非特异性核酸片段,则基因型为敏感纯合子(SS);如A、B位置均出现非特异性核酸片段和特异性核酸片段,则基因型为kdr抗性杂合子(RS);如A位置出现非特异性核酸片段,B位置出现非特异性核酸片段和特异性核酸片段,则基因型为kdr抗性纯合子(RR)。如未与此3种情况相匹配,则试验失败,不能确定其基因型。
图1 AS-PCR扩增示意图
Fig.1 Schematic drawing of AS-PCR amplification
采用AS-PCR检测方法,分别对在大连、丹东、朝阳口岸采集的淡色库蚊进行击倒抗性kdr基因型检测。根据AS-PCR反应结果,对3个国境口岸样本的各个基因型检出数量进行统计,各基因型频率为每个基因型检出数量占实际有效样本数的百分比。再根据各个基因型频率计算kdr等位基因突变频率,具体计算公式为:
kdr等位基因突变频率(%)=[RS型基因突变频率(%)+RR型基因突变频率(%)×2]/2
大连、丹东、朝阳国境口岸的部分AS-PCR反应电泳图见图2~4,3个国境口岸淡色库蚊kdr等位基因突变频率统计表见表1。每个地理种群均检测100组样本,除朝阳口岸实际有效样本数为93组外,其他2个国境口岸不存在无效基因组情况。丹东口岸淡色库蚊的kdr频率最高,为19.50%;其次为朝阳口岸,kdr频率为18.80%;大连口岸的kdr频率最低,为13.00%。
2.2 多序列比对分析
将不同口岸抗性杂合子和抗性纯合子基因型淡色库蚊的特异性基因扩增产物经纯化后测序,3个国境口岸抗性杂合子基因型淡色库蚊样本的特异性片段测序成功共计33个样本,包括13个敏感品系钠通道基因片段,22个抗性品系钠通道基因片段;抗性纯合子基因型淡色库蚊样本的特异性片段测序成功共计5个样本,即为5个抗性品系钠通道基因片段。将测序成功的序列使用NCBI的Blast程序分别进行相似性检索和比对,一致性可达99.39%~100%。38个样本的特异性扩增产物序列与淡色库蚊(Culex pipiens pallens)钠通道基因片段的一致性均较高。
不同口岸测序成功的敏感型和抗性型基因片段分别与淡色库蚊钠通道突变基因参考序列(GenBank序列号:GU198930.1)进行多序列比对分析,截取钠通道ⅡS6部分序列比对结果如图5至图7所示。3个国境口岸抗性品系淡色库蚊的钠通道ⅡS6节段L1014位点上,碱基由“TTA”突变为“TTT”,即由亮氨酸(L)突变为苯丙氨酸(F),该突变(L1014F型)说明3个国境口岸敏感品系和抗性品系淡色库蚊的钠通道氨基酸序列之间存在差异。
2.3 分子进化分析
使用MEGA X 软件,用邻接法构建38个淡色库蚊样本的敏感型和抗性型系统进化树,系统进化树如图8所示。从系统进化树上可发现,3个国境口岸淡色库蚊样本的不同等位基因大致分为2个聚类群,置信度均较高。各个聚类群中均包含3个国境口岸敏感型和抗性型的淡色库蚊样本。从整体分析可知,3个国境口岸的淡色库蚊均能不分地理种群、基因型而较好地聚集在一起。从分支上进行分析,A、B两类聚类群之间具有较近的亲缘关系。其中,A聚类群中大连国境口岸敏感型和抗性型的淡色库蚊样本居多,B聚类群中朝阳国境口岸敏感型和抗性型的淡色库蚊样本居多,丹东国境口岸敏感型和抗性型的淡色库蚊样本在2个聚类群则占比相当,说明大连、朝阳国境口岸的大部分淡色库蚊可按地域分别聚类,因地理种群原因存在略微差异。从AS-PCR检测结果可知,3个国境口岸淡色库蚊均存在不同程度的L1014位点突变,该突变碱基对聚类分析影响较小。
将多序列比对和分子进化分析相结合,以分析不同口岸淡色库蚊系统进化树2个聚类群的形成原因,其中编号为DD-Mo-73和CY-Mo-07的2个样本,是同时包括敏感型和抗性型序列数据的样本,如图9所示,发现经过比对后2个样本的L1014突变位点下游含有内含子,而内含子的核苷酸序列在不同地域之间呈现多态性,同一种群可出现不同的内含子核苷酸序列,而不同的种群也可出现同一种内含子。该多态性会造成以基因组DNA为模板进行扩增反应时产生的片段大小不一致,分析原因为内含子的存在将38个淡色库蚊样本的聚类群分成了两类。
3 讨论
国境口岸卫生检疫工作是防范媒介生物入侵的第一道防线,肩负着维护我国国家安全和保护人民健康的重任[15],需认真贯彻落实《中华人民共和国生物安全法》及《中华人民共和国国境卫生检疫法》,防范外来媒介生物入侵,加强口岸传染病防控能力建设。
媒介生物的控制是衡量国境口岸卫生状况的重要指标之一。而绝大部分的媒介生物是在国境口岸借助各种交通工具进入我国境内,携带病原体的媒介生物在口岸进行传染病的传播[16]。本研究选取2020—2021年辽宁省内大连、丹东和朝阳口岸的淡色库蚊,采用AS-PCR方法对各个口岸成蚊击倒抗性kdr基因型进行检测,结果显示,省内3个不同国境口岸的淡色库蚊均存在一定频率的特异性基因突变,并且特异性基因突变率随着采集地点的不同而存在差异,kdr频率由高到低依次为丹东口岸(19.50%)>朝阳口岸(18.80%)>大连口岸(13.00%),表明辽宁大连、丹东和朝阳3个国境口岸的淡色库蚊可能对拟除虫菊酯类杀虫剂已经产生了一定的抗药性,而kdr等位基因频率的升高,会造成种群逐步演变进化到抗药性的种群。
目前蚊虫kdr基因主要存在L1014F和L1014C突变类型。本研究将不同口岸测序成功的敏感型和抗性型淡色库蚊钠通道突变基因序列进行多序列比对分析,结果发现,辽宁地区3个国境口岸淡色库蚊样本的敏感型和抗性型在钠通道ⅡS6节段L1014位点上发生了单碱基突变,即1种L1014F类型突变,此突变因钠通道蛋白局部结构发生变化,影响拟除虫菊酯类杀虫剂与钠通道的结合,造成淡色库蚊个体对拟除虫菊酯类杀虫剂产生抗药性。宋锋林[12]在河北省、北京市等地的研究及刘宏美等[17]在山东省的研究均表明淡色库蚊kdr基因L1014F类型突变与拟除虫菊酯类杀虫剂抗性之间存在密切关系,本研究的结果与其相一致。同时许多研究证实其他昆虫也存在该突变位点,可见L1014 F型突变是一个较为常见的突变情况,可作为蚊媒抗性水平检测的分子靶标。
从分子进化分析中发现,辽宁地区3个国境口岸的淡色库蚊虽然地理种群、抗药性均存在差异却均能较好地聚集在一起,表明辽宁地区不同国境口岸敏感型和抗性型淡色库蚊之间存在较近的亲缘关系,不因基因型的不同而有较大的进化关系。从聚类群分支分析中发现,大连和朝阳国境口岸大部分淡色库蚊可分别聚为一类,证实辽宁地区港口和内陆口岸淡色库蚊基因型因地域、环境等因素影响存在略微差异。研究也发现在部分淡色库蚊样本中存在内含子,而内含子作为断裂基因的非编码区,序列不保守且进化速度快,此区域碱基的缺失是造成3个国境口岸淡色库蚊不同聚类群形成的主要原因,但在系统进化树上看出3个地域淡色库蚊在分子进化过程中还是具有较近的亲缘关系,自然种群遗传结构基本相同,种群之间没有明显的分化。
综上所述,研究了解辽宁口岸淡色库蚊的抗性水平及各地域淡色库蚊进化水平,为辽宁口岸媒介生物的防治和掌握其分布情况提供了技术依据。建议有关口岸采用几种拟除虫菊酯类杀虫剂轮用、混用或对其加入增效剂,以降低媒介生物对拟除虫菊酯类杀虫剂抗药性的速度。同时,应结合辽宁地区季节变化及环境特点[18],有针对性地对此地域国境口岸持续进行抗药性监测工作,同时在辽宁省内的其他地域也应定期开展蚊虫的抗药性监测,建立辽宁口岸病媒生物抗药性数据库,坚持关口前移,为国境口岸病媒生物风险评估、预测、预警和蚊媒病的防控提供科学依据及有效措施。
参考文献
[1] 王娟, 元正菊, 何于雯, 等. 昆明地区尖音库蚊复合组蚊虫分子鉴定[J]. 云南畜牧兽医, 2021, 1: 7-10.
[2] 张伟, 方圆, 张仪, 等. 山东省淄博市淄川区淡色库蚊kdr等位基因突变研究[J]. 中国血吸虫病防治杂志, 2019, 31(2): 134-138.
[3] 吴炜, 张衡谦, 齐福菊. 大连市1951—2002年流行性乙型脑炎趋势分析[J]. 中国媒介生物学及控制杂志, 2004, 15(3): 211-213.
[4] Wang H, Abbo S R, Visser T M, et al. Competition between Usutu virus and West Nile virus during simultaneous and sequential infection of Culex pipiens mosquitoes[J]. Emerging microbes & infections, 2020, 9(1): 2642-2652.
[5] Zheng Y Y, Li M H, Wang H Y, et al. Japanese encephalitis and Japanese encephalitis virus in mainland China[J]. Reviews in medical virology, 2012, 22(5): 301-322.
[6] Wu J Y, Lun Z R, James A A, et al. Dengue fever in mainland China[J]. The American journal of tropical medicine and hygiene, 2010, 83(3): 664-671.
[7] Smith J L, Fonseca D M. Rapid assays for identification of members of the Culex (Culex) pipiens complex, their hybrids, and other sibling species (Diptera: Culicidae)[J]. The American journal of tropical medicine and hygiene, 2004, 70(4): 339-345.
[8] 潘士贤. 蚊虫与疾病[J]. 应用预防医学, 2013, 19(4): 190+257.
[9] 陈琳. 淡色库蚊击倒抗性(kdr)相关钠离子通道基因多态性研究[D]. 昆明: 昆明理工大学, 2010.
[10] World Health Organization. Global plan for insecticide resistance management in malaria vectors[M]. France: World Health Organization, 2012.
[11] 吕园, 邱樊, 张红波, 等. 淡色库蚊羧酸酯酶基因高表达与溴氰菊酯抗药性相关性研究[J]. 寄生虫与医学昆虫学报, 2021, 48(4): 231-236.
[12] 宋锋林. 淡色库蚊对拟除虫菊酯击倒抗性(kdr)的分子生态学特征的研究[D]. 北京: 中国人民解放军军事医学科学院, 2004.
[13] 彭淑琼, 刘春晓, 赵纯中, 等. 分子生物学技术在蚊虫分类中的应用[J]. 中国国境卫生检疫杂志, 2010, 33(3): 207-213.
[14] Liu H, Lu Y, Liu Q, et al. Comparison of Pyrethroid Resistance in Adults and Larvae of Culex pipiens pallens (Diptera: Culicidae) From Four Field Populations in China[J]. Journal of Economic Entomology, 2013, 106(1): 360-365.
[15] 樊德海, 胡瑞新, 耿丽梅, 等. 国境口岸重要媒介生物抗药性测定方法[J]. 口岸卫生控制, 2010, 15(3): 4-6.
[16] 宋锋林, 李建训, 刘洪文, 等. 国境口岸医学媒介生物入侵的形势和管路策略[J]. 中国国境卫生检疫杂志, 2006, 8(29): 80-84.
[17] 刘宏美, 代玉华, 王海防, 等. 淡色库蚊kdr等位基因突变及抗药性检测方法的研究[J]. 中国人兽共患病学报, 2012, 28(08): 820-824.
[18] 刘起勇. 气候变化对中国媒介生物传染病的影响及应对[J]. 中国媒介生物学及控制杂志, 2021, 32(1): 1-11.
注: 27~38为大连口岸部分淡色库蚊样本编号, 每个样本的基因型的判读参照图1结果.
图2 大连口岸淡色库蚊AS-PCR电泳图(部分结果)
Fig.2 Electrophoresis diagram of AS-PCR detection for Culex pipiens pallens from Dalian Port (partial results)
注: 89~100为丹东口岸部分淡色库蚊样本编号, 每个样本的基因型的判读参照图1结果.
图3 丹东口岸淡色库蚊AS-PCR电泳图(部分结果)
Fig.3 Electrophoresis diagram of AS-PCR detection for Culex pipiens pallens from Dandong Port (partial results)
注: 29~40为朝阳口岸部分淡色库蚊样本编号, 每个样本的基因型的判读参照图1结果.
图4 朝阳口岸淡色库蚊AS-PCR电泳图(部分结果)
Fig.4 Electrophoresis diagram of AS-PCR detection for Culex pipiens pallens from Chaoyang Port (partial results)
表1 辽宁地区3个国境口岸淡色库蚊kdr等位基因突变频率统计表
Table 1 The frequencies of kdr allele mutation in Culex pipiens pallens from three border Ports in Liaoning Province
种群 | 样本标识 | 检测样本数 | 实际有效样本数 | kdr频率 (%) | 基因型及频率 | |||||
SS型 | SS (%) | RS型 | RS (%) | RR型 | RR (%) | |||||
大连口岸 | DL-Mo- | 100 | 100 | 13.00 | 79 | 79.00 | 16 | 16.00 | 5 | 5.00 |
丹东口岸 | DD-Mo- | 100 | 100 | 19.50 | 67 | 67.00 | 27 | 27.00 | 6 | 6.00 |
朝阳口岸 | CY-Mo- | 100 | 93 | 18.82 | 64 | 68.82 | 23 | 24.73 | 6 | 6.45 |

图5 大连口岸淡色库蚊样本多序列比对结果
Fig.5 Multiple sequence alignment results of Culex pipiens pallens samples from Dalian Port

图6 丹东口岸淡色库蚊样本多序列比对结果
Fig.6 Multiple sequence alignment results of Culex pipiens pallens samples from Dandong Port

图7 朝阳口岸淡色库蚊样本多序列比对结果
Fig.7 Multiple sequence alignment results of Culex pipiens pallens samples from Chaoyang Port
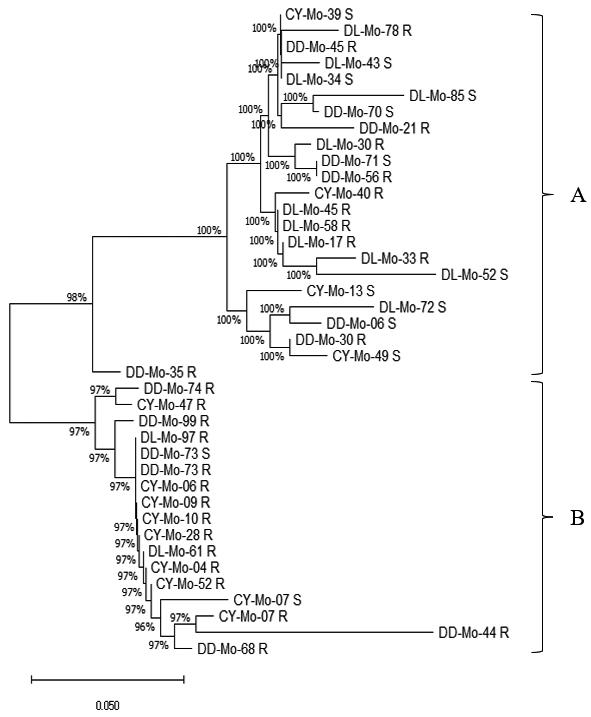
图8 辽宁口岸38只淡色库蚊系统进化树
Fig.8 Phylogenetic trees of 38 Culex pipiens pallens from Liaoning border ports

图9 DD-Mo-73和CY-Mo-07淡色库蚊中的内含子
Fig.9 Introns in Culex pipiens pallens DD-Mo-73 and CY-Mo-07
基金项目:山东省医药卫生科技发展计划项目(202112060725);济宁市重点计划研发项目(医学研究和临床医学类2021071)
第一作者:孔政(1985—),女,汉族,山东济宁人,本科,主管技师,主要从事微生物检验工作,E-mail: 306495806@qq.com
通信作者:焦伯延(1983—),男,汉族,山东济宁人,博士,副主任技师,主要从事微生物检验工作,E-mail: j198319831983@126.com
共同通信作者:韩淑琪(1982—),女,汉族,山东济宁人,本科,主管技师,主要从事微生物检验工作,E-mail: 254836413@qq.com
1. 济宁市疾病预防控制中心微生物检验科 济宁 272000
2. 济宁市疾病预防控制中心质量控制科 济宁 272000
1. Department of Laboratory, Jining Center for Disease Control and Prevention, Jining 272000
2. Department of Quality Control, Jining Center for Disease Control and Prevention, Jining 272000








