CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
QuEChERS与液相色谱-串联质谱联用检测保健食品中的双醋酚丁、托拉塞米和脱乙酰比沙可定
作者:王晗 杨青 万莹 赵晓亚 尚吟竹 王惠 王鹏
王晗 杨青 万莹 赵晓亚 尚吟竹 王惠 王鹏
Abstract A method based on QuEChERS pretreatment combined with liquid chromatography-mass spectrometry/mass spectrometry (LC-MS/MS) was established for the determination of diaotyldiphenolisatinum, torasemide and deacetylbisacodyl in health foods. The samples were subjected to the extraction of acetonitrile and purification of QuEChERS sorbents, and the extraction solution was then introduced into LC-MS/MS for multiple reaction monitoring (MRM) detection. The detection limit of the method for the three target analytes was 0.002 mg/kg, and the quantification limit was 0.010 mg/kg. The established method was used to detect diaotyldiphenolisatinum, torasemide and deacetylbisacodyl in commercially available tablets, powders, oral liquids, capsules, extracts, and pill-type health foods, and no target analytes were detected in the samples. For tablets, powders, oral liquids, capsules, extracts, and pills, the recovery rates of the spike recovery test were between 86.8%-108% , and the precision was between 5.2%-12.0% (c = 0.010 mg/kg, 0.020 mg/kg, 0.100 mg/kg, n = 7). This indicates that the established method is rapid, simple, easy to batch operate, and has good accuracy, and can satisfy the determination of diaotyldiphenolisatinum, torasemide and deacetylbisacodyl in health foods.
Keywords QuEChERS; liquid chromatography-mass spectrometry/mass spectrometry; health foods; diaotyldiphenolisatinum; torasemide; deacetylbisacodyl
近年来,不少消费者通过服用减肥类保健食品来达到减肥瘦身的目的,市面上各种减肥类保健食品的销售量不断增加。然而,根据美国、欧盟等国家和地区的研究人员对市场中保健食品的长期监测结果,保健食品中可能含有未经批准的物质,即药理活性成分(Pharmacologically active ingredients)[1-2],以加强其声称的效果。研究显示,2007—2016年,在美国保健食品中发现了750多种未申报的药物制剂,在欧盟国家,保健食品掺入药理活性成分的趋势也有所上升[3]。在韩国[4-6]、新加坡[7]的减肥类保健食品中均曾检出比沙可定。因此,针对进口及国产保健食品中药理活性成分非法添加建立相应的检测标准,对保障人民群众身体健康具有重要意义。
双醋酚丁、托拉塞米、脱乙酰比沙可定均属于违禁的药理活性成分,其中双醋酚丁和脱乙酰比沙可定为刺激性泻药,托拉塞米为利尿剂,在减肥瘦身类保健食品中违法添加后能引起服用者的排便和利尿,进而可能会严重影响身体健康。我国在2021年就将托拉塞米和双醋酚丁列为保健食品风险监测项目,但缺少相应的食品安全国家标准。
双醋酚丁、托拉塞米、脱乙酰比沙可定的常见检测手段主要是液相色谱-串联质谱检测法,其具有灵敏度高、选择性好的优点。由于保健食品的剂型多样,包含片剂、粉剂、口服液、胶囊剂、煎膏剂和丸剂等类型,基质复杂多样,且在实际使用时需要对保健食品中的双醋酚丁、托拉塞米、脱乙酰比沙可定进行大批量样品的筛查,因此亟待建立快速、灵敏、可批量处理的方法对保健食品中的双醋酚丁、托拉塞米、脱乙酰比沙可定进行分析。近年来,QuEChERS方法作为一种新型样品前处理手段,由于其具有操作简便、可批量处理、分析速度快等优点,已被广泛应用于食品[8]、环境样品[9]中的农药残留[10]、杀菌剂[11]、兽药残留[12]、生物毒素[13]等目标分析物的检测。
基于此,本研究拟将QuEChERS前处理方法与液相色谱-串联质谱联用,开发适用于保健食品中双醋酚丁、托拉塞米和脱乙酰比沙可定的检测方法,以期为保障保健食品消费者的身体健康提供技术支撑。
1 实验部分
1.1 仪器与参数
岛津LC-20ADXR型液相色谱仪(Shimadzu,日本);QTRAP6500型串联质谱仪(SCIEX,美国);MS型分析天平(Mettler Toledo,上海);2-16PK型低温离心机(Sigma,德国);SA300型振荡器(Yamato,日本);MS2型涡旋混合器(IKA,德国)。
1.2 药品、试剂及实际样品
双醋酚丁、托拉塞米和脱乙酰比沙可定标准物质的纯度均≥98%;甲醇、乙腈、甲酸为色谱纯试剂(LiChrosolv,Merck,德国);氯化钠、无水硫酸镁为分析纯试剂(国药集团化学试剂有限公司)。QuEChERS吸附剂十八烷基键合硅胶(C18)、N-丙基乙二胺(PSA)和石墨化炭黑(GCB)均购自上海CNW Technology公司。
本研究建立的方法被应用于7类保健食品中的双醋酚丁、托拉塞米和脱乙酰比沙可定的检测,实际样品包括片剂、粉剂、口服液、硬胶囊、软胶囊、煎膏和大蜜丸,均从网络平台购买。硬胶囊连胶囊壳一起用粉碎机捣碎并混合均匀;软胶囊将胶囊壳与内容物分离,胶囊壳用粉碎机捣碎,与内容物一起混合均匀;片剂和丸剂用粉碎机捣碎并混合均匀。
1.3 溶液配制
分别称取双醋酚丁、托拉塞米和脱乙酰比沙可定标准品(精确至0.1 mg),配制成浓度为1.0 mg/mL的标准溶液,-18℃下避光保存。在实验过程中,精确吸取适量标准溶液,用甲醇溶液逐级稀释至所需中间浓度,工作曲线溶液采用基质空白溶液配制。
1.4 样品前处理
对于口服液:称取1.0 g试样(精确到0.001 g)于50 mL离心管中,加入10 mL乙腈、1 g氯化钠和4 g无水硫酸镁,迅速剧烈混合后振荡提取30 min,8000 r/min离心5 min,取上清液待净化;吸取2 mL上清液于15 mL离心管中,加入200 mg C18和20 mg GCB,涡旋振荡2 min,8000 r/min离心5 min,取上清液过0.22 μm滤膜后使用液相色谱-串联质谱仪测定。若检测结果超过基质标准曲线线性范围,将样品以基质空白溶液稀释浓度至线性范围内测定。
对于片剂、丸剂、粉剂、胶囊剂、煎膏剂,称取1.0 g试样(精确到0.001 g)于50 mL离心管中,加入10 mL乙腈,振荡提取30 min,8000 r/min离心5 min,取上清液待净化;吸取2 mL上清液于15 mL离心管中,加入200 mg C18和20 mg GCB(对于含水量较高的煎膏剂,净化时加入150 mg无水硫酸镁),涡旋振荡2 min,8000 r/min离心5 min,取上清液过0.22 μm滤膜后使用液相色谱-串联质谱仪测定。若检测结果超过基质标准曲线线性范围,将样品以基质空白溶液稀释至线性范围内测定。
实验中所有样品均设置3个平行组。
1.5 色谱及质谱条件
Waters HSS T3 C18色谱柱(100 mm×3 mm,3.5 μm);流速:0.30 mL/min;柱温:30℃;进样量:5 μL。流动相:A相为含0.1%(v/v)甲酸的水溶液;B相为乙腈。梯度洗脱程序见表1。
表1 液相色谱的梯度洗脱程序
Table 1 Gradient elution program of liquid chromatography
时间 (min) | 流动相A (%) | 流动相B (%) |
0.00 | 90 | 10 |
2.00 | 90 | 10 |
5.00 | 5 | 95 |
7.00 | 5 | 95 |
7.50 | 90 | 10 |
10.00 | 90 | 10 |
离子化模式:ESI+;电喷雾电压(IS):4500 V;气帘气为241 kPa;雾化气压力为413 kPa;辅助气压力为344 kPa;检测方式:多反应监测;质谱检测参数见表2。
表2 双醋酚丁、托拉塞米和脱乙酰比沙可定的
主要质谱参数
Table 2 Main mass spectrometry parameters for diaotyldiphenolisatinum, torasemide and deacetylbisacodyl
名称 | (m/z) | (m/z) | (V) | CE (eV) |
双醋酚丁 | 402.1 | 224.1* | 80 | 31 |
266.2 | 80 | 14 | ||
托拉塞米 | 349.0 | 264.1* | 38 | 21 |
290.2 | 38 | 14 | ||
脱乙酰比沙可定 | 278.2 | 184.2* | 50 | 23 |
167.2 | 50 | 55 |
注: *代表定量离子对
2 结果与讨论
2.1 样品提取条件的选择
在样品提取条件优化阶段,向空白样品中加入混合标准溶液,双醋酚丁、托拉塞米和脱乙酰比沙可定的含量为20 μg/kg,以此作为模拟样品。双醋酚丁和脱乙酰比沙可定是碱性化合物,托拉塞米为酸性化合物,3种化合物的LogP在2.53~3.82之间,属于具有一定极性的物质。因此,考虑采用极性溶剂进行提取。
2.1.1 固体样品提取溶剂
固体样品采用空白粉剂保健食品作为模拟样品,考察了不同极性溶剂(50%甲醇水溶液、甲醇、乙腈、丙酮、异丙醇、乙酸乙酯)对3种目标化合物的提取效果,结果如图1a所示。结果表明,对于固体保健食品中的双醋酚丁、托拉塞米、脱乙酰比沙可定,异丙醇和乙酸乙酯具有较好的提取效果,然而采用以上两种溶剂需在提取后进行溶剂交换,才能使用液相色谱-串联质谱仪进行检测。由结果可知,乙腈对固体保健食品中双醋酚丁、托拉塞米、脱乙酰比沙可定的提取效率虽然不及丙酮、异丙醇和乙酸乙酯,但考虑到其提取后无需进行溶剂交换就可引入液相色谱-串联质谱检测,因此选择乙腈作为提取溶剂。
由于双醋酚丁和脱乙酰比沙可定是碱性化合物,托拉塞米为酸性化合物,提取溶剂的酸碱度可能对提取效果产生影响,因此对比了采用1%甲酸乙腈、乙腈和5%氨水乙腈的提取效果,结果如图1b所示。甲酸和氨水的加入不仅对3种目标物质的提取没有促进作用,反而会使其提取效率下降,尤其是对于脱乙酰比沙可定,氨水的加入会使得提取溶液的色谱峰发生分叉,因此,选择直接使用乙腈对3种目标物质进行提取。
2.1.2 液体样品提取溶剂
液体样品采用空白口服液为模拟样品,考察了不同极性溶剂(50%甲醇水溶液、甲醇、乙腈、丙酮、异丙醇、乙酸乙酯)对3种目标化合物的提取效果,结果如图2a所示,由于部分溶剂可与水互溶,在提取样品时均加入4 g无水硫酸镁和1 g氯化钠。结果表明,对于液体保健食品中的双醋酚丁、托拉塞米、脱乙酰比沙可定,乙腈和乙酸乙酯具有较好的提取效果,考虑到使用乙腈提取后无需进行溶剂交换就可引入液相色谱-串联质谱检测,在后续实验中采用乙腈对液体保健食品进行提取。
此外,由于双醋酚丁和脱乙酰比沙可定是碱性化合物,托拉塞米为酸性化合物,提取溶剂的酸碱度可能对提取效果产生影响,因此对比了采用1%甲酸乙腈、乙腈和5%氨水乙腈的提取效果。结果如图2b所示,与固体保健食品类似,甲酸和氨水的加入不仅对3种目标物质的提取没有促进作用,反而会使其提取效率下降,因此,选择直接使用乙腈对3种目标物质进行提取。
2.1.3 提取溶剂体积
随后考察了提取溶液体积对于提取效果的影响,采用3 mL、5 mL、8 mL、10 mL、12 mL、15 mL乙腈分别对1.0 g固体、液体保健食品进行考察,结果如图3a和3b所示。结果表明,当提取液体积为10 mL时,提取效率就达到了平台期,随后提取液体积增加,提取效率基本不变。因此,对固体、液体保健食品在后续检测中均选择提取液体积为10 mL。
2.1.4 提取时间
考察了10 min、20 min、30 min、45 min、60 min和90 min的提取效率,结果如图4a和4b所示。结果表明,提取时间达到20 min后提取效率就达到了平台期,随后提取时间增加,提取效率基本不变。为保证提取完全,因此,对固体、液体保健食品在后续检测中选择提取时间为30 min。
2.2 QuEChERS净化条件的选择
考虑目标分析物中既有酸性化合物也有碱性化合物,因此使用基于阴离子交换或者阳离子交换的固相萃取小柱对双醋酚丁、托拉塞米、脱乙酰比沙可定进行同时萃取净化并不可行。由于提取条件优化中效果较好的溶剂均为有机试剂,都不是C18和HLB固相萃取小柱的合适样品溶剂,因此考虑在提取后采用分散相固相净化的方式对提取液进行净化。
采用正交试验对分散相固相净化剂进行了考察,取2 mL提取液加入净化剂净化,正交试验中使用净化剂的量见表3,净化后固体保健食品提取液和液体保健食品提取液中双醋酚丁、托拉塞米、脱乙酰比沙可定的回收率见表4和表5。由结果可知,第1~4组分散相固相净化配方对双醋酚丁、脱乙酰比沙可定的回收率均高于85%,但对于托拉塞米,所有分散相固相净化配方均对其有极强的吸附作用。由于托拉塞米是唯一的酸性化合物,且具有磺酰基结构,LogP在3个化合物中最小,即最亲水,因此分散相固相净化剂对其起吸附作用的材料可能是PSA。
表3 正交试验条件 (n = 3)
Table 3 Conditions for orthogonal test (n = 3)
分组 | PSA (mg) | C18 (mg) | GCB (mg) |
1 | 50 | 50 | 5 |
2 | 50 | 100 | 10 |
3 | 50 | 150 | 15 |
4 | 10 | 50 | 10 |
5 | 100 | 100 | 15 |
6 | 100 | 150 | 5 |
7 | 150 | 50 | 15 |
8 | 150 | 100 | 5 |
9 | 150 | 150 | 10 |
表4 不同吸附剂用量条件下对固体保健食品提取液中双醋酚丁、托拉塞米、脱乙酰比沙可定的回收率 (n = 3)
Table 4 Recoveries of diaotyldiphenolisatinum, torasemide and deacetylbisacodyl under different adsorbent amount conditions in solid health foods extraction solution (n = 3)
分组 | 回收率 (%) | ||
双醋酚丁 | 托拉塞米 | 脱乙酰比沙可定 | |
1 | 96.9 | 7.41 | 87.6 |
2 | 87.8 | 7.17 | 96.9 |
3 | 94.2 | 10.5 | 101.0 |
4 | 87.5 | 1.00 | 81.0 |
5 | 83.4 | 1.32 | 94.0 |
6 | 84.4 | 1.13 | 88.7 |
7 | 79.3 | 0.22 | 76.5 |
8 | 74.9 | 0.28 | 75.5 |
9 | 71.4 | 0.26 | 78.8 |
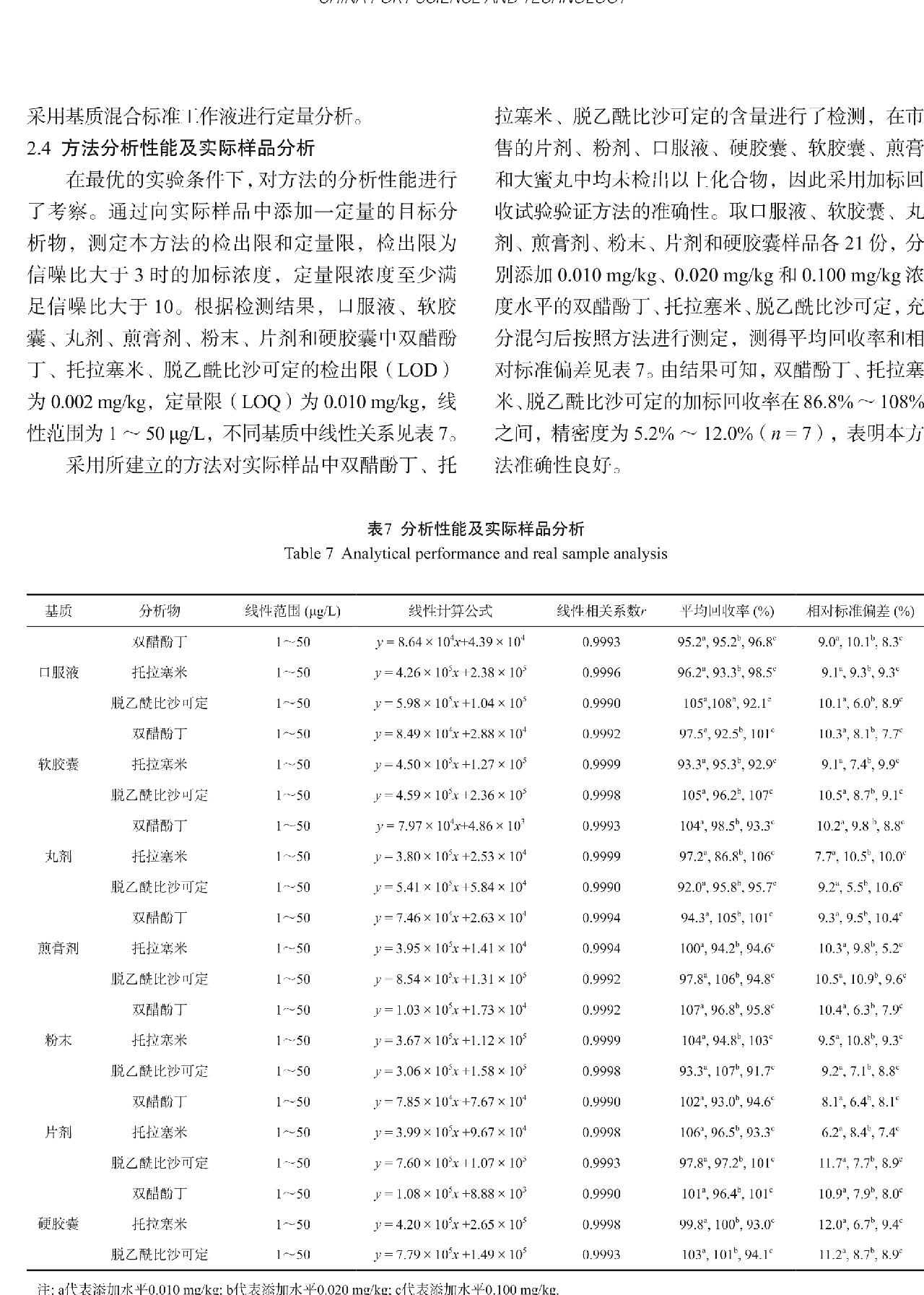
随后采用100 mg PSA、100 mg C18和10 mg GCB分别作为分散相固相净化剂考察净化后双醋酚丁、托拉塞米、脱乙酰比沙可定的回收率,结果如图5所示。由图可知,在仅加入100 mg PSA后,托拉塞米在固体保健品的提取液中的回收率将至10%以下,在液体保健品中回收率不足1%,以上结果可确定对托拉塞米具有吸附作用的净化剂的确是PSA,因此在分散相固相净化过程中不能加入PSA。
表5 不同吸附剂用量条件下对液体保健食品提取液中双醋酚丁、托拉塞米、脱乙酰比沙可定的回收率 (n = 3)
Table 5 Recoveries of diaotyldiphenolisatinum, torasemide and deacetylbisacodyl under different adsorbent amount conditions in liquid health foods extraction solution (n = 3)
分组 | 回收率 (%) | ||
双醋酚丁 | 托拉塞米 | 脱乙酰比沙可定 | |
1 | 100.0 | 0.6270 | 89.6 |
2 | 101.0 | 0.5560 | 89.1 |
3 | 99.6 | 0.5940 | 75.6 |
4 | 100.0 | 0.1690 | 88.9 |
5 | 99.8 | 0.1340 | 77.6 |
6 | 100.0 | 0.0909 | 77.3 |
7 | 101.0 | 0.0596 | 71.5 |
8 | 100.0 | 0.0557 | 79.7 |
9 | 101.0 | 0.0492 | 75.8 |
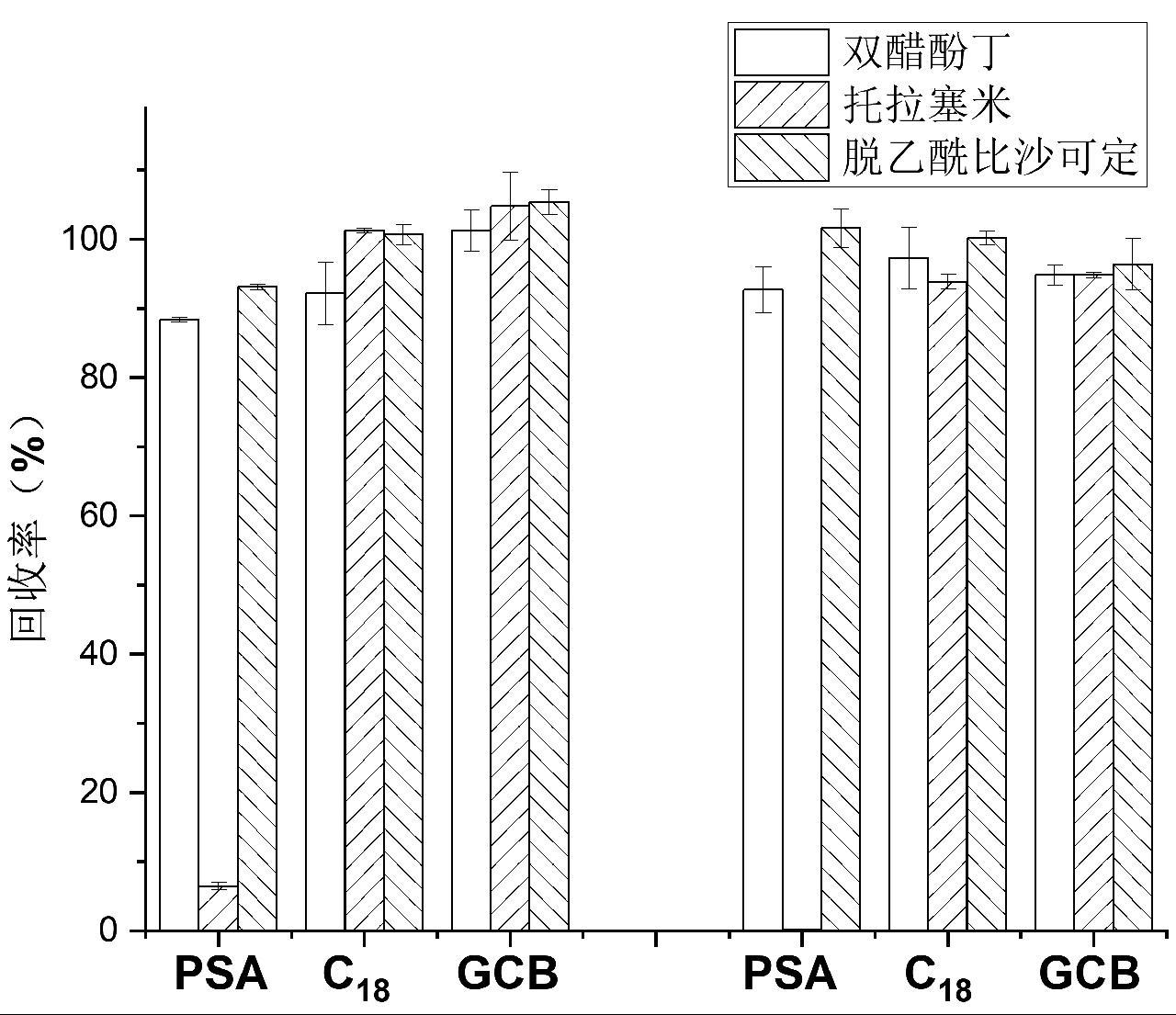
图5 PSA、C18和GCB对保健食品中双醋酚丁、托拉塞米、脱乙酰比沙可定的净化回收率
(左为固体保健品,右为液体保健品)
Fig.5 Recoveries of diaotyldiphenolisatinum, torasemide and deacetylbisacodyl with PSA, C18 and GCB as adsorbents
(left: solid health foods; light: liquid health foods)
以上单独使用不同净化剂的实验结果表明对托拉塞米有影响的净化剂只有PSA,因此分别考察使用不同量的C18和GCB(100 mg C18、200 mg C18、300 mg C18、10 mg GCB、20 mg GCB、30 mg GCB、100 mg C18和10 mg GCB、200 mg C18和20 mg GCB、300 mg C18和30 mg GCB)的净化效果。结果表明,对于固体保健品中的双醋酚丁、托拉塞米、脱乙酰比沙可定,使用200 mg C18和20 mg GCB净化后,回收率均可高于85%;对于液体保健品中的双醋酚丁、托拉塞米、脱乙酰比沙可定,使用200 mg C18和20 mg GCB净化后,回收率均可高于85%。因此,在后续净化中固体保健品使用200 mg C18和20 mg GCB进行净化,液体保健品采用200 mg C18和20 mg GCB进行净化。
2.3 基质效应
采用空白口服液、软胶囊、丸剂、煎膏剂、粉末、片剂和硬胶囊样品按照本方法的前处理步骤分别进行提取净化,在得到的净化液中加入双醋酚丁、托拉塞米和脱乙酰比沙可定的标准溶液,配置成20.0 μg/L基质添加溶液,每种做3个平行,得到的响应值的平均值与纯溶剂(乙腈溶液)配置20.0 μg/L溶液的响应值进行比较,得出双醋酚丁、托拉塞米、脱乙酰比沙可定在7种基质中的基质效应,列于表6。由表中结果可知,7类基质对双醋酚丁没有明显的基质效应,软胶囊和丸剂基质对托拉塞米有明显的增强效应,软胶囊、丸剂、粉剂和片剂基质对脱乙酰比沙可定都显示出明显的抑制效应。因此,本方法采用基质混合标准工作液进行定量分析。
2.4 方法分析性能及实际样品分析
在最优的实验条件下,对方法的分析性能进行了考察。通过向实际样品中添加一定量的目标分析物,测定本方法的检出限和定量限,检出限为信噪比大于3时的加标浓度,定量限浓度至少满足信噪比大于10。根据检测结果,口服液、软胶囊、丸剂、煎膏剂、粉末、片剂和硬胶囊中双醋酚丁、托拉塞米、脱乙酰比沙可定的检出限(LOD)为0.002 mg/kg,定量限(LOQ)为0.010 mg/kg,线性范围为1~50 μg/L,不同基质中线性关系见表7。
采用所建立的方法对实际样品中双醋酚丁、托拉塞米、脱乙酰比沙可定的含量进行了检测,在市售的片剂、粉剂、口服液、硬胶囊、软胶囊、煎膏和大蜜丸中均未检出以上化合物,因此采用加标回收试验验证方法的准确性。取口服液、软胶囊、丸剂、煎膏剂、粉末、片剂和硬胶囊样品各21份,分别添加0.010 mg/kg、0.020 mg/kg和0.100 mg/kg浓度水平的双醋酚丁、托拉塞米、脱乙酰比沙可定,充分混匀后按照方法进行测定,测得平均回收率和相对标准偏差见表7。由结果可知,双醋酚丁、托拉塞米、脱乙酰比沙可定的加标回收率在86.8%~108%之间,精密度为5.2%~12.0%(n = 7),表明本方法准确性良好。
3 结论
本研究针对口服液、软胶囊、丸剂、煎膏剂、粉末、片剂和硬胶囊中的双醋酚丁、托拉塞米、脱乙酰比沙可定,建立了一种基于QuEChERS前处理技术与LC-MS/MS联用的检测新方法,通过对提取溶剂、提取液体积、提取时间及净化条件的优化,确定了最优的前处理条件,所建立的方法的检出限为0.002 mg/kg,定量限为0.010 mg/kg,线性范围为1~50 μg/L。采用所建立的方法对市售的7类保健食品进行检测,未检出双醋酚丁、托拉塞米和脱乙酰比沙可定,采用加标回收试验验证方法的准确性,回收率在86.8%~108%之间,精密度为5.2%~12.0%,结果表明本方法具有良好的准确性,且适用于保健食品中双醋酚丁、托拉塞米和脱乙酰比沙可定的精准、大批量筛查分析检测。
参考文献
[1] Sharpless K E, Ulberth F. Food and dietary supplements[J]. Analytical and Bioanalytical Chemistry, 2007, 389(1): 1-2.
[2] Bandara S B, Urban A, Liang L G, et al. Active pharmaceutical contaminants in dietary supplements: a tier-based risk assessment approach[J]. Regulatory Toxicology and Pharmacology, 2021, 123(Suppl 1): 104955.
[3] Costa J G, Vidovic B, Saraiva N, et al. Contaminants: a dark side of food supplements[J]. Free Radical Research, 2019, 53(sup1): 1113-1135.
[4] Kim H J, Lee J H, Park H J, et al. Monitoring of 29 weight loss compounds in foods and dietary supplements by LC-MS/MS[J]. Food Additives & Contaminants: Part A, 2014, 31(5): 777-783.
[5] Kim J Y, Park H J, Kim J W, et al. Development and validation of UPLC and LC-MS/MS methods for the simultaneous determination of anti-obesity drugs in foods and dietary supplements[J]. Archives of Pharmacal Research, 2016, 39(1): 103-114.
[6] Yun J, Choi J, Jo C H, et al. Detection of Synthetic Anti-Obesity Drugs, Designer Analogues and Weight- Loss Ingredients as Adulterants in Slimming Foods from 2015 to 2017[J]. Journal of Chromatography & Separation Techniques, 2018, 9(1): 1000396.
[7] Zeng Y, Xu Y, Kee C L, et al. Analysis of 40 weight loss compounds adulterated in health supplements by liquid chromatography quadrupole linear ion trap mass spectrometry[J]. Drug Testing and Analysis, 2017, 9(2): 334-334.
[8] 梁明, 胡均鹏, 吴玉銮, 等. QuEChERS/超高效液相色谱-串联质谱法测定动物源食品中氟啶虫胺腈和氟吡呋喃酮残留量[J]. 分析测试学报, 2023, 42(6): 722-728.
[9] 温勇, 顾茜, 崔昕毅. 小鼠器官中新型全氟化合物QuEChERs分析方法的建立与应用[J]. 环境化学, 2022, 41(10): 3125-3134.
[10] 庄鹏, 纪少凡, 谢宏洋, 等. HPLC-MS/MS法测定热带水果中新烟碱类杀虫剂哌虫啶和环氧虫啶[J]. 中国口岸科学技术, 2023, 5(3): 66-73.
[11] 王娇, 吴桐, 王新全, 等. QuEChERS-液相色谱-串联质谱法测定中草药中22种三唑类农药残留[J]. 色谱, 2023, 41(4): 330-338.
[12] 季宝成, 韩雨, 杨澜瑞, 等. 改良QuEChERs-超高效液相色谱-串联质谱法测定羊肉中28种药物残留[J]. 质谱学报, 2023, 44(3): 442-451.
[13] 周春红, 彭文静. 超高效液相色谱-三重四级杆质谱多反应监测模式测定葡萄酒中41种农药和7种真菌毒素残留[J]. 食品与发酵工业, 2023, 49(4): 264-267.


图1 不同溶剂对固体保健食品中双醋酚丁、托拉塞米、脱乙酰比沙可定的提取效果
Fig.1 The effect of extraction solution for diaotyldiphenolisatinum, torasemide and deacetylbisacodyl in solid health foods
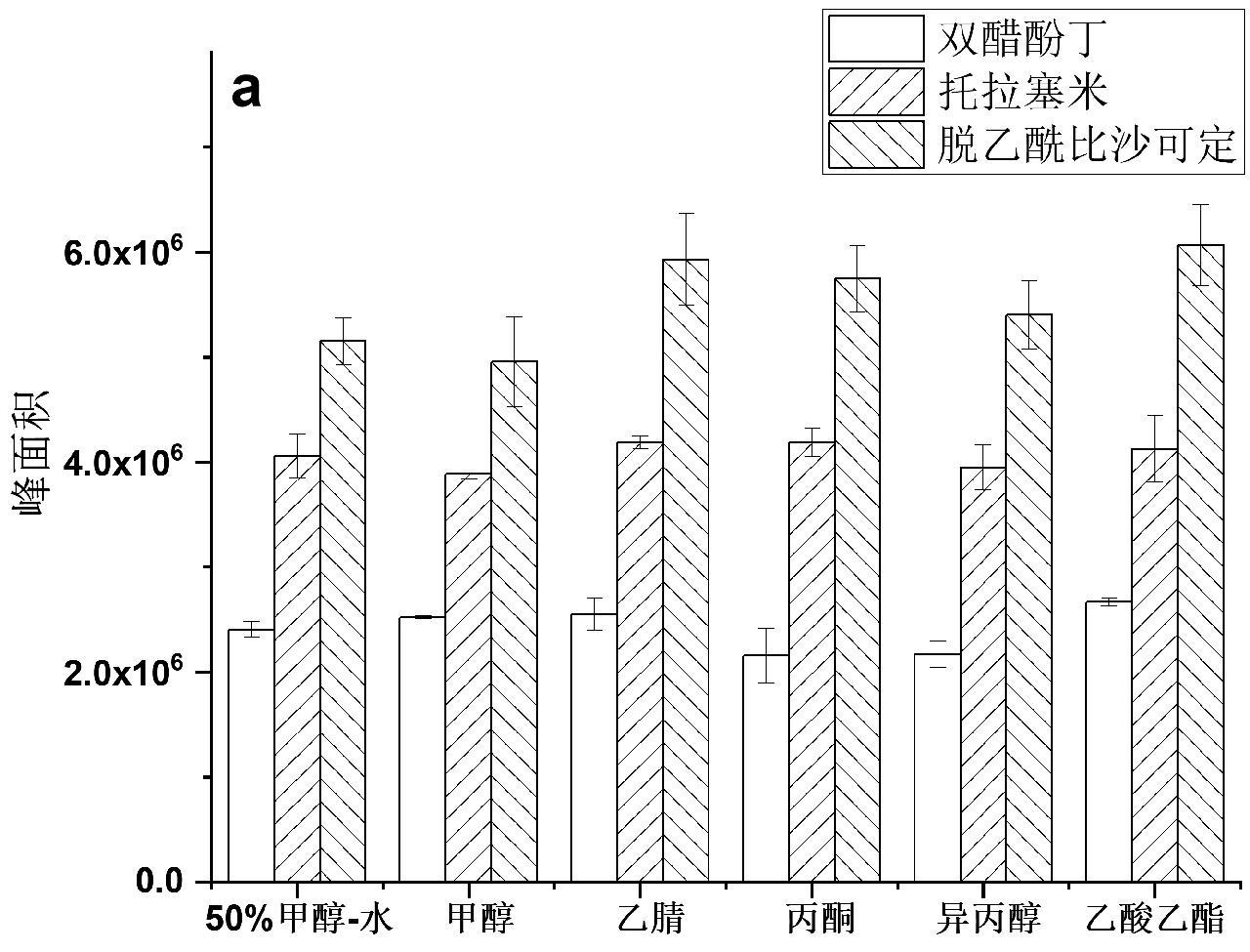
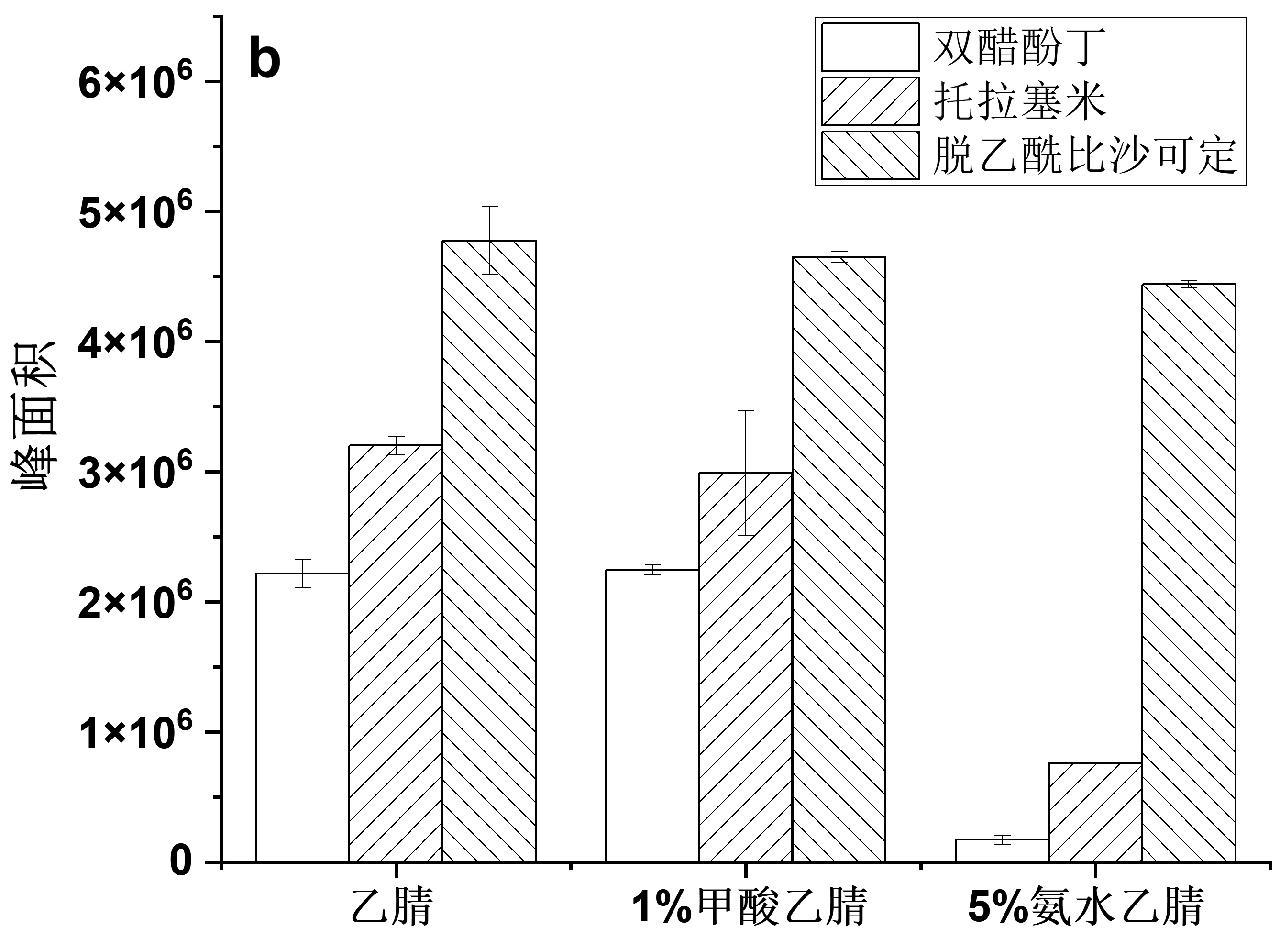
图2 不同溶剂对液体保健食品中双醋酚丁、托拉塞米、脱乙酰比沙可定的提取效果
Fig.2 The effect of extraction solution for diaotyldiphenolisatinum, torasemide and deacetylbisacodyl in liquid health foods
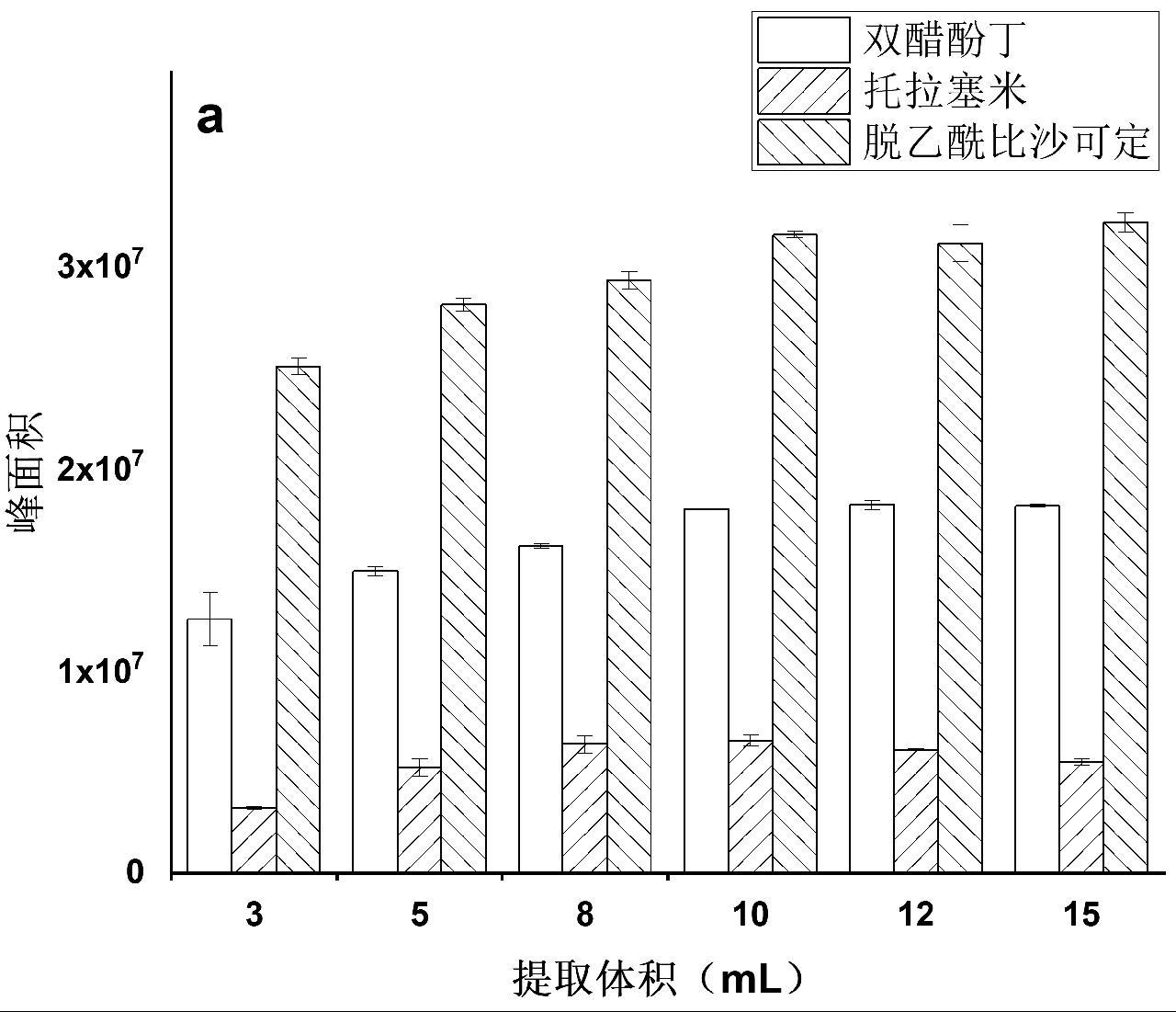
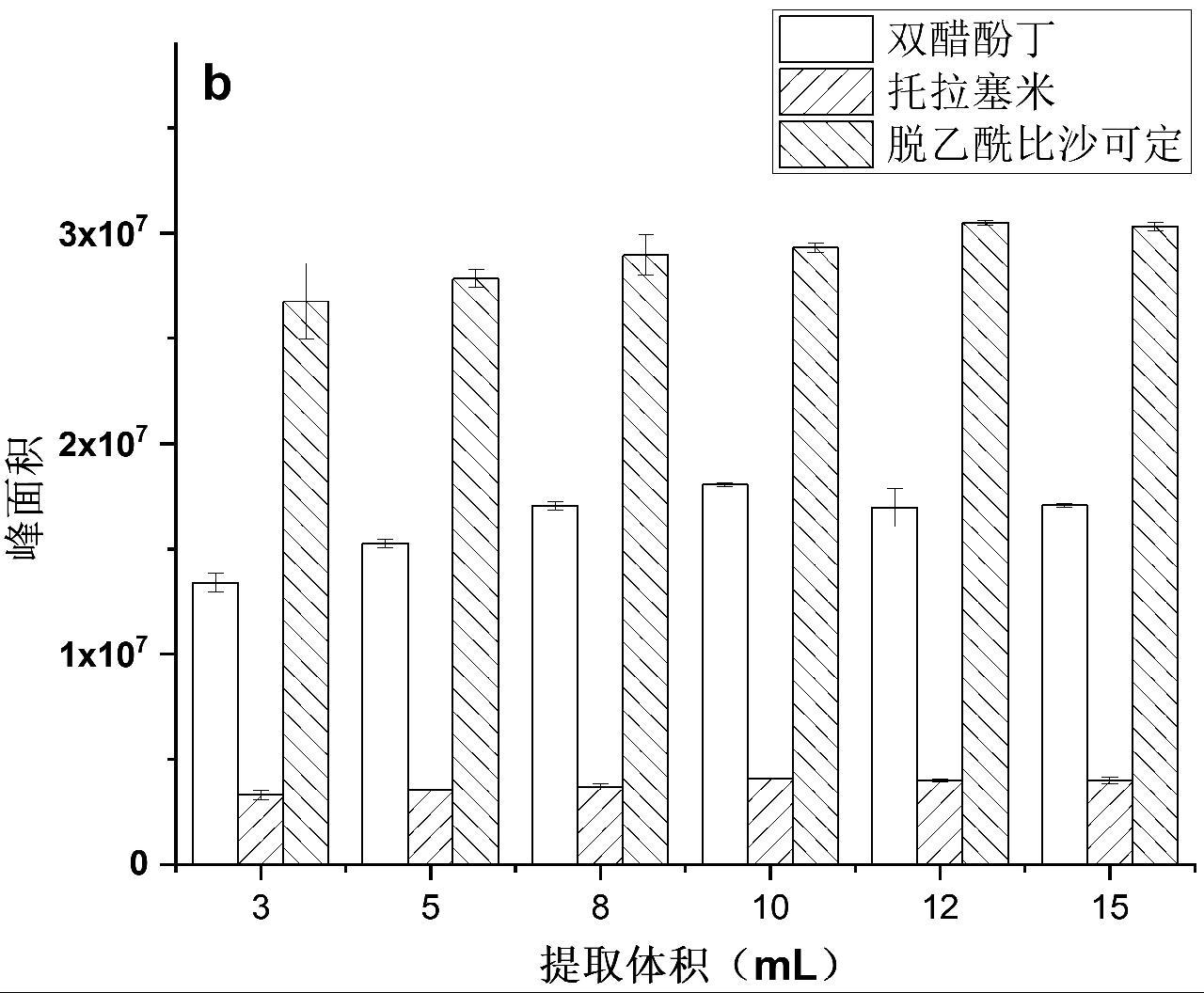
图3 提取液体积对固体保健食品(a)和液体保健食品(b)中双醋酚丁、托拉塞米、脱乙酰比沙可定的提取效果
Fig.3 The effect of extraction volume for diaotyldiphenolisatinum, torasemide and deacetylbisacodyl in solid health foods (a) and liquid health foods (b)

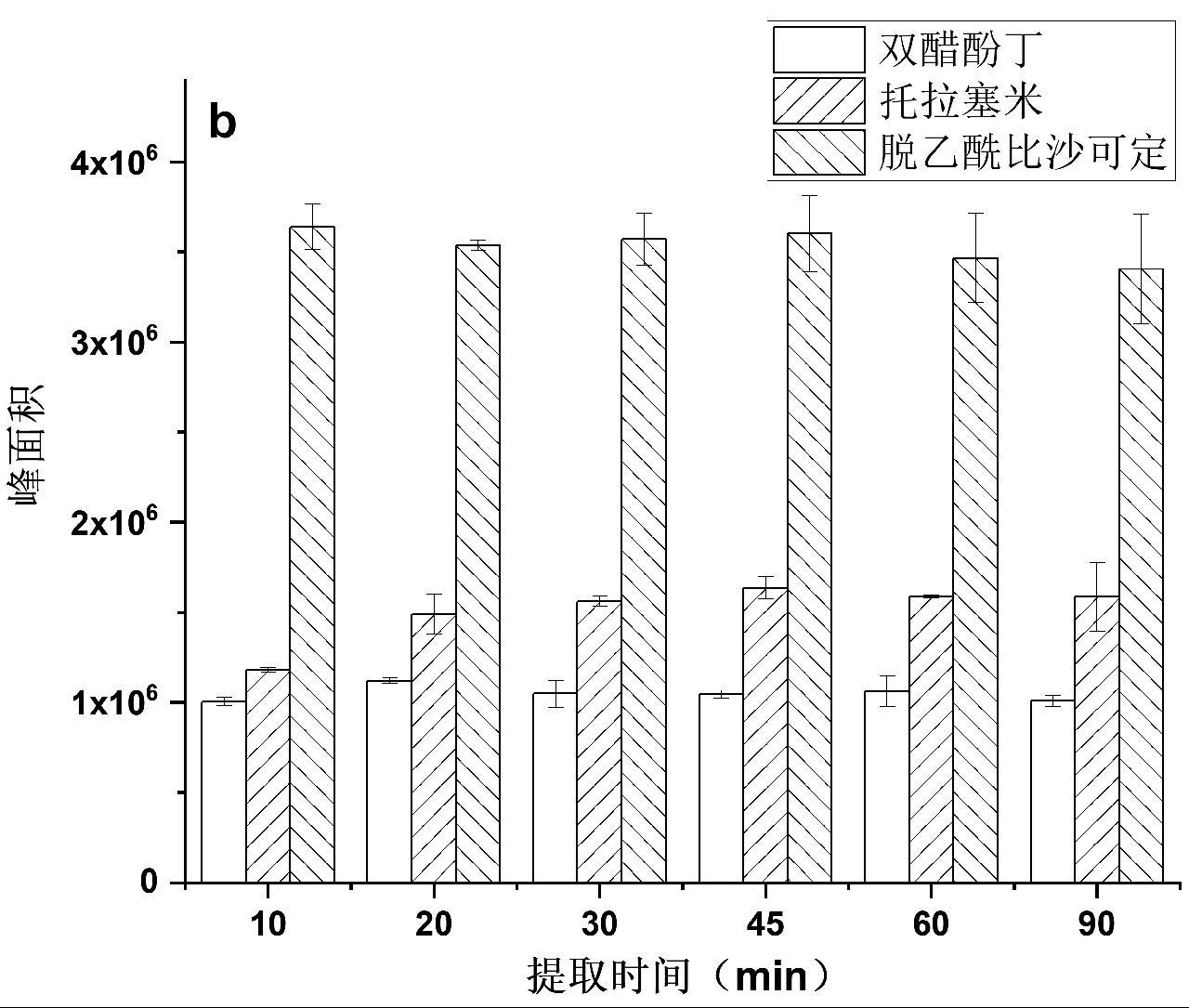
图4 提取时间对固体保健食品(a)和液体保健食品(b)中双醋酚丁、托拉塞米、脱乙酰比沙可定的提取效果
Fig.4 The effect of extraction time for diaotyldiphenolisatinum, torasemide and deacetylbisacodyl in solid health foods (a) and liquid health foods (b)
表6 不同保健食品基质中双醋酚丁、托拉塞米、脱乙酰比沙可定的基质效应因子 (n = 3)
Table 6 Matrix effect factor of diaotyldiphenolisatinum, torasemide and deacetylbisacodyl in different health foods matrices (n = 3)
基质 | 基质效应因子 (%) | ||
双醋酚丁 | 托拉塞米 | 脱乙酰比沙可定 | |
口服液 | 104.0 | 104 | 82.2 |
软胶囊 | 103.0 | 135 | 64.5 |
丸剂 | 85.6 | 128 | 65.0 |
煎膏剂 | 103.0 | 119 | 101.0 |
粉末 | 97.9 | 122 | 59.3 |
片剂 | 104.0 | 98.2 | 74.3 |
硬胶囊 | 97.6 | 117 | 83.7 |
表7 分析性能及实际样品分析
Table 7 Analytical performance and real sample analysis
基质 | 分析物 | 线性范围 (μg/L) | 线性计算公式 | 线性相关系数r | 平均回收率 (%) | 相对标准偏差 (%) |
口服液 | 双醋酚丁 | 1~50 | y = 8.64×104x+4.39×104 | 0.9993 | 95.2a, 95.2b, 96.8c | 9.0a, 10.1b, 8.3c |
托拉塞米 | 1~50 | y = 4.26×105x +2.38×105 | 0.9996 | 96.2a, 93.3b, 98.5c | 9.1a, 9.3b, 9.3c | |
脱乙酰比沙可定 | 1~50 | y = 5.98×105x +1.04×105 | 0.9990 | 105a,108b, 92.1c | 10.1a, 6.0b, 8.9c | |
软胶囊 | 双醋酚丁 | 1~50 | y = 8.49×104x +2.88×104 | 0.9992 | 97.5a, 92.5b, 101c | 10.3a, 8.1b, 7.7c |
托拉塞米 | 1~50 | y = 4.50×105x +1.27×105 | 0.9999 | 93.3a, 95.3b, 92.9c | 9.1a, 7.4b, 9.9c | |
脱乙酰比沙可定 | 1~50 | y = 4.59×105x +2.36×105 | 0.9998 | 105a, 96.2b, 107c | 10.5a, 8.7b, 9.1c | |
丸剂 | 双醋酚丁 | 1~50 | y = 7.97×104x+4.86×103 | 0.9993 | 104a, 98.5b, 93.3c | 10.2a, 9.8 b, 8.8c |
托拉塞米 | 1~50 | y = 3.80×105x +2.53×104 | 0.9999 | 97.2a, 86.8b, 106c | 7.7a, 10.5b, 10.0c | |
脱乙酰比沙可定 | 1~50 | y = 5.41×105x +5.84×104 | 0.9990 | 92.0a, 95.8b, 95.7c | 9.2a, 5.5b, 10.6c | |
煎膏剂 | 双醋酚丁 | 1~50 | y = 7.46×104x +2.63×104 | 0.9994 | 94.3a, 105b, 101c | 9.3a, 9.5b, 10.4c |
托拉塞米 | 1~50 | y = 3.95×105x +1.41×104 | 0.9994 | 100a, 94.2b, 94.6c | 10.3a, 9.8b, 5.2c | |
脱乙酰比沙可定 | 1~50 | y = 8.54×105x +1.31×105 | 0.9992 | 97.8a, 106b, 94.8c | 10.5a, 10.9b, 9.6c | |
粉末 | 双醋酚丁 | 1~50 | y = 1.03×105x +1.73×104 | 0.9992 | 107a, 96.8b, 95.8c | 10.4a, 6.3b, 7.9c |
托拉塞米 | 1~50 | y = 3.67×105x +1.12×105 | 0.9999 | 104a, 94.8b, 103c | 9.5a, 10.8b, 9.3c | |
脱乙酰比沙可定 | 1~50 | y = 3.06×105x +1.58×105 | 0.9998 | 93.3a, 107b, 91.7c | 9.2a, 7.1b, 8.8c | |
片剂 | 双醋酚丁 | 1~50 | y = 7.85×104x +7.67×104 | 0.9990 | 102a, 93.0b, 94.6c | 8.1a, 6.4b, 8.1c |
托拉塞米 | 1~50 | y = 3.99×105x +9.67×104 | 0.9998 | 106a, 96.5b, 93.3c | 6.2a, 8.4b, 7.4c | |
脱乙酰比沙可定 | 1~50 | y = 7.60×105x +1.07×105 | 0.9993 | 97.8a, 97.2b, 101c | 11.7a, 7.7b, 8.9c | |
硬胶囊 | 双醋酚丁 | 1~50 | y = 1.08×105x +8.88×103 | 0.9990 | 101a, 96.4b, 101c | 10.9a, 7.9b, 8.0c |
托拉塞米 | 1~50 | y = 4.20×105x +2.65×105 | 0.9998 | 99.8a, 100b, 93.0c | 12.0a, 6.7b, 9.4c | |
脱乙酰比沙可定 | 1~50 | y = 7.79×105x +1.49×105 | 0.9993 | 103a, 101b, 94.1c | 11.2a, 8.7b, 8.9c | |
注: a代表添加水平0.010 mg/kg; b代表添加水平0.020 mg/kg; c代表添加水平0.100 mg/kg. | ||||||
基金项目:海关总署科研项目(2021HK194);金华市科学技术研究计划项目(2021-4-353)
第一作者:曹丹(1983—),女,汉族,浙江金华人,硕士,高级工程师,主要从事食品、化妆品及轻工消费品安全检测研究,E-mail: jinhuacaod@sina.com
通信作者:朱倩(1988—),女,汉族,浙江金华人,工程师,主要从事食品和化妆品安全检测研究,E-mail: zhuq0731@sina.com
1. 金华海关综合技术服务中心 金华 321015
2. 杭州海关技术中心 杭州 310063
3. 宁波海关技术中心 宁波 315012
1. Jinhua Customs Comprehensive Technical Service Center, Jinhua 321015
2. Hangzhou Customs Technology Center, Hangzhou 310063
3. Ningbo Customs Technology Center, Ningbo 315012