CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
驼乳中牛乳和羊乳掺假快速检测试纸条的研制
作者:付辉 于志强 黄素文 赵秀玲 张吉红 黄永健 马涛
付辉 于志强 黄素文 赵秀玲 张吉红 黄永健 马涛
驼乳因其过敏原性低,营养物质丰富,氨基酸种类齐全且浓度高,不饱和脂肪酸所占比例较高,富含钙、磷等矿物元素和多种维生素而广受消费者青睐[1-4]。同时,低产量、较偏僻的骆驼养殖饲养场和较高的运输成本等因素导致其市售价格普遍高于牛乳和羊乳。一些不法商贩利用牛乳、羊乳和驼乳的价格差,向驼乳中掺入价格低廉的牛乳和羊乳,从而非法牟取暴利[5-7]。
目前对掺假驼乳进行检测的方法主要有核酸检测方法、核磁共振光谱、色谱检测技术及生物传感等。核酸检测法的缺点是仪器设备昂贵、需要专业技师、探测范围窄、探测时间长等,对现场探测来说并不适用[8]。核磁共振光谱法的缺点主要是需要在繁琐的样品处理过程后才能进行相关指标的检验,且设备成本较高,一般机构难以承受[9]。色谱检测技术的缺点为成本高、检测速度慢,无法快速检测牛奶[10]。生物传感器法(Bio-sensormethod)的主要问题在于成本较高、技术复杂,杂交的专一性和自动化程度还需要改进,且目前扫描结果、背景扣分、后期数据处理等技术还不够完善[11]。
试纸条检测技术是20世纪70年代兴起的适用于现场检测的一种快速检验技术,相较于酶联免疫吸附试验(ELISA),其具有普适性、快捷性等优点。免疫层析试纸条检测技术具有操作简便、结果快速且稳定、无需大型设备及成本低廉等优势。
为助力市场监管部门在现场检测中能够快速筛选掺假驼乳,本研究研制了一种能够快速检测出驼乳中是否掺有牛乳或羊乳等低价乳制品的快速检测试纸条,旨在为净化我国驼乳制品市场、打击掺假违法行为、维护广大消费者的合法权益、促进我国驼乳产业健康有序发展提供技术支持。
1 材料与方法
1.1 主要材料
胶体金和Giagen DNeasy Blood & Tissue Kit购自simga公司;驼乳中牛乳和羊乳掺假酪蛋白单抗、乳品掺假抗原和羊抗鼠IgG均为自制;硝酸纤维素膜购自美国Millipore公司;驼乳购自新疆奶农。
1.2 主要设备
移液器购自德国eppendorf公司;电子天平QUINTIX124-1CN购自德国赛多利斯公司;高速离心机X1R购自美国赛默飞世尔科技公司;涡旋混合器购自中国其林贝尔公司;LightCycler®480II荧光定量PCR仪购自瑞氏罗氏ACCU-CHEK公司等。
1.3 单抗和多抗的制备
1.3.1 单抗的制备
1)腹水的制备。对每只Balb/c小鼠腹腔内注射0.5 mL液态石蜡。接种阳性杂交瘤细胞株前一周,扩大培养单克隆细胞株。一周后,从细胞瓶中吹下扩大培养的细胞,1000 r/min离心10 min,去上清,用RPMI 1640培养液洗2次,加入RPMI 1640培养液,混匀计数,将细胞密度调至1~2×106 个/mL,每只小鼠腹腔内注射0.5 mL细胞悬液。每天观察接种细胞后的小鼠腹部,7~10 d后待小鼠腹部明显膨大、行动困难时,将其颈椎脱臼处死,用无菌注射器从小鼠腹部吸出暗红色液体10000 r/min离心10 min,取上清分装并标记好,在-20℃的温度下保存,备用。
2)单克隆抗体的纯化。将上述检验合格的酪蛋白单抗腹水在4℃下12000 r/min离心20 min,去除沉淀,上清用PBS稀释2倍,上peotein-A亲和柱进行纯化。先用10倍柱容积的0.02 mol/L的PBS(pH 7.4)洗柱,然后以1 mL/min的速度用蠕动泵加入腹水样品,再用5~10倍柱容积的PBS缓冲液清洗。最后,用3~5倍柱容积的0.1 mol/L的甘氨酸-盐酸(pH 3.5)进行洗脱,将含抗体的洗脱液收集起来,用1 mol/L Tris pH 9.0的缓冲液中和,4℃进行透析。单克隆抗体经提纯后定量分装,保存在-20℃以下,备用。
1.3.2 包被用多抗的制备
1)免疫程序。使用全乳化的弗氏全佐剂抗原,配合假酪蛋白,以60 μg/只的免疫剂量,皮下多点免疫注射羊(共免疫10只)。首免后28 d,然后使用不完全福氏佐剂乳化酪蛋白,免疫剂量为100 μg/只的皮下多点免疫绵羊;28 d后进行1次强化免疫,免疫剂量为P73蛋白100 μg/只。
2)采血。免疫后7 d开始每周进行耳静脉采血,若血清效价不低,则对采集的羊抗鼠血清进行2倍稀释。用自然凝结法将血清效价合格的羊进行血清分离,经颈动脉无菌放血。
3)纯化。按照辛酸硫酸铵法进行纯化。
1.4 胶体金标记酪蛋白单抗
1.4.1 待标记单抗的准备
取出-20℃条件下保存的酪蛋白单抗,自然解冻,用抗体稀释液稀释至1 mg/mL。
1.4.2 标记最佳反应条件的选定
取6个1.5 mL离心管,分别加入1 mL胶体金,然后依次加入1 μL、2 μL、3 μL、4 μL、6 μL、8 μL 0.5 mol/L的Tris(pH 9.0),混匀;再分别加入2 μL的1 mg/mL的单抗,混合均匀;静置15 min后,分别加入200 μL 10% NaCl,混合均匀,再静置15 min后观察颜色变化。
1.4.3 标记蛋白最佳浓度的选定
取8个1.5 mL离心管,分别加入l mL胶体金,再各加适量0.5 mol/L Tris(pH 9.0)调至最适pH值。混合均匀后依次加入1 μL、2 μL、3 μL、4 μL、5 μL、6 μL、8 μL、10 μL 1 mg/mL单抗,再次混匀;静置15 min后,分别加入200 μL 10% NaCl,混合均匀,再静置15 min后观察颜色变化。
1.4.4 封闭液浓度的选定
取5根1.5 mL的离心管,加入1 mL的胶体金。每管加入适量0.5 mol/L的Tris(pH 9.0),调至最合适的pH值,搅拌均匀即可。然后,加入一定量的单抗,使其浓度达到最佳,混合均匀后静置15 min。按顺序加入1%、5%、10%、15%、20% BSA,搅拌均匀,静置15 min。4℃下10000 r/min离心15 min。对各管胶体金挂壁及沉淀情况进行观察,对封闭作用进行比较。
1.5 试纸条的制备
试纸由样品垫、吸水纸、硝酸纤维素膜和底板组成。用点膜仪按1 μL/cm的量在硝酸纤维素膜上喷涂乳剂掺假抗原1/6、羊抗鼠IgG 0.17 mg/mL,分别作为检测线和质控线。将喷涂好的硝酸纤维素放在50℃的烘箱中烘干16~25 h。在底板上依次贴上硝酸纤维素膜和样品垫,再贴上吸水纸。然后,切成宽4.40 mm的试纸,装进密封袋,加入干燥剂,4℃密封保存即可。
1.6 特异性实验
选取1个阴性骆驼生鲜乳,用冻干的金标抗体和包被了乳品掺假抗原和羊抗鼠IgG二抗的硝酸纤维素膜,按照操作步骤,依次添加磺胺类药物、氟喹诺酮类药物、四环素类药物、黄曲霉毒素M1等,测试重复2次。
1.7 灵敏性试验
选择2个阴性骆驼生鲜乳,分别添加0%、0.015%、0.030%、0.050%含量的牛乳和0%、0.15%、0.30%、0.50%含量的羊乳。每个添加量平行测试2次。
在反应杯中加入100 μL纯水和100 μL奶样,上下抽吸5~10次混匀;40℃温育3 min;试纸条插入到试剂微孔中,反应3 min;从微孔中取出试纸条,去掉下端样品垫,并进行结果判读。
1.8 检测原理和结果判定
本产品采用胶体金免疫层析技术,在硝酸纤维素膜的检测线(T线)和对照线(C线)处分别包入乳剂掺假抗原和绵羊抗鼠IgG二抗,用于微孔冻干金标抗体的检测。若样本中含有牛乳成分或羊乳成分,则在微孔温育过程中与含有胶体金标的酪蛋白单克隆抗体结合,从而抑制了含有掺假抗原的奶制品在硝酸纤维素膜上包被的金标抗体与乳制品的结合。若T线颜色弱于C线或不显色,即样品中牛乳成分或羊乳成分等于或超过产品检出限,反之T线颜色强于C线颜色,则说明样品中牛乳成分或羊乳成分低于产品检出限。
1.9 重复性试验
取空白组驼奶与4个不同的加标组驼奶,每组各50份,加标浓度为检测上限浓度。随机抽取快速检测试纸条,检测驼奶样品,计算符合率结果得出试纸条的灵敏度和特异性。各检测指标计算公式如下:
阳性符合率=阳性样本中检测阳性结果数量/实际阳性数量
假阳性率=阴性样本中检测假阳性结果数量/实际阴性数量
阴性符合率=阴性样本中检测阴性结果数量/实际阴性数量
假阴性率=阳性样本中检测阴性结果数量/实际阳性数量
1.10 一致性试验
取100 μL奶样(分别是混入牛乳0.05%、混入羊乳0.50%)至1.5 mL离心管,加入180 μL ATL和20 μL蛋白激酶K,56℃金属浴孵育1 h至完全裂解。加入200 μL AL,56℃金属浴孵育10 min。加入200 μL AL无水乙醇,震荡混匀,6000 r/min离心1 min。把上清转移至DNeasy Mini spin column柱子中,6000 r/min离心1 min。把DNeasy Mini spin column柱子放到新的收集管中,加500 μL buffer AW1,6000 r/min离心1 min;把DNeasy Mini spin column柱子放到新的收集管中,加500 μL buffer AW2,6000 r/min离心3 min。把DNeasy Mini spin column柱子放到新的1.5 mL离心管中,加100 μL AE,室温静置1 min,6000 r/min离心1min。离心后的液体作为模板按照表1的反应体系进行加样。使用罗氏480II荧光定量PCR仪进行荧光定量PCR实验,反应条件为:50℃ 2 min→95℃ 10 min→40×(95℃ 15 s→60℃ 1 min)收集荧光。
取100 μL上述奶样,将试纸条插入到试剂微孔中,反应3 min;从微孔中取出试纸条,去掉下端样品垫,并进行结果判读。
2 实验结果
2.1 单抗的标记
2.1.1 标记最适反应pH的选择
胶体金表面带负电荷,酸性条件下呈现出加入蛋白的胶体金状态,容易发生团聚,形成灰色或紫色复合物,所以一般pH会略偏碱性。如表2所示,在加入NaCl后,1号样品的颜色变为灰色或紫色,说明胶体金不稳定并发生了团聚;2号样品之后的胶体金依旧保持红色,证明胶体金性质稳定。因此,综合考虑成本,标记最适反应条件选择1 mL胶体金加2 μL 0.5 mol/L的Tris(pH 9.0)。
2.1.2 标记蛋白最适浓度
不同蛋白浓度条件下,各管颜色变化见表3,8管颜色均保持红色。在最小蛋白稳定量的基础上再增加20%,即为标记所需的最适蛋白量。因此,标记此单抗的最适蛋白浓度应为2 μg/mL。
2.1.3 封闭液浓度的选择
如图1所示,在1% BSA和5% BSA封闭条件下,均出现胶体金挂壁现象,其中1% BSA封闭时挂壁最为严重,5% BSA封闭时有极轻微挂壁。当BSA浓度升高到10%以及以上时,胶体金不再出现挂壁现象,因此,综合考虑成本,选用10% BSA封闭。

图1 不同浓度BSA封闭效果
Fig.1 Blocking effect of different concentrations of BSA
2.2 T线包被抗原的选择
选用硝酸纤维素膜,将不同浓度的奶制品掺假抗原和羊鼠IgG分别喷涂在检测线(T线)和质控线(C线)上。阳性检测样本为牛驼乳添加物0.03%~0.05%、羊驼乳添加物0.3%~0.5%,阴性样本为不含添加物的羊驼乳,比较包被效果。阴性样品检测结果没有出现假阳性情况;阳性样品在检测限量范围内均可报告为阳性(图2)。
2.3 金标单抗最佳工作浓度的选择
将金标单抗用抗体稀释液按照1∶1、1∶2、1∶5、1∶10的比例进行稀释;将奶制品掺假抗原按1/6的浓度稀释后以1 μL/cm的量喷涂在硝酸纤维素膜上,将0.17 mg/mL的羊抗鼠IgG喷在质控线上;制备组装后进行检测,检测结果表明,1∶1稀释后的金标抗体具有更明亮的亮度和更好的结合抗原的特性(图3)。金标单抗被稀释1∶2、1∶5、1∶10的浓度,检测线金标结合物显色下降与浓度下降正相关,故后续实验均选用1倍稀释的金标抗体。
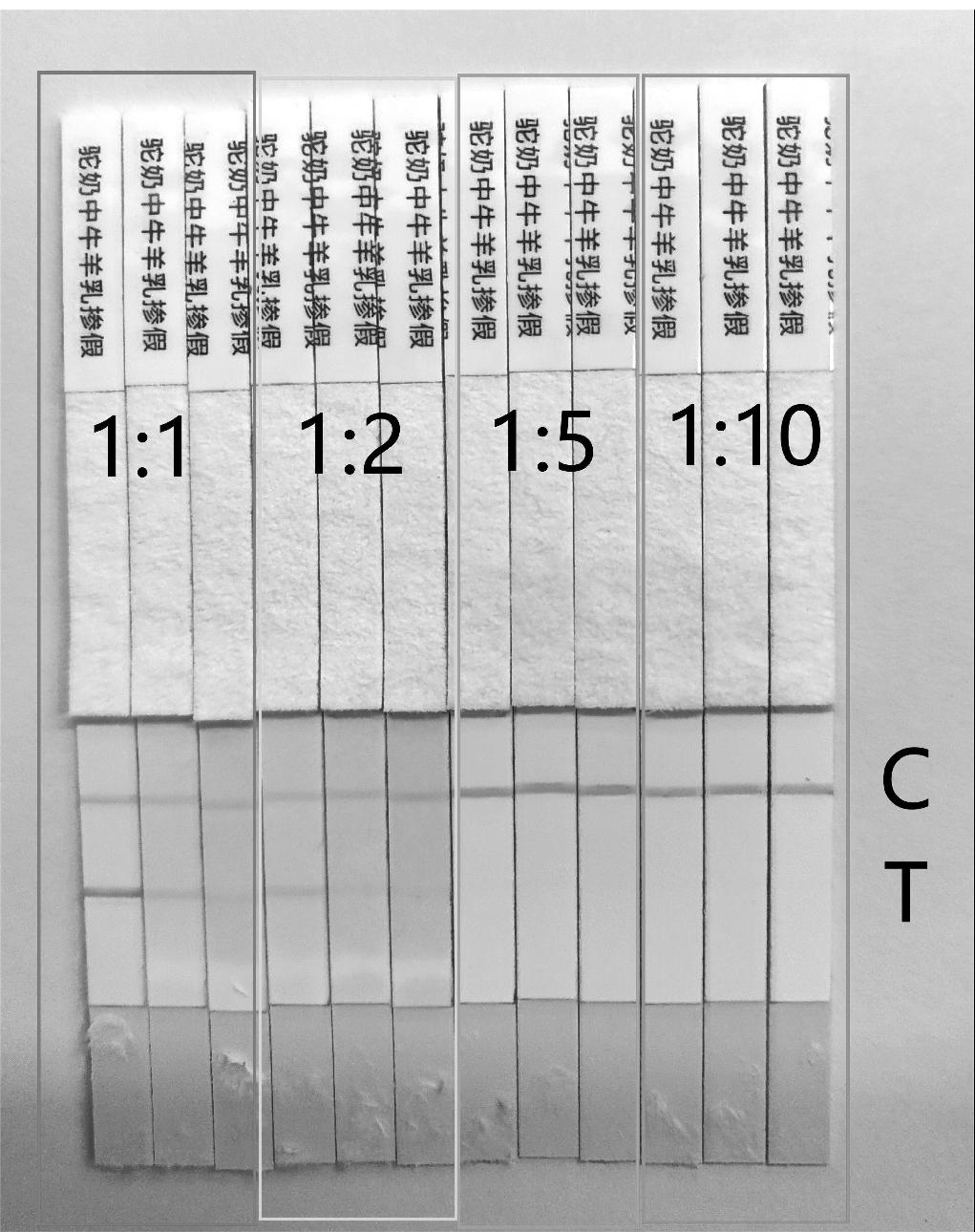
图3 使用不同浓度金标单抗的检测结果
Fig.3 The results of different concentrations of gold labeled monoclonal antibody
2.4 特异性试验
按上述优化条件制备试纸条,加入磺胺类药物、氟喹诺酮类药物、四环素类药物、黄曲霉毒素M1等。检测结果显示皆为阴性,表明本产品与磺胺类药物、氟喹诺酮类药物、四环素类药物、黄曲霉毒素M1等不发生交叉反应(图4)。
2.5 灵敏度试验
用胶体金试纸条检测0.000%~0.050%的驼乳牛乳添加物和0.00%~0.50%的驼乳羊乳添加物,以0.030%~0.050%的驼乳牛乳添加物和0.3%~0.5%的驼乳羊乳添加物为阳性检测样本,不含添加物的驼乳为阴性检测样本。从表4和表5可以看出,当牛、羊乳添加浓度分别为0.030%和0.30%时,阳性率为50%~80%和60%~80%,当牛、羊乳添加浓度为0.050%和0.50%时,阳性率为100%,因此驼乳牛乳添加物检测限定为0.030%~0.050%,驼乳羊乳添加物检测限定为0.30%~0.50%。

1: 对照组; 2: 磺胺类药物; 3: 四环素类药物; 4: 氟喹诺酮类药物; 5: 黄曲霉毒素M1
图4 针对不同药物的检测结果
Fig.4 Detection results of different drugs
表4 牛奶添加检测限试验结果
Table 4 Results of the detection limit test for cow milk addition
样品 | (%) | (份) | (份) | (份) | (%) |
驼乳1 | 0.000 | 20 | 0 | 20 | 0 |
0.015 | 20 | 0 | 20 | 0 | |
0.030 | 20 | 10 | 10 | 50 | |
0.050 | 20 | 20 | 0 | 100 | |
驼乳2 | 0.000 | 20 | 0 | 20 | 0 |
0.015 | 20 | 0 | 20 | 0 | |
0.030 | 20 | 12 | 10 | 60 | |
0.050 | 20 | 20 | 0 | 100 | |
驼乳3 | 0.000 | 20 | 0 | 20 | 0 |
0.015 | 20 | 0 | 20 | 0 | |
0.030 | 20 | 16 | 4 | 80 | |
0.050 | 20 | 20 | 0 | 100 | |
驼乳4 | 0.000 | 20 | 0 | 20 | 0 |
0.015 | 20 | 0 | 20 | 0 | |
0.030 | 20 | 10 | 10 | 50 | |
0.050 | 20 | 20 | 0 | 100 |
2.6 重复性试验
由表6可以看出,对50份牛奶加标样品和50份空白样品分别进行检测,其中加标样品检测结果100%显示阳性,空白样本检测结果100%显示阴性,该方法的灵敏度与特异性均为100%,假阳性率和假阴性率均为0%。
2.7 一致性试验
通过荧光定量PCR检测可以看出驼乳中混入牛乳0.05%的Ct值为34.16;混入羊乳0.50%的Ct值为32.51,均为阳性结果。通过试纸条对上述奶样进行检测可发现,该奶样均为阳性结果。
在混入0.05%牛乳和0.5%羊乳的驼乳样品中,通过荧光定量PCR和试纸条两种检测方法检测结果一致。
3 结论
本研究主要采用待检抗原与胶体金标记的抗体特异性结合显色的原理,建立了检测驼乳中是否掺有牛乳或羊乳的一种免疫标记检测技术。其特点为:1)特异性强,与磺胺类药物、氟喹诺酮类药物、四环素类药物、黄曲霉毒素M1等无交叉反应,避免了药物残留造成的假阳性结果。2)灵敏度高,可检测驼乳中0.030%~0.050%含量的牛乳和0.30%~0.50%含量的羊乳。3)重复性强,通过对50份加标样品和50份空白样品分别进行检测,发现其中加标样品检测结果100%显示阳性,空白样品检测结果100%显示阴性,该方法的灵敏度与特异性均为100%,假阳性率和假阴性率均为0%。4)与其他检测方法具有一致性,对混有0.050%牛乳和0.50%羊乳的驼乳样品应用荧光定量PCR的方法和试纸条检测方法均得到阳性结果。
本方法操作简便、快捷,无需特殊仪器,只需要将待检样品加到试纸条的指定区域,静置3 min便可通过显色条带判断待测样品是否为混乳制品,其间不需要其他任何特殊仪器,可为市场监管部门现场快速筛查驼乳提供技术参考。
参考文献
[1]李超颖, 张娟, 卿德刚, 等. 骆驼乳营养成分及生物活性研究进展[J]. 食品工业科技, 2014, 35(23): 387-396.
[2]揭良, 苏米亚. 小品种特色乳营养成分研究进展[J]. 乳业科学与技术, 2021, 44(6): 58-62.
[3] HE J, XIAO Y C, ORGOLDOL K, et al. Effects of geographic region on the composition of bactrian camel milk in Mongolia[J]. Animals, 2019, 9(11): 890-900.
[4]李磊, 王昆, 何静, 等. 驼、牛、羊乳中脂肪酸含量的比较分析[J]. 食品科学, 2019, 40(6): 223-227.
[5]刘琴, 何晓瑞, 陆东林, 等. 驼乳掺假牛乳检测技术研究进展[J]. 新疆畜牧业2022, 37(2): 24-26+30.
[6]蔡扩军, 徐 敏, 王梅, 等. 骆驼奶、驴奶中牛乳掺假检出限的测定[J]. 新疆畜牧业2020, 35(2): 18-20.
[7]包琴, 张茜, 成晓情, 等. 市售6种驼乳(制品)质量调查分析[J]. 安徽农业科学, 2021, 49(20): 192-194.
[8]杨艳歌, 李莉, 王丹丹, 等. 多重real-time PCR 技术快速鉴别特种乳中的乳源动物成分[J]. 食品科学, 2021, 42(16): 312-321.
[9]斯仁达来. 利用低场核磁共振技术快速检测掺假驼乳的研究[D]. 呼和浩特: 内蒙古农业大学, 2016.
[10]李玲玉, 王俊, 李敏婧, 等. 基于乳清蛋白的骆驼乳中掺假牛乳的检测及热处理对方法的影响[J]. 食品科学. 2022, 43(10): 329-335.
[11]吴丹丹, 其布勒, 斯仁达来, 等. 电子鼻对驼乳中牛乳掺假的快速检测[J]. 食品工业科技, 2021, 42(11): 263-267.
基金项目:浙江省重点研发计划项目(2021C02059);海关总署科研项目(2021HK227)
第一作者:付辉(1984—),男,汉族,江西南昌人,本科,工程师,主要从事产品检测方法的开发与应用工作,E-mail: fuhui@bioeasy.com
通信作者:于志强(1986—),男,汉族,辽宁新金人,博士,高级兽医师,主要从事产品检测方法的开发与应用工作,E-mail: yzqtd@163.com
1. 深圳市易瑞生物技术股份有限公司 深圳 518100
2. 宁波海关技术中心/宁波市口岸生物与食品安全检测重点实验室 宁波 315800
1. Bioeasy Technology Inc, Shenzhen 518100
2. Ningbo Customs Technology Center/Ningbo Key Laboratory of Port Biological and Food Safety Testing, Ningbo 315800

表1 荧光定量PCR反应体系
Table 1 Fluorescence quantitative PCR reaction system
试剂名称 | 用量 (μL) |
荧光PCR反应super Mix | 10.0 |
上游引物 | 0.5 |
下游引物 | 0.5 |
探针 | 0.5 |
ddH20 | 4.5 |
模板 | 4.0 |
表2 不同pH条件下各管颜色变化
Table 2 Color changes under different pH conditions
序号 | 胶体金 (mL) | 0.5M Tris (pH 9.0) (μL) | 1 mg/mL单抗 (μL) | 10% NaCl (μL) | 颜色 |
1 | 1 | 1 | 2 | 200 | 紫 |
2 | 1 | 2 | 2 | 200 | 红 |
3 | 1 | 3 | 2 | 200 | 红 |
4 | 1 | 4 | 2 | 200 | 红 |
5 | 1 | 6 | 2 | 200 | 红 |
6 | 1 | 8 | 2 | 200 | 红 |
表3 不同蛋白浓度条件下各管颜色变化
Table 3 Color changes under different protein concentration
序号 | 胶体金 (mL) | 0.5 mol/L Tris (pH 9.0) (μL) | 1 mg/mL单抗 (μL) | 10%NaCl (μL) | 颜色 |
1 | 1 | 2 | 1 | 200 | 红 |
2 | 1 | 2 | 2 | 200 | 红 |
3 | 1 | 2 | 3 | 200 | 红 |
4 | 1 | 2 | 4 | 200 | 红 |
5 | 1 | 2 | 5 | 200 | 红 |
6 | 1 | 2 | 6 | 200 | 红 |
7 | 1 | 2 | 8 | 200 | 红 |
8 | 1 | 2 | 10 | 200 | 红 |
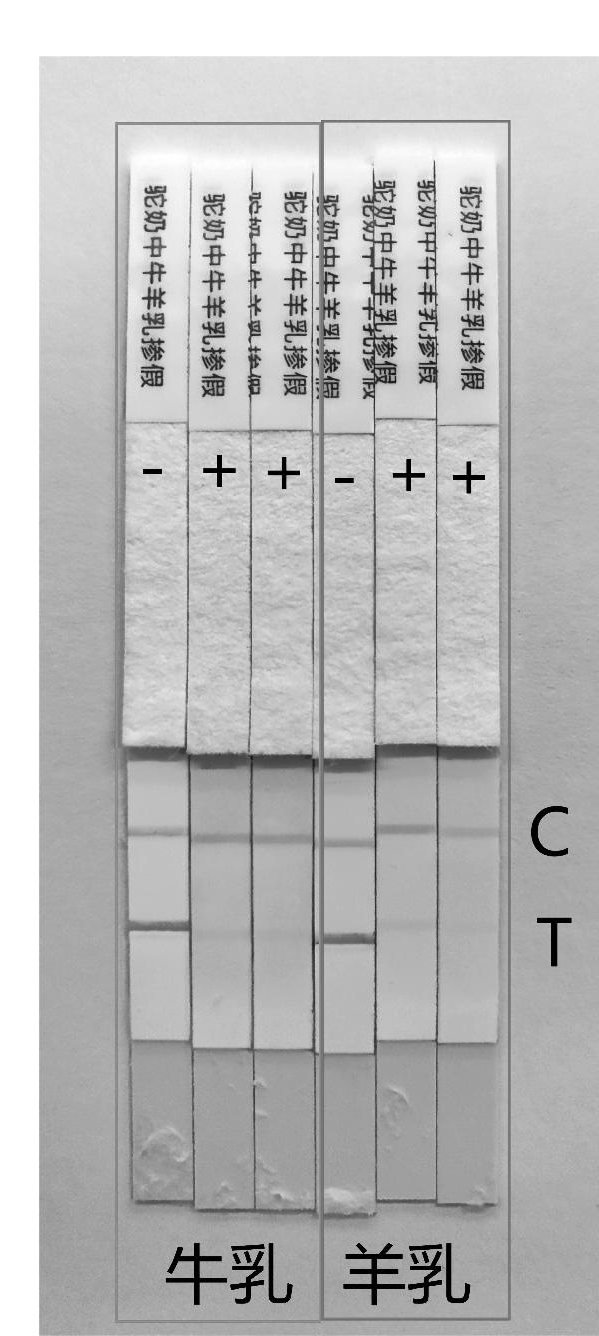
图2 T线包被乳品掺假不同浓度效果对比
Fig.2 Comparison of the effects of different concentrations of T-line-coated dairy adulteration
表5 羊奶添加检测限试验结果
Table 5 Results of the detection limit test for goat milk addition
样品 | (%) | (份) | (份) | (份) | (%) |
驼乳1 | 0.00 | 20 | 0 | 20 | 0 |
0.15 | 20 | 0 | 20 | 0 | |
0.30 | 20 | 14 | 6 | 70 | |
0.50 | 20 | 20 | 0 | 100 | |
驼乳2 | 0.00 | 20 | 0 | 20 | 0 |
0.15 | 20 | 0 | 20 | 0 | |
0.30 | 20 | 13 | 7 | 65 | |
0.50 | 20 | 20 | 0 | 100 | |
驼乳3 | 0.00 | 20 | 0 | 20 | 0 |
0.15 | 20 | 0 | 20 | 0 | |
0.30 | 20 | 16 | 4 | 80 | |
0.50 | 20 | 20 | 0 | 100 | |
驼乳4 | 0.00 | 20 | 0 | 20 | 0 |
0.15 | 20 | 0 | 20 | 0 | |
0.30 | 20 | 12 | 8 | 60 | |
0.50 | 20 | 20 | 0 | 100 |
表6 灵敏度、特异性、假阳性率与假阴性率结果
Table 6 The results of sensitivity, specificity, false positive rate and false negative rate
加标样品 | 样品 | 添加浓度 (%) | 检测结果 | 灵敏度 (%) | 特异性 (%) | 假阳性率 (%) | 假阴性率 (%) |
牛奶 | 驼乳1 | 0 | 0(+),50(-) | 100 | 100 | 0 | 0 |
0.5 | 50(+),0(-) | ||||||
驼乳2 | 0 | 0(+),50(-) | 100 | 100 | 0 | 0 | |
0.5 | 50(+),0(-) | ||||||
驼乳3 | 0 | 0(+),50(-) | 100 | 100 | 0 | 0 | |
0.5 | 50(+),0(-) | ||||||
驼乳4 | 0 | 0(+),50(-) | 100 | 100 | 0 | 0 | |
5 | 50(+),0(-) | ||||||
羊奶 | 驼乳1 | 0 | 0(+),50(-) | 100 | 100 | 0 | 0 |
0.5 | 50(+),0(-) | ||||||
驼乳2 | 0 | 0(+),50(-) | 100 | 100 | 0 | 0 | |
0.5 | 50(+),0(-) | ||||||
驼乳3 | 0 | 0(+),50(-) | 100 | 100 | 0 | 0 | |
0.5 | 50(+),0(-) | ||||||
驼乳4 | 0 | 0(+),50(-) | 100 | 100 | 0 | 0 | |
0.5 | 50(+),0(-) |
第一作者:王晶(1987—),女,汉族,山西太原人,硕士,工程师,主要从事食品与农产品检测工作,E-mail: 419788982@.com
通信作者:花锦(1986—),女,汉族,山西太原人,硕士,高级工程师,主要从事食品与农产品检测工作,E-mail: 13835149925@163.com
1. 太原海关技术中心 太原 030001
2. 太原学院 太原 030001
3. 山西省检验检测中心 太原 030012
1. Taiyuan Customs Technology Center, Taiyuan 030001
2. Taiyuan University, Taiyuan 030001
3. Shanxi Provincial Inspection and Testing Center, Taiyuan 030012








