CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
热厉螨多重实时荧光PCR种属鉴定方法研究
作者:高志强 汪琳 朱忠武 白子龙 赵相鹏 蒲静 张伟 刘环
高志强 汪琳 朱忠武 白子龙 赵相鹏 蒲静 张伟 刘环
Abstract As a bee brood parasite, Tropilaelaps can seriously affect bee larvae and pupae. Timely detection and preventive measures can prevent catastrophic damage to bee colonies. In this study, on the basis of sequence comparison analysis, four pairs of primers and five probes were designed for the COⅠ gene of T. clareae, T. mercedesae and T. koenigerum, as well as the 16S rRNA gene of Apoidea (internal control), respectively. A multiplex real-time PCR (mRT-PCR) assay was established to quickly identify the three types of Tropilaelaps by reaction system optimization, and the analytical performance of the method was evaluated. The results showed that the LOD of mRT-PCR for the pathogenic targets were 6.07 copies, 5.67 copies and 6.21 copies, respectively, and there was no cross-reaction with other bee pathogen nucleic acids. The established mRT-PCR was used to detect 201 bees or bee products with 1 positive for T. clareae and 1 positive for T. mercedesae. Sequencing and sequence alignment confirmed the specific sequences of the respective Tropilaelaps mites. In this study, the mRT-PCR including Apoidea internal reference target is specific and sensitive, and can monitor the whole process of sampling, nucleic acid extraction and amplification, providing a reliable method for rapid screening and species identification of Tropilaelaps spp.
Keywords internal reference target; Tropilaelaps spp.; multiplexreal-time PCR (mRT-PCR)
热厉螨又称小蜂螨,属于厉螨科,为蜜蜂的重要害螨,可对蜂产业造成巨大损害。热厉螨包括4个种:即亮热厉螨(Tropilaelaps clareae)、梅氏热厉螨(T. mercedesae)、柯氏热厉螨(T. koenigerum)和泰氏热厉螨(T. thaii)。其中亮热厉螨主要见于亚洲,是侵害本土大蜜蜂小舌亚种(Apis dorsata breviligula)、炳式大蜜蜂(A. dorsata binghami)和引进物种西方蜜蜂(A. mellifera)的重要寄生虫;梅氏热厉螨和柯氏热厉螨是亚洲大陆地区危害大蜜蜂指名亚种(A. dorsata dorsata)的重要寄生虫;梅氏热厉螨同时也是危害黑大蜜蜂(A. laboriosa)和西方蜜蜂的寄生虫[1-2]。热厉螨侵染蜂巢,造成蜜蜂生存环境恶化,破坏蜜蜂免疫力,从而造成幼蜂大量死亡,有时可高达50%[3]。热厉螨还可作为生物媒介传播一些蜜蜂病害,如羽翼畸形病毒(Deformed wing virus,DWV),有研究表明DWV可在梅氏热厉螨体内繁殖并进而传播到蜂群[4-6]。
及时发现和鉴别、尽早采取针对性防治措施对于小蜂螨防控非常重要。由于蜂房中常常存在多种形态相似的螨虫,采用形态学方法鉴定热厉螨非常困难[7],因此目前常常采用PCR方法进行鉴定确认。常用方法为对热厉螨线粒体部分COⅠ基因进行扩增。由于WOAH描述的引物COⅠ-TCF1和COⅠ-TCR2扩增片段约为580 bp,但这段引物并不特异,也可能扩增出其他寄生虫的COⅠ基因,因此,还需进一步测序才能确认[1]。研究结果表明,采用快速、高精度小蜂螨分子鉴别检测方法具有重要的实用价值。采用多重实时PCR(mRT-PCR)进行热厉螨种属鉴定,不仅灵敏度高、特异性强、快速,不易出现假阳性,而且可以实时进行结果判读。
但基于核酸扩增的检测,如果样品采集不理想,DNA提取不成功,或扩增体系中存在抑制物等都可致检测结果不准确,因此,体系中加入针对宿主保守基因的引物探针对检测过程进行质控,可提高结果的可信度。本研究分别针对亮热厉螨、梅氏热厉螨、柯氏热厉螨COⅠ基因,以及蜂16S rRNA基因(内对照)设计4对引物和5条探针,建立了针对热厉螨种属检测和鉴定的四重实时荧光PCR检测方法,对灵敏度、特异性等性能进行了评价,并用于蜂及蜂产品的检测。本方法可用于口岸进境蜂及蜂产品中热厉螨的快速检测。
1 材料和方法
1.1 被检核酸及样品
pBSK-LRLM(亮热厉螨COⅠ)、pBSK-MSRLM(梅氏热厉螨CO Ⅰ)以及pBSK-KSRLM(柯氏热厉螨CO Ⅰ)标准质粒,由上海生工合成。熊峰DNA、西方蜜蜂DNA、幼虫芽孢杆菌核酸、蜂房蜜蜂球菌核酸、蜂球囊菌核酸、瓦螨核酸、蜂房小甲虫核酸,蜂及蜂产品样品201份,以上阳性对照和样品均由本实验室收集保存。
1.2 主要试剂
HS Taq DNA聚合酶、dNTP及缓冲液等,为TaKaRa产品;样品基因组DNA提取试剂盒(DP316),为天根生化科技有限公司产品;引物、双标记核酸探针,由上海生工公司合成。
1.3 主要设备
Q5及Q7荧光PCR仪,为Thermo Fisher公司产品;毛细管电泳仪QIAxcel及配套筛查卡夹试剂盒, 为QIAGEN公司产品。
1.4 前处理及核酸提取
蜂及蜂产品均使用0.01 mol/L pH 为7.2 PBS充分研磨成20%的悬液,使用商品化微量基因组提取试剂盒提取DNA,洗脱于60 μL无核酸酶水中,-20°C保存备用。
1.5 引物和探针的设计合成
对于蜂内参靶标,选取西方蜜蜂(Apis mellifera)、黑小蜜蜂(Apis andreniformis)、小蜜蜂(Apis florea)、苏威拉西蜂(Apis nigrocincta)、绿努蜂(Apis nuluensis)、东方蜜蜂(Apis cerana)、沙巴蜂(Apis koschevnikovi)以及小峰熊蜂(Bombus hypocrita)16S rRNA基因进行序列比对,选取保守位置设计引物探针(图1);对于热厉螨,根据其线粒体COⅠ序列,通过比对,分别针对亮热厉螨、梅氏热厉螨以及柯氏热厉螨进行引物探针设计(图2)。引物、探针名称、序列及扩增长度见表1。
1.6 荧光PCR反应体系和条件优化
按照Green M R , Sambrook J所述方法[8]对多重反应体系的引物、探针以及镁离子浓度进行优化,并通过比较不同反应条件下的扩增效果,筛选最优反应条件。
1.7 标准曲线建立
将已知质量浓度的pBSK-LRLM、pBSK-MSRLM以及pBSK-KSRLM质粒从40 pg/μL起始,作10倍倍比稀释,熊蜂总DNA则以4 pg/μL起始,作10倍倍比稀释。然后使用建立的荧光PCR方法进行检测,选其中5个浓度的模板,以Ct值为纵轴,以上样pg数为横轴,通过Q 7自带分析软件做出标准曲线,得出回归系数(R2)和PCR扩增效率。
1.8 灵敏度试验
为确定方法的最低检测限(LOD),对0.5~16 copies的pBSK-LRLM、pBSK-MSRLM以及pBSK-KSRLM质粒进行每个梯度8管的重复检测,统计不同梯度检测阳性率,并采用Statgraphics 19进行概率回归确定在95%概率下的检测下限。
1.9 特异性试验
应用优化的多重PCR方法,分别对幼虫芽孢杆菌核酸、蜂房蜜蜂球菌核酸、蜂球囊菌核酸、瓦螨核酸、蜂房小甲虫以及熊蜂DNA和西方蜜蜂DNA核酸进行检测,并对产物进行毛细管电泳,检测产物条带。
1.10 样品检测
应用建立的多重荧光PCR方法对实验室保存的201份蜂及蜂产品进行检测,检出阳性结果再对扩增产物进行测序确认。
2 结果
2.1 多重荧光PCR体系建立
经优化确立反应体系:每个反应体系均包含1×PCR Buffer, 5.0 mmol/L MgCl2,0.15% BSA,400 nmol/L dNTP, 0.5 μmol/L的Tcla-F/Tcla-R引物,0.1 μmol/L的Tcla-P1和Tcla-P2探针;0.5 μmol/L的Tmer-F/Tmer-R引物,0.15 μmol/L的Tmer-P探针;0.5 μmol/L的Tkoe-F/Tkoe-R引物,0.1 μmol/L的Tkoe-P探针;0.3 μmol/L的Ap-F/Ap-R引物,0.1 μmol/L的Ap-P探针;反应总体系为25 μL,模板DNA用量为5 μL。反应参数为95°C /3 min;94°C/15 s,51°C/10 s,60°C/30 s,45个循环,在每个循环60°C时,进行荧光信号收集。
2.2 标准曲线建立及PCR效率测定结果
以倍比稀释的已知质量浓度质粒pBSK-LRLM、pBSK-MSRLM、pBSK-KSRLM以及熊蜂DNA作为模板,进行多重荧光PCR检测,得出扩增曲线和标准曲线。其中质粒在0.02~200 pg范围内,熊蜂总DNA在0.002~20 pg范围内,Ct值与上样pg数呈现线性关系。多重扩增曲线见图3,标准曲线见图4。对于pBSK-LRLM,回归斜率为-3.036,扩增效率为113.52%;对于pBSK-MSRLM,回归斜率为-3.079,扩增效率为111.23%;对于pBSK-KSRLM,回归斜率为-3.058,扩增效率为112.33%,三者R2均为0.999;对于熊蜂DNA,回归斜率为-2.941,R2 = 0.997,扩增效率为118.78%。
2.3 LOD测定结果
对0.5~16 copies的pBSK-LRLM、pBSK- MSRLM以及pBSK-KSRLM质粒进行每个梯度8管的重复检测,不同copies核酸的阳性率见图5。经概率回归、95%概率下,3种靶标的最低检测限分别为6.07 copies、5.67 copies和6.21 copies。
2.4 特异性试验结果
对蜜蜂常见病原核酸以及熊蜂DNA和西方蜜蜂DNA进行检测。结果显示,建立的检测方法与上述病原核酸无交叉反应,阴阳性对照成立,熊蜂DNA和西方蜜蜂DNA内参基因均有阳性扩增,与预期一致,见图6;毛细管电泳结果显示其他病原核酸均无目的条带出现,阳性对照4个条带在134~137 bp之间,电泳不能区分;熊蜂和西方蜜蜂DNA均存在约134 bp大小条带,见图7。
2.5 保存样品检测结果
对实验室保存的201份蜂及蜂产品进行检测,从某蜂场采集的蜜蜂样品中检出1份亮热厉螨核酸阳性,1份梅氏热厉螨核酸阳性(见图8),进一步对阳性产物使用表1相应引物进行两头测序,序列分析显示荧光PCR判定结果一致(见图9)。
3 讨论
目前热厉螨的形态学鉴定方法仅适用于成虫鉴定,且蜂房中可能存在的其他螨虫,形态非常相似,因此形态学鉴定方法相对困难且容易造成误判[7]。采用分子生物学鉴定方法可对疑似感染进行准确鉴定。热厉螨属于节肢动物,目前分子鉴定方法包括DNA条形码、PCR-RFLP、RAPD 等方法[9-10]。目前最常用的方法是DNA条形码鉴定方法,即对线粒体的COⅠ基因进行测序和序列比对分析。但目前用于热厉螨DNA条形码鉴定的PCR引物并不是热厉螨特异引物,为COⅠ通用引物,扩增产物须测序才能确认,而且COⅠ基因存在于各种生物体内,因此扩增也很容易被其他生物DNA竞争抑制,不利于热厉螨的准确快速鉴定。
本研究针对3种热厉螨COⅠ基因以及蜜蜂总科16S rRNA基因,建立了含内参基因的可快速对3种热厉螨进行种属鉴定的多重荧光PCR方法,对方法的最低检测限和特异性进行了测定和评估,通过软件进行概率分析得出了该方法中3个病原靶标的最低检测限,表明建立的多重荧光PCR方法检测下限低、特异性强,与其他常见蜂病病原核酸无交叉反应。在实际样品检测中,检出1份亮热厉螨核酸阳性和1份梅氏热厉螨阳性,并通过对PCR产物进行测序进行了确认。基于位点特异性的PCR鉴别检测试验可能被标本中的一些离子及生物活性物质所抑制,特别是蜂产品中存在多种活性物质,很可能在反应扩增中产生抑制作用,出现假阴性,而检测试剂的阴、阳性对照中核酸纯度相对较高,一般不会发生抑制。因此在对蜂产品进行核酸检测时,含针对宿主内参基因进行同步检测的反应体系可有效对标本采集、前处理、核酸提取以及PCR扩增等过程进行监控。常见的内参基因往往会选择真核生物通用的18S和β-actin等保守基因。本研究为提高内参检测特异性,针对蜜蜂总科16S rRNA特异基因进行了内参设计,理论上可作为各种蜜蜂科物种及其产品的检测内参,但本研究仅对蜜蜂属和熊蜂属的西方蜜蜂和熊蜂进行了验证。
4 结论
本研究基于序列分析,分别针对亮热厉螨、梅氏热厉螨、柯氏热厉螨线粒体COⅠ基因以及蜜蜂总科16S rRNA特异基因设计引物探针,经体系优化建立了含内参的快速对亮热厉螨、梅氏热厉螨、柯氏热厉螨进行种属鉴定的四重荧光PCR检测方法。经概率回归分析显示,方法的最低检测限分别为6.07 copies、5.67 copies和6.21 copies,特异性试验显示不与其他常见蜂病病原发生交叉反应。应用本方法从201份蜂及蜂产品中检出亮热厉螨核酸阳性1份,梅氏热厉螨核酸阳性1份,并通过PCR产物测序进行了确认。本研究建立的含蜂内参靶标的多重实时荧光PCR方法特异、灵敏,并可对采样、核酸提取及扩增进行全程质控,为热厉螨的快速筛查和种属鉴定提供了可靠方法。
参考文献
[1] World Organisation for Animal Health. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals[S]. Paris: WOAH, 2018: 765-776.
[2]赵红霞, 罗岳雄, 梁勤,等. 小蜂螨的研究现状[J]. 环境昆虫学报, 2016, 38(4): 852-856.
[3] Khongphinitbunjong K, Guzman L I D, Tarver M R, et al. Interactions of Tropilaelaps mercedesae, honey bee viruses and immune response in Apis mellifera[J]. Journal of Apicultural Research, 2015, 54(1): 1-8.
[4]马世龙, 杨扬, 刁青云, 等. 梅氏热厉螨寄生对西方蜜蜂生存率和取食量的影响[J]. 应用昆虫学报, 2018, 55(6): 1066-1073.
[5] Dainat B, Ken T, Berthoud H, et al. The ectoparasitic mite Tropilaelaps mercedesae (Acari, Laelapidae) as a vector of honeybee viruses[J]. Insectes Sociaux, 2009, 56(1): 40-43.
[6] Forsgren E, Miranda J R D, Isaksson M, et al. Deformed wing virus associated with Tropilaelaps mercedesae infesting European honey bees (Apis mellifera) [J]. Experimental & Applied Acarology, 2009, 47(2): 87-97.
[7] Morgan A M J. Genetic and morphological variation of bee-parasitic Tropilaelaps mites (Acari: Laelapidae): new and redefined species[J]. Experimental & Applied Acarology, 2007, 43: 1-24.
[8] Green M R, Sambrook J.Optimizing Primer and Probe Concentrations for Use in Real-Time Polymerase Chain Reaction (PCR) Assays[J]. Cold Spring Harbor Protocols, 2018(10): 825-835.
[9] Tangjingjai W, Verakalasa P, Sittipraneed S, et al. Genetic differences between Tropilaelaps clareae and Tropilaelaps koenigerum in Thailand based on ITS and RAPD analyses[J]. Apidologie, 2003, 34(6): 513-524.
[10] Guzman L I D, Simone-Finstrom M, Cervancia C, et al. Tropilaelaps species identification and viral load evaluation of Tropilaelaps and Varroa mites and their Apis mellifera hosts in Palawan, Philippines[J]. Journal of Invertebrate Pathology, 2020, 170: 1-3.
图1 蜂内参引物探针设计区域的序列比对
Fig.1 Sequence alignment of the primer and probe design region for Apoidea internal reference
图2 热厉螨引物探针设计区域的序列比对
Fig.2 Sequence alignment of the primer and probe design region for Tropilaelaps spp.
表1 多重荧光PCR检测的引物和探针
Table 1 Primers and probes for multiplex real-time PCR
物种名称 | 基因名称 | 引物名称和序列 (5'- 3' ) | 扩增长度 (bp) |
亮热厉螨 | COⅠ | Tcla-F: CAACWATYTTAAAYATACGACCA | 137 |
Tcla-R: AGTTAATAGTATAGTAATAGCTGCA | |||
Tcla-P1: [FAM]-ACAGCAATTCTACTYTTACTCAGAT-[BHQ1] | |||
Tcla-P2: [FAM]-ACAGCAATCCTACTTTTACTTAGA-[BHQ1] | |||
梅氏热厉螨 | COⅠ | Tmer-F: CAACWATYTTAAAYATACGACCA | |
Tmer-R: TTAGAAGTATGGTAATAGCTG | 135 | ||
Tmer-P: [VIC]-TAATCCCTTTATTTGTATGATCTGT-[BHQ1] | |||
柯氏热厉螨 | COⅠ | Tkoe-F: TACAACAATTCTTAACATACGACCA | |
Tkoe-R: TGAGGAGTATGGTGATTGCTG | 137 | ||
Tkoe-P: [CY5]-ATTGCTGTAATTAAAACAGAT-[MGB] | |||
蜂 | 16S rRNA | Ap-F: GTAAGATTTTAAAAGTCGAACAGACTTA | 134 |
Ap-R: CCTTAGGGATAACAGCGTAATATC | |||
Ap-P: [ROX]-CTTAATTCAACATCGAGGTCGCAA-[MGB] |

图3 亮热厉螨、梅氏热厉螨、柯氏热厉螨以及蜂DNA多重扩增曲线
Fig.3 Multiplex amplification curves of T. clareae, T. mercedesae, T. koenigerum and Apoidea DNA
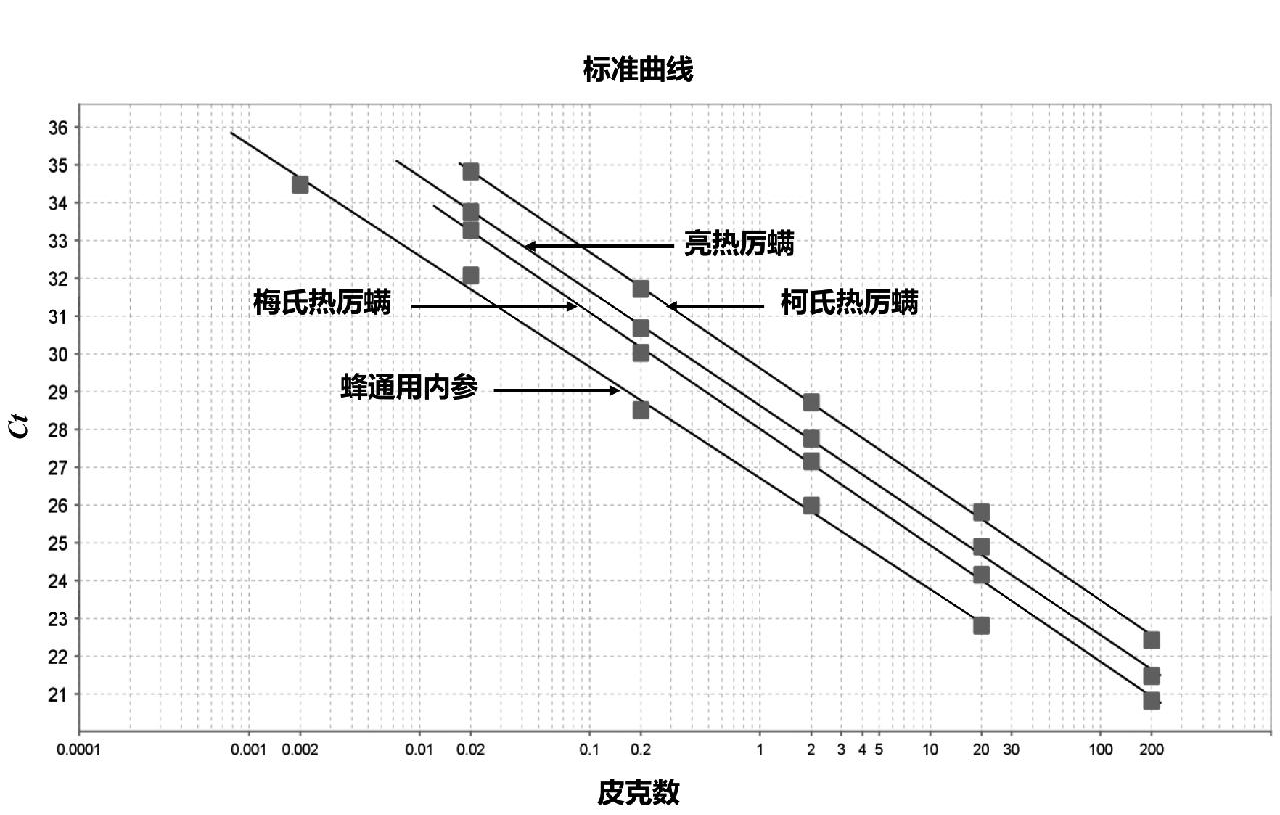
图4 亮热厉螨、梅氏热厉螨、柯氏热厉螨以及蜂DNA多重标准回归曲线
Fig.4 Multiplex standard regression curves of T. clareae, T. mercedesae, T. koenigerum and Apoidea DNA
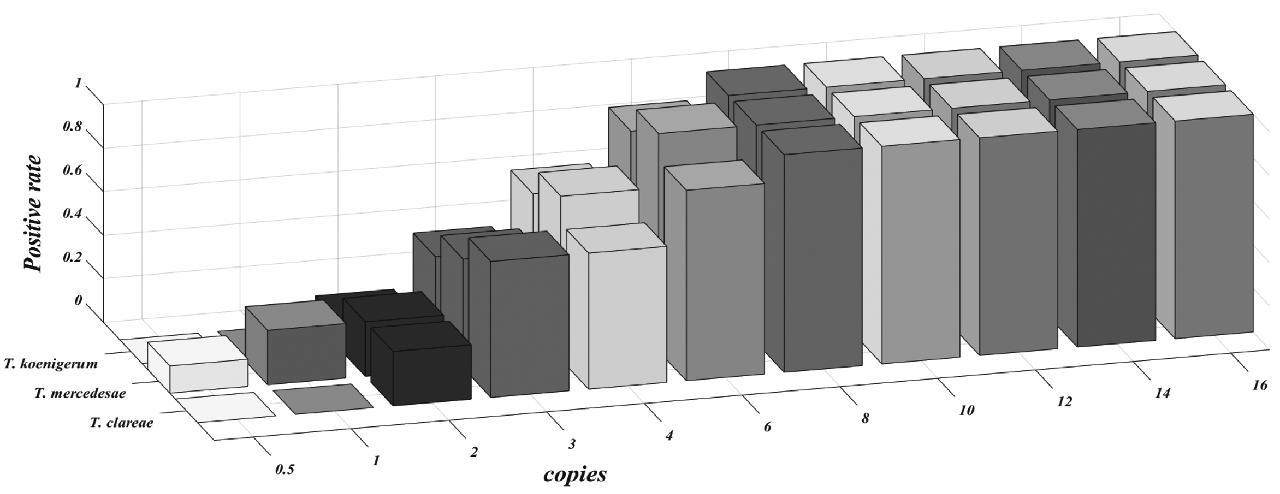
图5 多重荧光PCR 最低检测限结果
Fig.5 Limit of detection (LOD) of multiplex real-time PCR
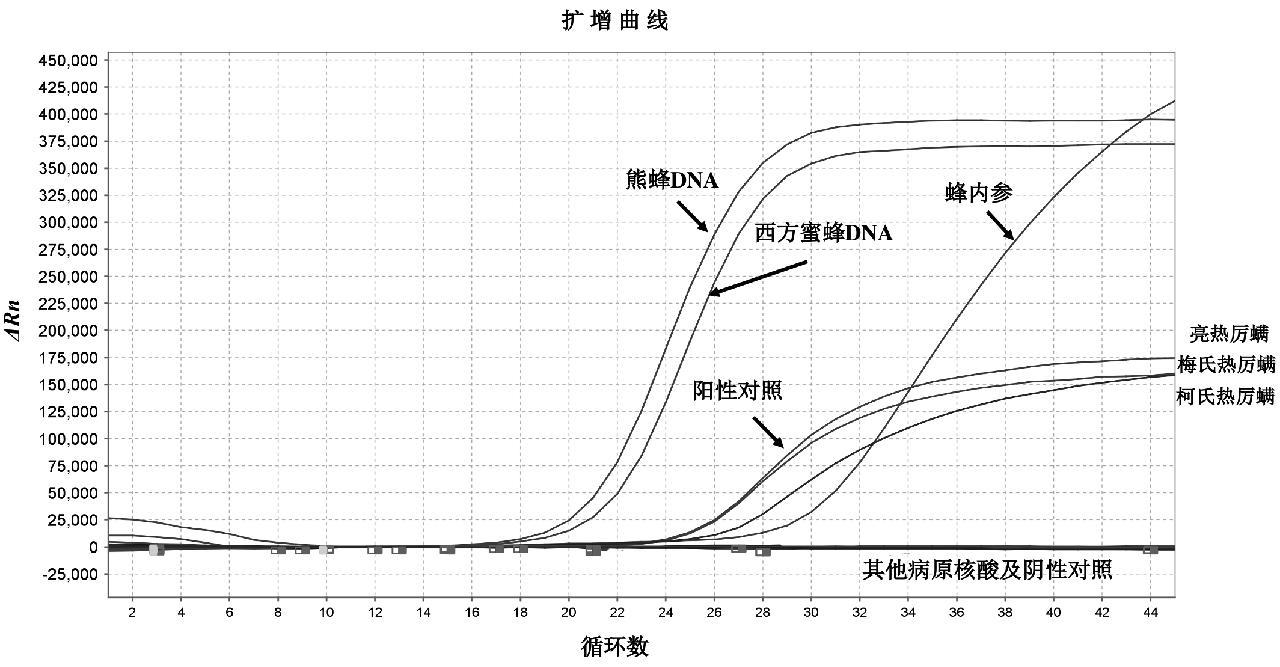
图6 特异性试验结果
Fig.6 Results of specificity tests

A1: DNA分子量标准; A2: 阳性对照; A3: 阴性对照; A4: 幼虫芽孢杆菌; A5: 蜂房蜜蜂球菌; A6:蜂球囊菌; A7: 瓦螨; A8: 蜂房小甲虫; A9: 熊蜂; A10: 西方蜜蜂
图7 特异性试验的多重荧光PCR产物电泳结果
Fig.7 Electrophoresis results of multiplex real-time PCR products from specificity tests
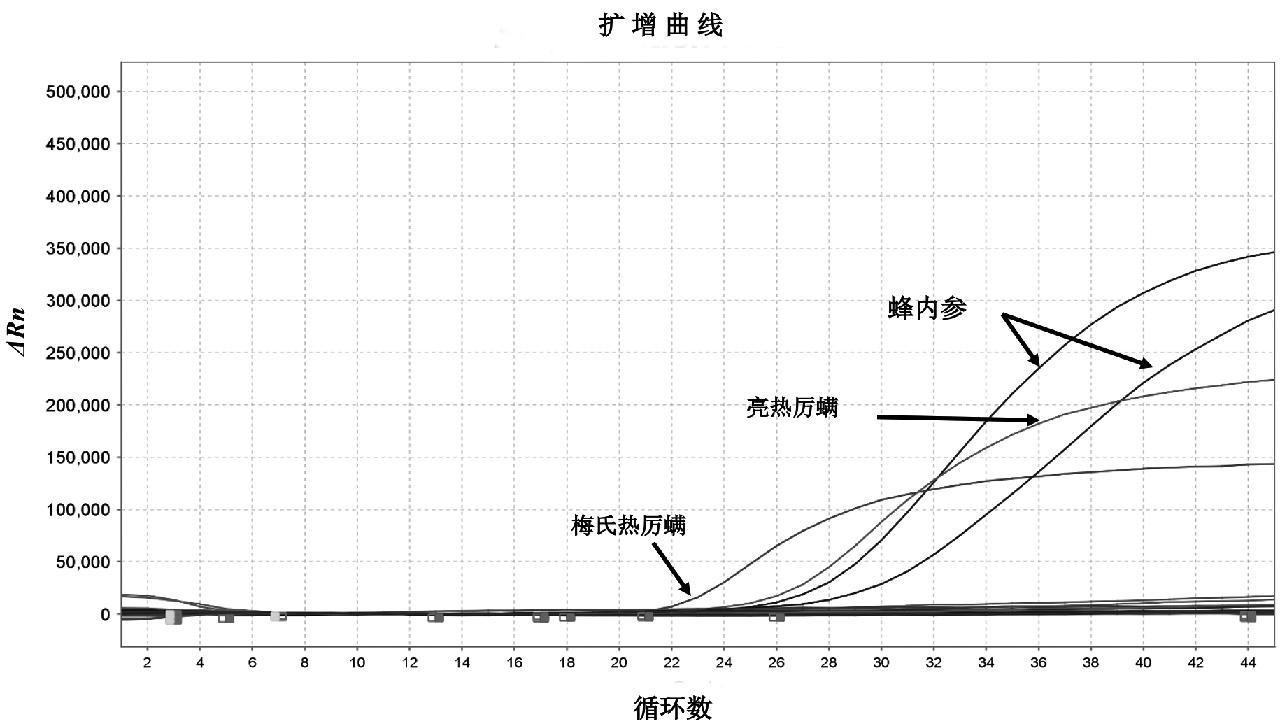
图8 阳性样品的多重荧光PCR检测结果
Fig.8 Detection results of delivered positive samples by multiplex real-time PCR
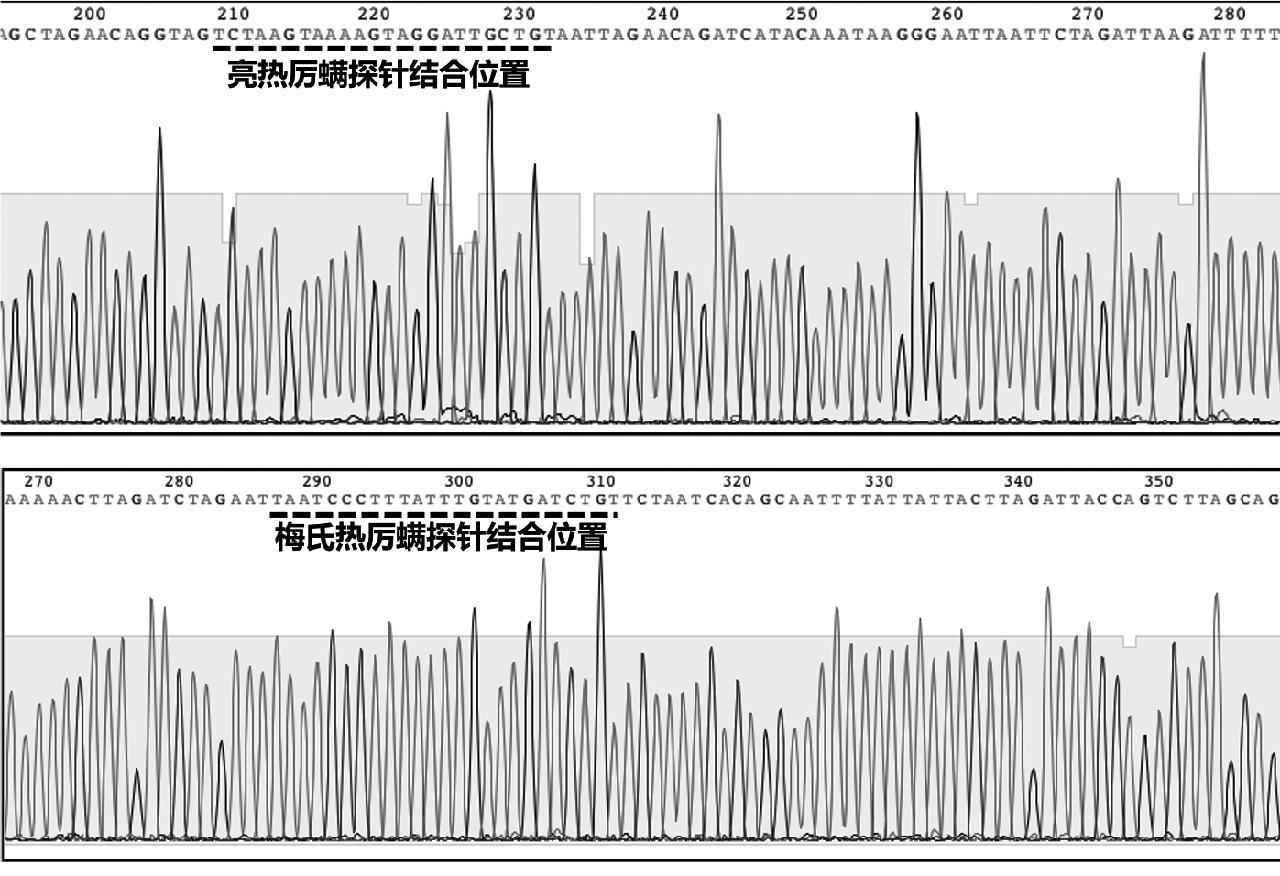
图9 阳性样品产物的测序结果
Fig.9 Sequencing results of PCR products of positive samples







