CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶实时荧光RPA快速检测方法研究
作者:郑剑 周旋 苏丽娜 王柘珉 邹彩娟 曾宪东
郑剑 周旋 苏丽娜 王柘珉 邹彩娟 曾宪东
Abstract Ictalurus punctatus, Cynoglossus semilaevis and Pangasianodon hypophthalmuson are very similar in meat quality and product morphology, making them difficult to distinguish from each other. This leads to market name confusion and frequent mismatches between labels and actual products in import and export goods. In this experiment, based on the conserved gene sequences of the three fishes, three pairs of specific recombinase polymerase amplification (RPA) primers and probes were designed and screened. A rapid detection method for the species composition of Ictalurus punctatus, Cynoglossus semilaevis and Pangasianodon hypophthalmuson based on real-time fluorescent RPA technology was established and analyzed for specificity and sensitivity. The results show that the established real-time fluorescent RPA detection method has good specificity and sensitivity, and it’s simple and fast, with the entire amplification time taking only 20 minutes. This provides a quick and accurate detection basis for identifying the species composition of related products.
Keywords Ictalurus punctatus; Cynoglossus semilaevis; Pangasianodon hypophthalmus; real-time fluorescent RPA; species identification
我国是水产养殖、贸易和消费大国,随着社会经济的发展和人们生活水平的不断提高,半滑舌鳎(俗称龙利鱼)、低眼无齿巨鲶(俗称巴沙鱼)和斑点叉尾鮰等水产品在饮食中所占的比例逐年增加,进出口贸易量也不断攀升。因半滑舌鳎、低眼无齿巨鲶和斑点叉尾鮰的加工产品均主要为鱼片,其在外观形态特征和食用肉质口感上都极其相似,难以辨认[1]。而市面真正的龙利鱼产品比较少,以巴沙鱼冒充龙利鱼和斑点叉尾鮰牟取暴利的现象屡见不鲜[2-6],且我国出口美国斑点叉尾鮰在实施批批扣检的基础上,要求对产品实施DNA检测[7]。因此,为避免商业欺诈、逃避关税等现象扰乱我国水产品出口秩序,应对国外技术性贸易措施,实现货物快速通关,需建立半滑舌鳎、低眼无齿巨鲶和斑点叉尾鮰物种鉴定的快速核酸检测方法。
核酸扩增是大多数基于核酸检测策略中的一个必要步骤。传统的核酸检测放大技术,如普通PCR、实时荧光PCR和数字PCR,均依赖于复杂的仪器,如温度调节设备、信号的检测或复杂的微反应体系生成设备,比较适用于专业的检测实验室,但对一些基层实验室的应用和非实验室环境条件下的现场检测来说存在很大困难。近年来,为适应现场快速检测和实验室大规模筛查检测的需求,克服传统PCR检测技术的缺点,越来越多的恒等温扩增技术被开发出来。重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)就是恒等温扩增技术中的一大亮点,因其具有反应快速、高敏感性、高特异性、低设备依赖性等传统体外核酸扩增技术所不具备的优点,结合侧流层析试纸技术或荧光检测装置,可以在简易实验设备甚至现场条件下实现对核酸的快速扩增和定性检测[8],当前RPA检测技术已广泛应用于食品安全、医学诊断和农业生产等领域。本研究利用RPA检测技术可快速区分半滑舌鳎、低眼无齿巨鲶和斑点叉尾鮰3种易混淆鱼制品,为相关水产品的源性成分鉴别提供了科学依据,也为食品卫生检测以及进出口检验领域提供了新思路。
1 材料与方法
1.1 材料与试剂
实验检测所用的长丝巨鲇、鲤鱼、鳕鱼、革胡子鲶、草鱼、南方大口鲶、鲷鱼、黄颡鱼、鳗鱼、短吻红舌鳎、小黄鱼、斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶均从农贸市场、超市和网络平台购买。磁珠法通用型基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;TwistAmp exo Kit购自TwistDX公司;引物和探针的合成以及测序均委托天一华煜基因科技有限公司完成。
1.2 仪器与设备
qubit4.0核酸/蛋白荧光定量仪(美国赛默飞世尔公司);QuantStudio 5实时荧光定量PCR系统(美国赛默飞世尔公司);5430 R高速冷冻离心机(德国艾本德公司)。
1.3 实验方法
1.3.1 质粒标准品的构建及拷贝数的计算
根据NCBI核酸数据库中公布的斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的基因序列,序列号分别为NC_030440.1、NC_012825.1、MH374076.1,筛选保守序列,设计引物,进行PCR扩增,将扩增获得的基因序列克隆至pUC57载体,构建标准重组质粒pUC57-C2PI。提取质粒后用核酸/蛋白荧光定量仪进行浓度测量,根据公式计算重组质粒拷贝数:

1.3.2 DNA提取
样品DNA提取方法参照磁珠法通用型基因组DNA提取试剂盒的操作说明进行操作,提取的核酸用qubit4.0荧光定量仪检测DNA浓度和纯度。提取的DNA溶液置于-20℃保存备用。
1.3.3 引物和探针设计
根据NCBI核酸数据库中已公布的斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的基因序列,使用NCBI Blast进行序列比对,筛选出物种的保守基因序列,根据英国TwistDx公司网站公布的RPA引物和探针的设计原则,利用Oligo 6.0设计实时荧光RPA特异性的引物和探针,引物和探针序列以及预期扩增片段大小见表1。
1.3.4 实时荧光RPA体系的建立
反应体系为50 μL,包括Buffer 29.5 μL,上下游引物(10 μmol/L)各为 2.1 μL,探针(10 μmol/L)0.6 μL,dd H2O11.2 μL。根据体积大小依次添加以上试剂,充分摇匀后,分别添加模板DNA 2.0 μL,最后加入MgOAc(280 mmol/L)2.5 μL,充分混匀后瞬时离心,立即将反应管放置于实时荧光PCR仪。反应条件为39℃,40 s;39℃,30 s,收集荧光,40个循环。
1.3.5 实时荧光RPA引物筛选
设计1条探针,并在探针上下游位置分别设计5对引物,以构建的质粒标准品DNA为模板,对不同的引物进行实时荧光RPA扩增,筛选出有明显特征的扩增曲线,且荧光信号出现早、荧光值高的引物作为最佳扩增引物。
1.3.6 实时荧光RPA特异性验证
分别以长丝巨鲇、鲤鱼、鳕鱼、革胡子鲶、草鱼、南方大口鲶、鲷鱼、黄颡鱼、鳗鱼、短吻红舌鳎、小黄鱼、斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的DNA为模板,按实时荧光RPA反应条件进行扩增反应,从而验证RPA引物和探针对斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的特异性。
1.3.7 实时荧光RPA灵敏性验证
将定量计算后的质粒pUC57-C2PI进行10倍梯度稀释,取其中7个梯度稀释液(拷贝数在2.7×107~2.7×101 copies/μL之间)为模板,以双蒸无菌水为空白对照,用实时荧光RPA体系进行扩增,分析特异性检测方法的灵敏度。
1.3.8 实时荧光RPA检测方法的应用
用建立的实时荧光RPA和实时荧光PCR检测方法[9]同时对实验室收集的34份水产样品进行检测,通过比较两种方法的检测结果,从而验证实时荧光RPA检测方法的准确性和稳定性。
2 结果与讨论
2.1 质粒标准品的构建与拷贝数计算
对构建的标准质粒pUC57-C2PI进行酶切和测序,结果表明,构建的重组序列大小正确,序列和GenBank中NC_030440.1、NC_012825.1、MH374076.1的部分序列的相似性为100 %。质粒浓度测定为36.5 ng/μL,根据公式计算所提取的质粒的拷贝数为2.7×109 copies/μL。
2.2 实时荧光RPA引物筛选
将不同的引物对和探针组合进行实时荧光RPA扩增,筛选最佳的引物和探针组合。结果如图1所示,设计的斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的每对引物和探针组合均有明显的扩增,所有扩增均在3 min左右起峰,相差不大,但扩增效率和荧光信号会有明显的区别。根据扩增效率最高,Ct值最小,荧光信号最强的原则,选择最佳扩增引物。
2.3 特异性分析
选择最优引物和探针组合,利用建立的实时荧光RPA检测方法对斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶进行特异性验证。由图2可知,3个扩增反应中仅对应的斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶有扩增曲线,其他物种的扩增反应均未出现荧光信号,表明建立的实时荧光RPA检测方法对斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶具有很好的特异性,与其他水产品均无交叉反应。
2.4 实时荧光RPA灵敏性分析
按优化后的实时荧光RPA方法分别进行斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶扩增反应的灵敏性分析。结果显示,当模板浓度为2.7×101 copies/μL时,实验均没有明显的荧光信号出现,表明体系没有出现明显的扩增反应,模板浓度低于方法的最低检测限,判定为不能检出;当模板浓度大于或等于2.7×102 copies/μL时,实验均出现明显扩增曲线,最快2 min左右出现明显的荧光信号,判定为可以检出(图3),实时荧光RPA最低检测限为2.7×102 copies/μL。根据实验数据可知,当模板超过一定浓度后,实时荧光RPA扩增信号出现时间并无明显区别,当接近检测限时,随着模板拷贝数降低,荧光信号出现时间会逐渐延后,表明所建立的实时荧光RPA检测方法扩增效率较高,方法灵敏性较好。
2.5 实时荧光RPA检测方法的应用
对实验室收集的34份水产样品进行两种检测方法的检测,通过和实时荧光PCR检测结果进行比较,从而检验实时荧光RPA检测方法的准确性。结果如图4所示,34份测试样品中,实时荧光RPA和实时荧光PCR的检测结果完全一致,均检出7份阳性,其中检出低眼无齿巨鲶成分阳性2份,检出半滑舌鳎成分阳性2份,检出斑点叉尾鮰成分阳性3份,表明建立的实时荧光RPA检测方法准确可靠,并具有检测时间短,设备简单的优势。
3 结语
水产品加工方式多样,在成品和半成品中,由于形态、细胞结构和蛋白质的破坏,传统的形态学鉴定方法难以适用,便给不法商人创造了可乘之机,在商品进出口时存在伪报与瞒报等行为。这种违法行为不仅逃避税收,损害国家利益,而且破坏了水产品贸易的公平性,也损害了消费者的合法权益,甚至带来食品安全问题。根据文献资料,目前还没有斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶及其加工品的快速且特异性的分子生物学检测方法。因此,针对以上几种易混淆水产品建立快速、准确的鉴定方法,对于严格执行关税政策和严厉打击走私、保护国家和消费者利益、促进贸易发展至关重要,对于维护水产品产业的健康发展也具有重要的意义。
水产品的物种鉴定,已从传统的形态学鉴定方法发展到目前广泛应用的分子生物学方法。分子生物学方法主要包括蛋白质检测方法和核酸检测方法,蛋白质的理化性质及空间结构常因产品加工被破坏,导致分析结果的可靠性降低;而DNA检测方法由于具有特异性好、灵敏度高、不依赖产品形态以及稳定性好等优势,已广泛应用于鱼类的物种鉴定[10],其中DNA条形码技术因结果准确和鉴定流程标准化而被应用最多[11-12],美国FDA也已开发了条形码标准操作方法对本国内加工和进口海产品进行物种鉴定[13],但DNA条形码需结合测序和序列分析,存在耗时长和条形码无法区分近似物种的可能,甚至在样品成分复杂时,无法使用条形码方法进行测序。在斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的特异性分子生物学检测方法中,目前仅有关于斑点叉尾鮰的物种特异性PCR检测方法的相关报道[14],但该方法在PCR扩增后需进行酶切才能和革胡子鲶区分,存在操作复杂、耗时耗力的问题。RPA最初由Piepenburg开发,是一种敏感的、基于等温的核酸检测技术[15],其利用引物和重组蛋白产生DNA扩增子,既可以通过凝胶电泳或侧向免疫层析试纸条实现可视化,也可以通过荧光探针进行实时监控,因其便携、快速、高灵敏度和高特异性等特点,已广泛应用于分子生物学检测领域[16-17]。
本研究基于斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶基因组特异保守序列设计了特异性的RPA引物和探针,经过引物筛选,最终建立了斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶实时荧光RPA检测方法。实验证实,此方法具有良好的特异性和灵敏性,可在20 min完成扩增反应,对于强阳性样品,5~10 min即可作出定性判断,且无需复杂设备,可在39℃恒温条件下完成反应,非常适合实验室大规模筛查检测和现场快速检测。本方法的建立将为斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的真伪鉴别提供科学快速的鉴定依据,也将为技术执法和快速通关提供更全面的保障。
参考文献
[1]吴湘生. 2007年中国输美水产品贸易争端评述[J]. 内陆水产, 2007(10): 18-20+44.
[2]石蕊寒, 南汇珠, 丁红田, 等. DNA条形码技术鉴别市售鱼肉制品真伪[J]. 肉类研究, 2018, 32(2): 54-59.
[3] WONG E, HANNER R. DNA barcoding detects market substitution in North American seafood[J]. Food Research International, 2008, 41(8): 828-837.
[4]邱德义, 胡佳, 刘德星, 等. DNA条形码技术在肉品防欺诈鉴别中的应用[J]. 肉类研究, 2013, 27(4): 40-43.
[5]王敏, 刘荭, 黄海, 等. DNA条形码技术在深圳鱼肉制品鉴定中的应用[J]. 食品科学, 2015, 36(20): 247-251.
[6]李新光, 王璐, 赵峰, 等. DNA条形码技术在鱼肉及其制品鉴别中的应用[J]. 食品科学, 2013, 34(18): 337-342.
[7]肖友红. 中国鮰鱼产业如何应对美国新政[J]. 中国水产, 2010(7): 27-28+56.
[8]兰海鸥, 柯义强, 马咸莹, 等. 重组酶聚合酶等温扩增技术在食品安全检测领域的应用[J]. 食品与发酵工业, 2019, 45(14): 233-238.
[9]郑剑, 周旋. 斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶三重荧光PCR检测方法[J]. 中国食品, 2021(21): 134-135.
[10]王嘉鹤, 陈双雅, 陈伟玲,等. DNA检测方法在鱼类物种鉴定中的应用[J].海南大学学报(自然科学版), 2012, 30(3): 293-298.
[11] HUBERT N, HANNER R, HOLM E, et al. Identifying Canadian freshwater fishes through DNA barcodes[J]. PLoS One, 2008, 3(6): e2490.
[12] WARD R D, HOLMES B H, WHITE W T, et al. DNA barcoding Australasian chondrichthyans: Results and potential uses in conservation[J]. Mar FreshwaterRes, 2008, 59: 57-71.
[13] Handy S M, Deeds J R, Ivanova N V, et al. A single-laboratory validated method for the generation of DNA barcodes for the identification of fish for regulatory compliance[J]. Journal of Aoac International. 2011, 94(1): 201-10.
[14]罗志萍, 肖武汉, 黄迎波, 等. 线粒体DNA分子技术在斑点叉尾鮰物种鉴定中的应用[J]. 安徽农业科学, 2015(11): 20-23.
[15] Piepenburg O, Williams C, Stemple D, et al. DNA detection using recombination proteins[J]. PLoS Biol, 2006, 4(7): e204.
[16] James A, Macdonald J. Recombinase polymerase amplification: Emergence as a critical molecular technology for rapid, low-resource diagnostics[J]. Expert Rev Mol Diagn. 2015, 15(11): 1475-89.
[17]任君安, 满燕, 李安, 等. 重组酶聚合酶扩增技术及其在食品检测中的应用[J]. 食品安全质量检测学报, 2018, 9(9): 2063-2071.
表1 RPA扩增引物和探针
Table 1 Primers and probes of RPA amplification
物种 | 引物和探针 | 序列 (5' ~3' ) | 扩增大小 (bp) |
低眼无齿巨鲶 | P.h-F | gcatgctgagtgctaacaggttcgaactggcca | 194 |
P.h-R | acattagatggcatcagacaggtaacccacact | ||
P.h-P | c[bhq2-dt]ctgcattaagtag-c3 spacer | ||
半滑舌鳎 | C.s-F | tccttctccttgcaatctggtcattagaaacca | 163 |
C.s-R | gtggttagtgagttgaggttggcggccccgtgg | ||
C.s-P | c[bhq1-dt]acccctatacttc-c3 spacer | ||
斑点叉尾鮰 | I.p-F | tatgttcaaggggtaggatttgtctagaatgc | 146 |
I.p-R | aaaggatgcggtttggaaagaagttttgaaaat | ||
I.p-P | c[bhq1-dt]agttttcattgttcag-c3 spacer |



图A~C分别为斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的不同引物扩增图谱
图1 实时荧光RPA引物筛选
Fig.1 Primer screening for real-time fluorescent RPA



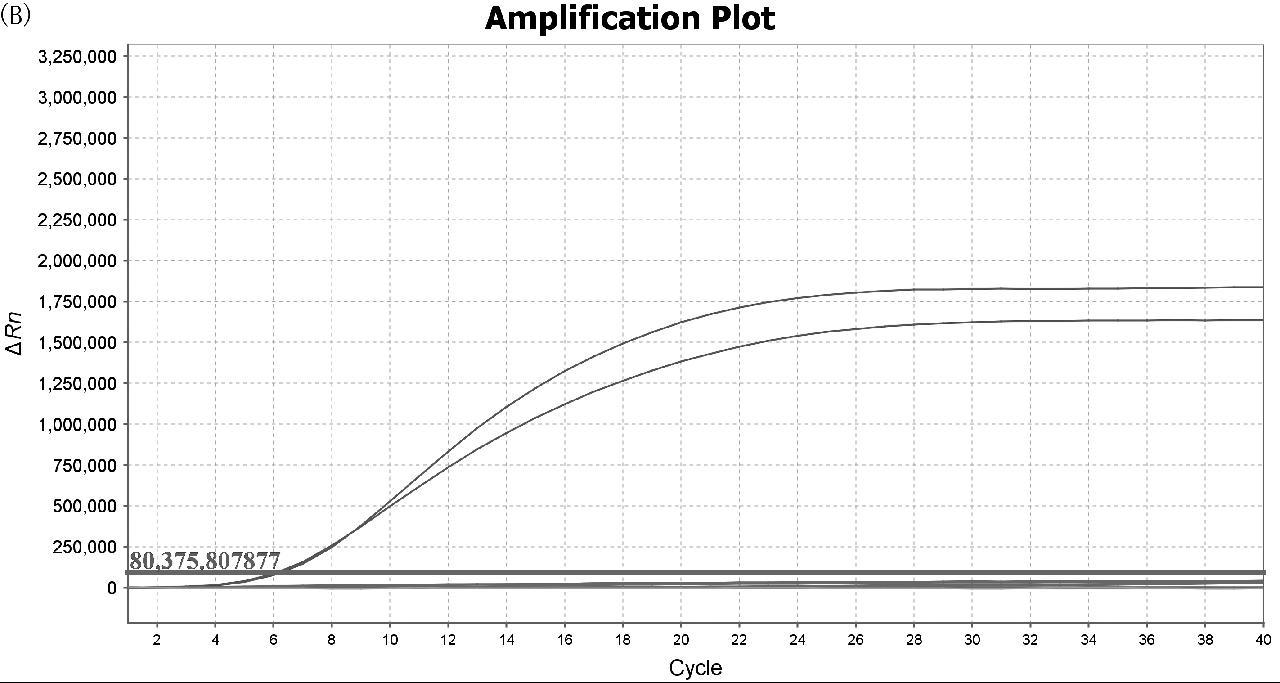


图A~C分别为斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的特异性扩增图谱
图2 实时荧光RPA特异性扩增曲线
Fig.2 Specific amplification curve of real-time fluorescence RPA
图A~C分别为斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的灵敏性扩增图谱,1~7分别为质粒模板1~7倍梯度稀释液
图3 实时荧光 RPA 灵敏性试验
Fig.3 Sensitivity test of real-time fluorescence RPA

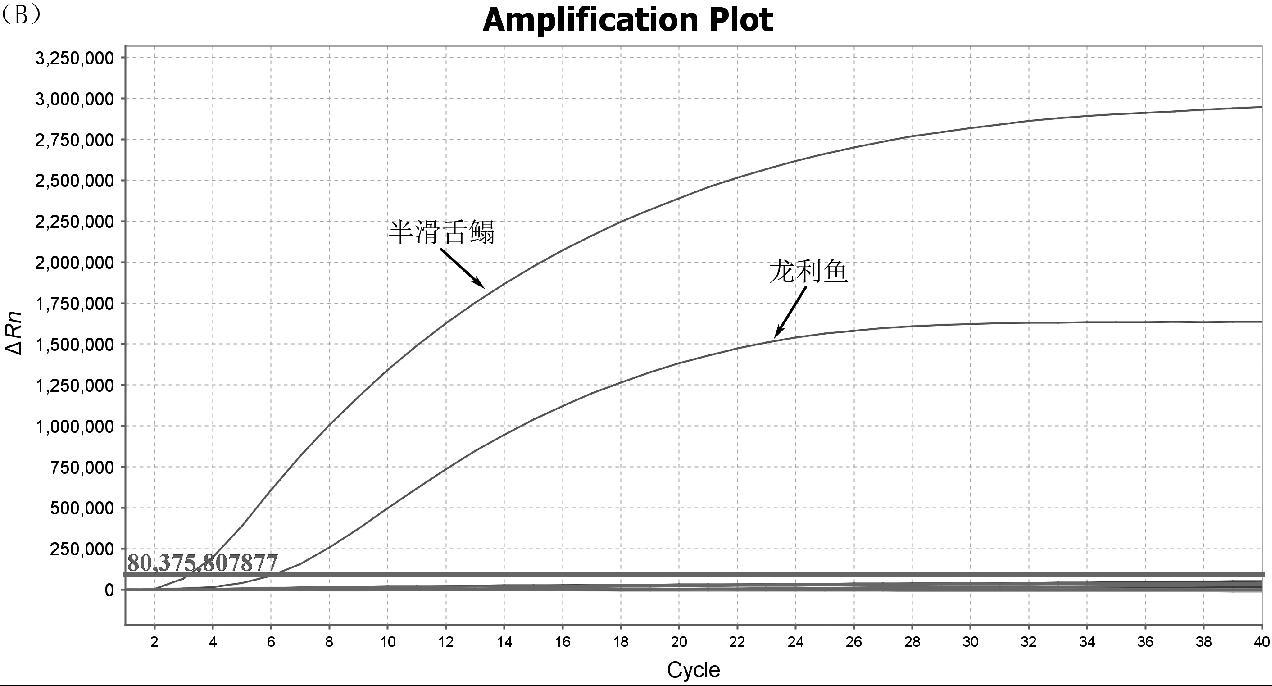


图A~C分别为斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的实时荧光RPA扩增图谱,图D是斑点叉尾鮰、半滑舌鳎和低眼无齿巨鲶的三重实时荧光PCR扩增图谱
图4 实时荧光 RPA 检测方法的应用
Fig.4 Application of real-time fluorescence RPA detection
method







