CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
食品中单核细胞增生李斯特氏菌ddPCR定量检测方法的建立及应用
作者:魏茂琳 姜彦芬 韩钦 孙晓霞 王金凤 刘立兵 王建昌
魏茂琳 姜彦芬 韩钦 孙晓霞 王金凤 刘立兵 王建昌
Abstract In this study, a rapid and quantitative droplet digital PCR (ddPCR) method was established for the detection of Listeria monocytogenes (LM) in foods. By optimizing reaction conditions and reaction systems, a fast quantitative ddPCR detection method for LM in foods was established. The specificity, sensitivity, and repeatability of this method were examined, and its feasibility was validated using artificially contaminated ready-to-eat sausage and dairy cheese sticks as samples. The results showed that after optimization, the optimal upstream and downstream primer concentrations for the ddPCR method were determined to be 900 nmol/L, the optimal probe concentration was 250 nmol/L, the optimal annealing temperature was 58.3℃, the extension time was 60 s, and the cycle number was 45 cycles. The established ddPCR method exhibited good specificity, a limit of quantification (LOQ) of 294 CFU/mL, and a coefficient of variation of less than 12% for repeated testing. There was a strong linear correlation (R² = 0.998) between the ddPCR quantification results and the plate count results. The LOQ could achieve 102 CFU/g in the manual spiking test with simultaneous ddPCR and plate counting assay, which demonstrated good reproducibility and accuracy. The ddPCR method for the quantitative determination of LM in foods established in this study was highly specific, sensitive and accurate, providing technical support for the rapid quantitative determination of LM.
Keywords Listeria monocytogenes; droplet digital PCR; plate counting; quantitative detection
单核细胞增生李斯特氏菌(Listeria monocytogenes,LM)是一种革兰氏阳性菌,属于李斯特菌属,其主要通过食物传播,是一种会危害人体健康的食源性致病菌[1]。目前,李斯特菌有10余种,包括LM、伊氏李斯特氏菌(L.ivanovii)、英诺克李斯特氏菌(L.innocua)等,其中LM是唯一能够引发人类疾病的李斯特菌[2],该菌在全球的平均致死率约30%,已超过沙门氏菌、肉毒梭菌所引发的疾病[3-4]。LM作为一种以腐烂有机物为食的腐生菌,能够引发严重的食物中毒、脑膜脑炎以及败血症等[5-7]危及人类健康的疾病。由于该菌对盐浓度、温度和pH值等条件具有一定的耐受性[8-9],因此广泛存在于自然环境中,食品中若含有LM将给人体健康带来危险。随着我国居民饮食习惯的改变、冷链运输业的发展以及即食食品的消费需求增加,我国感染单核细胞增生李斯特菌的散发病例也逐年增高[10],因此加强对食品中LM的检测及监测具有重要意义。
目前,我国对食品中LM的检测方法主要有传统培养法[11]、实时荧光PCR法、免疫检测法等,这些方法均无法做到绝对定量,而“金标准”传统培养法耗时较长、步骤繁琐,并且难以满足实验室对快速检测的需求[12]。因此,为了能更好地监测食品中LM污染情况,减少由LM引起的食源性疾病的发生,建立一种对LM快速、绝对定量的检测方法显得尤为重要。
作为第三代PCR技术的微滴式数字PCR(droplet digital PCR,ddPCR)方法将微滴生成油与待检测的样品核酸在微滴生成仪的作用下随机生成微滴,这些微滴经PCR仪扩增后,通过微滴读取仪进行微滴数的判读,从而可对目标基因实现绝对定量[13-15]。目前,该技术在转基因生物量化[16]、物种鉴定[17]等多个领域得到应用,具有良好的前景。本研究以LM单拷贝基因hlyA为靶基因,通过对其反应体系和条件的优化及灵敏性、特异性、准确性进行分析,建立了一种对食品中LM快速、可靠、绝对定量的检测方法。
1 材料与方法
1.1 材料与试剂
单核细胞增生李斯特氏菌(ATCC19114)、阪崎肠杆菌(ATCC29544)、英诺克李斯特氏菌(CICC10297)、伊氏李斯特氏菌(CICC21663)、斯氏李斯特氏菌(CICC21671)、副溶血弧菌(CICC21617)、大肠埃希氏菌O157:H7(CICC21530)(中国工业微生物菌种保藏管理中心);大肠杆菌、金黄色葡萄球菌以及沙门氏菌(由本实验室分离);ddPCR Supermix for Probes(no dUTP)(预混液)、微滴生成油(美国BIO-RAD 公司);细菌基因组DNA提取试剂盒(北京天根公司);香肠、奶酪棒(石家庄市某超市)。
1.2 仪器与设备
QX200TMddPCR微滴生成仪、PX1TM热封仪、Nano Drop 2000c超微量分光光度计、T100TM梯度PCR仪、QX200TM微滴读取仪,以上设备均已进行计量确认和技术性验收且运行正常。
1.3 实验方法
1.3.1 引物设计与合成
经查阅相关文献[18-19]及NCBI数据库,选取保守性高且具有种属特异性的hlyA单拷贝基因作为靶序列,并根据Suo等[20]所报道的LM引物和探针序列,结合NCBI数据库进行对比分析,确定用于本研究的引物探针序列,见表1。
表1 ddPCR扩增引物和探针序列
Table 1 Primer and probe sequence of ddPCR
名称 | 序列 (5′~3′) | (bp) |
上游引物 | 5′-ACTGAAGCAAAGGATGCATCTG-3′ | 101 |
下游引物 | 5′-TTTTCGATTGGCGTCTTAGGA-3′ | |
探针 | FAM-CACCACCAGCATCTCCGCCTGC-BHQ1 |
1.3.2 平板计数
用接种环将已活化的LM菌株接种于显色培养基中,(36±1)℃培养48 h后,选取一定数量的单菌落置于含0.85%氯化钠溶液的麦氏浊度仪试管中,以浊度为1.0的菌液为初始稀释液,并在装有9 mL 0.85%氯化钠溶液的离心管中加入1 mL初始稀释液进行梯度稀释,逐级稀释至10-8,吸取后3个稀释度的菌液1 mL分别置于无菌培养皿中,立即将冷却至46℃的平板计数琼脂培养基倒于培养皿中,每个培养皿15~20 mL,并轻轻晃动培养皿使其混匀,(36±1)℃培养48 h,每个稀释度做3个平行。选取菌落数在30~300 CFU之间、无蔓延菌落生长的培养皿进行计数,取平均值,以此推算原始菌落总数[21]。
1.3.3 细菌DNA提取
分别取1.1节所述的10种菌株的纯菌液2 mL,使用细菌基因组DNA提取试剂盒提取DNA,定容体积为100 μL,使用超微量分光光度计对浓度和纯度进行测定,使提取的DNA OD260 /OD280比值在1.8~2.0范围内。根据公式(1)计算其DNA拷贝数,并使用洗脱缓冲液进行10倍梯度稀释,使核酸浓度依次在1.0~1.0×106 copies/μL范围间。同时分别取101~106 CFU/mL的LM菌液100 μL,提取其DNA。
 (1)
(1)
式(1)中,c1:提取的细菌DNA拷贝数浓度,copies/μL;a:Nano Drop 2000c测得的DNA浓度,ng/μL;b:细菌基因组长度,bp。
1.3.4 LM微滴式数字PCR方法的建立和优化
1)退火温度的优化。以浓度为1.0×104 copies/μL的LM基因组DNA为模板,分别在56℃、56.4℃、57.2℃、58.3℃、59.7℃、60.8℃、61.6℃、62℃这8个温度下进行PCR扩增反应,通过扩增结果选择最佳退火温度,每个温度重复3次。
ddPCR扩增条件:ddPCR预混液10 μL,上下游引物终浓度为900 nmol/L(1.8 μL),探针终浓度为250 nmol/L(0.5 μL),模板1 μL,用水补足20 μL。反应条件为95℃预变性10 min;94℃变性30 s,退火温度为56~62℃,延伸60 s,循环40 次;98℃酶失活10 min;以2℃/s的速率进行升降温。
2)引物、探针浓度的优化。按照1)确定的最佳退火温度,通过分组试验设置上下游引物终浓度分别为1200 nmol/L、900 nmol/L、600 nmol/L、400 nmol/L;探针终浓度分别为500 nmol/L、250 nmol/L、250 nmol/L、200 nmol/L,进行ddPCR扩增反应,根据扩增结果确定最佳引物探针浓度,每个组合重复3次。
3)循环数、延伸时间的优化。按照1)和2)确定的退火温度和引物探针浓度,继续对循环数和延伸时间进行优化,设定6个组合:60 s,40个循环;60 s,45个循环;55 s,40个循环;55 s,45个循环;50 s,40个循环;50 s,45个循环;为确定最佳延伸时间和循环数,每组重复3 次。
1.3.5 LM微滴式数字PCR方法的特异性试验
以1.3.3节所提取的10株菌株DNA为模板,以水作为空白对照。依照优化后的最佳退火温度、循环数、延伸时间和引物探针浓度进行LM微滴式数字PCR特异性分析,并重复3次。
1.3.6 LM微滴式数字PCR方法的灵敏度试验
以10倍梯度稀释的LM菌液DNA作为模板,依照优化后的最佳退火温度、循环数、延伸时间和引物探针浓度进行ddPCR方法灵敏性试验,并重复3次。将根据不同梯度读取的微滴数代入公式(2),分别计算出各梯度菌液浓度。确定ddPCR检测LM的灵敏性,同时对ddPCR计算出来的菌液浓度与平板计数结果进行比较,并建立线性关系。
 (2)
(2)
式(2)中,c2:对应菌液浓度,CFU/mL;D:20 μLddPCR反应体系中测得的DNA拷贝数,copies/20 μL;v1:提取DNA的最终定容体积,μL;v2:ddPCR反应体系中加入的DNA模板体积,μL;v3:提取的菌液体积,mL。
1.3.7 人工污染样品的检测
选择经GB 4789.30—2016《食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验》[11]标准检测,证实无LM的市售香肠、奶酪棒样品作为添加基质。制备人工污染试验样品,分别称取香肠和奶酪棒25 g,加入225 mL缓冲蛋白胨水,用拍击式均质器拍击2 min彻底混匀,向其中分别加入LM菌液,使其污染水平在101 CFU/g、102 CFU/g、103 CFU/g、104 CFU/g,每个添加水平重复3次,同时设置阴性对照。取100 μL各样品均质液提取其核酸,使用50 μL洗脱缓冲液对提取的核酸进行洗脱,使用ddPCR进行检测。再对以上4个添加水平的样品分别梯度稀释进行平板计数,比较两种方法的检测结果。
2 结果与分析
2.1 ddPCR方法的优化结果
2.1.1 退火温度优化结果
退火温度优化的结果显示,随温度下降荧光强度逐渐升高,达到一定温度后,荧光强度又呈下降趋势(图1),当退火温度为58.3℃时,阳性微滴和阴性微滴间距最大,阳性微滴分布较为集中,两簇之间弥散微滴数目较少,因此确定最佳退火温度为58.3℃。
1~8分别代表退火温度62℃、61.6℃、60.8℃、59.7℃、58.3℃、57.2℃、56.4℃、56℃
图1 退火温度的优化结果
Fig.1 Optimization results of annealing temperatures
2.1.2 引物探针浓度优化结果
通过对不同浓度的引物探针进行优化,结果表明,当上下游引物浓度为900 nmol/L、探针浓度为250 nmol/L时,阳性、阴性微滴间距较大,能够进行有效区分,且阳性微滴分布最为紧凑集中,与其他浓度相比该浓度组合下荧光信号较强(图2),因此确定最佳的引物探针浓度分别为900 nmol/L和250 nmol/L。
2.1.3 延伸时间和循环数优化结果
延伸时间和循环数优化试验结果显示,随着延伸时间和循环数的增加,阳性微滴分布越来越集中,当延伸时间为60 s时,循环数为45个时,荧光信号最强,阴阳性微滴间距明显,两簇之间弥散微滴数目也较少,扩增效果最好(图3)。
2.2 LM微滴式数字PCR方法的特异性结果
结果显示,ddPCR方法仅对LM基因组DNA有阳性微滴,而空白对照、其余9株菌株的基因组DNA均未出现扩增,表明所建立的ddPCR检测方法特异性良好,见图4。
2.3 LM微滴式数字PCR方法的灵敏性结果
按照平板计数法确定的LM初始菌液浓度为1.5×108 CFU/mL,其菌落计数Lg值为8.18。以梯度稀释的LM菌液DNA为模板进行ddPCR方法的灵敏性检测。结果显示,1.5×102 CFU/mL有阳性微滴,1.5×101 CFU/mL 3次重复均未出现阳性微滴(图5、表2)。进一步分析,对1.5×102 CFU/mL的菌液DNA进行1.5倍、2倍、4倍稀释,结果也无阳性微滴生成。因此,所建立的LM ddPCR方法最低可检测到1.5×102 CFU/mL。在整个试验过程中,3次重复的检测结果变异系数均小于12%(表2),展现出较好的重复性。基于ddPCR方法的检测结果,根据公式(2)计算其对应的原菌液浓度(CFU/mL),结果显示,ddPCR最低检出限(LOD)和定量限(LOQ)均为294 CFU/mL(表2)。
1~7分别为:1.5×106 CFU/mL; 1.5×105 CFU/mL; 1.5×104 CFU/mL; 1.5×103 CFU/mL; 1.5×102 CFU/mL; 1.5×101 CFU/mL; 空白对照
图5 ddPCR方法灵敏性试验结果
Fig.5 Sensitivity test results of ddPCR method
2.4 LM微滴式数字PCR方法与平板计数测定结果的比较
根据建立的ddPCR方法和平板计数法对培养后的LM进行菌液浓度测定 ,结果显示,平板计数法测定的LM浓度为1.5×108 CFU/mL,其Lg值为8.18;由公式(2)计算出的各梯度菌液浓度再与对应稀释倍数相乘,得到ddPCR方法测定的原菌液浓度为1.26×108~2.94×108 CFU/mL,其Lg值为8.10~8.47,平均值为8.24,与平板计数法相比高0.06个Lg值,偏差最大为3.6%(表2)。由测定结果可知,ddPCR方法的检测结果与平板计数结果间具有较好的线性相关性,相关系数R2 = 0.998(图6)。
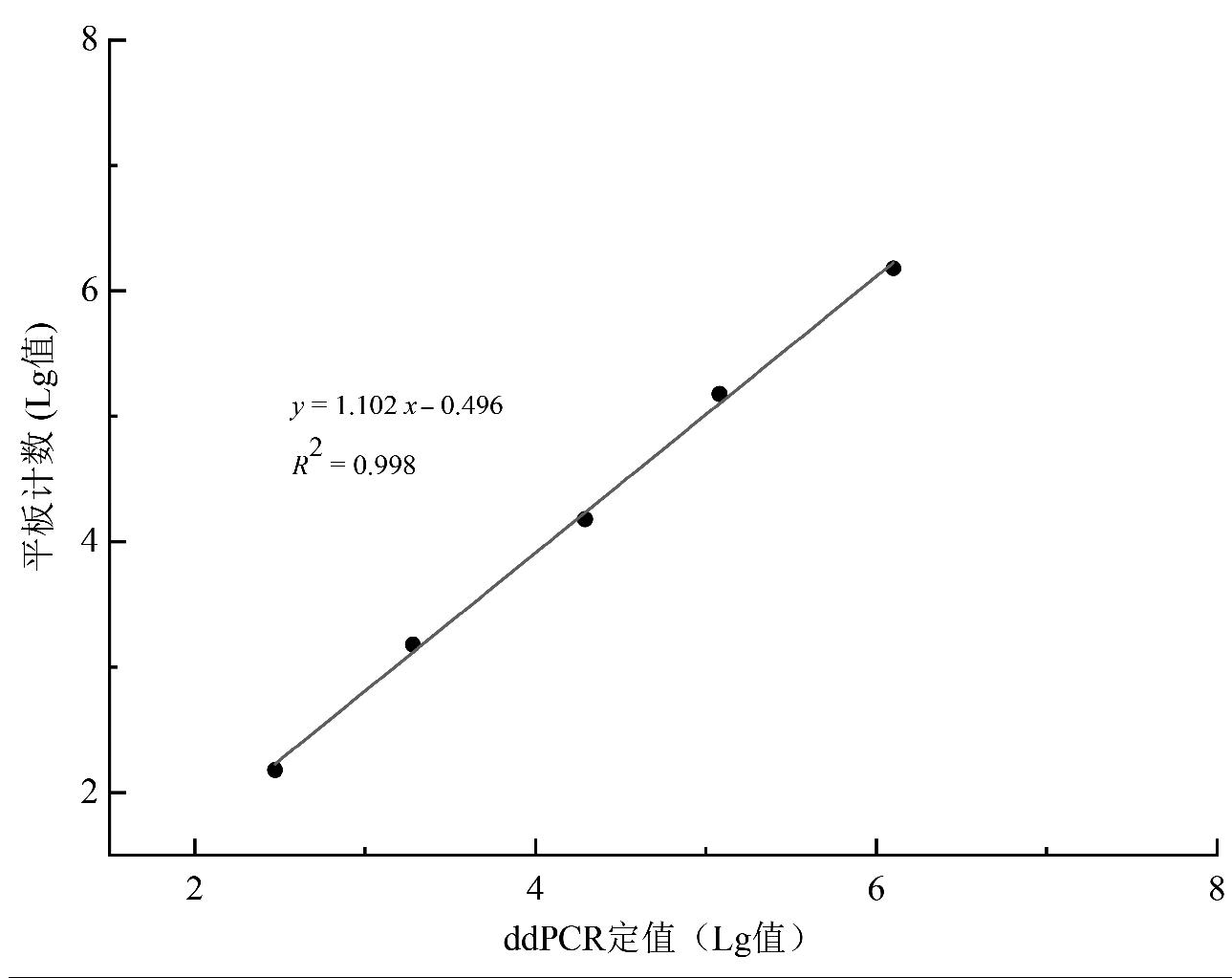
图6 ddPCR定值结果与平板计数的关系
Fig.6 Relationship between ddPCR quantification and plate counting results
2.5 人工污染样品的检测结果
以建立的ddPCR方法和平板计数法分别对4个添加水平的样品进行LM检测,并进行比较分析。结果显示,ddPCR方法检测中阴性对照、空白对照中均未出现阳性微滴,两种人工污染样品香肠、奶酪棒的检测中LOQ分别为133 CFU/g和153 CFU/g,变异系数均小于10%,展现出良好的重复性,与平板计数相比较,偏差小于15%,结果表明,ddPCR方法的定值结果与平板计数法检测的结果较为吻合,见表3。
3 讨论
本研究对ddPCR反应体系和反应条件进行一系列优化,如退火温度、引物探针浓度、循环数和延伸时间,优化退火温度过程中发现,退火温度较低可提高ddPCR反应的灵敏性,但会使特异性变弱,而较高的退火温度又可以使特异性增强,但降低了其扩增效果,因此有必要找到最佳退火温度;延伸时间和循环数的改变可以使阳性与阴性两簇间的分辨率提高,减少具有中间荧光的微滴数量。但在这种情况下,可能会增加产生非特异性扩增的风险,因此选择最佳的延伸时间和循环数对该ddPCR方法进行定量检测尤为重要。通过优化后LM基因组DNA扩增效果良好,可将阳性微滴和阴性微滴区分开,减少了“雨”的形成,从而提高了ddPCR方法的特异性、灵敏性和准确性。
同时,利用ddPCR方法和传统方法分别对LM梯度稀释的菌液、两种人工污染样品进行检测,比较两种方法的检测结果。ddPCR中LM梯度稀释的菌液LOD和LOQ均为294 CFU/mL,变异系数均小于12%,比平板计数结果平均高0.06个Lg值,ddPCR与平板计数定值结果的对数偏差均小于4%;两种人工污染样品的检测中LOQ分别为133 CFU/g和153 CFU/g,变异系数均小于10%,与平板计数相比较,偏差均小于15%。另外,通过检测人工添加LM的香肠、奶酪棒样品,ddPCR方法的检测结果比平板计数较低(表2),产生这个现象的原因可能是由于样品成分复杂,取上清时含有部分样品残渣,影响核酸提取效率。本研究所建立的ddPCR方法通过微滴生成仪将核酸分子随机分布到上万个微滴中,因此对样品中PCR抑制剂具有较高的耐受性[22-25]。综上分析,此研究中ddPCR方法的检测结果与传统培养法检测的结果吻合性较好,所建立的单核细胞增生李斯特氏菌ddPCR检测方法具有良好的灵敏性、重复性和特异性。
4 结论
本研究与现行GB 4789.30—2016的传统培养方法相比,ddPCR方法能够弥补传统培养法费力又耗时的缺点,且由于传统培养法依赖于细菌的表型特征,其结果往往存在可变性,而ddPCR仅需1 d就能完成检测,大幅缩短了检测周期,能够满足快速检测的需求,具有绝对定量、灵敏性高、重复性好等特点,因此本研究建立的ddPCR方法为食品中LM的快速准确定量提供了一种技术支持,也为后续相关研究提供了数据支撑。
参考文献
[1]杨卫海, 闫泽一. 不可忽视的李斯特菌[J]. 中国海关, 2023(1): 51.
[2]李孟华, 闫帅帅, 李德志, 等. 单增李斯特菌生物膜形成调控机制的研究进展[J]. 生物工程学报, 2021, 37(9): 3151-3161.
[3] Scallan E, HOEKSTRA R M, Angulo F J, et al. Foodborne illness acquired in the United States-major pathogens[J]. Emerging Infectious Diseases, 2011, 17(1): 7-15.
[4] Mylène M M, Hélène B D, Lei H, et al. Hypervirulent Listeria monocytogenes clones’adaption to mammalian gut accounts for their association with dairy products[J]. Nature Communications, 2019, 10(1): 1-13.
[5]连凯, 叶舒扬, 殷月兰, 等. 分子分型方法在单核细胞增生性李斯特菌流行病学研究中的应用[J]. 中国人兽共患病学报, 2015, 31(8): 757-762.
[6]萨仁高娃, 胡文忠, 姜爱丽, 等. 产单核细胞增生性李斯特氏菌致病机制的研究进展[J]. 食品工业科技, 2013, 34(1): 372-376.
[7]杨建伟. 单核细胞增生性李斯特菌最新研究进展[J]. 齐鲁医学杂志, 2013(5): 465-467.
[8] Megha G, Michael L C. Listeria: A foodborne pathogen that knows how to survive[J]. International Journal of Food Microbiology, 2006, 113(1): 1-15.
[9]马彦宁, 赵悦, 郭云昌, 等. 即食食品中单核细胞增生李斯特菌的血清学分型和毒力基因分析[J]. 中国食品卫生杂志, 2017, 29(1): 14-18.
[10]郝民, 阮明捷, 王恒伟, 等. 北京市朝阳区单核细胞增生李斯特菌关键毒力基因缺失与致病性关联性研究[J]. 中国食品卫生杂志, 2022, 34(1): 75-81.
[11] GB 4789.30—2016 食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验[S]. 北京: 中国标准出版社, 2016.
[12]赵丽青, 方佩佩, 唐静, 等. 数字PCR定量检测食品中单核细胞增生李斯特氏菌方法的研究[J]. 食品安全质量检测学报, 2017, 8(11): 4133-4138.
[13] Chen Y, Régis P. Comparative evaluation of direct plating and most probable number methods for the enumeration of low levels of Listeria monocytogenes in naturally contaminated ice cream products[J]. International Journal of Food Microbiology, 2017, 241: 15-22.
[14]刘立兵, 石蕊寒, 项佳林, 等. 应用微滴式数字聚合酶链式反应定量检测牛肉制品中的猪源性成分[J]. 肉类研究, 2018, 32(9): 29-34.
[15] Kojabad A A, Farzanehpour M, Galeh HEG, et al. Droplet digital PCR of viral DNA/RNA, current progress, challenges, and future perspectives[J]. Journal of Medical Virology, 2021, 93(7): 4182-4197.
[16] Morisset D, Štebih D, Milavec M, et al. Quantitative analysis of food and feed samples with droplet digital PCR[J]. Plos One, 2013, 8(5): 1-9.
[17] Floren C, Wiedemann I, Brenig B, et al. Species identification and quantification in meat and meat products using droplet digital PCR (ddPCR) [J]. Food Chemistry, 2015, 173: 1054-1058.
[18] Grudlewska-Buda K, Skowron K, Gospodarek-Komkowska E. Comparison of the intensity of biofilm formation by Listeria monocytogenes using classical culture-based method and digital droplet PCR[J]. AMB Express, 2020, 10(1): 75-85.
[19] Moura G F, Tomborelli P M, Carvalho R C T, et al. Listeria monocytogenes and other species as persistent contaminants in the processing of chicken meat[J]. Journal of Applied Poultry Research, 2019, 28(2): 470-478.
[20] Suo B, He Y P, Tu S I, et al. A multiplex real-time Polymerase Chain Reaction for simultaneous detection of Salmonella spp., Escherichia coli O157, and Listeria monocytogenes in meat products[J]. Foodborne Pathogens and Disease, 2010, 7(6): 619-628.
[21] GB 4789.2—2022 食品安全国家标准 食品微生物学检验菌落总数测定[S]. 北京: 中国标准出版社, 2022.
[22] Pavšič J, Devonshire A S, Parkes H, Schimmel H, et al. Standardization of Nucleic Acid Tests for Clinical Measurements of Bacteria and Viruses[J]. Journal of Clinical Microbiology, 2015, 53(7): 2008-2014.
[23] Devonshire A S, Honeyborne I, Gutteridge A l, et al. Highly reproducible absolute quantification of Mycobacterium tuberculosis complex by digital PCR[J]. Analytical Chemistry, 2015, 87(7): 3706-3713.
[24] Tatsuhiko H, Fumio I. Molecular quantification of environmental DNA using microfluidics and digital PCR[J]. Systematic And Applied Microbiology, 2012, 35(6): 390-395.
[25] Irena H. Digital PCR analysis of circulating nucleic acids[J]. Clinical Biochemistry, 2015, 48(15): 948-956.
1 2 3 4 5 6 7 8
1~2: 上下游引物400 nmol/L和探针200 nmol/L; 3~4: 上下游引物600 nmol/L和探针250 nmol/L; 5~6: 上、下游引物900 nmol/L和探针250 nmol/L; 7~8: 上下游引物1200 nmol/L和探针500 nmol/L
图2 引物探针浓度的优化结果
Fig.2 Optimization results of primer and probe concentrations
图A: 60 s, 45次循环; 图B: 55 s, 45次循环; 图C: 50 s, 45次循环; 图D: 60 s, 40次循环; 图E: 55 s, 40次循环; 图F: 50 s, 40次循环
图3 延伸时间和循环数的优化结果
Fig.3 Optimization results for extension time and number of cycles

1~11分别代表: LM、空白对照、伊氏李斯特氏菌、斯氏李斯特氏菌、英诺克李斯特氏菌、金黄色葡萄球菌、沙门氏菌、大肠杆菌、阪崎肠杆菌、副溶血弧菌、大肠埃希氏菌O157:H7
图4 特异性试验结果
Fig.4 Results of the specificity test
表2 ddPCR方法定量检测梯度稀释的LM结果
Table 2 Quantitative detection results of gradient diluted LM by ddPCR
序号 | 平板计数 (CFU/mL) | ddPCR定量结果 (copies/mL) | ||||||
重复1 | 重复2 | 重复3 | 平均值 | CV (%) | 原菌液浓度Lg (CFU/mL) | 偏差 (%) | ||
1 | 1.5×106 | 1240000 | 1280000 | 1260000 | 1260000 | 1.6 | 8.10 | 1.0 |
2 | 1.5×105 | 134000 | 124000 | 106000 | 121000 | 11.7 | 8.08 | 1.2 |
3 | 1.5×104 | 20000 | 19600 | 18400 | 19300 | 4.3 | 8.29 | 1.3 |
4 | 1.5×103 | 2000 | 1800 | 1920 | 1910 | 5.3 | 8.28 | 1.2 |
5 | 1.5×102 | 280 | 320 | 280 | 294 | 7.9 | 8.47 | 3.6 |
6 | 1.5×101 | — | — | — | — | — | — | — |
注: “—”代表阴性
表3 ddPCR方法定量检测人工污染香肠、奶酪棒样品中LM的结果(CFU/g)
Table 3 LM quantification results in artificially contaminated sausage and cheese stick samples by ddPCR method (CFU/g)
样品 | (CFU/g) | 平板计数结果 | ddPCR定量结果 | ||||||||
计数值 | Lg值 | 重复1 | 重复2 | 重复3 | 平均值 | CV (%) | Lg值 | 偏差 (%) | |||
香肠 | 104 | 2.8×104 | 4.45 | 23600 | 25200 | 24200 | 24333 | 3.3 | 4.39 | 1.3 | |
103 | 3.0×103 | 3.48 | 2660 | 2600 | 2500 | 2587 | 3.1 | 3.38 | 2.9 | ||
102 | 2.0×102 | 2.30 | 120 | 140 | 140 | 133 | 8.7 | 2.12 | 7.8 | ||
101 | 1.4×101 | 1.15 | — | — | — | — | — | — | — | ||
阴性对照 | — | — | — | — | — | — | — | — | — | ||
空白对照 | — | — | — | — | — | — | — | — | — | ||
奶酪棒 | 104 | 5.8×104 | 4.76 | 33400 | 34400 | 32200 | 33333 | 3.3 | 4.52 | 5.0 | |
103 | 3.5×103 | 3.54 | 2080 | 2060 | 2200 | 2113 | 3.6 | 3.32 | 6.2 | ||
102 | 3.3×102 | 2.52 | 160 | 140 | 160 | 153 | 7.5 | 2.18 | 13.5 | ||
101 | 1.8×101 | 1.26 | — | — | — | — | — | — | — | ||
阴性对照 | — | — | — | — | — | — | — | — | — | ||
空白对照 | — | — | — | — | — | — | — | — | — | ||
注: “—”代表阴性
基金项目:福建省对外合作项目(2022I0029);福州海关科研项目(FK2022-01)
第一作者:余思宸(1997—),男,汉族,福建福州人,硕士在读,公共卫生专业,E-mail: 495701459@qq.com
共同第一作者:党晓霞(1978—),女,汉族,甘肃张掖人,本科,主管护师,主要从事卫生检疫工作,E-mail: 942008326 @qq.com
通信作者:黄恩炯(1981—),男,汉族,福建晋江人,博士,主任技师,主要从事病媒生物控制工作,E-mail: enjiong@163.com
1. 福建医科大学公共卫生学院 福州 350000
2. 新疆国际旅行卫生保健中心 乌鲁木齐 830000
3. 福州国际旅行卫生保健中心 福州 350001
1. Public Health School of Fujian Medical University, Fuzhou 350000
2. Xinjiang International Travel Health care Center, Urumqi 830000
3. Fuzhou International Travel Health care Center, Fuzhou 350001








