CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
分子印迹-Ru(bpy) 32+探针电化学传感器法测定食品中的组胺
作者:曾诚 钱志娟 石金伟 汪玲
曾诚 钱志娟 石金伟 汪玲
摘 要 组胺是人体内一种重要的生物化学物质,但摄入过量会导致组胺不耐症和组胺中毒等问题。因此,开发一种高选择性、低成本的检测食品中组胺的方法尤为重要。本研究以组胺为模板分子,邻苯二胺为功能单体,利用电化学聚合的方法,在玻碳电极表面制备了组胺分子印迹传感器。传感器利用三联吡啶钌(Ru(bpy)32+)作为探针,借助循环伏安特性曲线,以电极对组胺分子在传感器上的吸附、洗脱后电流和组胺浓度的定量关系为工作原理,测定了几种食品基质中的组胺含量。同时,对该分子印迹电流传感器的选择性、重现性以及稳定性进行了考察。传感器的检测线性浓度范围为1.0×10-5~1.0×10-7 mol/L,相关系数为0.993,检出限为8.4×10-8 mol/L(3σ/S),加标回收率在91.2%~106.6%之间,RSD值小于5%。该方法操作简单,具有很好的特异性,可适用于食品中组胺的检测。
关键词 组胺;电化学聚合;分子印迹;循环伏安法;三联吡啶钌电化学探针
Electrochemical Sensor for the Determination of Histamine in Food by Molecular Imprinting-Ru(bpy)32+ Probe System
ZENG Cheng 1 QIAN Zhi-Juan 2 SHI Jin-Wei 3 WANG Ling 1
Abstract Histamine (HA) is an important biochemical substance in the human body, but excessive consumption of HA can lead to problems such as histamine intolerance and histamine poisoning. Therefore, it is particularly necessary to develop selective and low-cost detection methods for HA in food. In this study, an HA molecular imprinting sensor was prepared on the surface of a glassy carbon electrode using HA as a template molecule and o-phenylenediamine as a functional monomer through electrochemical polymerization. The sensor used tris (2-pyridyl) ruthenium (Ru(bpy)32+) as a probe, and based on the quantitative relationship between histamine concentration and current after adsorption and elution of histamine molecules on the sensor, the content of histamine in several food substrates was determined by cyclic voltammetry characteristic curve. The detection linear concentration range of the prepared sensor was 1.0×10-5 to 1.0×10-7 mol/L, with a correlation coefficient of 0.993 and a detection limit of 8.4×10-8 mol/L (3 σ/S). The recovery rate of spiked samples was between 91.2% and 106.6%, with an RSD value of less than 5%. This method is simple to operate, has good specificity, and can be applied to the detection of HA in different food substrates.
Keywords histamine; electrochemical polymerization; molecularly imprinting; cyclic voltammetry; Ru(bpy)32+ electrochemical probe
基金项目:南京海关科研项目(2021KJ21)
第一作者:曾诚(1983—),男,汉族,江苏扬州人,本科,工程师,主要从事进出口食品安全检验检测工作,E-mail: 26579189@qq.com
1. 扬州海关 扬州 225000
2. 南京海关轻工产品与儿童用品检测中心 扬州 225009
3. 扬州大学 扬州 225007
1.Yangzhou Customs District, Yangzhou 225000
2. Nanjing Customs District Light Industry Products and Children’s Products Inspection Center, Yangzhou 225009
3.Yangzhou University, Yangzhou 225007
组胺(Histamine,HA)是人体内一种重要的生物化学物质[1-2],发酵食品、海鲜食品中都会含有组胺,结构式如图1所示。人体摄入过量组胺会造成偏头痛、心悸、呕吐、呼吸窘迫等过敏性症状,严重的还会导致休克,甚至危及生命。组胺是欧洲立法规定的唯一具有监管限制的生物胺,在新鲜鱼类中最高可达200 mg/kg [3]。因此,食品中HA的定量检测对发酵食品、海鲜食品的安全保障至关重要。
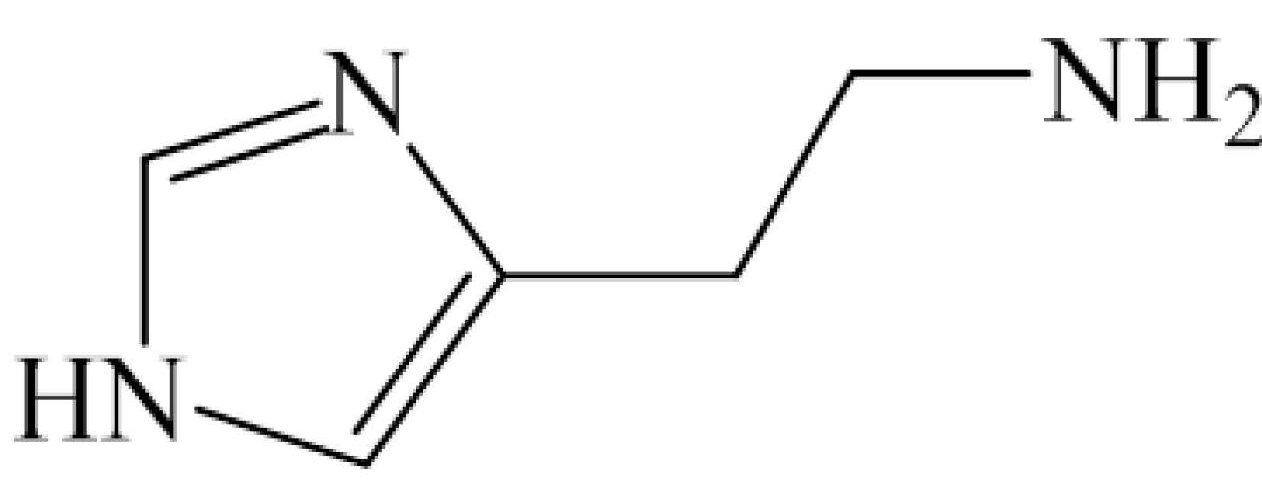
图1 HA的化学结构式
Fig.1 The molecular structures of HA
目前测定血液、尿液和组织等生物样品中HA水平的主要方法有分光光度法、色谱法、免疫分析法、毛细管电泳法、电化学方法等。分光光度法是我国国家标准方法GB/T 5009.45—2003《水产品卫生标准的分析方法》规定的水产品中组胺测定方法[4]。此方法样品处理时间长,结果重现率低,所使用的偶氮试剂在反应中被还原分解成芳香胺中间体时对人体有一定危害。气相色谱法经常被用来检测生物体中的组胺,由于生物组织中基质成分复杂,对前处理要求较高,可能降低了HA的回收率[5]。高效液相色谱-荧光检测是广泛使用的组胺检测方法,组胺分子是一种弱荧光物质,因此在用荧光检测器测定组胺时需要繁琐的衍生化过程[6]。电化学法因其操作简便、灵敏度高、成本低廉,所用仪器设备简单、更易于微型化和实现现场快速检测而受到广泛关注[7]。但组胺在电化学氧化过程中成为自由基阳离子与其他组胺自由基阳离子形成“多组胺”聚合物,会牢固黏附在电极表面并污染电极[8]。因此,不可能用一个电极连续进行测量。
电化学传感器具有高灵敏度、高信号传导性能,经常被用来与组胺分子印迹聚合物结合进行分子的测定[9-13]。分子印迹技术的原理是将某种特定的物质当作模板分子,选取某种合适的材料作为功能单体聚合后将聚合物中的模板分子洗脱出来,可得到一个特异吸附该种模板分子的空腔。对于组胺分子印迹聚合物应用最多的功能单体是甲基丙烯酸,但制备出来的印迹聚合物特异选择性并不理想[9],且制备过程繁琐、成本高。为解决上述问题,本研究以组胺为模板分子、邻苯二胺为功能单体,利用电化学聚合的方法,在玻碳电极表面制备组胺分子印迹传感器,以Ru(bpy)32+作为探针间接测定组胺含量。
1 材料与方法
1.1 材料与试剂
邻苯二胺(分析纯,98%,麦克林生化科技有限公司);三联吡啶氯化钌六水合物(Ru(bpy)32+ 6H2O,分析纯,99.95%,美国Sigma公司),组胺盐酸盐(分析纯,96%,上海阿拉丁生化科技股份有限公司);苯乙胺、腐胺、尸胺、精胺、无水乙醇、磷酸二氢钠、铁氰化钾(K3[Fe(CN)6])(均为分析纯,国药集团化学试剂有限公司)。
1.2 仪器与设备
CHI 800D电化学工作站(上海华辰仪器有限公司),使用传统的三电极系统,分别为铂丝辅助电极(上海蓝双电气),Ag/AgCl参比电极(北京精科科学仪器有限公司),玻碳工作电极(直径3 mm,上海鲁硕实业有限公司)。
1.3 实验方法
1.3.1 电极的预处理
依次使用1.0 μm、0.3 μm、0.05 μm的氧化铝抛光粉在麂皮上小心地打磨玻碳电极,直至电极表面呈镜面状,并在超声波清洗器中用无水乙醇和超纯水连续冲洗。使用三电极系统,将清洗过的电极放在0.5 mol/L的H2SO4中进行活化操作,以100 mV/s的速率在-1.0 V和+1.0 V之间循环。然后,将电极置于K3[Fe(CN)6]溶液中,在-1.0 V和+1.0 V的电位范围内进行循环伏安法扫描,直到观察到一对明确的氧化还原峰后停止。用去离子水清洗电极并用N2吹干,在使用前保持干燥。
1.3.2 HA分子印迹膜修饰电极的制备
将先前配制的50 mmol/L邻苯二胺单体和25 mmol/L HA模板分子各取10 mL混合后,加入0.77 g NH4Ac再用HAc调pH至5.2,定容至50 mL。将预处理后的电极置于得到的含有10 mmol/L邻苯二胺单体和5 mmol/L HA模板分子的0.1 mol/L HAc/NH4Ac缓冲液中,匀速通入高纯N2 10 min,以防止溶液中氧自由基阻碍分子印迹聚合物的形成。随后,在-1.0 V和+1.0 V范围内进行20次循环伏安扫描,扫描速率为50 mV/s。在电聚合后,将得到的改性电极浸泡于20 mL 无水乙醇中一定时间,以去除电极表面的HA,从而制备出HA分子印迹聚合物修饰电极(MIP-GCE)。非印迹聚合物改性电极(NIP-GCE)的处理方法与前面相同,只是在电聚合过程中未加入模板分子。
1.3.3 制备条件的优化
(1)功能单体与模板分子的比例。本研究设置邻苯二胺功能单体与HA模板分子浓度比例分别为1∶1、2∶1、3∶1、4∶1,以0.1 g/L的Ru(bpy)32+为探针,根据CV曲线的峰电流来确定功能单体和模板分子的比例。
(2)洗脱时间的优化。使用制备好的传感器必须通过洗脱步骤去除截留在聚合物基质中的模板以释放印迹位点。为考察模板分子的洗脱情况,将新制备的分子印迹电极浸入无水乙醇中,每5 min以0.1 g/L的Ru(bpy)32+为探针检测一次CV峰电流值,考察峰电流随着时间的变化情况,以峰电流达到最高或平衡状态的时间作为最终的洗脱时间。
(3)吸附时间的优化。优化吸附时间通常是提高分子印迹传感器灵敏度的一种简单有效的方法。从MIP膜上去除HA模板分子后,将传感器在10-2 mol/L的HA溶液中浸泡不同时间,然后用蒸馏水冲洗,依次在氮气下干燥,并采用CV扫描定量测量峰值电流。
(4)电聚合扫描循环周期的优化。电聚合扫描循环的次数影响着电化学传感器的灵敏度。为了获得电聚合过程中的最佳循环次数,实验进行了5、10、15、20、25、30周期等一系列不同循环次数的电极制备实验。
1.3.4 电极选择性、重复性和稳定性实验
MIP-GCE对HA的选择性通过在一些可能的干扰物质色胺、酪胺、邻氯苯胺、苯乙胺、腐胺、尸胺、精胺存在下测试其CV曲线峰电流评估。检测条件为:MIP-GCE,HA 1.0×10-6 mol/L,干扰物质1.0×10-3 mol/L,Ru(bpy)32+ 0.1 g/L,循环伏安扫描速率100 mV/s,电压扫描范围0~1.5 V。采用三电极系统,以同一支MIP-GCE为工作电极,0.1 g/L的Ru(bpy)32+为探针,连续测量10 μmol/L和0.1 μmol/L HA标准溶液的CV响应电流来评估测量的重复性。将MIP-GCE置于1 μmol/L的HA溶液中测定,根据1周后相同条件下该传感器氧化峰电流的衰减评估其稳定性。
1.3.5 标准添加法加标回收率测定
标准添加回收实验中,分别向鱼提取液和啤酒样品中加入1.0 mL、3.0 mL、5.0 mL的100 μmol/L HA标准溶液再各自进行测定,记录峰电流,回收率计算公式为P = [C1×(V1+V0)-C0×V0]/(Cs×Vs)×100%,其中,P为加标回收率(%);C0为试样浓度(μmol/L),即试样测定值,V0为试样体积(L);C1为加标试样浓度(μmol/L),即加标试样测定值,Cs为标准样品浓度(μmol/L);Vs为加标体积(L)。
1.3.6 实际样品测定
秋刀鱼、啤酒和鱼露样品均购自超市。秋刀鱼样品需要进行HA的提取,其处理过程主要参照文献[14],具体操作如下:把秋刀鱼的头、内脏和骨头去掉后,切成薄片,放入绞肉机中加工成泥。准确称取10 g鱼酱多份,分别用25.0 mL 0.1 mol/L磷酸盐缓冲液(pH = 7.0)超声处理10 min,离心后用0.45 μm的滤膜过滤。啤酒和鱼露样品移取100 mL,加入0.01 g Ru(bpy)32+和0.14 g Na2HPO4,并用0.1 mol/L的HCl调至pH为7.4后直接进行测定。然后,用0.1 g/L Ru(bpy)32+-PBS溶液将滤液稀释至100 mL,用于CV扫描测定其中的HA含量。每次实验运行后,将分子印迹传感器在10%(v/v)三氯乙酸乙醇溶液中清洗20 min,以彻底去除吸附遗留的HA,清洗过程结束后再重复使用。
标准添加回收实验中,分别向鱼提取液和啤酒样品中加入1.0 mL、3.0 mL、5.0 mL的100 μmol/L HA标准溶液再各自进行测定,记录峰电流,回收率计算公式为P = [C1×(V1+V0)-C0×V0]/(Cs×Vs)×100%,其中P为加标回收率(%);C0为试样浓度(μmol/L),即试样测定值,V0为试样体积(L);C1为加标试样浓度(μmol/L),即加标试样测定值,Cs为标准样品浓度(μmol/L);Vs为加标体积(L)。
2 结果与分析
2.1 分子印迹电化学聚合表征
在0.1 mol/L HAc/NH4Ac缓冲液(pH = 5.2)中,通过CV扫描将邻苯二胺电聚合在玻碳电极表面。如图2所示的CV图中,在第一次扫描中,在+0.32 V的电位下出现不可逆阳极氧化峰,这可能是邻苯二胺单体被氧化为二聚体状态。随着循环次数的增加,邻苯二胺单体的氧化峰电位向阳极电位偏移,且电流强度迅速变小,当循环次数达到10次时,氧化峰电流几乎消失。这表明邻苯二胺在电化学作用下逐渐聚合在电极表面形成非导电膜,从而阻碍了邻苯二胺继续在玻碳电极表面发生电氧化反应。
图2 MIP(A)与NIP(B)的邻苯二胺电化学聚合循环伏安曲线
Fig.2 Cyclic voltammetry curves of MIP (A) and NIP (B) electrochemical polymerization of o-phenylenediamine
2.2 电极修饰电化学表征
裸电极以及分子印迹电极洗脱前后在5.0 mmol/L K3[Fe(CN)6]中,扫描速率为0.1 V/s时的循环伏安曲线如图3所示。从图中可以看出,裸电极循环伏安曲线上存在一对清晰的K3[Fe(CN)6]的可逆氧化还原峰,其峰电流达到60 µA。然而,在未洗脱的分子印迹电极上,K3[Fe(CN)6]探针的CV峰完全消失,表明通过电聚合,电极表面形成了一个绝缘致密层,阻碍了探针到达电极表面的扩散。经过无水乙醇洗涤后,电流峰值显著增加,达到50 µA左右,表明MIP膜中模板HA已被去除,此时分子印迹传感器表面会存在大量的HA识别“空穴”,这种多孔膜的形成有利于探针的扩散和随后的电子转移。
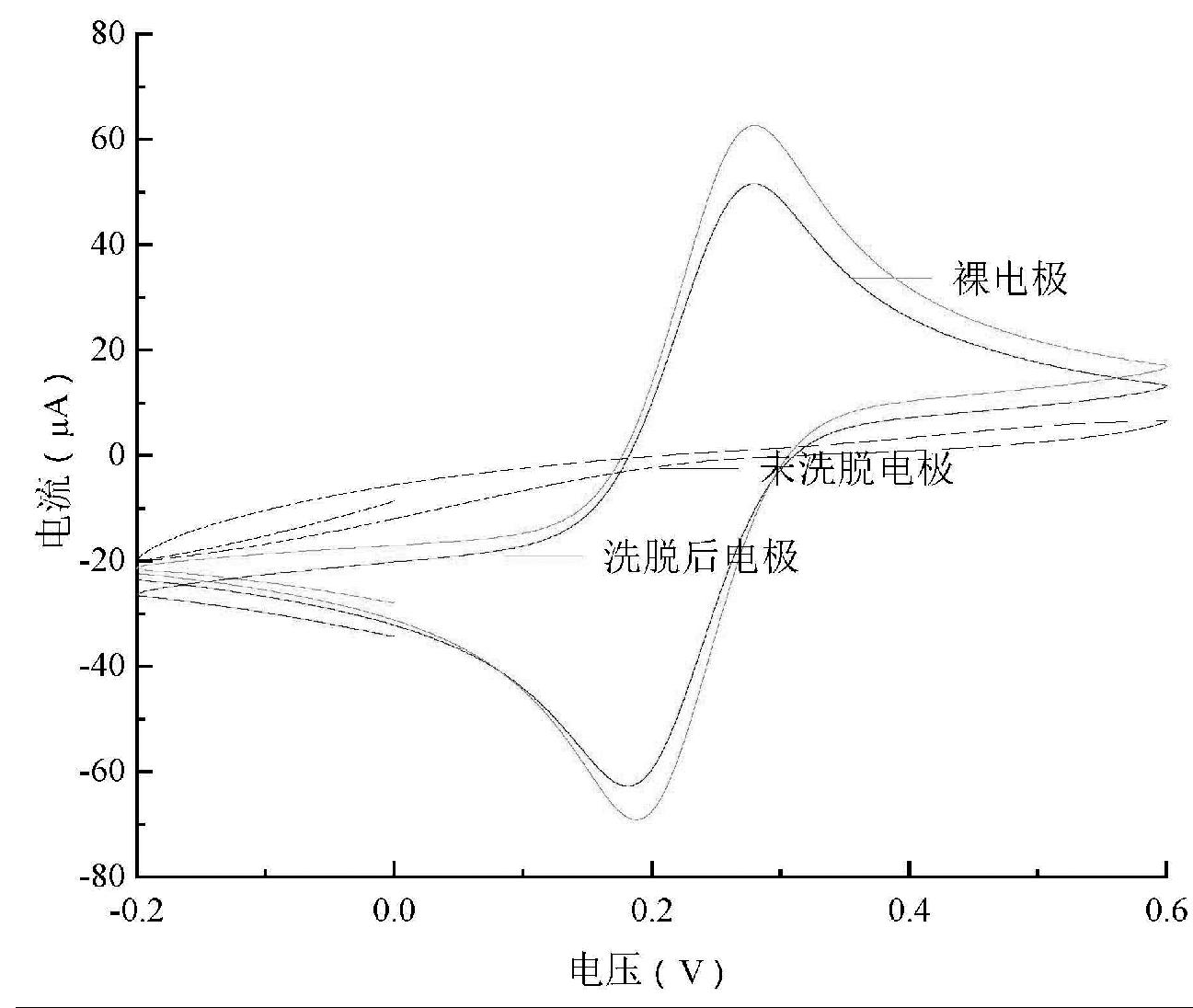
图3 裸电极和洗脱前后分子印迹电极在5.0 mmol/L K3[Fe(CN)6]溶液中的CV图
Fig.3 CV voltammograms of bare electrode and molecular-imprinted electrode before and after elution in 5.0 mmol/L K3[Fe(CN)6] solution
2.3 洗脱与吸附时间优化
模板分子是否完全被洗脱对灵敏度、选择性和重现性都有较大的影响。从洗脱时间和响应电流之间的关系(图4)可以看到,响应电流随浸泡时间的增加而快速增大,当浸泡时间为20 min时,响应电流达到最高,此后开始缓慢下降。因此,为了获得最高的效率,选择20 min作为模板去除的最佳洗脱时间。
同时,HA的吸附时间是电化学检测过程中的一个重要参数。将模板分子被完全洗脱后的MIP-GCE浸入10-2 mol/L HA溶液,以0.1 g/L的Ru(bpy)32+为探针,每隔5 min进行一次CV扫描,记录相应的峰电流,结果如图4所示。可以看出,随着培养时间的增加,峰值电流显著降低,在20 min后趋于稳定,说明20 min时传感器已经接近吸附平衡,而较快的吸附平衡时间表明所制备的印迹膜对HA分子具有较快的识别能力和较高的亲和力。尽管在25 min时峰值电流又有了很小程度的增加,但为节约分析时间,我们选择20 min作为HA测定的培养时间。
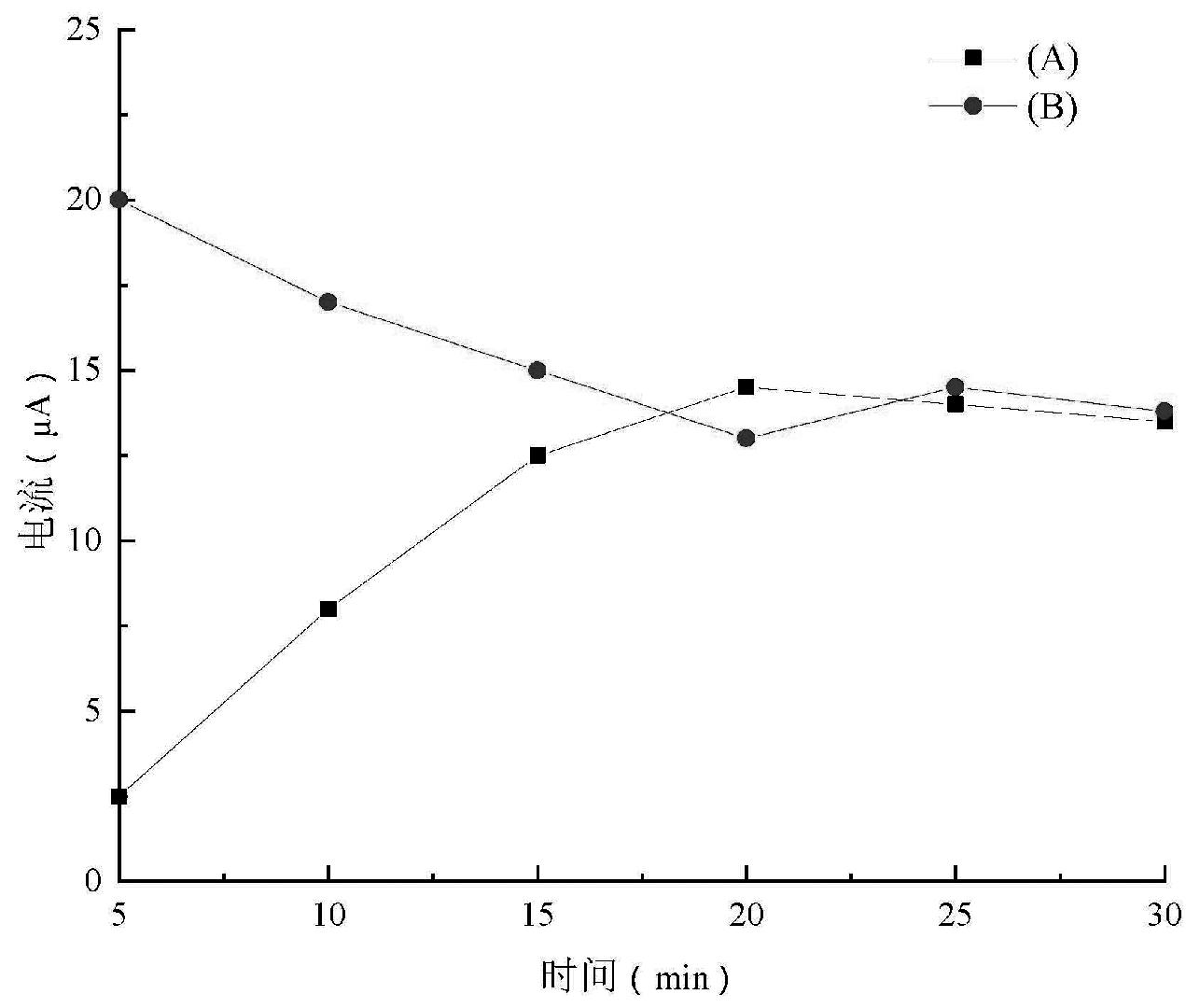
图4 洗脱时间(A)和培养时间(B)对CV峰电流的影响
Fig.4 Effect of the elution (A) and culture time (B) on the peak current of the CV response
2.4 功能单体-模板分子比例的优化
为了确定功能单体与模板分子的最佳比例,采用不同的摩尔比构建了四支分子印迹传感器,并采用CV扫描方式对其在峰电流进行了考察。结果表明,当功能单体与模板分子的摩尔比为1∶1时,由于邻苯二胺功能单体不足,修饰后的电极表面非特异性吸附点较多,特异性吸附HA的位点较少,从而峰电流相应较低(图5),而当功能单体与模板分子的摩尔比超过2∶1后,可能功能单体比值过大,使得电聚合产物过于紧密,这不仅使得模板分子洗脱困难,也降低了HA分子再吸附的能力,造成响应电流值的下降。因此,本研究选择功能单体与模板分子的比例为2∶1进行电极的修饰。
本研究以峰电流为指标,对单体和模板分子的浓度比例进行了筛选,可能忽视了单体和模板分子间的相互作用,以及选择性和亲和力等指标。近年来,核磁共振波谱、傅里叶变换红外光谱以及紫外光谱常被应用于电化学聚合物结构的表征,并以之进行单体的选择和单体和模板分子摩尔比的确定[15]。
2.5 扫描速率和扫描周期的优化
分子印迹电化学聚合过程中,CV扫描速率对聚合物膜的形态有着重要影响。一般来讲,玻碳电极表面缓慢电沉积的分子印迹薄膜致密、光滑,但是当扫描速率太低时,模板又很难被去除,而在生长速率较高时电极表面粗糙、多孔,这又降低了电极的选择性。本研究选择电化学扫描速率为50 mV/s。
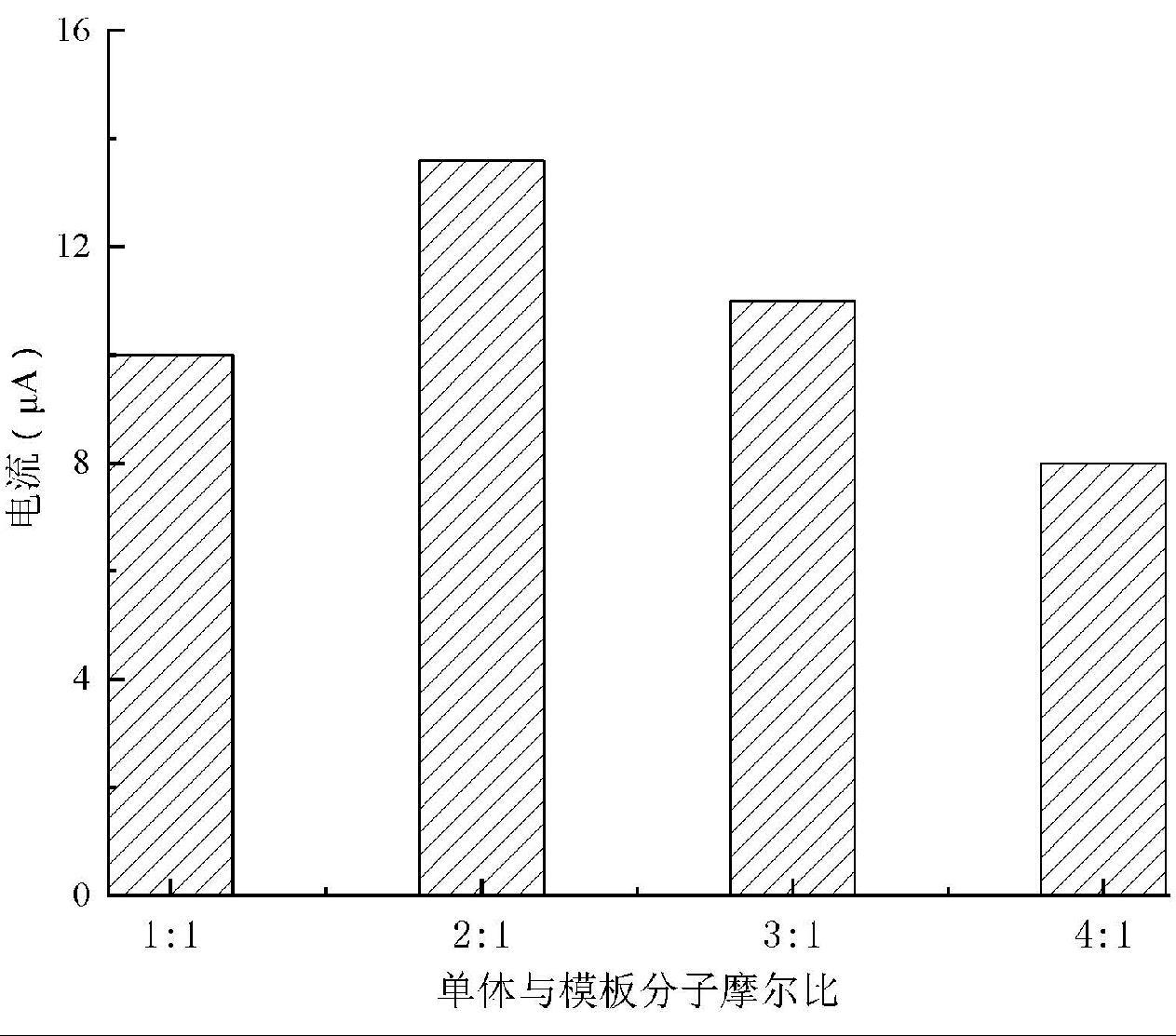
图5 功能单体与模板分子摩尔比对CV峰电流的影响
Fig.5 Effect of the ratio of monomer to template molecule on the peak current of the CV response
MIP膜的厚度会影响HA分子的嵌入量,进而影响传感器的灵敏度,而电聚合循环次数可以调节印迹聚合物膜的厚度。一般来讲,随着印迹膜厚度的增加,印迹位点的数量增加。然而,如果膜太厚,则HA分子又很难进入位于中心区域的印迹位点,因为HA分子具有很高的传质阻力。因此,较厚的印迹膜位点可达性和结合能力均较差,从而导致峰值电流较低。如图6所示,可观察到峰值电流随着扫描圈数的增加迅速增加,并在20个循环中达到最大值,然后在更高的循环中降低。因此,本研究选择扫描20个周期,以获得最高的灵敏度。
利用模板分子HA和邻苯二胺单体,通过电聚合反应,在玻碳电极表面反应生成一个对HA有特异性吸附的薄膜,获得HA的分子印迹传感器,并通过实验获得了制备最优化条件:单体与模板分子浓度比例为2∶1,电化学聚合扫描速率为50 mV/s,电化学聚合圈数为20圈,洗脱时间20 min,吸附时间20 min。
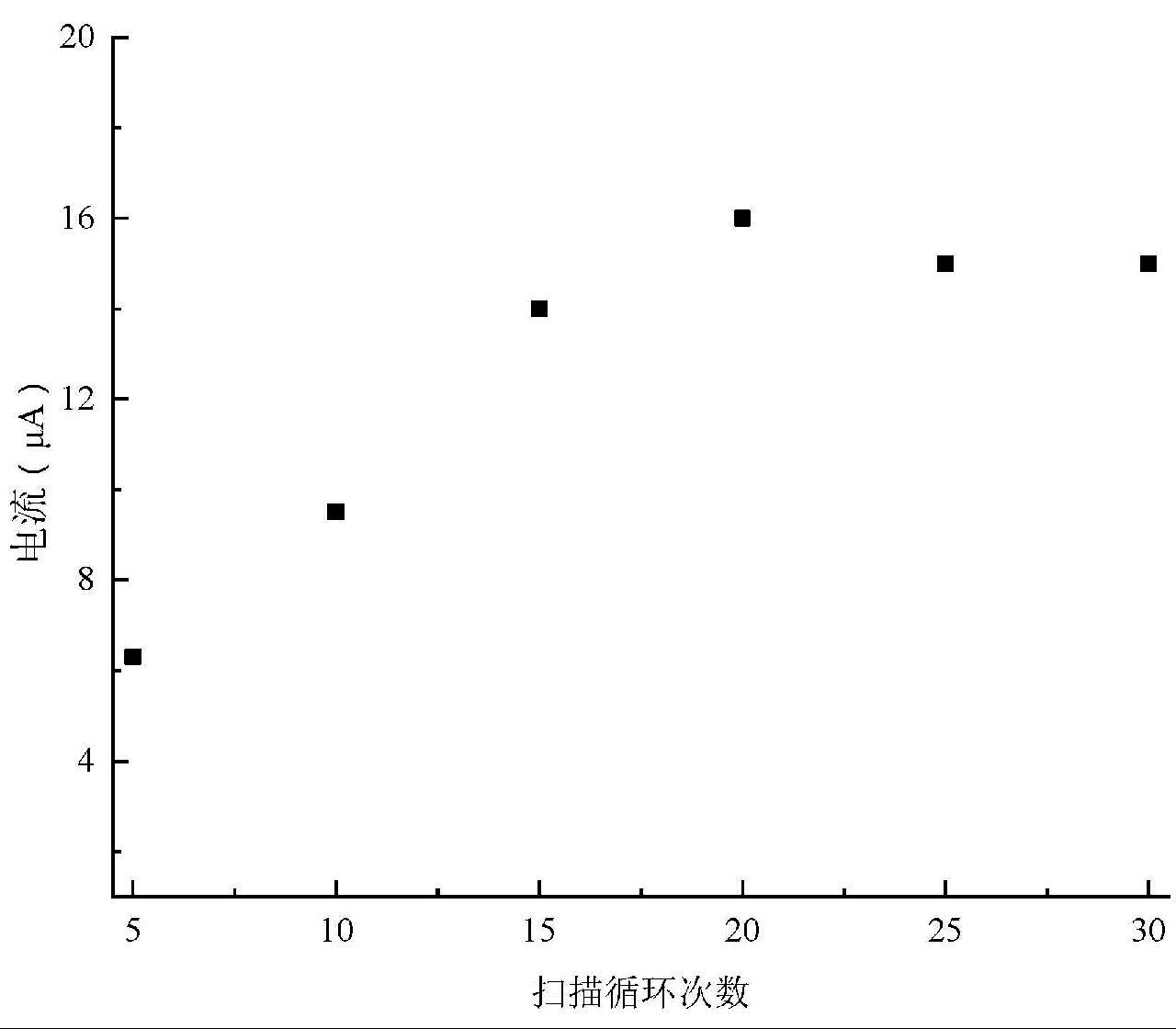
图6 扫描周期对CV峰电流的影响
Fig.6 Effect of the electropolymerization cycles on the peak current of the CV response
2.6 分子印迹传感器选择性
通过检测HA在色胺、酪胺、邻氯苯胺存在下的CV反应,对分子印迹传感器的选择性进行了评价。如图7所示,在MIP-GCE上,1 μmol/L的组胺物质的峰电流达到12 μA,Ru(bpy)32+的背景电流为1.78 μA;而1 mmol/L 的色胺、酪胺、邻氯苯胺的峰电流仅有2 μA左右,这说明色胺、酪胺、邻氯苯胺对组胺测定影响很小。而在NIP-GCE上,1 μmol/L的组胺和1 mmol/L的色胺、酪胺、邻氯苯胺的峰电流同样仅有2 μA左右,这说明2 μA可能只是背景电流,即使加大干扰物质的浓度,其响应电流也增大有限,这进一步说明本研究所制备的分子印迹传感器具有极好的选择性。
2.7 分子印迹传感器的重现性与稳定性
通过在相同的MIP-GCE下连续测量10 μmol/L和0.1 μmol/L HA标准溶液的CV响应来评估测量的重现性。5次连续测定的相对标准偏差(RSD)分别为4.9%、5.3%,表明该传感器在线性范围内具有较好的测定重现性。而稳定性测试结果表明,在连续测定一周后,CV扫描曲线中,氧化峰电流为初始的92%,这说明所制备的传感器具有良好的稳定性,可以在较长时间内使用。
2.8 实际样品测定与加标回收试验
在最优条件下,将修饰后的电极置于添加了Ru(bpy)32+-PBS的HA标准溶液系列中,记录不同浓度下的MIP-GCE的响应,以浓度的负对数为横坐标,峰电流为横坐标,绘制标准曲线,结果如图8所示。随着浓度的升高,峰电流趋于稳定,表明HA分子逐渐占据了印迹位点。峰电流与HA浓度对数在1.0×10-5~1.0×10-7 mol/L范围内呈线性关系;线性回归方程为I(μA) = 52.9 + 7.3×lgC(mol/L),相关系数R2 = 0.993,计算出该传感器的检出限为8.4×10-8 mol/L(LOD = 3σ/S)。
目前,间接法测定非电活性物质常采用K3[Fe(CN)6]溶液作为探针,通过探针分子的峰电流随待测溶液浓度的增大而减小的变化来建立间接循环伏安分析方法[16],但是其主要利用非电活性物质占据印迹位点后K3[Fe(CN)6]响应值降低这一现象进行检测,因此灵敏度相对较低。研究表明,胺类物质可以在电极表面被氧化,然后失去质子形成自由基,该自由基可以将Ru(bpy)33+还原得到Ru(bpy)32+*,随后产生化学发光效应[17]。从所得到的CV曲线来看,显然探针分子的峰电流随待测溶液浓度增大而增大,说明组胺的存在确实大大提高了Ru(bpy)33+的响应电流,使得检测灵敏度得到极大提升。
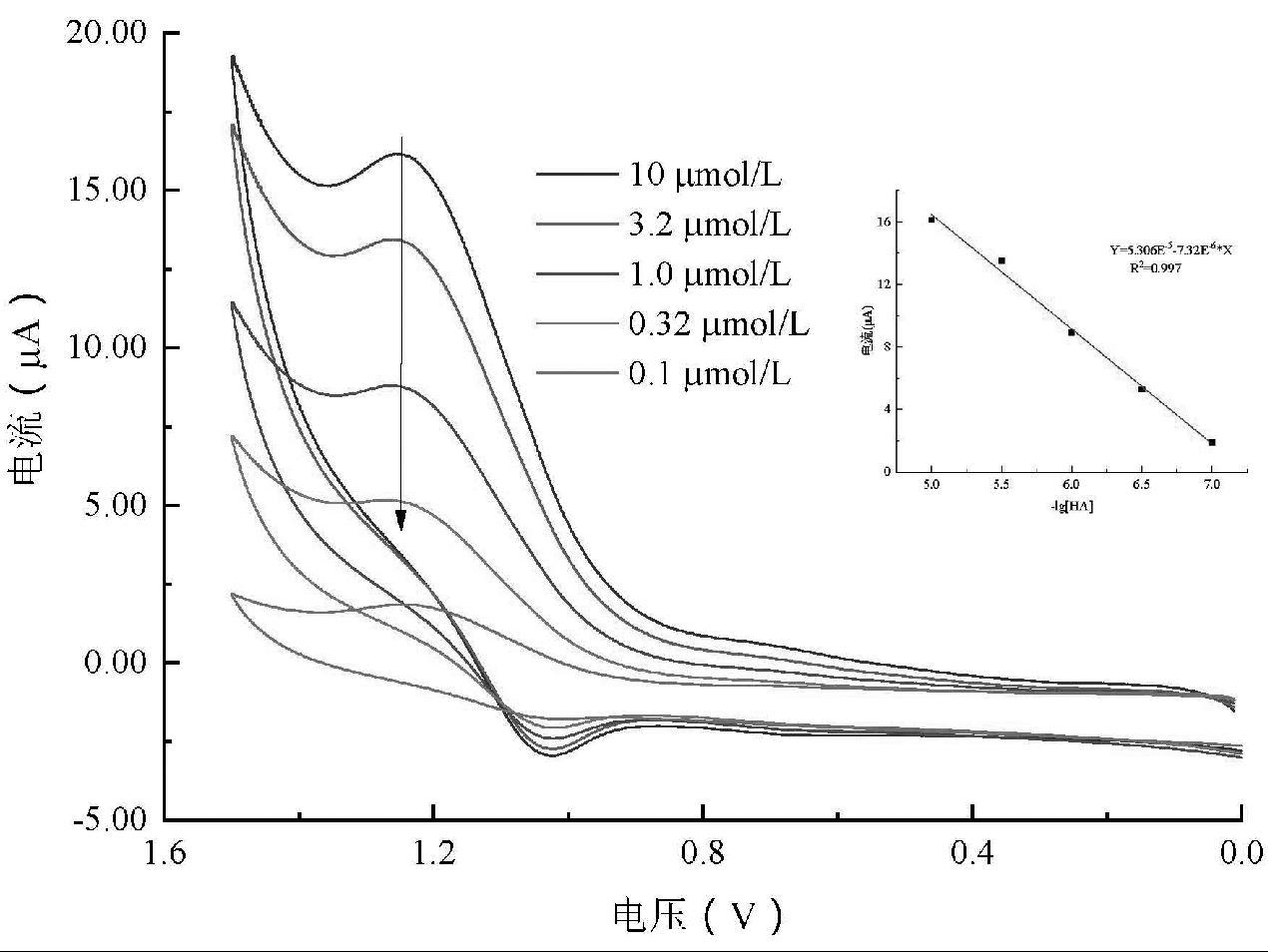
图8 HA分子印迹传感器对不同浓度组胺标准溶液的CV图(插图为标准曲线)
Fig.8 CV plots of HA molecular imprinting sensor for HA standard solutions (illustration is the standard curve)
为验证方法的准确性,在最佳条件下以所制备的邻苯二胺分子印迹传感器为工作电极,以0.1 g/L的Ru(bpy)32+为探针,以1.0 µmol/L、3.0 µmol/L和5.0 µmol/L HA为加标物,对鱼提取液、啤酒及鱼露样品进行了加标回收率试验(表1),鱼类和啤酒样品中的HA含量分别为53.4 µmol/kg(5.9 ppm)和3.21 µmol/L(0.50 ppm),均远低于美国食品药品监督管理局(FDA)所规定的50 ppm最大残留限值。其回收率在91.2%~106.6%之间,RSD值均<5%。表2比对了用本方法和GB/T 5009.208—2008《食品中生物胺含量的测定》中国标法测定的上述3种实样中组胺含量。测定结果显示:在鱼类、啤酒和鱼露样品中的HA含量分别为53.4 µmol/kg(5.9 ppm)、3.21 µmol/L(0.50 ppm)和49.96 µmol/L(50 ppm),均低于美国食品药品监督管理局(FDA)所规定的50 ppm最大残留限值,与我国国标法测定结果无显著性差异(设国标法测定结果为相对真值)。这些均表明所创建的分子印迹传感器电化学检测方法准确可靠,可应用于实际样品中组胺的测定。
表1 不同样品中组胺的加标回收率
Table 1 Recovery rates of histamine spiked in different samples
基质名称 | 加标浓度范围 (µmol/L) | 回收率 (%) | RSD (%) |
秋刀鱼提取液 | 1.0~5.0 | 91.2~104.3 | 3.5 |
啤酒 | 1.0~5.0 | 93.1~102.1 | 4.5 |
鱼露 | 1.0~5.0 | 93.0~102.6 | 3.8 |
表2 本方法和GB/T 5009.208—2008方法对不同样品中的组胺含量测定结果比较
Table 2 Comparison of histamine content determination results between the developed method and GB/T5009.208-2008 method in different samples
基质名称 | 组胺含量 (µmol/L) | |
本方法 | GB/T 5009.208—2008 | |
秋刀鱼提取液 | 5.54 | 5.58 |
啤酒 | 3.21 | 3.29 |
鱼露 | 49.96 | 52.50 |
表3比较了目前组胺常见分析方法所获得的结果,表中可见尽管本方法未能达到酶联免疫法的分析特性,但同等于或优于其他所列出分析方法,可直接应用于选择性测定水产品中的组胺含量。从选择性、重复性、稳定性和准确性等方面对所制备的分子印迹传感器的性能的评价和使用该传感器对实际样品中的HA含量进行了测定结果,表明所制备的传感器电极制备简单、省时且成本低,具有较高的灵敏度、特异性和准确性,可长期使用于水产品中组胺的检测。
3 结论
本研究以组胺为模板分子、邻苯二胺为功能单体,利用电化学聚合的方法,在玻碳电极表面制备了组胺分子印迹传感器。利用Ru(bpy)32+作为探针,借助循环伏安特性曲线,采用间接法对组胺进行电化学检测。结果表明,所构建的分子印迹传感器具有较宽的线性范围、较低的检测限,色胺、酪胺、邻氯苯胺等类似结构物质对组胺检测干扰小、准确度高,可用于不同食品基质中组胺的选择性低成本测定。
参考文献
[1] Hungerford JM. Scombroid poisoning: a review[J]. Toxicon, 2010, 56: 231.
[2] Luss LV. Use of antihistamines in a physician’s clinical practice[J]. Terapevt Arkh, 2014: 86: 106.
[3] Visciano P, Schirone M, Tofalo R, et al. Histamine poisoningand control measures in fish and fishery products[J]. Frontiers in Microbiology, 2014, 5: 500.
[4] 陈雪营, 樊静静, 宋书锋, 等. 偶氮染色-光谱法快速检测牛乳中组胺和酪胺含量[J]. 中国食品卫生杂志, 2022, 34: 943-946.
[5] 王芳, 罗敏, 陶文波, 等. 固相萃取-气相色谱法测定腌肉中5种生物胺[J]. 理化检验(化学分册), 2018, 54: 512-515.
[6] Peng JF, Fang KT, Xie DH, et al. Development of an automated on-line pre-column derivatization procedure for sensitive determination of histamine in food with high-performance liquid chromatography-fluorescence detection[J]. Journal of Chromatography A, 2008, 1209: 70-75.
[7] 姜随意, 吴业宾, 王浩, 等. 用于组胺检测的新型电化学传感技术研究[J]. 食品研究与开发, 2017, 38: 113-118.
[8] Puthongkham P, Lee ST, Venton BJ. Mechanism of histamine oxidation and electro-polymerization at carbon electrodes[J].Analytical Chemistry, 2019, 91(13): 8366-8373.
[9] TRIKKA F A, YOSHIMATSU K, YE L, et al. Molecularly imprinted polymers for histamine recognition in aqueous environment[J]. Amino Acids, 2012, 43(5): 2113-2124.
[10] 王帅帅, 朱秋劲. 组胺分子印迹聚合物中模板分子制备比例的紫外光谱学研究[J]. 中国酿造, 2016, 35(11): 149-152.
[11] 姜随意, 宁保安, 白家磊, 等. 基于分子印迹膜用于检测组胺的电化学传感器[J]. 食品研究与开发, 2014, 35(18): 73-76.
[12] 赵如静, 李瑾, 钟莲, 等. 基于纳米复合材料的新型组胺分子印迹电化学传感器的制备及性能研究[J].化工新型材料, 2023, 51(7): 276-281.
[13] 李欣培, 王秀君, 徐斐, 等. 组胺表面分子印迹聚合物的制备及其在酸奶中的应用[J]. 食品与发酵工业, 2021, 47(11): 1-7.
[14] Yang F, Xu L, Dias ACP, et al. A sensitive sandwich ELISA using a modified biotin-streptavidin amplified system for histamine detection in fish, prawn and crab[J]. Food Chemistry, 2021, 350(15): 129196.
[15] RATNANINGSIH E, KADJA GTM, PUTRI RM, et al. Molecularly Imprinted Affinity Membrane: A Review[J]. ACS Omega, 2022, 7: 23009-23026.
[16]赵玲钰, 高林, 庞军, 等. 胺菊酯分子印迹电化学传感器的制备及性能[J]. 食品科学, 2017, 38(8): 283-289.
[17] 杨洋, 孙世国, 刘凤玉, 等. 三联吡啶钌电化学发光机理及改善其强度的途径[J]. 化学通报, 2009(9): 768-775.
[18] Kim K Y, Kwon H J, Cho S H, et al. Development and validation of a highly sensitive LC-MS/MS method for in vitro measurement of histamine concentration[J]. Journal of Pharmaceutical and Biomedical Analysis, 2019: 172: 33-41.
[19] Šimat V, Dalgaard P. Use of small diameter column particles to enhance HPLC determination of histamine and other biogenic amines in seafood[J]. LWT-Food Science and Technology, 2011, 44(2): 399-406.
[20] Antoine FR, Wei CI, Otwell WS,et al. Gas chromatographic analysis of histamine in mahi-mahi (Coryphaena hippurus) [J]. Journal of Agricultural and Food Chemistry, 2002, 50(17): 4754-4759.
[21] Kounnoun A, Louajri A, Cacciola F, et al. Development and validation of a TLC-densitometry method for histamine monitoring in fish and fishery products[J]. Molecules, 2020, 25(16): 3611.
[22] Cao D, Xu X, Feng X, et al. Designed multifunctional visual observation of magnetic ionic liquid coupling with microwave-assisted derivatization for determination of biogenic amines[J]. Food Chemistry, 2020, 333: 127518.
[23] Lv R, Huang X, Dai C, et al. A rapid colorimetric sensing unit for histamine content of mackerel using azo reagent[J]. Journal of Food Process Engineering, 2019, 42(5): e13099.
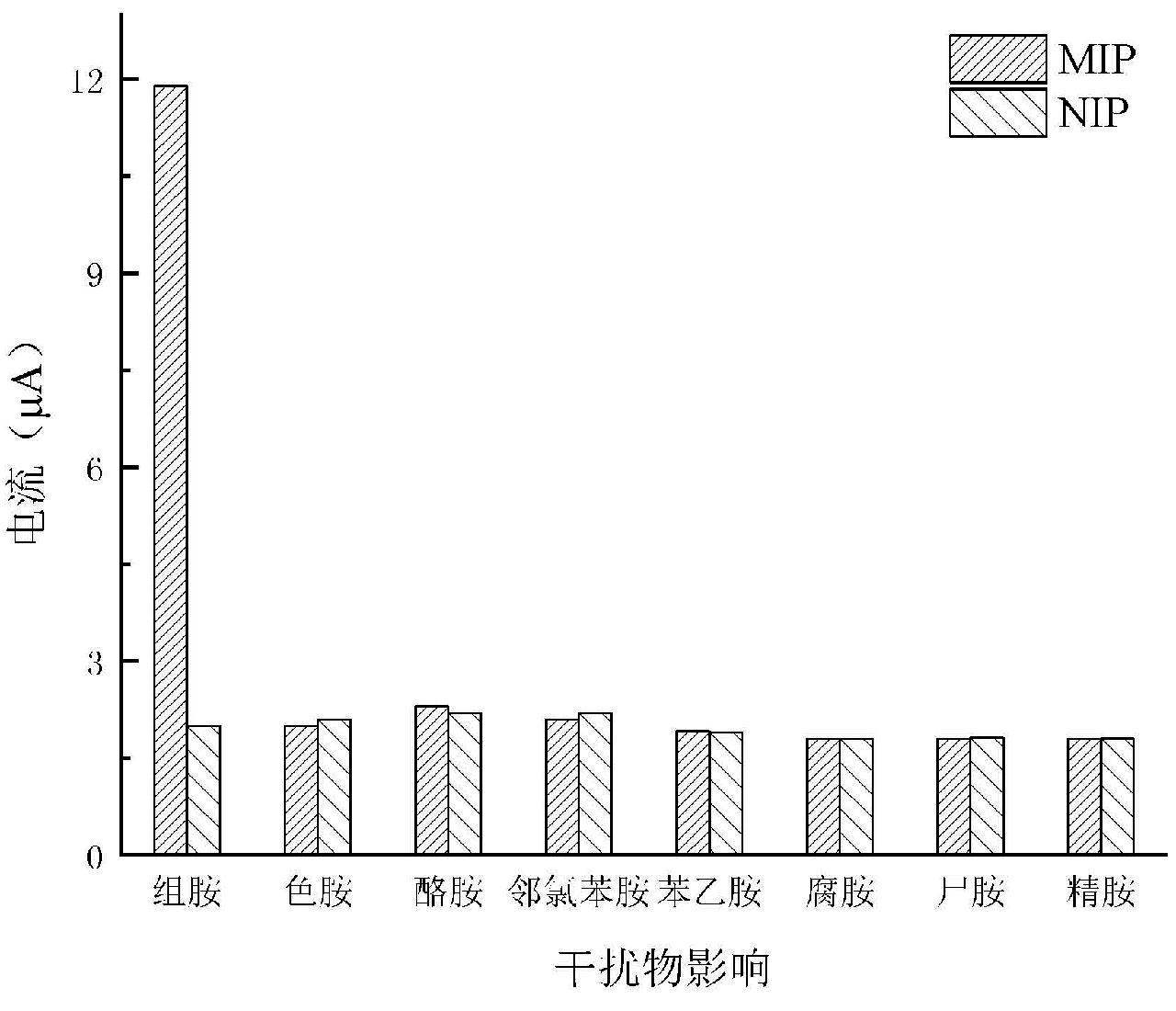
图7 MIP-GCE与NIP-GCE对食品中常见有机胺的电流响应
Fig.7 Current responses of MIP-GCE and NIP-GCE to common organic amines in food
表3 不同组胺检测方法的比较
Table 3 Comparison of the proposed assay for histamine detection with other methods
检测方法 | 线性范围 | 检出限 | 参考文献 |
液相色谱-质谱 | 0.1~100 µg/L | 0.1 µg/L | [18] |
液相色谱 | 0.5~100 mg/L | 0.3 mg/kg | [19] |
气相色谱 | 100~1000 mg/kg | 7 mg/kg | [20] |
薄层层析 | 6.25~100 mg/kg | 4.4 mg/kg | [21] |
MIL-DLLMEa | 5~500 µg/L | 0.88 µg/L | [22] |
分光光度法 | 20~120 mg/L | 20 mg/L | [23] |
酶联免疫 | 1.2~3.4 µg/L | 1.2 µg/L | [14] |
分子印迹传感器 | 11.1~111 µg/L | 9.4 µg/L | 本文 |
注: a MIL-DLLME为磁性离子液体耦合分散液-液微萃取







