CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
核酸气溶胶清除仪器验证与综合评价
作者:任宇捷 孔维恒 费永亮 杨菲 孟庆建 邱烨 刘鑫 王艺凯
任宇捷 孔维恒 费永亮 杨菲 孟庆建 邱烨 刘鑫 王艺凯
摘 要 基于聚合酶链式反应技术的核酸检测因其优异的特异性、灵敏度和相对便捷的操作而被广泛应用于人类及动物疫病筛查等体外诊断领域,但实验环境中极其微量的核酸污染有可能导致假阳性问题,影响检测准确性。彻底清除实验环境中的核酸片段残留,能够有效减少假阳性检测结果的出现。本研究旨在提出一种核酸气溶胶清除设备的验证与综合评价方案,通过人为模拟制造核酸气溶胶污染环境,以实时荧光定量PCR(Real-Time Quantitative Fluorescence Polymerase Chain Reaction,RT-PCR)技术检测某种市售核酸气溶胶清除仪清除前后相关核酸检测循环数阈值(Cycle Threshold,Ct)的差异,以评估仪器的核酸清除效果。结果显示,0.5 h、1 h和过夜清除后Ct值均显著下降,表明该核酸气溶胶清除仪能够满足实验室核酸清除要求,且过夜清除后Ct值为40.00及以上,表明过夜清除能更高效地清除空气中的气溶胶。本研究为核酸气溶胶清除仪的性能验证与综合评价提供了技术方法,为核酸分子生物学实验室的日常核酸污染清除提供了解决方案。
关键词 核酸检测;核酸污染;假阳性;核酸气溶胶清除仪
Study of Nucleic Acid Aerosol Scavenger Performance Evaluation Method
REN Yu-Jie1 KONG Wei-Heng1 FEI Yong-Liang2 YANG Fei1
MENG Qing-Jian3 QIU Ye1 LIU Xin1 WANG Yi-Kai1*
Abstract Nucleic acid testing based on Polymerase Chain Reaction (PCR) technology is widely used in vitro diagnostics, such as human and animal disease screening, due to its excellent specificity, sensitivity, and relatively convenient operation. However, even extremely small amounts of nucleic acid contamination may lead to false-positive problems, thereby compromising test accuracy. Thorough removal of residual nucleic acid fragments from the experimental environment can effectively reduce the occurrence of false-positive test results. This study proposes a validation and comprehensive evaluation scheme for nucleic acid aerosol pollution removal devices. By artificially simulating nucleic acid aerosol contamination, this study employed Real-Time Quantitative Polymer Chain Reaction (RT-PCR) technology to detect the differences in Cycle Threshold (Ct) values before and after the use of a commercially available nucleic acid aerosol clearance instrument. The results indicated that Ct values significantly decreased after 0.5 hours, 1 hour, and overnight clearance, suggesting that the instrument meets laboratory requirements for nucleic acid clearance. Notably, the Ct value reached 40.00 or higher after overnight clearance, indicating that overnight clearance can more effectively eliminate airborne aerosols. This study provides a technical method for the performance verification and comprehensive evaluation of nucleic acid aerosol removal devices, and provides a solution for daily nucleic acid contamination removal in molecular testing laboratories.
Keywords nucleic acid detection; nucleic acid contamination; false-positive; nucleic acid aerosol cleaning device
基金项目:海关总署科研项目(2023HK141)
第一作者:任宇捷(1994—),女,汉族,博士,工程师,主要从事海关仪器研发与验证评价工作,E-mail: renyujie168@163.com
通信作者:王艺凯(1982—),男,汉族,硕士,高级工程师,主要从事海关仪器研发与验证评价工作,E-mail: wangyikai_2001@163.com
1. 中国海关科学技术研究中心 北京 100026
2. 海关总署(北京)国际旅行卫生保健中心 北京 100023
3. 无锡百泰克生物技术有限公司 无锡 214000
1. China Customs Science and Technology Research Center, Beijing 100026
2. International Travel Health Care Center, General Administration of Customs (Beijing), Beijing 100023
3. BioTeke Corporation(wuxi) Co., Ltd., Wuxi 214000
聚合酶链式反应(Polymerase Chain Reaction,PCR)于1985年由美国Kary Mullis博士提出[1]。PCR是一种在体外模拟DNA复制的扩增技术,基础反应过程分为三步:DNA双链在高温条件下变性解链;引物与单链DNA结合;DNA聚合酶在引物引导下合成一条互补DNA链。通过40次左右的循环扩增,可将目的片段的数量放大几百万倍[2-3]。由于基于PCR技术的核酸检测具有灵敏度高、特异性强、检测方便、耗时短等优点,被广泛应用于人类及动物疫病筛查等领域 [4-7]。
在核酸检测技术的推广应用中,分子生物学实验室常常受到假阳性结果的困扰[8-10],不仅给实验室工作带来了额外的负担,还可能导致医疗资源的浪费。实时荧光定量PCR(Real-time Quantitative Fluorescence Polymerase Chain Reaction,RT-PCR)技术作为核酸分子检测的主流方法,虽然采用了闭管式检测方式,但由于核酸检测涉及样本加样、核酸提取、体系配制、扩增等多个步骤,任何一个环节的不规范操作和意外情况,都可能导致实验过程中产生的核酸气溶胶附着在实验台面、仪器表面、人员衣物等介质上,导致假阳性结果,并对实验人员造成健康威胁,如引起呼吸道感染等。目前,分子生物学实验室对于假阳性结果的预防主要依赖于物理隔离,如严格划分实验区域、设置梯度负压及缓冲间、分装使用试剂等[11-12]。然而,一旦产生污染,传统的处理方式如更换试剂和耗材、紫外灯消毒以及酒精或84消毒液喷洒等只能缓解污染较轻区域的部分污染,不能从根源处将实验环境中的核酸片段彻底消除,假阳性现象仍然时有发生[13]。在此背景下,市面上涌现出多种核酸气溶胶污染清除仪器及其配套清除剂。
核酸气溶胶污染清除仪通过超声物化技术将液态核酸清除剂雾化为颗粒直径为微米级别的干雾颗粒。这些干雾颗粒体积小,在空气中受自身重力影响极其微弱,空气阻力与自身重力相互平衡,在受到空气中其他分子撞击时,可做类似分子的无规则布朗运动,能够在整个空间迅速弥散。当核酸清除剂被释放至空气中后,会迅速与O2发生氧化反应,形成具有高度活性的羟基自由基(-OH),可以切割核酸分子碳骨架之间的磷酸二酯键[14-15],从而降解并清除空气中的核酸污染物。由于干雾形式的核酸清除剂可以长时间悬浮并保持活性,因此能够对空气中的核酸气溶胶起到较长时间的清除。尽管依据上述原理,核酸气溶胶污染清除仪理论上具有高效的核酸清除作用,但分子生物学实验室设备布局和设施环境复杂多样,市面上的仪器性能参差不齐。因此,建立一套科学而系统的核酸气溶胶污染清除仪验证与综合评价体系,对于分子生物学实验室筛选优质核酸气溶胶污染清除仪、促进设备制造商产品优化升级具有重要意义。
本研究选取了一种具有代表性的市售核酸气溶胶污染清除仪及其配套核酸清除剂,旨在从易用性、可拓展性及核酸清除能力等方面,全面评估该设备在不同使用参数条件下对分子生物学实验室环境中核酸气溶胶的清除能力,验证其是否能够满足分子生物学实验室对假阳性现象的控制需求,从而构建核酸气溶胶污染清除仪验证与综合评价方案,为后续相关仪器的验证与综合评价提供参考,以及为分子生物学实验室筛选优质核酸气溶胶污染清除仪、防控核酸气溶胶污染提供新方案。
1 实验设计
1.1 设备与试剂
微生物气溶胶发生器(型号:TK-3)(常州市国旺仪器制造有限公司);核酸气溶胶污染清除仪(型号:NC1001)(无锡百泰克生物技术有限公司);实时荧光定量PCR仪(型号:CFX96 Touch Real-Time PCR Detection System)(伯乐生命医学产品(上海)有限公司)。
高特异性qPCR试剂TB Green® Premix Ex Taq™(货号:RR820Q)(Takara公司);DNase/RNase-Free Deionized Water(货号:A57775)(Thermo Scientific™公司;PUC57-RV质粒扩增引物(扩增产物大小约130 bp)(Invitrogen™公司);核酸清除剂(货号:R0127)(碧云天公司)。
1.2 检测方法
1.2.1 核酸气溶胶清除仪性能验证评价
基本运行指标:对外观、易用性、可扩展性等综合指标进行系统评价。
关键性能指标:空气中核酸气溶胶含量要求清除前后∆∆Ct≥ 3.3;物表核酸气溶胶含量要求清除前后∆∆Ct≥ 3.3。
1.2.2 核酸清除剂效果验证
按照表1配制实时荧光定量PCR反应混合液。
表1 实时荧光定量PCR反应混合液配方(20 μL体系)
Table 1 Formula for real-time quantitative fluorescence PCR reaction mixture (20 μL System)
反应体系组分名称 | 用量 (µL) |
TB Green® Premix Ex Taq™ (2×) | 10.0 |
ROX Reference DyeⅡ (50×) | 0.4 |
上游引物 (F) | 0.4 |
下游引物 (R) | 0.4 |
核酸模板 | 2.0 |
去离子水 | 6.8 |
总体积 (Total) | 20.0 |
按照表2程序进行实时荧光定量PCR反应。
吸取扩增产物10 μL,用去离子水稀释100倍。将稀释后的扩增产物以10∶1的比例和核酸清除剂混合,混匀后室温静置0 min、15 min、30 min、45 min。对照组用去离子水替代核酸清除剂。混合液静置至指定时间后,立刻进行实时荧光定量PCR反应。实验中每个反应进行3次重复。
表2 实时荧光定量PCR反应程序
Table 2 Real-time quantitative fluorescence PCR reaction protocol
温度 (℃) | 时间 (s) | 循环圈数 (圈) |
95 | 10 | 1 |
95 | 5 | 40 |
60 | 20 | |
4 | 永久 | — |
注: “—”表示无
1.2.3 对模拟核酸气溶胶的清除效果检测
(1)模拟核酸气溶胶污染制备。吸取扩增后核酸产物10 μL,用去离子水稀释1000倍,放入微生物气溶胶发生器中。将微生物气溶胶发生器置于右仓气雾室,将气雾室所有门关闭。把两个20 m³气雾室(一个进行试验,一个做对照)内的温度和相对湿度调至相同,关闭气雾室通风系统,启动电源开关,用微生物气溶胶发生器同时向两个气雾室喷洒核酸产物20 min。喷洒的同时打开搅拌器开关。喷洒结束后,将装有1 mL去离子水的离心管放在房间低、中、高3个高度(地面处、距离地面0.5 m处、距离地面1.0 m处),每个高度设置3个采样点,用空气沉降法对空气中的核酸气溶胶进行采样,采样时间1 h。空气采样结束后,在木质桌面表面,用规格板标出10块面积为25 cm2的区域,每2个区域彼此相邻,共5组区域。用一次性采样棉签在5个物表区域涂抹采样,横竖往返各8次。将样本棉签分别加入1 mL去离子水中震荡20 s。
(2)实验室气溶胶清洁。用空气净化消毒器将核酸清除剂喷洒于20 m³右仓气雾室中,喷洒量为10 mL/m³,喷洒时间60 min。喷洒结束后,机器回收核酸清除剂,回收时间90 min。在左仓气雾室,用纯水取代核酸清除剂作为对照组。使用同型号空气净化消毒器在左仓喷洒纯水,对照组纯水喷洒量、喷洒时间、回收时间和实验组相同。
(3)清洁后采样。回收时间结束后,将装有1 mL去离子水的离心管放在房间低、中、高3个高度(地面处、距离地面0.5 m处、距离地面1.0 m处),每个高度设置3个采样点,用空气沉降法对空气中,核酸气溶胶进行采样,采样时间1 h。空气采样结束后,在木质桌面表面,用一次性采样棉签在对应的5个物表区域涂抹采样,横竖往返各8次。将样本棉签分别加入1 mL去离子水中震荡20 s。
(4)按实时荧光定量PCR扩增体系检测上述样本。
1.2.4 不同清除时间对模拟核酸气溶胶的清除效果检测
(1)模拟核酸气溶胶污染制备。同1.2.3操作步骤(1)。
(2)实验室气溶胶清洁。同1.2.3操作步骤(2),喷洒消毒时间为30 min。
(3)清洁后采样。同1.2.3操作步骤(3)。
(4)按实时荧光定量PCR扩增体系检测上述样本。同1.2.3操作步骤(4)。
(5)重复进行,同1.2.3操作步骤(2),喷洒时间改为60 min,回收时间90 min,其余步骤不变。
(6)再次重复,同1.2.3操作步骤(2),喷洒时间及回收时间设置为0,房间过夜消毒,核酸清除剂自然沉降后再次采样。
2 验证和评价结果
2.1 易用性评价
2.1.1 设备外观
该核酸气溶胶清除仪器外观平整,表面颜色均匀,且无伤痕、划痕等缺陷;设备表面标记、标识清晰、牢固;设备显示屏显示直观、醒目,无缺字等现象。
2.1.2 设备操作性
该设备操作简单,能够对常用程序设置快捷方式,可以直接在主界面选择,无需查找;程序参数“消毒时间”“体积”“用量”等均在一个界面,无须反复进行界面切换;清除完成后会出现提示窗口。
2.1.3 人工介入情况
设备运行前需人工手动加入核酸清除试剂,清除完成后需人工关闭设备,整体而言人工介入程度较低。
2.1.4 设备维修保养情况
设备启动时会进行系统自检,发生故障时会进行提示,容易定位问题原因,易于维修保养。
2.1.5 设备结果可追溯性
试验操作人员、试验起止时间有记录,使得试验具有可追溯性。
总体而言,综合上述几项验证指标,符合设备易用的预期需求。
2.2 可扩展性评价
试验时可根据实验目的修改仪器中试剂添加参数;实验数据可经U盘导出;可通过遥控器对设备进行远程控制。总体而言,用户可根据具体使用要求自定义编辑仪器参数、进行数据管理及远程控制,设备可拓展性较强。
2.3 核酸清除效果验证
为了测试核酸气溶胶清除剂对核酸的清除作用,本研究测试了不同处理时间对模拟核酸气溶胶的清除效果。通过图1的扩增曲线可知,核酸清除剂与核酸混合后,实验组扩增曲线相较对照组明显滞后,ΔCt为10.51,表明核酸清除剂具有降解核酸的能力。经过核酸清除剂分别处理15 min、30 min和45 min处理后,实验组Ct值相较对照组出现更明显的滞后,ΔCt分别为32.07、33.02和33.79,表明随着核酸清除剂作用时间的延长,核酸片段被降解得更加彻底,在45 min处理的实验组中,Ct值达到40.00,且扩增曲线未出现扩增信号,表明体系中残留的核酸已低于实时荧光PCR检测体系的最低限度。因此,实验说明核酸清除剂具有快速降解核酸的能力。
2.4 对模拟核酸气溶胶的清除结果
本研究分别检测了核酸气溶胶清除仪器对空气中和物体表面核酸气溶胶污染的清除效果。用空气沉降法采集空气中的核酸气溶胶,使用实时荧光定量PCR试验检测核酸气溶胶清除仪器清除核酸扩增产物气溶胶污染的效果,试验结果见表3。采集物体表面的核酸气溶胶,使用实时荧光定量PCR试验检测核酸气溶胶清除仪器清除核酸扩增产物气溶胶污染的效果,试验结果见表4。
结果显示,清除处理0.5 h、1 h和过夜清除后,实验组和对照组3个采样地点(地面处、离地0.5 m处、离地1 m处)的核酸含量均下降,表现为清除前后实时荧光定量PCR试验Ct值增大。且核酸清除仪喷洒处理1 h,空气中核酸气溶胶的ΔΔCt为6.42,远高于预期标准3.3。假设PCR的扩增效率为100%,则处理1 h,空气中核酸片段清除效率可达98.83%;物体表面的ΔΔCt为6.05,清除效率约为98.50%,略低于空气核酸清除效率。随着实验组处理时间的延长,ΔΔCt整体呈增大趋势。针对空气中悬浮的初始浓度约为Ct值30的气溶胶污染,过夜清除后,荧光PCR结果显示Ct值均为40.00,已经超出本次实验的检测极限,未检测到扩增的荧光信号,因此清除效率可达到预期。物体表面的污染初始Ct值约为27,相比于空气中的核酸浓度更高,过夜清除可达到99.4%。
3 讨论
核酸气溶胶污染是分子生物学实验室中极易被忽视但又极具危害性的污染源,常造成假阳性结果[8,16]。核酸气溶胶消除仪器能够通过高效的雾化技术和特定的化学消毒剂或清除剂,实现对分子生物学实验室环境中核酸气溶胶污染的高效清除。本研究选取一种市售核酸气溶胶清除仪,从易用性和可拓展性等基本性能与核酸清除效果等方面对其进行验证与评价,以期全面了解其性能特点,制定针对核酸气溶胶清除仪器的性能验评方案,为分子生物学实验室选择合适的污染防控设备和相关设备产品的优化升级提供参考依据。
对设备易用性和可拓展性等基本性能进行验证与评价,结果显示:(1)参数设置方便,仅需人工输入房间体积、试剂单位体积用量、消毒时间和回收时间4个参数即可进行自动化工作;(2)设备能够根据设置的参数智能化计算核酸清除剂的使用量;(3)具备液位探测功能,若现有试剂量低于实际清除需要量,会报警提示补充试剂量,避免清除过程的不必要中断;(4)具备远程控制功能和预约功能,无须人员进入现场,方便使用;(5)设备清除剂装载量较大,喷雾速度较快,可以适应较大实验空间的清除需求。
对设备核酸清除效果进行验证与评价,结果显示:使用该仪器进行0.5 h、1 h和过夜清除,均可清除空气中或物体表面的核酸残留,一般程度的核酸污染(Ct值≥33.00)经过夜清除后,清除效率显著增强(Ct值≥40.00),符合预期要求,表明该仪器有助于分子生物学实验室应对不明原因所致的假阳性污染,提高核酸检测效率。
综上所述,本研究通过对某市售核酸气溶胶清除仪的易用性、可扩展性及核酸清除效果进行评价与验证,表明该设备操作便捷、自动化和智能化程度高,能够满足分子生物学实验室的核酸清除需求。本研究为核酸气溶胶清除设备的性能验证与综合评价方法提供了全面而系统的技术参考,并探讨了其在公共卫生、实验室安全及生物安全防护领域的应用潜力,为后续相关仪器的研发、测试及评估工作奠定了基础。
参考文献
[1] Mullis K B. Process for amplifying nucleic acid sequences: U.S. Patent US4683195A[P]. 1987.
[2] Saiki R K, Gelfand D H, Stoffel S, et al. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase[J]. Science, 1988, 239(4839): 487-491.
[3] Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): 2002-2007.
[4] Yang J, Qi X M, Wu Y G. The application analysis of multiplex real-time polymerase chain reaction assays for detection of pathogenic bacterium in peritoneal dialysis-associated peritonitis[J]. Blood Purification, 2019, 47(4): 337-345.
[5] Denis J A, Perrier A, Nectoux J, et al. Development of molecular analysis by digital PCR for clinical practice: Positioning, current applications and perspectives[J]. Annales de Biologie Clinique, 2019, 77(6): 619-637.
[6] Yücesan B. Molecular Models of Toxoplasma gondii in Humans and Animals[J]. Turkiye Parazitol Derg, 2024, 48(2): 128-132.
[7] Pusterla N, Dorman D C, Burgess B A, et al. Viremia and nasal shedding for the diagnosis of equine herpesvirus-1 infection in domesticated horses[J]. Journal of Veterinary Internal Medicine, 2024, 38(3): 1765-1791.
[8] Aslanzadeh J. Preventing PCR amplification carryover contamination in a clinical laboratory[J]. Annals of Clinical & Laboratory Science, 2004, 34(4): 389-396.
[9] Esteve C, Catherine F X, Chavanet P, et al. How should a positive PCR test result for COVID-19 in an asymptomatic individual be interpreted and managed[J]. Medecine Maladies Infectieuses, 2020, 50(8):633-638.
[10] Wernike K, Keller M, Conraths F J, et al. Pitfalls in SARS-CoV-2 PCR diagnostics[J]. Transboundary and Emerging Diseases, 2021, 68(2): 253-257.
[11] 中国疾病预防控制中心. 全国艾滋病检测技术规范 (2015年修订版)[J]. 中国病毒病杂志, 2016, 6(6): 401-427.
[12] Hirschhorn J W, Avery A, Schandl C A. Managing a PCR Contamination Event in a Molecular Pathology Laboratory[J]. Methods in Molecular Biology, 2023, 2621: 15-26.
[13] Park K, Lee J. Dealing with carryover contamination in PCR: an enzymatic strategy[J]. CSH Protocols, 2006(1): 4092.
[14] Cadet J, Douki T, Ravanat J L. Oxidatively generated damage to the guanine moiety of DNA: mechanistic aspects and formation in cells[J]. Accounts of Chemical Research, 2008, 41(8): 1075-1083.
[15] Henle E S, Linn S. Formation, prevention, and repair of DNA damage by iron/hydrogen peroxide[J]. Journal of Biological Inorganic Chemistry, 1997, 272(31): 19095-19098.
[16] Yang S, Rothman R E. PCR-based diagnostics for infectious diseases: uses, limitations, and future applications in acute-care settings[J]. Lancet Infectious Diseases, 2004, 4(6): 337-348.
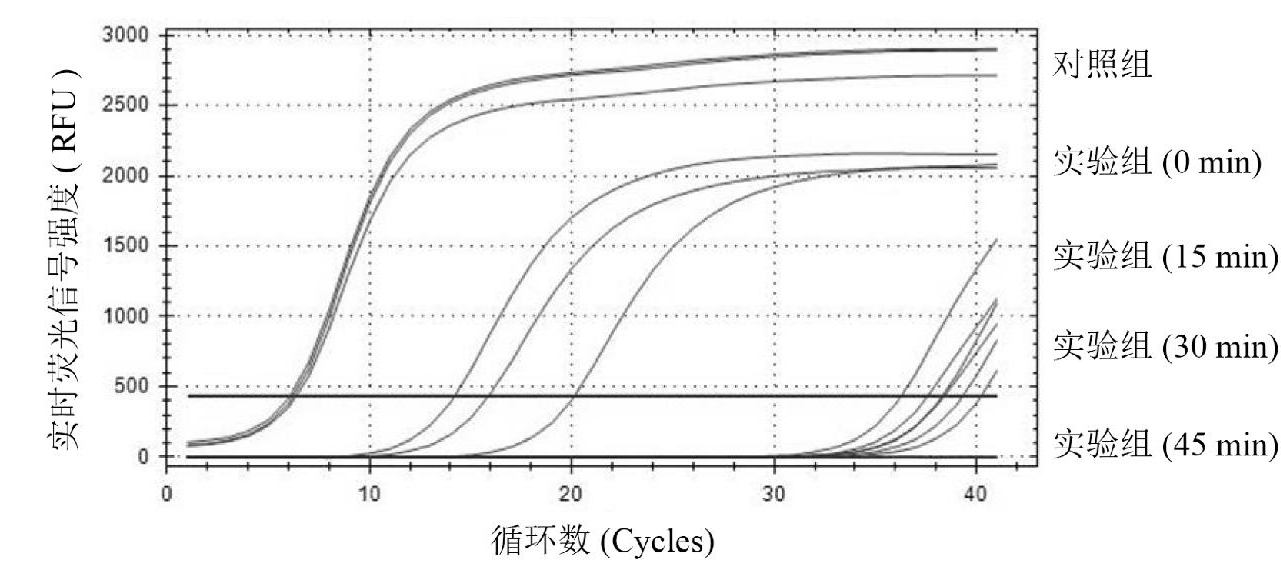
图1 核酸清除剂不同处理时间下实时荧光定量PCR扩增曲线
Fig.1 Real time fluorescence quantitative PCR amplification curves under different treatment times with nucleic acid scavengers
表3 核酸气溶胶清除仪器不同处理时间对空气中核酸气溶胶的清除效果(Ct值)
Table 3 Removal efficiency of nucleic acid aerosols in air
(Ct value) using different treatment times with the aerosol clearance instrument
采样位置 | 清除0.5 h | 清除1 h | 过夜清除 | |||||||||||
清除前 | 清除后 | 清除前 | 清除后 | 清除前 | 清除后 | 清除前 | 清除后 | 清除前 | 清除后 | 清除前 | 清除后 | |||
地面 | 30.84 | 40.00 | 29.90 | 34.10 | 29.10 | 37.14 | 30.14 | 32.64 | 30.22 | 40.00 | 29.88 | 34.42 | ||
29.81 | 40.00 | 29.79 | 35.59 | 29.03 | 39.58 | 29.04 | 33.01 | 29.35 | 40.00 | 30.33 | 34.03 | |||
29.72 | 37.43 | 29.40 | 33.56 | 28.97 | 40.00 | 29.77 | 33.02 | 29.92 | 40.00 | 30.45 | 35.04 | |||
离地0.5 m处 | 29.39 | 39.56 | 29.36 | 32.70 | 29.02 | 40.00 | 28.57 | 33.04 | 30.18 | 40.00 | 30.16 | 33.07 | ||
29.68 | 36.51 | 29.72 | 33.46 | 28.82 | 40.00 | 29.88 | 32.47 | 30.14 | 40.00 | 29.60 | 33.87 | |||
29.58 | 38.13 | 30.25 | 34.52 | 28.56 | 37.15 | 29.54 | 34.30 | 29.50 | 40.00 | 30.41 | 33.29 | |||
离地1.0 m处 | 29.53 | 38.01 | 30.73 | 34.34 | 29.00 | 38.56 | 29.68 | 34.64 | 30.46 | 40.00 | 30.74 | 34.12 | ||
30.41 | 40.00 | 29.68 | 34.74 | 29.61 | 40.00 | 29.77 | 32.80 | 30.95 | 40.00 | 29.63 | 34.53 | |||
29.98 | 37.85 | 30.83 | 36.95 | 29.27 | 39.96 | 30.08 | 33.77 | 30.27 | 40.00 | 31.46 | 35.02 | |||
Ct平均值 | 29.88 | 38.61 | 29.96 | 34.44 | 29.04 | 39.15 | 29.61 | 33.30 | 30.11 | 40.00 | 30.30 | 34.15 | ||
ΔCt | 8.73 | 4.48 | 10.11 | 3.69 | 9.89 | 3.85 | ||||||||
ΔΔCt | 4.25 | 6.42 | 6.04 | |||||||||||
注: ΔCt = (Ct清除后-Ct清除前); ΔΔCt =ΔCt实验组-ΔCt对照组
表4 核酸气溶胶清除仪器不同处理时间对物体表面核酸气溶胶的清除效果(Ct值)
Table 4 Removal efficiency of nucleic acid aerosols on surfaces (Ct value) using different treatment times with the aerosol clearance instrument
采样位置 | 清除0.5 h | 清除1 h | 过夜清除 | |||||||||||
清除前 | 清除后 | 清除前 | 清除后 | 清除前 | 清除后 | 清除前 | 清除后 | 清除前 | 清除后 | 清除前 | 清除后 | |||
物体表面 | 26.54 | 33.96 | 27.23 | 29.70 | 25.57 | 35.14 | 27.13 | 28.64 | 27.00 | 35.73 | 27.47 | 30.15 | ||
27.42 | 33.67 | 26.50 | 30.65 | 26.20 | 36.17 | 26.95 | 29.40 | 28.65 | 36.95 | 28.30 | 28.89 | |||
26.92 | 33.45 | 28.24 | 29.74 | 27.80 | 34.25 | 26.99 | 29.35 | 28.19 | 40.00 | 27.25 | 29.26 | |||
26.82 | 34.77 | 27.15 | 31.17 | 26.25 | 34.06 | 26.73 | 30.01 | 27.01 | 35.61 | 27.31 | 28.62 | |||
26.86 | 32.93 | 27.64 | 30.05 | 26.48 | 35.29 | 26.68 | 29.44 | 27.17 | 35.42 | 27.34 | 29.49 | |||
Ct平均值 | 26.91 | 33.76 | 27.35 | 30.26 | 26.46 | 34.98 | 26.90 | 29.37 | 27.6 | 36.74 | 27.53 | 29.28 | ||
ΔCt | 6.84 | 2.91 | 8.52 | 2.47 | 9.14 | 1.75 | ||||||||
ΔΔCt | 3.93 | 6.05 | 7.39 | |||||||||||
注: ΔCt = (Ct清除后-Ct清除前); ΔΔCt = ΔCt实验组-ΔCt对照组







