CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
基于UHPLC-MS/MS的红肉猕猴桃中花色素检测方法研究
作者:董莹 陈子凡 王国胜 池少铃 谢珊珊 郑少锋 张南峰
董莹 陈子凡 王国胜 池少铃 谢珊珊 郑少锋 张南峰
董 莹 1,2 陈子凡 3 王国胜 4 池少铃 5 谢珊珊 6 郑少锋 1,2 张南峰 1,2 *
摘 要 本文建立了一种基于超高效液相色谱-质谱联用法(Ultra High-Performance Liquid Chromatography-Mass Spectrometry,UHPLC-MS/MS)测定红肉猕猴桃中矢车菊素、飞燕草素、矮牵牛素、花葵素、芍药素、锦葵色素的方法。样品经含0.1%甲酸的甲醇水溶液直接提取,在电喷雾电离源(Electron Spray Ionization,ESI)于正离子模式下,采用选择性反应监测(Selected Reaction Monitoring,SRM)进行检测。结果显示,在5~500 ng/mL含量之间质量浓度范围内具有良好线性关系,线性相关系数r均在0.997以上,回收率为65.0%~99.6%,精密度为4.1%~9.1%,检出限为0.0003 mg/kg,定量限为0.001 mg/kg。结果表明,该方法可对红肉猕猴桃中6种花色素物质进行含量检测,具有简便高效、结果准确、灵敏度高、重复性好的特点。
关键词 红肉猕猴桃;花色素;超高效液相色谱-质谱
Development of a UHPLC-MS/MS Method for the Detection of Anthocyanins in Red Flesh Kiwifruit
DONG Ying1,2 CHEN Zi-Fan3 WANG Guo-Sheng4 CHI Shao-Ling5
XIE Shan-Shan6 ZHENG Shao-Feng1,2 ZHANG Nan-Feng1,2*
Abstract This study established a method for the determination of cyanidin, delphinidin, petunidin, malvidin, peonidin, and pelargonidin in red flesh kiwifruit using ultra high-performance liquid chromatography-tandem mass spectrometry (UHPLC-MS/MS). Samples were directly extracted with a methanol aqueous solution containing 0.1% formic acid and analyzed using electrospray ionization (ESI) in positive ion mode with selected reaction monitoring (SRM). The results showed good linearity within the concentration range of 5-500 ng/mL, with linear correlation coefficients (r) above 0.997. The recovery rates were between 65.0% and 99.6%, precision ranged from 4.1% to 9.1%, and the limits of detection and quantification were 0.0003 mg/kg and 0.001 mg/kg, respectively. The method demonstrated its capability for the content determination of six anthocyanin compounds in red flesh kiwifruit, characterized by simplicity, efficiency, accuracy, high sensitivity, and good repeatability.
Keywords red kiwi; anthocyanins; ultra high-performance liquid chromatography-mass spectrometry (UHPLC-MS/MS)
基金项目:广东省口岸安全智能化检测重点实验室项目(2023B1212010011);河源市社会发展科技计划项目(230613111602379)
第一作者:董莹(1979—),女,汉族,黑龙江黑河人,硕士,高级工程师,主要从事食品质量、实验室管理工作,E-mail: dongying51@126.com
通信作者:张南峰(1979—),男,汉族,广西壮族自治区南宁人,博士,研究员,主要从事实验室智能化工作,E-mail: Benzhang713@163.com
1. 广东省口岸安全智能化检测重点实验室 广州 510700
2. 黄埔海关技术中心 东莞 523000
3. 河源市食品检验所 河源 517000
4. 河源海关技术中心 河源 517000
5. 河源市药品检验所 河源 517000
6. 广州采芝林药业有限公司 广州 510000
1. Guangdong Provincial Key Laboratory of Intelligent Port Security Inspection, Guangzhou 510700
2. Technology Center of Huangpu Customs, Dongguan 523000
3. Heyuan Food Inspection Institute, Heyuan 517000
4. Technology Center of Heyuan Customs, Heyuan 517000
5. Heyuan Drug Inspection Institute, Heyuan 517000
6. Guangzhou Caizhilin Pharmaceutical Co., Ltd., Guangzhou 510000
随着国民经济的蓬勃发展和果树种植等工作的开展,水果品种不断丰富。其中红肉水果富含花青素具有较高的营养和保健价值,受到消费者的青睐[1]。本文研究建立一种超高效液相色谱-质谱联用法(Ultra High-Performance Liquid Chromatography-Mass Spectrometry,UHPLC-MS/MS)测定红肉猕猴桃中花青素——车菊素、飞燕草素、矮牵牛素、花葵素、芍药素和锦葵色素的含量,可作为红肉猕猴桃产品质量评价的方法。
1 材料与方法
1.1 材料与试剂
甲醇(色谱纯)(霍尼韦尔公司);甲酸(色谱纯)(上海阿拉丁试剂公司);锦葵色素,美国化学会化学文摘社编号(Chemical Abstracts Service,CAS):643-84-5,色谱纯,纯度≥97%;天竺葵素(花葵素),CAS:134-04-3,色谱纯,纯度≥96%;飞燕草色素,CAS:528-53-0,色谱纯,纯度≥97%;矮牵牛色素,CAS:1429-30-7,色谱纯,纯度≥95%,以上4个标准品均购于上海源叶生物科技有限公司;氯化矢车菊素,CAS:528-58-5,色谱纯,纯度≥95%;氯化芍药素,CAS:134-01-0,色谱纯,纯度≥95%,以上2个标准品均购于上海麦克林生化科技股份有限公司;蒸馏水,4.5L/瓶(广州屈臣氏食品饮料有限公司)。红肉猕猴桃样品为实验室样品。
1.2 仪器与设备
TSQ Endura三重四极杆质谱仪,配电喷雾电离源(Electron Spray Ionization,ESI),UltiMate 3000液相色谱系统(赛默飞世尔科技(中国)有限公司);电子天平(CP225D型)(赛多利斯公司);ACQUITY UPLC HSS C18柱(100Å, 1.8 μm, 2.1 mm×100 mm)(沃特世科技(上海)有限公司);均质机(Gd-300)(深圳新锐公司);高速离心机(ST 16R型)(美国赛默飞世尔科技公司)。
1.3 实验方法
1.3.1 溶液配制
花色素单标储备液:精确称取6种花色素标准品10 mg至100 mL容量瓶中,用甲醇水(90∶10)溶液溶解并定容至刻度线,浓度为0.1 mg/mL。
花色素混标中间液:吸取各种储备液0.1 mL至10 mL容量瓶中,用甲醇水(10∶90)溶液溶解并定容至刻度线,浓度为1 μg/mL。
花色素系列混合标准工作液:分别吸取中间液,用甲醇水(10∶90)溶液稀释成500 ng/mL、250 ng/mL、100 ng/mL、50 ng/mL、25 ng/mL、10 ng/mL,5 ng/mL,制备成系列标准工作液[3]。
1.3.2 样品制备
取代表性样品,将其去皮切开后,用食品处理机搅碎后,放入清洁的试样袋中,-18℃保存,作为待测试样[4-5]。
1.3.3 样品提取
称取1.00 g试样(精确到0.01 g),放入15 mL离心管中,加入10 mL 0.1%甲酸的甲醇水(10∶90)溶液,使用均质机进行均质。在20℃条件下,进行超声提取5 min,再以8000 r/min转速离心5 min,经0.22 μm Nylon滤膜过滤后供UHPLC-MS/MS检测。
1.3.4 液相条件
柱温箱35℃,进样量10 μL,进样盘温度:15℃;流量梯度设置见表1,A相为0.1%甲酸水,B相为甲醇。
表1 梯度淋洗程序
Table 1 Gradient elution procedure
时间 (min) | 流速 (mL/min) | A相 | B相 |
0.000 | 0.300 | 90 | 10 |
2.000 | 0.300 | 90 | 10 |
6.000 | 0.300 | 10 | 90 |
7.999 | 0.300 | 10 | 90 |
8.000 | 0.300 | 90 | 10 |
10.000 | 0.300 | 90 | 10 |
1.3.5 质谱条件
三重四极杆液质联用仪离子源设置见表2。
扫描模式采用选择性反应监测(Selected Reaction Monitoring,SRM),使用驻留时间模式:10 ms;第一四极杆分辨率:0.7 半高峰宽(Full Width Half Maximum,FWHM);第三四极杆分辨率:0.7 FWHM;碰撞气:1.5 mTorr;离子源裂解电压:0 V;使用色谱过滤器。6种花色素的SRM方法参数见表3。
1.3.6 实验步骤
使用1.3.5仪器设置条件,对花色素系列标准工作液和样品待测液进行测定,同时测定绿色猕猴桃提取液作为样品空白溶液。以表3特征定量离子所得的质谱峰面积作为纵坐标,相应的质量浓度作横坐标,绘制标准工作曲线,采用外标法定量。
2 结果与讨论
2.1 质谱条件的优化
对6种花色素进行质谱优化,其中裂解曲线图如图1所示。6种花色素的产物离子的曲线最高点,都在裂解电压范围之间,没有出现最高点在左侧或右侧,不存在提前裂解或者无法裂解的情况,因此具有很好的分离性和特征性。
2.2 提取条件优化
由于花色素对温度敏感,在高温下容易分解,考察5~30℃的提取效果。在10~20℃之间存在一个提取效果没有显著变化的平台期,提取效果比低于10℃条件明显更好,但低于30℃的提取效果。考虑到在日常生活的使用中,需要进行额外加热,而且温度过高会造成花色素分解,因此选择样品在20℃条件下进行提取。
第二个影响较大的因素是提取时间,研究选取了0~30 min,提取浓度呈正相关趋势,而提取时间大于30 min,对提取浓度无显著影响。根据王欢等人的实验研究结果[6-7],超声时间过长,会造成花色素损失,故选用20 min作为超声提取时间。
2.3 流动相的确定
选择了0.1%甲酸水溶液+甲醇、5 mmol/L甲酸铵溶液+甲醇、水+甲醇3种流动相进行梯度洗脱效果比较,以确定流动相。结果发现添加0.1%甲酸的流动相,在ESI正模式下,可以提高化合物的峰形分离度和改善峰形,提高了正离子模式下的灵敏度,所以本研究选择了0.1%甲酸水溶液+甲醇作为流动相。
2.4 基质效应评价
由于猕猴桃中含有酚类、糖类等物质[8-9],会造成基质干扰,因此使用基质效应(Matrix Effect,ME)计算公式对影响进行了评价。
将空白样品按1.3.1进行处理后,得到空白基质提取液,吸取10 mL提取液放入离心管中,分别加入花色素混合标准溶液,使其含有10 ng目标物质。另取甲醇水(10∶90)溶液作为溶剂,加入标准溶液,使其同样含有10 ng目标物质。ME计算公式如下:
公式中,B为空白基质中目标物的响应值,A为溶剂中目标物的响应值。计算结果见表4,补骨脂素基质效应因子为1.6%,8-甲氧基补骨脂素基质效应为7.6%,佛手苷内酯基质效应为1.6%,|ME|<20%属于弱基质效应,可忽略。
表4 6种花色素的基质效应评价结果
Table 4 Matrix effect evaluation results of 6 anthocyanins
目标物 | 试样 | 响应值 | 平均值 | |ME| (%) | |
花葵素 | A溶剂 | 5871.25 | 6150.98 | 6011.12 | 1.15 |
B提取液 | 6670.56 | 7027.83 | 6849.20 | ||
矢车菊素 | A溶剂 | 7342.63 | 7328.80 | 7335.72 | 0.05 |
B提取液 | 7907.53 | 7217.88 | 7562.71 | ||
芍药素 | A溶剂 | 5058.13 | 4847.15 | 4952.64 | 1.08 |
B提取液 | 6138.46 | 6487.62 | 6313.04 | ||
飞燕草素 | A溶剂 | 4118.14 | 3720.47 | 3919.31 | 2.60 |
B提取液 | 4021.72 | 3581.71 | 3801.72 | ||
矮牵牛素 | A溶剂 | 17791.88 | 16057.85 | 16924.87 | 2.63 |
B提取液 | 18186.59 | 17134.68 | 17660.64 | ||
锦葵素 | A溶剂 | 24803.26 | 25880.14 | 25341.70 | 1.05 |
B提取液 | 26067.91 | 23425.16 | 24746.54 | ||
2.5 标准曲线的绘制
使用空白样品液配制6种花色素混合梯度标准溶液上机后,通过质谱软件可以计算得出线性方程和相关系数。检出限为空白样品的3倍信噪比(S/N)结果,定量限为10倍S/N结果。
结果如表5所示,飞燕草素质量浓度在5~500 ng/mL之间,花葵素质量浓度在10~500 ng/mL之间,矢车菊素质量浓度在10~500 ng/mL之间,芍药素质量浓度在10~500 ng/mL之间,矮牵牛素质量浓度在10~500 ng/mL之间,锦葵素质量浓度在10500 ng/mL之间的线性关系良好,相关系数r>0.997,6种花色素的检出限为0.0003 mg/kg,定量限为0.001 mg/kg。
2.6 精密度试验
计算其实验室内变异系数(Coefficient of Variation,CV)。在猕猴桃样品中加入6种花色素标准溶液,进行提取后上机,连续进样9次,试验结果见表4。
2.7 回收率试验
在样品中分别加入6种花色素标准溶液,制备平行样各2份,以检测结果的平均值作为测定值。结果见表7。
表7 6种花色素的加标量、平均值及回收率结果
Table 7 Results of spiked amounts, average values and recoveries of 6 anthocyanins
组分名称 | 加标量 (mg/kg) | 平均值 (mg/kg) | 回收率 (%) |
花葵素 | 0.250 | 0.249 | 99.6 |
矢车菊素 | 0.500 | 0.480 | 96.0 |
芍药素 | 0.200 | 0.195 | 97.5 |
飞燕草素 | 0.500 | 0.435 | 87.0 |
矮牵牛素 | 0.200 | 0.119 | 65.0 |
锦葵素 | 0.100 | 0.088 | 88.0 |
2.8 实际样品测定
对实验室样品红肉猕猴桃按1.3方法进行了检测,结果显示含有矢车菊素2~17 mg/kg,未测得其他5种花色素,含有花色素的种类与文献一致[2,10]。
3 结论
本研究建立了UHPLC-MS/MS模式测定红肉猕猴桃中花色素的检测方法,实现了6种花色素的定性定量分析。该方法标准曲线相关系数r>0.997,检出限为0.0003 mg/kg,定量限为0.001 mg/kg,回收率为65.0%~99.6%,CV值为4.1%~9.1%,实验结果符合GB/T 32465-2015中的性能指标要求[11]。
方法前处理采用了匀浆后高速离心,上机同时检测6种花色素。相比液相色谱法,有效缩短了检测时间,提高检测效率,可作为红肉猕猴桃产品质量评价的科学方法,保障消费者“果盘子”中的果品质量。
参考文献
[1] 姚玉新,王菲. 红肉水果种植现状与研究进展[J].落叶果树. 2024, 56(2): 6-11.
[2] 张坤.果肉全红型猕猴桃新种质的分子鉴定及其色泽形成机理初探[D].雅安: 四川农业大学, 2022.
[3]陈碧聪,陈子凡.超高效液相色谱-质谱联用法测定蓝莓中六种花色素含量[J]. 粮食与食品工业, 2023, 6(3): 64-67.
[4] 刘翠霞,李洁维,高建有,等. 广西不同地区红阳猕猴桃果实香气分析[J].果树学报, 2023, 40(10): 2170-2182.
[5] 田真,张萌,王银,等. 基于顶空气相色谱-离子迁移谱对不同品种猕猴桃果汁的香气指纹表征[J]. 食品与发酵工业, 2023, 49(1): 279-287.
[6] 王欢,谯顺彬,田辉,等. 高效液相色谱法测定蓝莓酒中六种花青素含量[J].食品与发酵工业, 2020, 46(8): 280-284.
[7] 陈子凡,池少铃,陈碧聪,等. 5种α-羟基酸提取蓝莓中花色素的条件选择及分析[J]. 食品工程, 2023, 6(2): 60-63.
[8] 陈怡. “红实2号”猕猴桃多糖提取优化及后熟过程中结构特征、体外生物活性变化规律的研究[D].雅安: 四川农业大学, 2023.
[9] 涂美艳,陈栋,廖明安,等.不同猕猴桃品种果肉色素含量及关键酶活性变化规律[J].西南农业学报, 2022, 35(10): 2395-2404.
[10] 王浩哲,钱海珍,尤红艳,等. 平原红猕猴桃花青苷积累规律及合成代谢关键基因发掘[J].果树学报, 2024, 41(8): 1534-1545.
[11] GB/T 32465—2015 化学分析方法验证确认和内部质量控制要[S]. 北京: 中国标准出版社, 2008.
表2 质谱离子源条件
Table 2 Mass spectrometry ion source conditions
质谱工作参数 | 设置 |
离子源模式 | ESI正模式 |
喷雾电压 | 静态 |
正离子 (V) | 3500 |
负离子 (V) | 3200 |
鞘气 (Arb) | 35 |
辅助气 (Arb) | 5 |
吹扫气 (Arb) | 2 |
蒸发温度 (℃) | 320 |
离子传输管温度 (℃) | 350 |
表3 SRM方法参数
Table 3 SRM method parameters
化合物 | 开始时间 (min) | 停止时间 (min) | 极性 | 前体离子 | 产物离子 | 碰撞能量 (V) | 射频电压 (V) |
花葵素 | 0.5 | 10 | 正电荷 | 271 | 121 | 33 | 157 |
271 | 141 | 34 | |||||
271 | 197 | 30 | |||||
矢车菊素 | 0.5 | 10 | 正电荷 | 287 | 137 | 33 | 156 |
287 | 213 | 31 | |||||
287 | 241 | 30 | |||||
芍药素 | 0.5 | 10 | 正电荷 | 301 | 201 | 39 | 149 |
301 | 258 | 25 | |||||
301 | 286 | 33 | |||||
飞燕草素 | 0.5 | 10 | 正电荷 | 303 | 173 | 33 | 157 |
303 | 229 | 32 | |||||
303 | 257 | 27 | |||||
矮牵牛素 | 0.5 | 10 | 正电荷 | 317 | 245 | 35 | 167 |
317 | 274 | 29 | |||||
317 | 302 | 25 | |||||
锦葵素 | 0.5 | 10 | 正电荷 | 331 | 242 | 33 | 170 |
331 | 287 | 33 | |||||
331 | 315 | 33 |
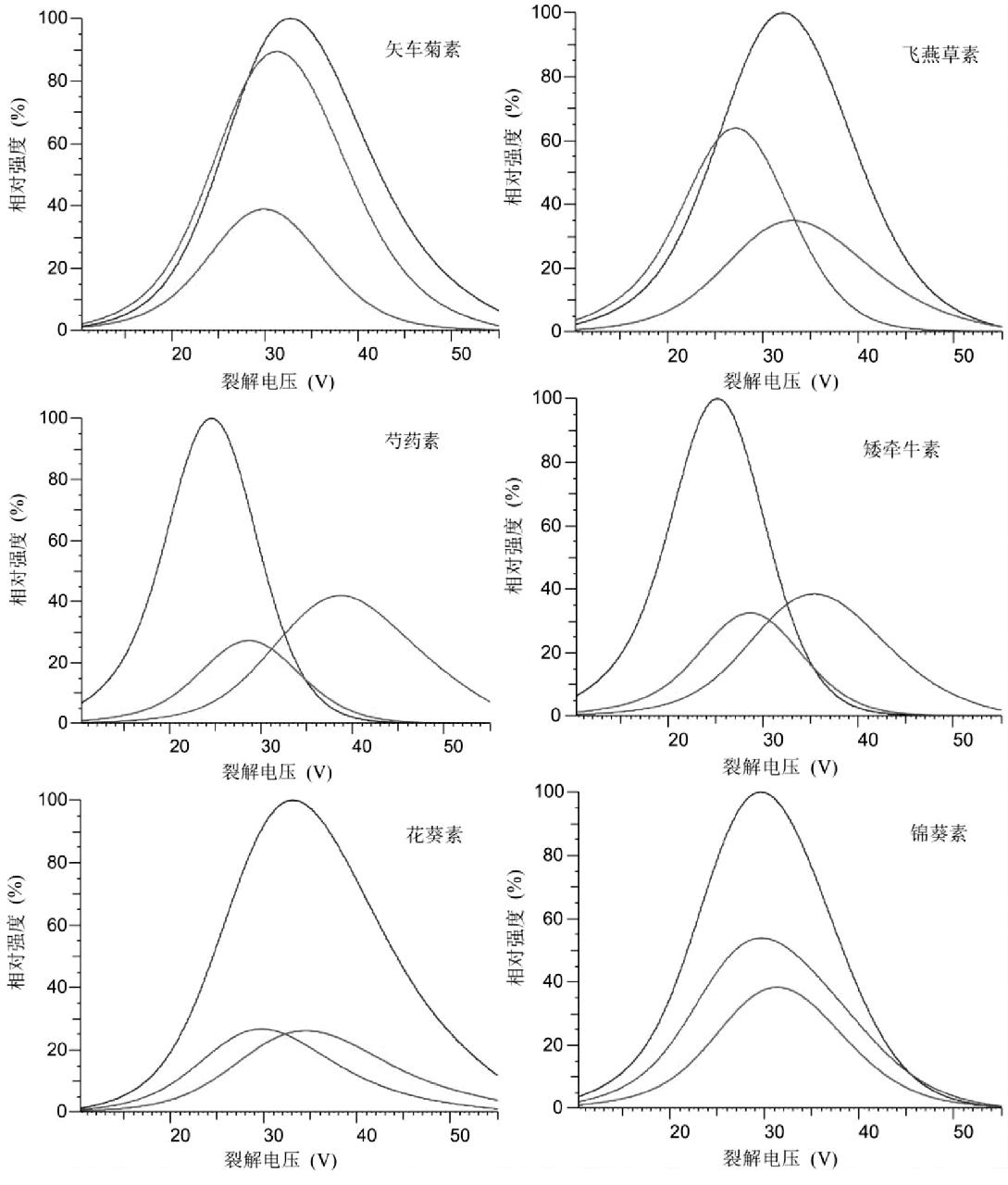
图1 6种花色素优化程序的裂解曲线图
Fig.1 Cleavage curves of optimization programs of 6 anthocyanins
表5 6种花色素线性方程、相关系数、检出限和定量限结果
Table 5 Results of linear equations, correlation coefficients, LODs and LOQs of 6 anthocyanins
组分名称 | 线性方程 | 相关系数 (r) | 检出限 (mg/kg) | 定量限 (mg/kg) |
花葵素 | y = 232.735×x+2147.35 | 0.999 | 1.5 | 5 |
矢车菊素 | y = 201.158×x+1801.92 | 0.999 | 1.5 | 5 |
芍药素 | y = 194.161×x+2181.23 | 0.998 | 1.5 | 5 |
飞燕草素 | y = 107.49×x+681.633 | 0.999 | 1.5 | 5 |
矮牵牛素 | y = 1059.43×x+8507.62 | 0.999 | 1.5 | 5 |
锦葵素 | y = 1986.39×x+13093.6 | 0.999 | 1.5 | 5 |
表6 6种花色素实验室内变异系数结果
Table 6 Results of laboratory variation coefficients of 6 anthocyanins
组分名称 | 试验号 | 平均值 (mg/kg) | CV (%) | ||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |||
花葵素 | 0.292 | 0.315 | 0.284 | 0.364 | 0.314 | 0.328 | 0.330 | 0.291 | 0.310 | 0.292 | 9.1 |
矢车菊素 | 0.468 | 0.588 | 0.537 | 0.474 | 0.477 | 0.467 | 0.471 | 0.469 | 0.494 | 0.468 | 8.5 |
芍药素 | 0.314 | 0.287 | 0.279 | 0.272 | 0.301 | 0.284 | 0.256 | 0.277 | 0.284 | 0.314 | 5.9 |
飞燕草素 | 0.480 | 0.424 | 0.512 | 0.492 | 0.583 | 0.513 | 0.470 | 0.485 | 0.492 | 0.480 | 8.8 |
矮牵牛素 | 0.107 | 0.122 | 0.125 | 0.113 | 0.101 | 0.111 | 0.115 | 0.103 | 0.114 | 0.107 | 9.1 |
锦葵素 | 0.088 | 0.097 | 0.089 | 0.090 | 0.095 | 0.095 | 0.091 | 0.098 | 0.093 | 0.088 | 4.1 |







