CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
急性肝胰腺坏死病重组酶介导恒温荧光快速检测方法的建立及在环境样品中的应用
作者:李家侨 刘荭 斯泽恩 谢艳辉 杨金金 张娜
李家侨 刘荭 斯泽恩 谢艳辉 杨金金 张娜
李家侨 1 刘 荭 2 斯泽恩 1 谢艳辉 1 杨金金 1 张 娜 3 *
摘 要 为建立急性肝胰腺坏死病(Acute Hepato Pancrentic Necrosis Disease,AHPND)实时荧光重组酶介导扩增(Recombinase Aided Amplification,RAA)快速检测方法,根据NCBI中致急性肝胰腺坏死病的副溶血性弧菌(Vibrio parahaemolyticus,VpAHPND)中PVA1质粒的保守序列设计了3对引物和1条探针,通过荧光值和出峰时间,筛选引物、优化反应温度、评估方法的敏感性和特异性,同时把该方法应用于临床模拟环境DNA(Environmental DNA,eDNA)样品检测。结果显示,筛选出的VpAHPND的F2/R2引物组特异性强,仅能扩增VpAHPND 阳性核酸,与常见的对虾病原肝肠胞虫(Enterocytozoon Hepato Penaei,EHP)、白斑综合征病毒(White Spot Syndrome Virus,WSSV)、传染性皮下和造血器官坏死病毒(Infectious Hypodermal and Haematopoietic Necrosis Virus,IHHNV)、细菌性肝胰腺坏死(Infection with Hepatobacter Penaei,NHPB)、十足目虹彩病毒1型感染(Decapod Iridescent Virus 1,DIV1)、副溶血性弧菌(Vibrio Parahaemolyticus,VP)均无交叉反应;检测方法灵敏度高,检测限低至1.4×102 copies /μL,并且在20 min内快速完成了VpAHPND的检测。采用实时荧光RAA法,在64份临床模拟环境DNA(eDNA)样品中检出VpAHPND阳性8份,检测结果与荧光定量PCR检测方法一致。研究表明eDNA采样策略与VpAHPND的实时荧光RAA检测方法相结合,能大大提升临床诊断速度,可为急性肝胰腺坏死病快速检测提供重要的技术依据。
关键词 急性肝胰腺坏死病;副溶血性弧菌;重组酶介导扩增;环境DNA;快速检测
Establishment of a Recombinase Aided Isothermal Fluorescencerapid Detection Method for Acute Hepatopan- creatic Necrosis and Its Application in Environmental Samples
LI Jia-Qiao 1 LIU Hong 2 SI Ze-En 1 XIE Yan-Hui 1 YANG Jin-Jin 1 ZHANG Na 3*
Abstract To establish a real-time fluorescence Recombinase Aid Amplification (RAA) rapid detection method for Acute Hepato Pancrentic Necrosis Disease (AHPND) in shrimp, three pairs of primers and one probe were designed based on the conserved sequence of the PVA1 plasmid in Vibrio parahaemolyticus (VpAHPND) causing acute hepatopancreatic necrosis disease in NCBI. The primers were screened, reaction temperature was optimized and the sensitivity and specificity of the method were evaluated using fluorescence value and peak time. This method was applied to detect VpAHPND in clinical simulated environment DNA (eDNA) samples. The results showed that the F2/R2 primer set of VpAHPND exhibited strong specificity and could only amplify AHPND positive nucleic acids. There was no cross reaction with common shrimp pathogens such as Enterocytozoon Hepato Penaei (EHP), White Spot Syndrome Virus (WSSV), infectious hypodermal and haematopoietic necrosis virus (IHHNV), Infection with Hepatobacter Penaei (NHPB), Decapod Iridescent Virus 1 (DIV1) or Vibrio Parahaemolyticus (VP). The detection method demonstrated high sensitivity and the lowest detection limits is 1.4×102 copies/μL. The detection of VpAHPND was completed within 20 minutes. Using the real-time fluorescence RAA method, VpAHPND was detected in 8 out of 64 clinical simulated eDNA samples, with results consistent with those obtained by fluorescence quantitative PCR. The research shows that the combination of eDNA sampling and real-time fluorescence RAA detection method of VpAHPND significantly improves the clinical diagnosis speed of shrimp, providing a rapid and reliable diagnostic method for customs and aquaculture.
Keywords acute hepatopannecrosis disease; vibrio parahaemolyticus; recombinase-aid amplification; environmental DNA; rapid detection
基金项目:海关总署科研项目(2023HK037);广东省“生物安全技术”专项重点研发项目(2022B1111030001);湛江市科技计划项目(2023B01020)
第一作者:李家侨(1987—),女,广东信宜人,硕士,兽医师,主要从事进出口动物疫病检验检疫,E-mail: zjdjsys@163.com
通信作者:张娜(1982—),女,高级兽医师,河南新乡人,硕士,高级兽医师,主要从事进出口动物疫病检验检疫,E-mail: vien512@126.com
1. 湛江海关技术中心 湛江 524000
2. 深圳海关动植物检验检疫技术中心 深圳 518045
3. 湛江国际旅行卫生保健中心 湛江 524000
1. Technology Center of Zhanjiang Customs, Zhanjiang 524000
2. Animal and Plant Inspection and Quarantine Technology Center of Shenzhen Customs District, Shenzhen 518045
3. Zhanjiang International Travel Health Care Center, Zhanjiang 524000
急性肝胰腺坏死病(Acute Hepatopannecrosis Disease,AHPND)也称为早期死亡综合征(Early Mortality Syndrome,EMS),是由副溶血性弧菌(Vibrio parahaemolyticus,VpAHPND)携带的质粒编码的pirA和pirB毒素基因引起的疾病,主要引起早期虾苗或者幼虾死亡[1-4]。该病在越南、马来西亚、泰国、墨西哥、菲律宾等多地均有报道[1-2,5-7]。AHPND作为一种细菌病,普遍采用药物治疗,但长期使用会形成耐药菌株。为此,本研究开发了一种适用AHPND现场监测的快速检测方法,以期为海关、渔业部门、养殖企业等提供参考依据。
常规的聚合酶链式反应(Polymerase Chain Reaction,PCR)、荧光PCR方法等对环境和人员的专业性要求较高,且每次检测所需时间较长,在口岸、养殖场等现场监测方面具有一定局限性。重组酶介导扩增(Recombinase Aided Amplification,RAA)技术是一种等温扩增检测技术[8],它包含重组酶、单链结合蛋白和DNA聚合酶,在37~43℃恒温条件下,利用荧光探针的标记,可以实现定时定量的结果分析,通常20 min内就可以得到荧光检测结果。RAA技术的出现,为分子检测技术带来突破性的变革,也为临床快速检测提供了更大的可能。环境DNA(Environmental DNA,eDNA)监测为水生动物疫病传统组织采样监测提供了补充或替代的方法,在流行率低的情况下,直接采集养殖水样,可以在动物出现临床症状之前,快速评估水体中的病原体水平,可用于水产养殖管理早期检测和风险预警。而且一般情况下,AHPND疫病监测是需要采集对虾肝胰腺组织增菌后进行检测[9],费时费力。本研究把RAA技术与eDNA监测结合起来,为AHPND疫病监测提供高效快速的检测策略。
1 材料与方法
1.1 阳性组织、阳性菌株、质粒和临床模拟样品
十足目虹彩病毒1型感染(Decapod Iridescent Virus 1, DIV1)阳性组织、传染性皮下和造血器官坏死病毒(Infectious Hypodermal and Haematopoietic Necrosis Virus,IHHNV)阳性组织、肝肠胞虫(Enterocytozoon Hepatopenaei,EHP)阳性组织、白斑综合征病毒(White Spot Syndrome Virus,WSSV)阳性组织、副溶血性弧菌(Vibrio Parahaemolyticus,VP)菌株、VpAHPND菌株、细菌性肝胰腺炎(Infection with Hepatobacter Penaei,NHPB)是pUC57-NHPB质粒,以上均为湛江海关技术中心实验室保存,阳性组织和阳性菌株均采用海洋动物组织基因组 DNA 提取试剂盒进行核酸提取。64批eDNA 模拟样品均为向养殖海水中添加了不同浓度的VpAHPND 病原体。
1.2 主要试剂、耗材与仪器
荧光型核酸扩增试剂(杭州众测生物科技有限公司,SOO2ZC);海洋动物组织基因组 DNA 提取试剂盒(天根生化科技(北京)有限公司);0.45 μm硝酸纤维素膜(北京优尼康生物科技有限公司);荧光PCR仪(赛默飞世尔科技公司); pUC57-PVA1重组质粒、引物和探针(湖州河马生物科技有限公司)。
1.3 VpAHPND的RAA引物和探针的设计与筛选
根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中VpAHPND的质粒PVA1保守序列(登录号:CP020036.1),同时结合RAA引物和探针要求,采用Primer Premier 5软件设计了3对引物和1条探针P(表1),可自由组成9组引物对(F1/R1、F1/R2、F1/R3、F2/R1、F2/R2、F2/R3、F3/R1、F3/R2、F3/R3),荧光探针采用荧光报告基团羧基荧光素(Carboxy-fluorescein,FAM)和荧光淬灭基团黑洞猝灭剂(Black Hole Quencher,BHQ)进行修饰。以VpAHPND 菌株经核酸提取后的核酸为模板,按照荧光型核酸扩增试剂说明书配置试剂体系,根据不同引物对的出峰时间和荧光强度综合评估,从而筛选最佳的引物探针组合。
1.4 VpAHPND的实时荧光RAA法反应温度优化
取经1.3中筛选的引物探针,按照荧光型核酸扩增试剂说明书配置试剂,VpAHPND阳性菌株取经核酸提取后为模板,优化不同反应温度(35℃、36℃、37℃、38℃、39℃和40℃)下的出峰时间和荧光值,确定最佳的反应温度。
1.5 特异性试验
为确保筛选的引物探针不与常见的对虾疫病出现非特异性扩增,取实验室保存的提取WSSV、IHHNV、DIV1、EHP阳性组织、VP和VpAHPND菌株和pUC-NHPB质粒为模板,其中阳性组织和阳性菌株均先经过核酸提取后,进行VpAHPND实时荧光RAA特异性试验。
1.6 灵敏度试验
合成的重组质粒pUC57-PVA1,通过添加 ddH2O倍比稀释制备标准溶液。起始浓度通用计算方法:拷贝数(copies/μL) = [6.02×1023×质量浓度(mg/L)×10-9]/(片段长度×660),pUC57-PVA1的起始拷贝数为1.4×1010 copies/μL,以制备好1.4×101~1.4×105 copies/μL的标准品,1.4中优化好反应温度,用于VpAHPND实时荧光RAA检测法的灵敏度测试。
1.7 临床模拟eDNA样品检测
在养殖海水中人工添加不同浓度的VpAHPND病原体,模拟临床样品。先进行eDNA中VpAHPND富集,250 mL水样用0.45 μm硝酸素纤维膜富集病原体后,经海洋动物组织基因组 DNA 提取试剂盒提取滤膜核酸,采用本研究建立的VpAHPND 实时荧光RAA法进行检测。同时,采用世界动物卫生组织(World Organization for Animal Health,WOAH)《水生动物诊断试验手册》2.2.1章中荧光定量PCR法对经富集后的水样开展检测,比较不同方法的检测结果,从而评估本研究中建立的VpAHPND实时荧光RAA方法在临床上的可行性。
2 结果与分析
2.1 VpAHPND实时荧光RAA引物的筛选
上游引物F1、F2、F3和下游引物R1、R2、R3自由组合成9组引物对(F1/R1、F1/R2、F1/R3、F2/R1、F2/R2、F2/R3、F3/R1、F3/R2、 F3/R3),探针均为P,VpAHPND菌株经核酸提取后为模板,按照荧光型核酸扩增试剂盒说明书配置反应体系。结果显示,所有引物组均能产生荧光信号,F3/R1和F2/R2的荧光强度最高,但是F2/R2反应速度最快,如图1所示,优选出F2/R2引物组合,探针为P,该引物探针组合已申请国家专利,专利公开号: CN116656847A。
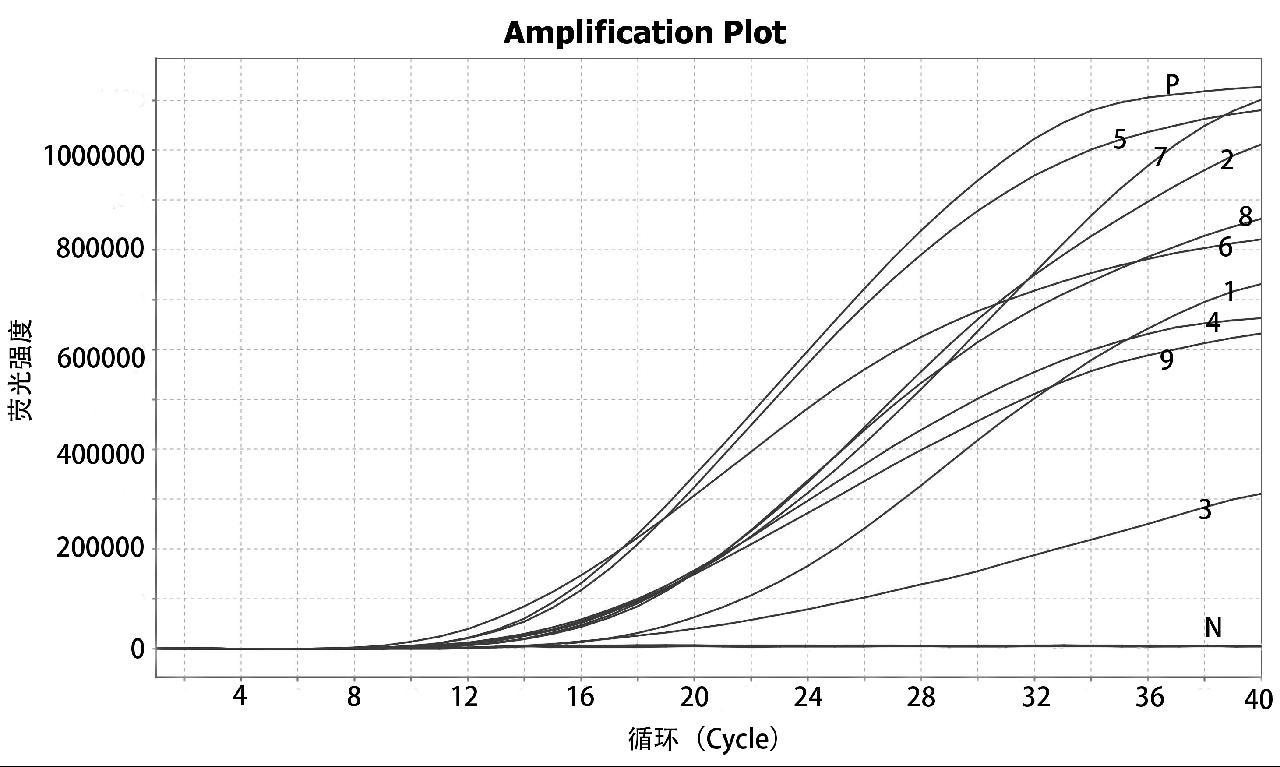
1: F1/R1; 2: F1/R2; 3: F1/R3; 4: F2/R1; 5: F2/R2; 6: F2/R3; 7: F3/R1; 8: F3/R2; 9: F3/R3; N: ddH2O; P:VpAHPND
图1 VpAHPND 实时荧光RAA法引物筛选结果
Fig.1 Primer screening results of VpAHPND real-time fluorescence RAA method
2.2 VpAHPND实时荧光RAA方法反应温度优化
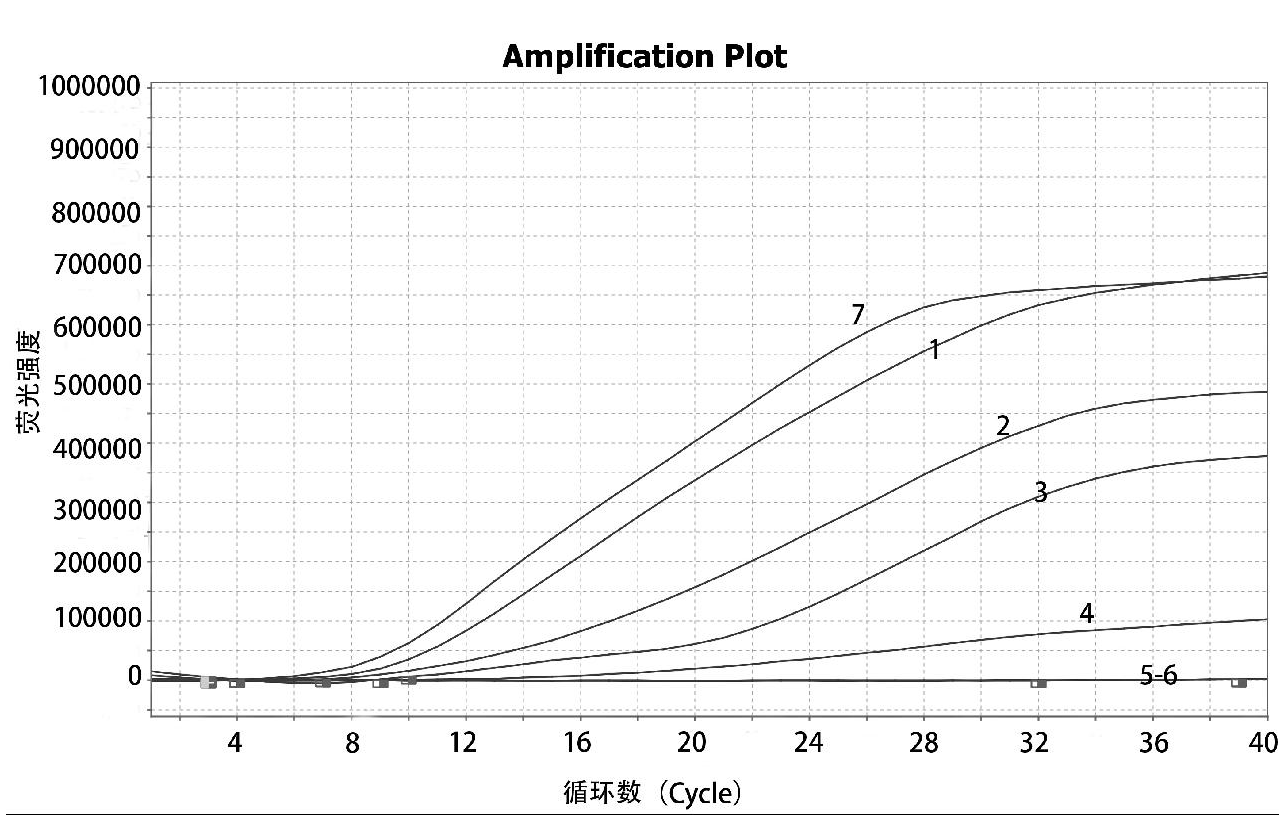
以VpAHPND阳性核酸为模板,优选的F2/R2引物组,按照荧光型核酸扩增试剂盒说明书配置反应体系,通过对反应温度(35℃、36℃、37℃、38℃、39℃和40℃)的摸索,结果显示,38℃、39℃的荧光强度最高,但是39℃的出峰时间更快,如图2所示,因此筛选39℃为最优的反应温度。最终确定试剂配置体系50 μL:干粉酶制剂中加入25 μL A Buffer、 浓度为10 μmol/L上游引物F2 2 μL 、浓度为10 μmol/L下游引物 R2 2 μL,浓度为10 μmol/L探针P 0.6 μL、12.9 μL的水,5 μL模板,最后加入2.5 μL B buffer, 充分混匀后,上荧光PCR仪,反应程序为:39℃ 60 s;39℃ 30 s,40个循环。
2.3 VpAHPND实时荧光RAA的特异性试验结果
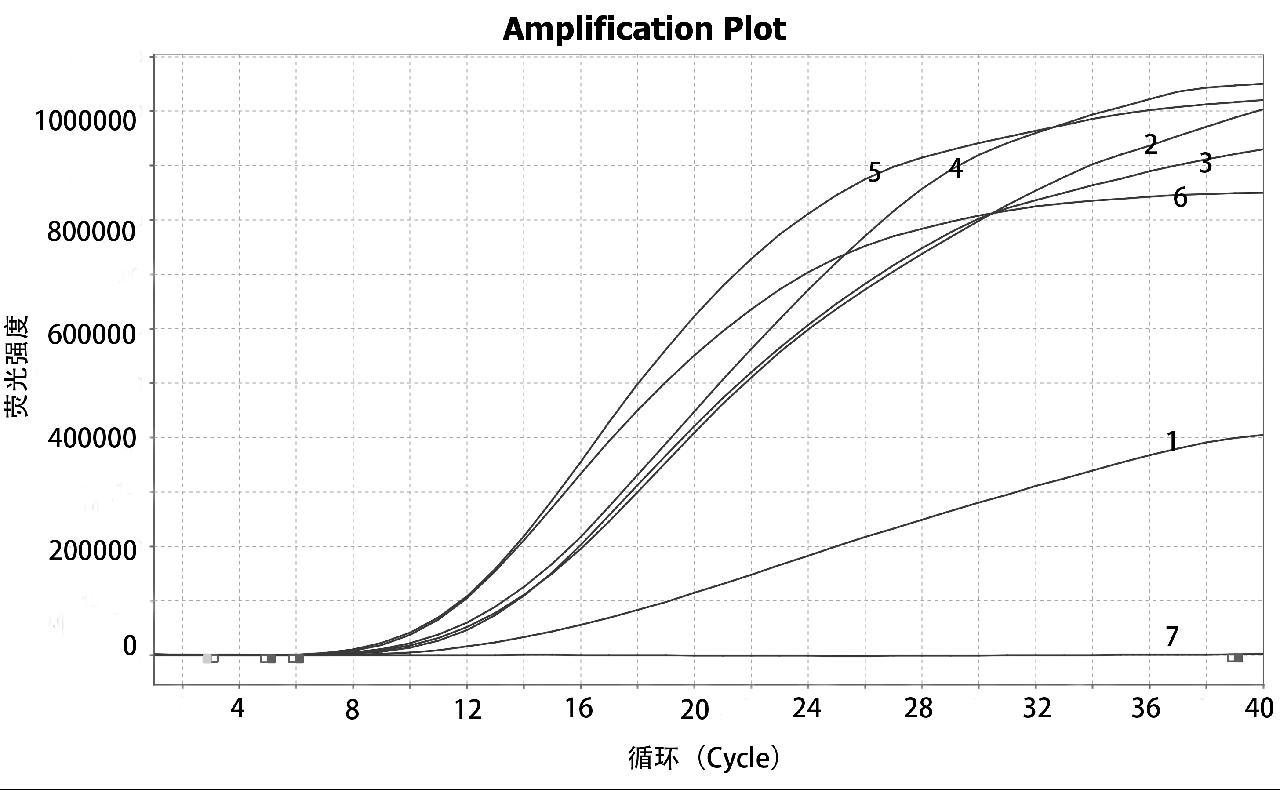
取经核酸提取后的WSSV、DIV1、IHHNV、VP、EHP、VpAHPND阳性核酸和pUC-NHPB质粒作为模板,进行实时荧光RAA检测,结果只有VpAHPND有阳性扩增曲线,WSSV、DIV1、IHHNV、VP、EHP和NHPB均阴性,如图3所示,表明建立的VpAHPND实时荧光RAA法的特异性较强,不与对虾其他常见病出现交叉反应。
1:VpAHPND; 2: WSSV; 3: IHHNV; 4: NHPB; 5: EHP; 6: DIV1; 7: VP; 8: ddH2O
图3 VpAHPND 实时荧光RAA法特异性试验结果
Fig.3 Specificity test results of VpAHPND real-time fluorescence RAA method
2.4 VpAHPND实时荧光RAA的灵敏度试验结果
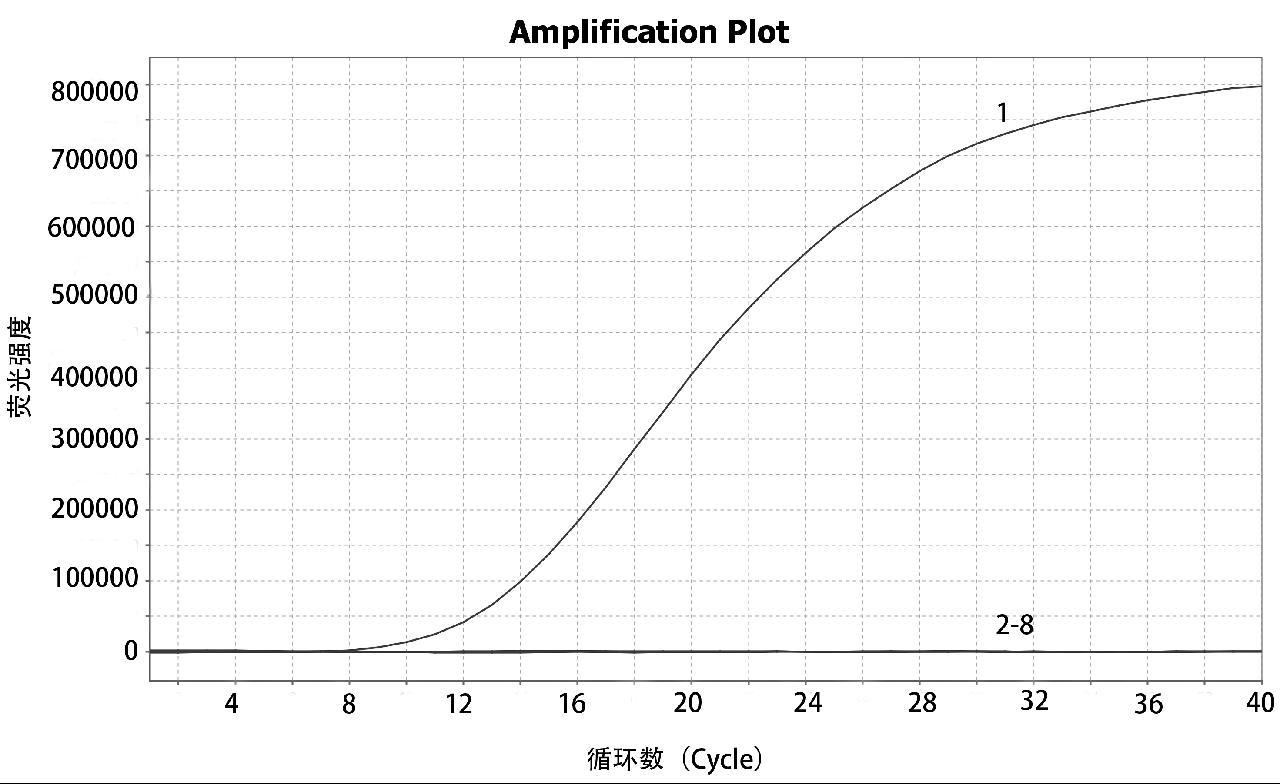
将10倍比稀释得到浓度为1.4×105~1.4×101 拷贝/μL pUC57-PVA1标准品作为模板,采用优化的反应温度和F2/R2引物组反应程序进行实时荧光RAA扩增。结果显示 VpAHPN标准品pUC的检测限为1.4×102 拷贝/μL,如图4所示,表明建立VpAHPND实时荧光RAA法灵敏度高。
1: 1.4×105 copies/μL; 2: 1.4×104 copies/μL; 3: 1.4×103 copies/μL; 4: 1.4×102 copies/μL; 5: 1.4×101 copies/μL; 6: ddH2O ; 7: positive control
图4 VpAHPND 实时荧光RAA法的敏感性试验结果
Fig.4 Sensitivity test results of VpAHPND real-time fluorescence RAA method
2.5 临床模拟样品检测
对人工添加了VpAHPND的养殖海水,经滤膜法富集和核酸提取DNA后,作为模板利用本研究中建立的VpAHPND 实时荧光RAA法进行检测,结果从64份eDNA样品中检出8份VpAHPND阳性,阳性率为12.5%。同时,采用荧光定量PCR方法富集后的水样开展检测,结果显示,采用实时荧光RAA法与常规荧光定量PCR方法检测结果一致,表明VpAHPND实时荧光RAA快速检测方法对现场AHPND监测结果的准确可靠。
3 讨论
重组酶介导等温扩增技术作为一种升级换代核酸快速扩增技术,由于在常温下反应速度快、操作简单、灵敏度高和特异性强,不依赖于复杂的仪器等优势,使得该技术在水生动物疫病检测领域研究不断深入。朱裕敏等 [10] 开发的鲤春病毒血症病毒重组酶介导扩增结合侧向流试纸条技术(RT-RAA-LFD)的检测限为2.42×102 copies /μL,在35℃ 15 min内快速完成了扩增。郑晓聪等 [11] 建立的鲤浮肿病毒荧光 RAA法,也是在39℃ 20 min完成了反应,检测下限为2.8×101 copies /μL,对于临床28份鱼类样品的检测结果与荧光定量PCR方法结果一致。荧光定量PCR方法是传统实验室常用的分子生物学检测方法,其具有灵敏度高、特异性强、检测高效等特征,但是在口岸等快筛实验室使用会受限于依赖昂贵的荧光PCR仪、需要配备专门的分子生物学实验室等条件限制。随着RAA方法的出现,其检测时间比荧光定量PCR方法缩短一半,为口岸现场快速检测提供了可能。
2016年,WOAH把AHPND列为需要通报的水生动物疾病。为进一步做好对AHPND的防控,采用RAA检测技术可为AHPND监测提供更快、更精准的检测技术。AHPND的常用检测方法有病原体分离、组织病理学、实时荧光PCR法、普通PCR法、LAMP法等,WOAH《水生动物诊断试验手册》中AHPND的荧光PCR法和普通PCR法均以pirAB毒素基因或者PVA1质粒为目标基因。当前虽然有AHPND的RAA恒温荧光检测法已经报道,它是以pirB为目标基因,但有一定的局限性,而pirAB毒素基因不稳定,容易出现缺失[12]和假阴性,因此本研究采用了质粒PVA1为目标基因,设计和筛选实时荧光RAA引物。研究建立VPAHPND实时荧光RAA法对1.4×102 copies/μL pUC-PVA1有检测信号,不会与常见的水生动物疾病发生交叉反应,检测灵敏度高,能在20 min内快速完成检测,在进出口货物快速通关的背景下,能大大缩短检测时间,提升临床的检测效率。
eDNA是近年来新兴的环境监测手段,早期主要应用于外来物种入侵、濒危物种鉴定、生物多样性评估等领域 [13-14],近年来应用到水生动物疫病病原体监测,显示出较大的潜力。但是水体中病原体的载量低,直接检测达不到检测限,先对水样进行富集后再进行检测,则能大大提高检测率。eDNA的病原体有病毒、细菌、真菌、寄生虫等类型,主要通过滤膜法和沉淀法进行富集[15-16]。病毒的粒子较小,一般采用沉淀法使小颗粒病毒进行富集,而细菌、寄生虫和真菌的粒子较大则通过滤膜法进行富集,滤膜的孔径则取决于病原体颗粒大小。AHPND是一种细菌病,由携带了pirAB毒素基因的弧菌引起,病原体大小约0.7~1.0 μm,病原粒子较大,因此采用0.45 μm硝酸纤维素富集病原,早期本课题组的研究已经证实该富集方法效果良好 [17]。
本研究采用实时荧光RAA法对环境水中的AHPND开展检测,水样通过滤膜法富集水体后,采用本研究建立实时荧光RAA法检测VpAHPND ,结果在64批临床模拟的eDNA样品中检出VpAHPND 阳性8批,与荧光定量PCR检测方法的结果一致,说明了基于eDNA采样,采用实时荧光RAA法在临床上检测VpAHPND 的可行性,不仅能大大节省采样成本,还能有效提高检测效率,为海关进口活水生动物疫病快速筛查、生物安全风险预警提供了新的检测策略。
参考文献
[1] Lightner D V, Redman R M, Pantoja C R, et al. Early mortality syndrome affects shrimp in Asia[J]. Global Aquaculture Advocate, 2012, 15: 40.
[2] Soto-Rodriguez S A, Gomez-Gil B, Lozano-Olvera R, et al. Field and Experimental Evidence of Vibrio parahaemolyticus as the Causative Agent of Acute Hepatopancreatic Necrosis Disease of Cultured Shrimp (Litopenaeus vannamei) in Northwestern Mexico[J]. Applied & Environmental Microbiology, 2015, 81(5): 1689-1699.
[3] Joshi J, Srisala J, Truong V H, et al. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND)[J]. Aquaculture, 2014, 428/429: 297-302.
[4] Tran L, Nunan L, Redman R M, et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J]. Diseases of Aquatic Organisms, 2013, 105(1): 45-55.
[5] NACA-FAO Quarterly Aquatic Animal Disease Report (Asia and Pacific Region)[R]. 2011/2, April-June 2011 (NACA, Bangkok).
[6] Linda, Nunan, Donald, et al. Detection of acute hepatopancreatic necrosis disease (AHPND) in Mexico[J]. Diseases of aquatic organisms, 2014, 111(1): 81-86.
[7] Pea L D L, Cabillon N, Catedral D D, et al. Acute hepatopancreatic necrosis disease (AHPND) outbreaks in Penaeus vannamei and P. monodon cultured in the Philippines[J]. Diseases of Aquatic Organisms, 2015, 116(3): 251-254.
[8] Li J, Macdonald J, Von Stetten F. Review: a comprehensive summary of a decade development of the recombinase polymerase amplification[J]. Analyst, 2018, 144(1): 31-67.
[9]郭书林, 陈信忠, 尤颖哲, 等. 福建省南美白对虾幼体急性肝胰腺坏死病病原分离与PCR检测[J]. 中国动物检疫, 2019, 36(6): 96-99.
[10] 朱裕敏, 吴江, 廖立珊, 等. 鲤春病毒血症病毒RT-RAA-LFD检测方法的建立[J]. 中国预防兽医学报, 2023, 45 (9): 916-921.
[11]郑晓聪, 陈雨, 温智清, 等. 鲤浮肿病毒荧光RAA快速检测方法的建立[J]. 中国预防兽医学报, 2019, 41 (7): 721-725.
[12] Lee C, Chen I, Yang Y, et al. The opportunistic marine pathogen Vibrio parahaemolyticus becomes virulent by acquiring a plasmid that expresses a deadly toxin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(34): 10798-10803.
[13] Song J W, Small M J, Casman E A. Making sense of the noise: the effect of hydrology on silver carp eDNA detection in the Chicago area waterway system[J]. Science of The Total Environment, 2017(605- 606): 713-720.
[14] Fukumoto S, Ushimaru A, Minamoto T, et al. A basin-scale application of environmental DNA assessment for rare endemic species and closely related exotic species in rivers: a case study of giant salamanders in Japan[J]. The Journal of Applied Ecology, 2015, 52(2): 358-365.
[15] Haramoto E, Kitajima M, Katayama H et al. Detection of koi herpesvirus DNA in river water in Japan.[J]. Journal of Fish Diseases, 2007, 30(1).59-61.
[16] Rusch J C, Haakon H, Strand D A , et al. Catching the fish with the worm: a case study on eDNA detection of the monogenean parasite Gyrodactylus salaris and two of its hosts, Atlantic salmon (Salmo salar) and rainbow trout (Oncorhynchus mykiss)[J]. Parasites & Vectors, 2018, 11(1): 1-12.
[17]李家侨, 谢艳辉, 张娜, 等. 基于eDNA技术富集水体中急性肝胰腺坏死病副溶血性弧菌的初步研究[J]. 中国口岸科学技术, 2023, 5(4): 60-68.
表1 VpAHPND 的实时荧光RAA法引物和探针序列
Tabel 1 Primers and probe sequence for VpAHPND Real-time fluorescence RAA method
引物和探针 | 序列 (5′-3′) |
F1 | TGAAACAAAAGAAACAAGCGAAACGGATGC |
F2 | AAAGAAACAAGCGAAACGGATGCCCAAGTC |
F3 | TCATTGAAACAAAAGAAACAAGCGAAACGG |
R1 | CGTATTGCATCAATAAGAAAACAAACATA |
R2 | CAAACATAAATGAAATGTTACTTTGTAAA |
R3 | GCATCAATAAGAAAACAAACATAAATGAA |
P | CTGTAAAATGAATTAGTTAACATATAT[FAM-dT]G[THF][BHQ-dT]CATAAAAATGCATTCT-C3 |
1: 35℃; 2: 36℃; 3: 37 ℃; 4: 38℃; 5: 39℃; 6: 40℃; 7: ddH2O
图2 VpAHPND 实时荧光RAA法反应温度的优化结果
Fig.2 Optimization of reaction temperature for VpAHPND
real-time fluorescence RAA method







