CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
液相色谱-四极杆/静电场轨道阱高分辨质谱测定植物油中8种真菌毒素
作者:祝伟霞 于卓然 郁露 刘亚风 魏蔚
祝伟霞 于卓然 郁露 刘亚风 魏蔚
祝伟霞 1 于卓然 2 郁 露 1 * 刘亚风 1 魏 蔚 1
摘 要 本研究建立了高效液相色谱-静电场轨道阱选择离子扫描质谱快速测定植物油中黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、黄曲霉毒素M1、赭曲霉毒素A、伏马毒素B2、玉米赤霉烯酮8种真菌毒素的方法。样品采用氯化钠盐析,甲醇-水(70∶30, v/v)溶液提取,正己烷除脂,经振荡、超声、离心和过滤前处理后即可进行测定,无需进一步净化。采用电喷雾正离子选择离子全扫描模式,基质外标法定量测定8种真菌毒素。在优化的实验条件下,8种真菌毒素浓度与对应峰面积线性关系良好,相关系数r≥0.9975,定量限在0.2~5.0 μg/kg之间,方法回收率为72.4%~108.3%,相对标准偏差(n = 6)在3.5%~15.0%之间。结果表明,该方法操作简单、灵敏度高,能够满足植物油中多种真菌毒素的快速检测要求。
关键词 液相色谱-四级杆/静电场轨道阱高分辨质谱;真菌毒素;黄曲霉毒素;植物油
Determination of 8 Mycotoxins in Plant Oil by Quadrupole Tandem Orbitrap High-resolution Mass Spectrometry
ZHU Wei-Xia 1 YU Zhuo-Ran 2 YU Lu 1* LIU Ya-Feng 1 WEI Wei 1
Abstract A method employing liquid chromatography-quadruplole tandem orbitrap high resolution mass spectrometry (Q-Exactive Targeted MS/MS) was developed to simultaneously analyze aflatoxins B1, B2, G1, G2, M1, ochratoxin A, fumonisin B2, zearalenone in plant oil. The plant oil sample underwent salting out with sodium chloride, followed by extraction with methanol-water (70:30, v/v) and defatting with n-hexane. After oscillation, ultrasound, centrifugation and filtration, samples can be measured without further purification. The analytes were determined by mass spectrometry using electrospray ionization in positive select ion full scanning mode and the quantification was implemented with matrix external standard method. The proposed method demonstrated excellent linear correlation with the correlation coefficients all above 0.9975. The limits of quantification (LOQs) ranged from 0.2 μg/kg to 5.0 μg/kg. The recovery rates ranged from 72.4% to 108.3%, with relative standard deviations (RSDs) between 3.5% and 15.0%. The method offers advantages in both simplicity and sensitivity, making it suitable for the rapid determination of mycotoxins in plant oil.
Keywords liquid chromatography-quadrupole tandem orbitrap high resolution mass spectrometry; mycotoxins; aflatoxins; plant oil
第6卷 第11期
2024年11月
分析化学 / Analytical Chemistry
基金项目:海关总署科研项目(2020HK227)
第一作者:祝伟霞(1979—),女,汉族,河南太康人,硕士,高级工程师,主要从事食品安全检测工作,E-mail: 36512248@qq.com
通信作者:郁露(1970—),女,汉族,河南郑州人,本科,工程师,主要从事食品安全检测工作,E-mail:469000105@qq.com
1. 郑州海关技术中心 郑州 450008
2. 上海海关 上海 200002
1. Zhengzhou Customs Technology Center, Zhengzhou 450008
2. Shanghai Customs, Shanghai 200002
真菌毒素是某些霉菌在生长过程中产生的二次代谢有毒产物,目前有300多种有毒的真菌次生代谢产物,其结构多样,物理化学性质也千变万化[1-2]。在这些代谢物中,黄曲霉毒素类、赭曲霉毒素、伏马毒素类以及玉米赤霉烯酮对人体健康危害大,超过一定摄入量后易损坏人的肝肾功能,致癌、致畸并诱发免疫抑制性疾病[3-4]。植物油是人们日常摄入的主要粮油制品,关系到大众健康,其安全问题不容忽视[5-6]。因此,建立植物油中多种真菌毒素污染物检测方法是非常必要的。
真菌毒素的检测主要有光谱法[7-8]、酶联免疫法[9]、薄层色谱法[10]、高效液相色谱法[11]、液相色谱-质谱法(LC-MS)[12-13]等。光谱法与酶联免疫法常用于真菌毒素的快速筛查,液相色谱法在测定过程中需进行衍生化处理;液相色谱-质谱法虽能提供丰富的结构信息并实现同时定性定量分析,却难以获得待测物的精确分子量。当前发布的检测标准多聚焦于单一类别真菌毒素的测定。本研究联合液相色谱的分离能力与高分辨质谱的精确检测技术,旨在进一步提升现在检测效果。在参考液相色谱-质谱法文献资料的基础上,考察了各参数对测定的影响,确定了操作过程中多个关键控制点,建立了高效液相色谱-静电场轨道阱质谱快速测定植物油中8种真菌毒素的方法。
1 实验部分
1.1 试剂与仪器
Q-Exactive液相色谱质谱联用系统(美国ThermoFisher Scientific公司);OASIS HLB柱和PRiME HLB柱(均为6 mL/200 mg,美国Waters公司);免疫亲和柱(IAC,3 mL,天津博纳艾杰尔科技有限公司);5210型超声波清洗器(美国Bransonic公司);SA-31振荡器(日本大和公司);24位固相萃取装置(上海安谱公司);CF15RXII离心机(日本Hitachi公司);标准品黄曲霉毒素B1(AF B1)、黄曲霉毒素B2(AF B2)、黄曲霉毒素G1(AF G1)、黄曲霉毒素G2(AF G2)、黄曲霉毒素M1(AF M1)购于美国Sigma公司,纯度均>98%;伏马毒素B2(F B2)、玉米赤霉烯酮(ZEN)和赭曲霉毒素A(OTA)购于上海安谱实验公司,纯度均≥99%;甲醇、乙腈(色谱纯,美国ThermoFisher公司);甲酸(色谱纯,美国Tedia公司);实验用水为经Milli-Q纯水系统(美国Millipore公司)过滤的超纯水(电阻率≥18 MΩ·cm-1)。
1.2 标准溶液配制
标准储备溶液:分别准确称取10.0 mg标准品于100 mL容量瓶中,用甲醇溶解并定容,配制成100.0 mg/L的标准储备溶液,于-18℃下避光保存,有效期6个月;取上述单标储备液用甲醇-水(1∶1,v/v)稀释成质量浓度为1.0 mg/L的混合工作液,于4℃下储存,有效期1个月;将混合工作液用甲醇-0.1%(v/v)甲酸水溶液(1∶4,v/v)稀释成试剂混合标准溶液;用空白样品提取液将标准储备溶液配制成适当浓度的基质混合标准工作溶液,基质混合标准工作溶液现配现用。
1.3 样品前处理
称取5.0 g植物油,置于50 mL聚四氟乙烯离心管中,加入1.0 g氯化钠,再加入70%(体积分数,下同)甲醇水溶液25 mL,涡旋振荡5 min,超声提取10 min,然后在4000 r/min转速下离心10 min,弃去油层,加入10 mL甲醇饱和的正己烷净化后弃去上层,下层溶液过0.22 μm微孔滤膜,供HPLC-Q/Exactive测定。
1.4 仪器条件
色谱条件:色谱柱:Hypersile Gold C18色谱柱,(100 mm×2.1 mm,1.9 μm);流动相A:甲醇;流动相B:0.1%甲酸的水溶液;洗脱条件:0~0.5 min,15%A;0.5~2 min,15%~50%A;2~5 min,50%~75%A;5~7 min, 75%~80%A;7~7.5 min,80%~15%A;7.5~11 min,15%A。六通阀位置:0~1.4 min至废液,1.4~8.0 min进质谱仪,8.0 min后至废液;流速:300 μL/min;柱温:30℃;进样体积:10 μL。
质谱条件:离子源:HESI;喷雾电压:3800 V(正离子模式);气化温度:300℃;鞘气压(N2):241.3 kPa;辅助气压(N2):69.0 kPa;离子传输管温度:320℃;质量扫描范围:m/z 50~900 amu;全扫描分辨率70000 FWHM,自动增益1×106,进样时间50 ms;二级扫描:分辨率15000 FWHM,自动增益2×105,进样时间100 ms;碰撞能量50 eV。8 种真菌毒素标准溶液的选择离子流图如图1所示。在本实验仪器条件下8种真菌毒素检测离子的精确质量数及质量偏差见表1。
2 结果与讨论
2.1 提取方法的优化
植物油中提取真菌毒素加入氯化钠产生盐析效应,可降低基质中亲水性成分的溶解度,提高样品提取效率。但是考虑到加入氯化钠会影响质谱离子化效果,降低响应值,故实验通过考察8种真菌毒素的回收率来确定植物油提取过程中是否需要添加氯化钠。由图2可以看出,加入氯化钠后8种真菌毒素的提取效率均提高。因此,实验选择在样品提取时加入氯化钠。
2.2 净化方法的优化
由于植物油中干扰物质较多,为了尽量避免这些杂质的干扰,实验尝试通过增加SPE净化步骤来优化提取过程。考虑到待测物质的化学性质,实验采用PRiME HLB柱、HLB柱、IAC柱对提取效率进行考察。将加标的空白植物油按照1.3的前处理方法提取后,取5 mL样液过PRiME HLB柱,分别取2.5 mL样液加5 mL水过HLB固相萃取柱和IAC净化柱。由图3可以看出,因免疫亲和柱具有净化效果,同时有富集作用,经IAC柱处理后各目标分析物回收率在78.2%~98.9%之间,与未经净化效果相当。而经其他两种柱净化后的回收率均低于只用溶剂提取的回收率。因此,为了节约成本,缩短前处理过程,实验最终选择不经SPE净化的方法。
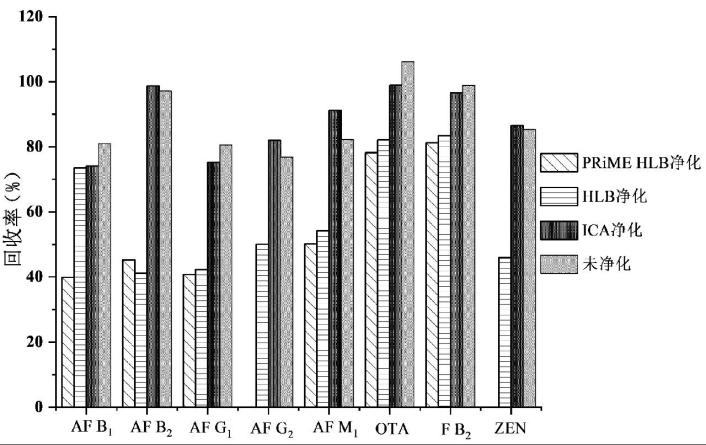
图3 SPE净化过程对真菌毒素的回收率的影响
Fig.3 Effect of the SPE clean-up step on the recoveries of the mycotoxins
2.3 真菌毒素标准溶液保存介质优化
实验将8种真菌毒素标准溶液浓度为5 μg/L,分别存放于未灭活与经硅烷化灭活后的玻璃进样瓶中,在0.5 h、3 h、12 h、24 h时测定标准溶液的稳定性。分析结果表明,存放于未灭活进样瓶中,AF B1、AF B2、AF G1、AF G2、AF M1在24 h内降解率近50%,OTA、F B2和ZEN的响应强度未发生变化;存放于经硅烷化灭活进样瓶中,24 h内8种真菌毒素的仪器响应强度未发生变化。AF B1、AF B2、AF G1、AF G2、AF M1在未灭活进样瓶中易产生吸附降解现象,因此本方法采用硅烷化去活玻璃进样瓶存放真菌毒素标准溶液。
2.4 定量方法的优化
由于样品中8种真菌毒素存在基质抑制效应,采用试剂混合标准溶液外标曲线定量的准确度较差,而且目前没有稳定的商品化的同位素标准品,为了弥补基质抑制效应,常采用基质标准溶液进行定量分析。由于不同商家出售的植物油样品的基质效应存在差异,为了保证准确定量,本方法采用基质标准曲线和标准加入两种方法联合进行定量。对于不含8种真菌毒素的植物油,采用阴性基质匹配标准曲线进行分析;对于含有8种真菌毒素的植物油,添加不同水平的目标物于样品中,根据线性方程计算分析物的本底值,实现分析物的准确定量。实验结果显示,8种真菌毒素中AF B1、AF B2、AF G1、AF G2、AF M1、OTA、F B2和ZEN受基质效应的抑制率在14.2%~48.4%之间。
2.5 方法定量限、线性范围、回收率与精密度
在植物油样品中添加不同浓度的混合标准工作溶液,按1.3方法处理后测定,定量离子的峰面积(Y)对质量浓度(X,μg/kg)呈良好线性关系(r≥0.9975),方法定量限(LOQ)为0.2~5.0 μg/kg,见表2,LOQ均低于国家标准中真菌毒素限量标准,满足限量检测的要求。
表2 植物油中8种真菌毒素的线性范围、相关系数及定量限
Table 2 Linear range, correlation coefficient, and limit of quantification for 8 mycotoxins in vegetable oils
化合物 | (μg/kg) | 线性方程 | 相关系数r | (μg/kg) |
AF B1 | 0.1~200 | Y = 353108X ‒ 70367 | 0.9986 | 0.5 |
AF B2 | 0.2~200 | Y = 95553.4X ‒ 31672.8 | 0.9983 | 2.0 |
AF G1 | 0.1~200 | Y = 319723X ‒ 66307.7 | 0.9981 | 0.5 |
AF G2 | 0.2~200 | Y = 86339.2X ‒ 42675.2 | 0.9975 | 2.0 |
AF M1 | 0.1~200 | Y = 349459X ‒ 46114 | 0.9996 | 0.5 |
OTA | 0.1~200 | Y = 361040X ‒ 18505.4 | 0.9998 | 0.5 |
F B2 | 1.0~200 | Y = 55945X ‒ 14896.7 | 0.9996 | 5.0 |
ZEN | 1.0~200 | Y = 71665.5X ‒ 31775.2 | 0.9993 | 5.0 |
在阴性植物油样品中分别添加1倍、2倍、5倍LOQ的3个水平的试剂混合标准溶液,每个浓度平行测定6次,基质匹配标准曲线定量。结果如表3所示,8种真菌毒素3个添加水平回收率为72.4%~108.3%,RSD为3.5%~15.0%。
表3 植物油中8种真菌毒素加标回收率及精密度(n = 6)
Table 3 Recoveries and precision of spiked samples for 8 mycotoxins in vegetable oils (n = 6)
化合物 | 加标水平 (μg/kg) | 平均回收率 (%) | 相对标准偏差 (%) |
AF B1 | 0.5 | 72.4 | 13.8 |
1.0 | 82.4 | 7.6 | |
2.5 | 80.3 | 4.5 | |
AF B2 | 2.0 | 97.5 | 15 |
4.0 | 89.6 | 8.2 | |
10 | 92.5 | 3.5 | |
AF G1 | 0.5 | 89.3 | 10.6 |
1.0 | 78.6 | 8.3 | |
2.5 | 75.4 | 4.3 | |
AF G2 | 2.0 | 108.3 | 9.8 |
4.0 | 83.2 | 7.6 | |
10 | 84.5 | 6.9 | |
AF M1 | 0.5 | 90.6 | 8.6 |
1.0 | 84.0 | 6.3 | |
2.5 | 82.4 | 5.4 | |
OTA | 0.5 | 98.4 | 5.6 |
1.0 | 96.3 | 6.3 | |
2.5 | 98.0 | 5.5 | |
F B2 | 5.0 | 96.8 | 6.2 |
10.0 | 96.3 | 5.3 | |
25.0 | 97.8 | 5.1 | |
ZEN | 5.0 | 72.6 | 8.6 |
10.0 | 74.0 | 6.4 | |
25.0 | 76.8 | 5.4 |
3 结论
本研究建立了一种采用四极杆-轨道阱质谱测定植物油中8种真菌毒素的分析方法,并考察了真菌毒素分析过程中的主要影响因素。用氯化钠盐析,甲醇-水(体积比为70∶30)溶液提取,正己烷除脂后进行检测。结果表明,该方法快速、简便,灵敏度、准确度高,能够满足植物油中真菌毒素的检测要求。
参考文献
[1] 陆智, 李亚贤, 刘凤松, 等. QuEChERS结合UPLC-MS/MS同时测定植物固体饮料中13种真菌毒素[J/OL]. 食品工业科技. 2024: 1-15.
[2] 黄忠亮, 王海波, 廖强, 等. 液质联用法结合自动固相萃取同时测定药食同源杂粮中14种真菌毒素[J]. 粮食与油脂. 2024, 37(8): 146-150.
[3] Ruan, H., Lu, Q., Wu, J., et al. Hepatotoxicity of food-borne mycotoxins: molecular mechanism, anti-hepatotoxic medicines and target prediction. Critical reviews in food science and nutrition. 2021, 62 (9): 2281-2308.
[4] Moretti, A., Susca, A., Mulé, G., et al. Molecular biodiversity of mycotoxigenic fungi that threaten food safety. International journal of food microbiology. 2013, 167(1): 57-66.
[5] 高琳, 张瑶, 王紫昕, 等. 食用植物油中常见污染物的来源、控制及检测方法[J]. 食品安全导刊. 2022 (12): 156-158.
[6] 卢晓蕊, 班楠, 崔杉, 等. 食用植物油抽检过程质量控制措施[J]. 食品安全质量检测学报. 2021, 12(19): 7813-7817.
[7] 李华英, 闫文婧, 李进春, 等. 粮油中多种真菌毒素检测技术研究进展[J]. 农产品加工. 2023(12): 67-70.
[8] 杨雪倩, 于慧春, 殷勇, 等. 拉曼光谱法检测玉米中黄曲霉毒素B1和玉米赤霉烯酮[J]. 核农学报. 2021, 35(1): 159-166.
[9] 陈聪聪, 常春立, 李超. 室温对酶联免疫法测定玉米中真菌毒素的影响[J]. 现代食品. 2022, 28 (12): 165-168.
[10] 赵亮. 粮油食品中的黄曲霉毒素检测技术分析[J]. 现代食品. 2021(14): 47-49.
[11] 李宗旺, 叶金, 李丽, 等. 多合一免疫磁珠全自动净化高效液相色谱法测定辣椒粉中5种真菌毒素[J]. 农产品质量与安全. 2024 (2): 55-61.
[12] 吴雪莹, 戴琴, 付睿婕, 等. 高效液相色谱-质谱法测定6种玉米赤霉醇类真菌毒素[J]. 食品工业. 2024, 45 (7): 296-301.
[13] Sarkar, R., Shinde, R., Dhanshetty, M., et al. Multi-mycotoxin analysis method using liquid chromatography with tandem mass spectrometry and fluorescence detection in Indian medicinal herbs: Development and validation[J]. Journal of chromatography A. 2022, 1677: 463310.

图1 8 种真菌毒素标准溶液的选择离子流图(2 μg/L)
Fig.1 Choice ion chromatograms of a standard mixture of the 8 mycotoxins (2 μg/L)
表1 8种真菌毒素母离子及碎片离子的精确质量数和质量偏差
Table 1 Accurate mass and quality deviation of precursor ion and fragment ions of 8 mycotoxins
化合物 | 质谱信息 | 母离子 | 碎片离子1 | 碎片离子2 | 碎片离子3 | 碎片离子4 |
AF B 1 | 质量偏差 (ppm) | - 0.595 | - 0.680 | - 0.690 | - 0.645 | - 0.745 |
AF B 2 | 质量偏差 (ppm) | - 0.835 | - 0.835 | - 0.790 | - 0.740 | - 0.545 |
AF G 1 | 质量偏差 (ppm) | - 0.639 | - 0.655 | - 0.481 | - 0.770 | - 0.785 |
AF G 2 | 质量偏差 (ppm) | - 0.759 | - 0.789 | - 0.715 | - 0.665 | - 0.770 |
AF M 1 | 质量偏差 (ppm) | - 0.939 | - 0.770 | - 0.620 | - 0.475 | - 0.391 |
OTA | 质量偏差 (ppm) | - 1.125 | - 0.533 | - 0.298 | - 1.333 | - 0.046 |
F B 2 | 质量偏差 (ppm) | - 9.85 | - 0.220 | - 1.021 | 0.089 | 0.083 |
ZEN | 质量偏差 (ppm) | - 0.243 | - 0.146 | - 0.191 | - 0.111 | - 0.086 |

图2 氯化钠对真菌毒素回收率的影响
Fig.2 Effect of NaCl on the recoveries of the mycotoxins







