CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
单核细胞增生李斯特氏菌与副溶血性弧菌RPA-CRISPR/Cas12a检测方法的建立
作者:谢晓倩 史梅梅 杨俊 王昱 汪琳 唐昌杰 姚嘉悦 聂福平
谢晓倩 史梅梅 杨俊 王昱 汪琳 唐昌杰 姚嘉悦 聂福平
谢晓倩 1 史梅梅 1 杨 俊 1 王 昱 1 汪 琳 2 唐昌杰 1 姚嘉悦 1 聂福平 1 *
摘 要 本研究建立了快速检测单核细胞增生李斯特氏菌(Listeria monocytogenes,LM)与副溶血性弧菌(Vibrio parahaemolyticus,VP)的重组酶聚合酶等温扩增(Recombinase polymerase amplification,RPA)方法。根据单核细胞增生李斯特氏菌hlyA基因和副溶血性弧菌tlh基因设计合成引物和CRISPR RNA(cr RNA),合成荧光标记ssDNA探针,建立RPA-CRISPR/Csa12a检测方法。对建立方法的特异性、灵敏度进行检测,并通过人工污染样本对方法进行验证。结果显示,建立的RPA-CRISPR/Cas12a方法可特异性检出单核细胞增生李斯特氏菌和副溶血性弧菌靶标基因,且不与大肠埃希氏菌、金黄色葡萄球菌、沙门氏菌、伊氏李斯特菌等常见致病菌发生交叉反应;灵敏度试验结果显示,对于质粒标准品,副溶血性弧菌检出限为27 copies/μL,单增李斯特菌检出限为21 copies/μL;人工污染样品检测结果显示,本方法可以准确快速地检出样品中的单核细胞增生李斯特氏菌和副溶血性弧菌。该方法特异性良好,灵敏度高,不依赖温度循环装置,可实现采样现场快速检测,提升检测效率。
关键词 单核细胞增生李斯特氏菌;副溶血性弧菌;等温扩增;CRISPR/Cas12a
Establishment of CRISPR/Cas12a System Combined with Recombinase Polymerase Amplification Method for Detection of Listeria monocytogenes and Vibrio parahaemolyticus
XIE Xiao-Qian1 SHI Mei-Mei1 YANG Jun1 WANG Yu1
WANG Lin2 TANG Chang-Jie1 YAO Jia-Yue1 NIE Fu-Ping1*
Abstract This study established a RPA-CRISPR/Cas12a method for detecting Listeria monocytogenes and Vibrio parahaemolyticus. Primers and CRISPR RNA (crRNA) were designed and synthesized based on the hlyA gene sequence of L. monocytogenes and the tlh gene sequence of V. parahaemolyticus, respectively. Fluorescently labeled ssDNA probes were synthesized to establish the RPA-CRISPR/Cas12a detection method. The specificity and sensitivity of the established method were tested, and the method was verified by artificial contaminated samples. The results showed that the established RPA-CRISPR/Cas12a method could specifically detect the target genes of Listeria monocytogenes and Vibrio parahaemolyticus without cross-reaction with common pathogens including Escherichia coli, Staphylococcus aureus, Salmonella and Listeria eiderii. Sensitivity test results showed that for plasmid standards, the detection limit for Vibrio parahaemolyticus was 27 copies/μL, and for Listeria monocytogenes, it was 21 copies/μL. Artificially contaminated sample detection results showed that the method could accurately and rapidly detect Listeria monocytogenes and Vibrio parahaemolyticus in samples. The method has good specificity, high sensitivity, does not require a temperature cycling device, and can achieve rapid detection on-site and improved detection efficiency.
Keywords Listeria monocytogenes; Vibrio parahaemolyticus; isothermal amplification; CRISPR/Cas12a
基金项目:重庆市技术创新与应用发展专项科研项目(CSTB2022TIAD-GPX0058);重庆海关关级科研项目(2021CQKY12)
第一作者:谢晓倩(1995—),女,汉族,河南平顶山人,硕士,兽医师,主要从事微生物检验工作,E-mail: 973992276@qq.com
通信作者:聂福平(1980—),女,汉族,重庆人,博士,正高级兽医师,主要从事动物疫病与病原微生物分子诊断研究工作,E-mail: nie1626@163.com
1. 重庆海关技术中心 重庆 400020
2. 中国海关科学技术研究中心 北京 100000
1. Chongqing Customs Technology Center, Chongqing 400020
2. Science and Technology Research Center of China Customs, Beijing 100000
单核细胞增生李斯特氏菌(Listeria monocy- togenes,LM)(以下简称“单增李斯特菌”)和副溶血性弧菌(Vibrio parahaemolyticus,VP)是能够引起人类疾病的重要食源性病原微生物,也是我国食源性致病菌重要检测指标[。单增李斯特菌生命力顽强,耐低温,能在冷链环境中存活和繁殖,是重要的人畜共患病原体[-。副溶血性弧菌天然存在于海洋环境中,若误食则可能导致胃肠炎、伤口感染和败血症[。因此,建立快速、准确、灵敏的检测方法对于预防食源性疾病具有重要意义。
目前,LM和VP的检测方法主要有传统培养分离鉴定法、全自动鉴定系统[、免疫学检测方法[9-10]、分子生物学检测方法[11]等。这些方法各具优势,但往往检测周期较长,需要大型设备,无法即时反应结果。传统的培养鉴定方法虽然成本低,但步骤繁琐,检测周期需一周以上,且特异性不强。免疫学方法利用抗原-抗体特异性反应,特异性强,检测时间相对较短,但成本高,操作复杂[12]。以聚合酶链式反应(Polymerase Chain Reaction,PCR)为代表的分子生物学检测方法,灵敏度高,稳定性好,但依赖于昂贵精确的热循环设备[。有研究者建立可同时检测水产品中LM和VP的多重PCR方法,单重条件下灵敏度可达pg级别,但多重条件下灵敏度低于单重PCR[13],暴露出多重PCR扩增效率较低,对引物设计要求较高等缺点。等温扩增则只需要单一反应温度,与传统PCR相比,降低了对仪器设备的要求,同时大大缩短扩增时间[14-15],环介导等温扩增(Loop-Mediated Isothermal Amplification,LAMP)和重组酶聚合酶等温扩增(Recombinase Polymerase Amplification,RPA)技术已被迅速应用于源性成分[16-18]、过敏原[19]、食源性致病菌[20-22]等检测领域。
规律成簇间隔短回文重复序列(Clustered Regularly Interspaced Short Palindromic Repeats,CRISPR)系统是细菌适应性免疫系统的组成部分,近年来已成为新兴的强大基因编辑工具,并逐渐被应用于检测领域[4, 6, 23]。CRISPR相关蛋白(CRISPR associated proteins,Cas)由于RuvC和HNH两个催化结构域表现出精确的双链DNA切割活性[24]。在这些蛋白中,Cas12a酶识别短的富含T的原间隔相邻基序(Protospacer-Adjacent Motif,PAM),然后催化CRISPR RNA(crRNA)成熟形成酶-RNA复合物,产生PAM-远端dsDNA断裂。当crRNA与互补DNA链结合后,触发Cas12a强大的非特异性切割任意单链DNA(ssDNA)活性[25]。检测应用中可通过荧光标记ssDNA捕捉检测信号,仅需简单的设备即可实现现场检测[26]。
本研究拟利用RPA结合CRISPR/Cas系统,选取单增李斯特菌与副溶血性弧菌靶标基因,设计特异性引物与crRNA,建立一种快速、准确灵敏的检测方法,以应用于现场单增李斯特菌与副溶血性弧菌检测工作。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
本研究所使用标准菌株均由重庆海关技术中心保存,详细信息见表1。
表1 实验标准菌株
Table 1 Standard test strains
菌株名称 | 菌株编号 | 菌株来源 |
副溶血性弧菌 | ATCC 17802 | 美国标准菌种保藏中心 |
单核细胞增生李斯特氏菌 | ATCC 7644 | 美国标准菌种保藏中心 |
沙门氏菌 | ATCC 13076 | 美国标准菌种保藏中心 |
金黄色葡萄球菌 | ATCC 6538 | 美国标准菌种保藏中心 |
伊氏李斯特菌 | ATCC 19119 | 美国标准菌种保藏中心 |
大肠埃希氏菌 | ATCC 25922 | 美国标准菌种保藏中心 |
1.1.2 试剂
细菌基因组DNA快速抽提试剂盒(NO. B518225,生工生物工程(上海)股份有限公司);李氏增菌肉汤(LB1、LB2)基础(HB4160,青岛高科技工业园海博生物技术有限公司);3%氯化钠碱性蛋白胨水(HB4129-1,青岛高科技工业园海博生物技术有限公司);基础性核酸扩增试剂盒(ERA法)(KS101,苏州先达基因科技有限公司);Cas12a酶(C001M,广州美格生物科技有限公司)。
1.2 仪器与设备
ESCO AC2-4S1生物安全柜(新加坡艺思高科技有限公司);INB 500恒温培养箱(德国美墨尔特有限公司);CHT210R高速离心机(湖南湘仪实验室仪器开发有限公司);GS8荧光恒温扩增仪(苏州先达基因科技有限公司);GelDoc-XR凝胶成像仪(美国BIO-Rad公司)。
1.3 方法
1.3.1 细菌培养及基因组提取
将纯化验证后的单增李斯特菌、副溶血性弧菌、大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌、伊氏李斯特菌等分别接种于相应液体培养基中过夜培养。离心后收集菌体,利用细菌基因组DNA快速抽提试剂盒提取基因组。
1.3.2 引物及探针设计与合成
利用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)在线网站对单增李斯特菌与副溶血性弧菌的基因组序列进行分析,根据基因功能和特性选择hlyA基因(李斯特菌溶血素O编码基因,ID:987033)作为单增李斯特菌检测目的基因,tlh基因(thermolabile hemolysin gene)、副溶血性弧菌不耐热溶血菌素基因,ID:M36437.1)作为副溶血性弧菌检测的靶标基因。利用Primer 5.0软件设计引物,根据引物扩增序列设计crRNA,序列见表2。
表2 引物和探针序列
Table 2 Sequences of primers and probes
名称 | 序列 (5'-3' ) |
>hlyA-F | CTAGCTCATTTCACATCGTCCATCTATTTG |
>hlyA-R | GCCCCAGATGGAGATATTTCTATTTTTCAC |
>tlh-F | GTATTTACTCAGAATTAGAGGGTTTAGTGAGA |
>tlh-R | CGAACATAGGTATAGGTTTGGTTTTCTTGC |
hlyA-crRNA | AUGCACUGGUUUAG |
tlh-crRNA | GGGUCAAUAACCAU |
ssDNA | FAM-TTATT-BHQ1 |
1.3.3 质粒标准品的制备
以单增李斯特菌和副溶血性弧菌基因组DNA作为模板,用对应的引物分别进行PCR扩增,将扩增出的目的条带进行胶回收,连接至pMD-19T载体后转化至感受态细胞,挑取阳性克隆菌液PCR后测序验证。选取测序正确的菌液进行扩大培养,提取质粒标准品。测定质粒浓度,并计算单位体积中质粒的拷贝数,保存于-80℃备用。
1.3.4 检测方法反应体系及反应条件
RPA扩增体系见表3,扩增程序为:37℃,20 min;95℃,5 min,终止反应。
表3 RPA扩增体系
Table 3 RPA system
试剂 | 体积 (μL) |
溶解剂 | 20 |
正向引物F (10 μmol/L) | 2 |
反向引物R (10 μmol/L) | 2 |
DNA | 4 |
ddH2O | 20 |
激活剂 | 2 |
共计 | 50 |
将RPA产物加在配置好的CRISPR/Cas12a体系的离心管盖上,具体体系见表4,离心后迅速放入荧光恒温扩增仪中检测。
表4 CRISPR/Cas12a体系
Table 4 CRISPR/Cas12a system
试剂 | 体积 (μL) |
Cas12a | 1 |
crRNA | 1 |
ssDNA (FQ) | 1 |
Buffer | 2 |
H2O | 11 |
RPA产物 | 4 |
共计 | 20 |
1.3.5 方法特异性检测
提取金黄色葡萄球菌、沙门氏菌、大肠埃希氏菌、伊氏李斯特菌、单增李斯特菌与副溶血性弧菌等6种细菌的核酸作为DNA模板,利用设计的引物分别进行RPA扩增,将扩增产物加入CRISPR/Cas12a系统中进行剪切反应,观察荧光恒温扩增仪的图像结果,验证建立的检测方法特异性。
1.3.6 方法灵敏度检测
提取单增李斯特菌与副溶血性弧菌阳性质粒,测定浓度进行10倍梯度稀释后作为DNA模板,利用设计的引物分别进行RPA扩增,将扩增产物加入CRISPR/Cas12a系统中进行剪切反应,检测方法灵敏度。
1.3.7 方法重复性与重现性检测
利用单增李斯特菌与副溶血性弧菌阳性质粒,各分为5组,分别进行RPA扩增,将扩增产物加入CRISPR/Cas12a系统中进行剪切反应,计算方法重复性。
利用单增李斯特菌与副溶血性弧菌阳性质粒,分别进行RPA扩增,将扩增产物加入CRISPR-Cas12a系统中进行剪切反应,整个实验重复5次,检测方法重现性。
1.3.8 人工污染样本检测
取样品10 g,分别加入90 mL 3%氯化钠碱性蛋白胨水与LB1液体培养基,再分别接入1 mL不同浓度的副溶血性弧菌与单增李斯特菌菌液,混合均匀,各取1 mL均质液使用细菌基因组DNA提取试剂盒提取核酸进行检测。
1.4 数据分析及图表绘制
分别采用Excel 2010、OriginPro 9软件进行数据分析与绘图。
2 结果与分析
2.1 质粒标准品的制备
以单增李斯特菌和副溶血性弧菌基因组DNA作为模板,用对应的引物分别进行PCR扩增。其中,单增李斯特菌目的条带所在位置约为159 bp,副溶血性弧菌目的条带所在位置约为253 bp,与预计相符,如图1所示。测序结果显示,扩增序列与GenBank中序列相似性达100%。将扩增出的目的条带进行胶回收,连接至pMD-19T载体后转化至感受态细胞,挑取阳性克隆,测序验证。选取测序正确的菌液进行扩大培养,提取质粒标准品。
2.2 方法特异性检测
如图2(a)所示,当以>hlyA引物进行RPA扩增后,将产物加入CRISPR/Cas12a体系,以单增李斯特菌基因组DNA为模板的体系可收集到ssDNA剪切荧光信号,以大肠埃希氏菌、金黄色葡萄球菌、副溶血性弧菌、伊氏李斯特菌、沙门氏菌基因组DNA为模板则无荧光信号;如图2(b)所示,以>tlh引物进行RPA扩增后,将产物加入CRISPR/Cas12a体系,以副溶血性弧菌基因组DNA为模板的体系可收集到ssDNA剪切荧光信号,以大肠埃希氏菌、金黄色葡萄球菌、单增李斯特菌、伊氏李斯特菌、沙门氏菌基因组DNA为模板则无荧光信号。结果表明所设计的引物及crRNA特异性良好,能够准确检测出目的菌株。
2.3 方法灵敏度检测
将构建成功的单增李斯特菌与副溶血性弧菌质粒进行10倍梯度稀释作为DNA模板,以单增李斯特菌>hlyA引物与副溶血性弧菌>tlh引物,进行RPA-CRISPR/Cas12a检测。检测结果如图3所示,单增李斯特菌检测灵敏度为21 copies/μL,副溶血性弧菌检测灵敏度为27 copies/μL。
2.4 重复性与重现性检测
单增李斯特菌取拷贝数为2.1×103 copies/μL的质粒,副溶血性弧菌取拷贝数为2.7×104 copies/μL的质粒,各分为5组,分别进行RPA扩增,将扩增产物加入CRISPR/Cas12a系统中进行剪切反应,5组数据相对标准偏差(Relative Standard Deviation,RSD)均小于5%,证明该方法重复性良好。重复实验5次检测方法重现性,5次实验RSD均小于5%,表明方法重复性良好。
2.5 人工污染样品检测
以人工加入目标菌株的方式污染肉类样品,两组各12份样品。其中,单增李斯特菌污染样品7份,检测结果如图5(a)所示,副溶血性弧菌污染样品5份,检测结果如图5(b)所示,检测结果与实际添加一致。
3 结论与讨论
由于单增李斯特菌和副溶血性弧菌具有较高传播风险,国际性组织、部分国家和地区都对其限量值进行了要求。在我国食品致病菌检测评价体系中,传统的培养分离鉴定方法依然为金标准,但其已不能满足快速检测、动态监控的市场要求。随着致病菌基因测序文库不断完善,以市场需求为导向,基于分子生物学的检测技术相继出现。
本研究以单增李斯特菌的hlyA基因与副溶血性弧菌tlh基因为靶标,设计特异性引物与crRNA,结合RPA与CRISPR/Cas12a技术分别建立检测方法,通过crRNA识别特定PAM序列,激活CRISPR/Cas12a非特异性剪切荧光探针,进一步增加检测方法特异性,二次放大检测信号,具有高度特异性和灵敏性。目前国际上已有一些基于RPA-CRISPR/Cas系统的检测方法被开发应用于病原微生物的快速检测,研究者开发了基于RPA结合试纸条或荧光基团等方法来快速检测LM、VP[4,6,7]。与RPA结合试纸条或荧光RPA方法相比,本研究建立的方法具有更高的灵敏度。例如,刘小青等[27]建立的RPA-exo副溶血性弧菌检测方法,质粒检测限为1×103 copies/μL,本研究建立的检测方法检测限为27 copies/μL。在检测时长方面,传统的单增李斯特菌与副溶血性弧菌检测均需要进行增菌、分离培养及生化鉴定,大约需要5~7 d,本研究建立的检测方法可根据样品污染情况进行增菌或不增菌,检测时长可缩短至1 d。此外,单增李斯特菌与副溶血性弧菌分别为李斯特菌属与弧菌属,在生化特征方面与同属菌株较为相似,传统检测方法往往难以区分,而本研究建立的检测方法可作为补充,进一步提高检测准确度。与PCR和荧光定量PCR相比,本实验反应条件温和,在37℃即可达到良好的反应,减少对大型仪器设备的依赖,使检测场景不局限于实验室而走向监管一线,具有良好的应用前景。
参考文献
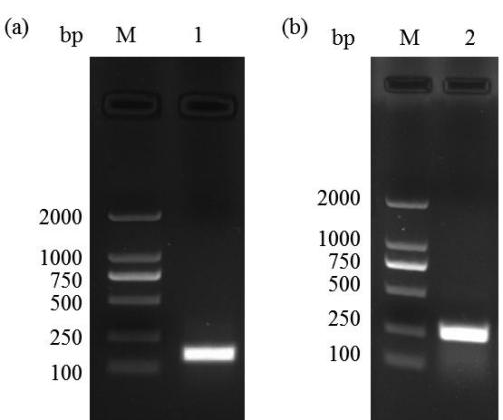
M: marker; 1: 单增李斯特菌; 2: 副溶血性弧菌
图1 目的基因的扩增(a)单增李斯特菌hlyA基因片段(b)副溶血性弧菌tlh基因片段
Fig.1 Amplification of hlyA gene (a) of LM and tlh gene of VP (b)
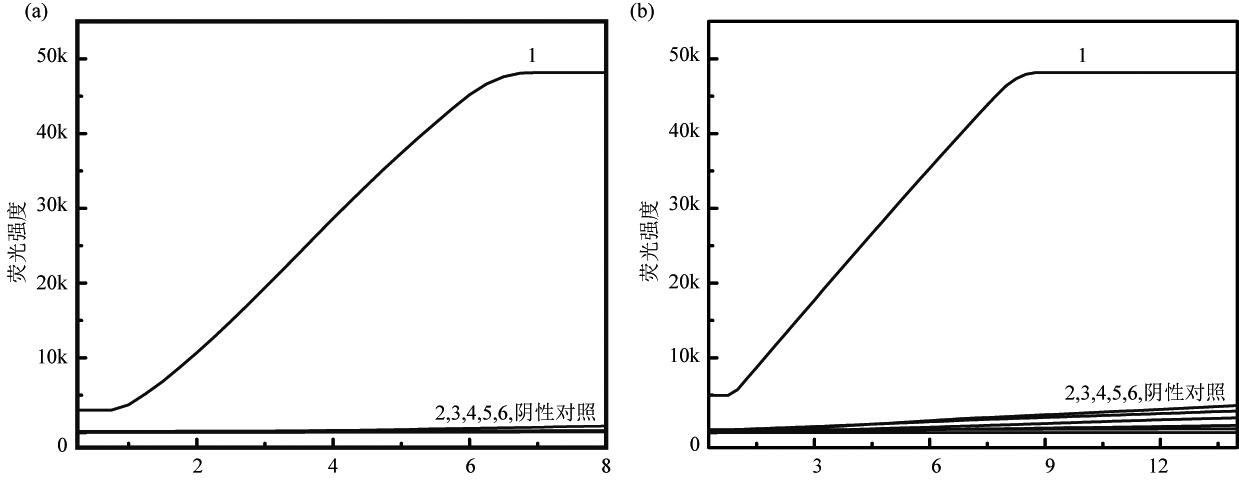
时间 (min)
时间 (min)
(a) 单增李斯特菌RPA-CRISPR/Cas12a方法特异性检测: 1为单增李斯特菌基因组DNA, 2~6分别为大肠埃希氏菌、金黄色葡萄球菌、副溶血性弧菌、伊氏李斯特菌、沙门氏菌基因组DNA, NC为灭菌去离子水; (b) 副溶血性弧菌RPA-CRISPR/Cas12a方法特异性检测: 1为副溶血性弧菌基因组DNA, 2~6分别为大肠埃希氏菌、金黄色葡萄球菌、单增李斯特菌、伊氏李斯特菌、沙门氏菌基因组DNA, NC为灭菌去离子水
图2 RPA-CRISPR/Cas12a方法特异性检测(a)单增李斯特菌(b)副溶血性弧菌
Fig.2 Specificity of Listeria monocytogenes (a) and Vibrio parahaemolyticus (b) by RPA-CRISPR/Cas12a system
单增李斯特菌RPA-CRISPR/Cas12a方法灵敏度检测: 1~7质粒浓度分别为2.1×105 copies/μL、2.1×104 copies/μL、2.1×103 copies/μL、2.1×102 copies/μL、21 copies/μL、2.1 copies/μL、0.21 copies/μL, NC为灭菌去离子水; (b) 副溶血性弧菌RPA-CRISPR/Cas12a方法灵敏度检测: 1~7质粒浓度分别为2.7×105 copies/μL、2.7×104 copies/μL、2.7×103 copies/μL、2.7×102 copies/μL、27 copies/μL、2.7 copies/μL、0.27 copies/μL, NC为灭菌去离子水; (c) 和 (d) 分别为单增李斯特菌与副溶血性弧菌阳性质粒拷贝数对数与荧光强度线性关系.
图3 方法灵敏度检测结果
Fig.3 Results of sensitivity of RPA-CRISPR/Cas12a systems


(a) 单增李斯特菌RPA-CRISPR/Cas12a方法重复性检测; (b) 单增李斯特菌RPA-CRISPR/Cas12a方法重现性检测; (c) 副溶血性弧菌RPA-CRISPR/Cas12a方法重复性检测; (d) 副溶血性弧菌RPA-CRISPR/Cas12a方法重现性检测.
图4 方法重复性与重现性检测结果
Fig.4 Results of repeatability and reproducibility of RPA-CRISPR/Cas12a systems

时间 (min)
时间 (min)
(a)人工污染单增李斯特菌样品检测结果: 1~7为人工添加单增李斯特菌样品, 8~12为肉类基质样品; (b) 人工污染副溶血性弧菌样品检测结果: 1~5为人工添加副溶血性弧菌样品, 6~12为肉类基质样品.
图5 人工污染样品检测结果
Fig.5 Test results of artificially contaminated samples







