CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
中远红外光谱结合PLS-DA算法对非洲象牙与常见仿制品的鉴别
作者:王波 解迎双 王娟 张红艳 王慧珺 苏倡 蒲静 刘阿静
王波 解迎双 王娟 张红艳 王慧珺 苏倡 蒲静 刘阿静
杜思乐 1 刘朋朋 1 汪 琳 1 徐子涵 1 白子龙 1 高志强 1 李小林 1 张竣宇 2 蒲 静 1 *
摘 要 本研究基于某机场海关在鱼胶产品中发现一头昆虫幼虫,通过图像采集、外部形态特征比对,同时结合DNA 条形码技术,应用3对通用引物(Cytb、COⅠ、16S rRNA)对未知昆虫幼虫3个部位进行核酸提取及基因扩增,精准鉴定为白腹皮蠹Dermestes maculatus(Degeer,1774),并与GenBank数据库中已知皮蠹属(Dermestes)下典型种的COⅠ参考序列进行系统发育分析。本研究提供的白腹皮蠹D. maculatus鉴定方案可为防范有害生物侵害与传播、快速检疫鉴定提供技术支撑。
关键词 白腹皮蠹;幼虫;外部形态特征;DNA条形码
Identification of Dermestes Maculatus Larva Based on M orphology and DNA B arcoding
DU Si-Le1 LIU Peng-Peng1 WANG Lin1 XU Zi-Han1
BAI Zi-Long1 GAO Zhi-Qiang1 LI Xiao-Lin1 ZHANG Jun-Yu2 PU Jing1*
Abstract This study is based on the discovery of an insect larva in fish glue products by an airport customs. By using image collection, external morphological characteristics comparison and DNA barcoding technology, the study focuses on three pairs of universal primers (Cytb, COⅠ, 16S rRNA) to extract nucleic acid and amplify genes from three parts of tissues in the unknown insect larva. After accurate identification, Dermestes maculatus (Degeer, 1774) was confirmed and conducted by phylogenetic analysis with the COⅠreference sequence of the known typical species of Dermestes in GenBank database. The identification scheme of D. maculatus can help customs prevent the invasion and spread of harmful organisms, and provide technical support for rapid quarantine and identification.
Keywords Dermestes maculatu; larva; external morphological characteristics; DNA barcoding
白腹皮蠹(Dermestes maculatus Degeer,1774)是一类重要的储藏物害虫,隶属于皮蠹科(Dermestidae)、皮蠹亚科(Dermestinae),早在1774年就被Degeer正式命名,现呈世界性分布,我国主要分布在南方地区。该害虫主要侵害干燥或储藏的动植物材料,食性杂,繁殖力强,可以忍耐环境中极低的湿度完成生活世代,幼虫有钻蛀木头等坚硬东西的习性,往往隐藏在木材、生皮张、鱼胶等多类货物中,其卵常散产在鱼干、奶粉、皮质、蚕丝、羊毛、蜂蜜、博物馆陈列品等储藏物品的表面,导致商品数量减少或品质损坏,从而影响商品的市场价值,造成一定的经济损失[1–6]。
作为皮蠹科昆虫中的一员,该类群的不同物种大多体型较小,近缘种间形态相似性极高,幼虫形态基本相似,从外部形态鉴别难度较大。尽管针对我国常见的皮蠹鉴定有专著《中国仓储品皮蠹害虫》[1]可以参考,但该书年代相对较早。近些年,Jirí Háva编写了The World Catalogue of the Dermestidae(Coleoptera),系统记述了世界皮蠹科的属种目录及相关信息,但缺乏详细的图像材料[7]。国内外其他论文多集中在常见皮蠹种间成虫的形态对比,但是幼虫的分类鉴定工作一直是形态分类学上的难题[8]。幼虫一般是根据触角类型和上内唇等特征来鉴别,不仅对鉴定人员的分类知识和经验技术要求高[6],对皮蠹害虫的完整性也有一定要求[9–10],针对口岸一线检验人员如何保证鉴定的精准性形成了一定的挑战。
近年来,DNA 条形码技术发展迅速,在皮蠹类昆虫中逐渐开始应用,通过利用生物体中DNA一段保守片段可对物种进行快速准确鉴定,有效去除了“幼虫”阶段的外部形态学不易观察的限制性条件。同时,DNA条形码技术在多种类群中已经形成良好的应用并形成标准。因此,通过形态学和DNA条形码相结合的方式,既能保证物种鉴定的有效性又能保证其精准性,两者相辅相成、相互验证。此类检验方法也可在多种类群中进行应用[11-12]。
鉴于我国的进出口木材、鱼干、生皮张等贸易往来频繁,口岸作为重要的货物运输关口,其干燥的环境及大量的动植物材料产品、制品是白腹皮蠹的天然生境,这些货物中极易携带皮蠹类昆虫。因此,为防止有害生物的入侵与传播,高效识别鉴定白腹皮蠹,以便在未形成规模性侵蚀前及时发现其卵及幼虫,进行一定的消杀工作,有助于保护口岸货物的品质及完整性。本文基于某机场海关送检的样本,对口岸截获的白腹皮蠹幼虫进行图像采集及形态学描述,同时结合DNA条形码技术对其进行精准鉴定,为口岸一线关员现场查验和快速鉴定提供技术支撑。
1 材料和仪器
1.1 材料
样品为2023年4月某机场海关从鱼胶产品中发现一头昆虫幼虫,并对该“鱼胶虫”进行报检。该虫全身黑色或黑褐色,少部分区域为棕褐色,伴有细长、密集的刚毛,头胸腹保存完好。接收样品后,将样品于4℃干燥保存。
1.2 仪器
1.2.1 形态学鉴定仪器
HiROX超景深三维显微镜RX-100电子数字显微镜(上海浩视仪器科技有限公司)。
1.2.2 分子生物学鉴定仪器
冷冻离心机(型号Centrifuge 5415 R,Eppendorf);涡旋振荡器(型号MS3,艾卡(广州)仪器有限公司);加热制冷震荡金属浴(型号SCI-100HCM-Pro,SCILOGEX);全自动核酸提取仪(型号KINGFI-SHER-Duo,Thermo Fisher Scientific);梯度PCR仪(型号TG-9,德国BIOMETRA);电泳仪(型号PowerPac Basic,BIO-RAD公司)。
1.3 试剂
Prefilled Viral Total NA Kit-Duo试剂盒(Thermo Fisher Scientific);蛋白酶 K(20 mg/mL,RT403,天根生化科技有限公司);HS Taq DNA 聚合酶、dNTP、10XEx Taq PCR Buffer、MgCl2、磷酸缓冲液等(TaKaRa);Cytb、COⅠ、16S rRNA三对通用引物的合成及样品测序均委托生工生物工程(上海)股份有限公司。
2 实验方法
2.1 形态学鉴定
2.1.1 显微镜形态学研究
使用HiROX超景深三维显微镜RX-100电子数字显微镜观察送检昆虫样本的背面观、腹面观、侧面观及头、胸、腹各个部分的相关结构,比较触角、口器、腹节、生殖器等外部形态特征,并用Z轴叠加功能采集外部形态特征,形成形态学特征图谱。
2.2 分子生物学鉴定
2.2.1 样本前处理
用磷酸盐缓冲液(Phosphate Buffered Saline,PBS)溶液清洗样本3—4次,使虫体表面清洁干净,不沾染尘土等其他成分。用解剖针、手术剪将幼虫体躯解剖,将其分为足(单侧全部足)、头部、胸腹部三个部分,分别置于3根2.0 mL离心管中,依次标记为1—3号。于3根管中分别加入1 mL PBS溶液和20 μL蛋白酶K,震荡混匀,置入加热制冷震荡金属浴中,37℃过夜消化。
2.2.2 DNA提取
消化后的样品涡旋后10000 rpm离心1 min,采用Fisher Scientific Prefilled Viral Total NA Kit-Duo(Lot No.00LSKFRPD805812E29W009)试剂盒,按照说明书提取DNA。
2.2.3 PCR扩增和测序
根据美国国家生物信息中心(NCBI)数据库和已经发表的皮蠹科基因序列,选择3对通用引物,分别为线粒体基因细胞色素b(Cytb)、线粒体细胞色素氧化酶Ⅰ基因(CO I)和16S rRNA 核糖体RNA基因(16S rRNA)[13-14]同时对样本进行扩增。所用引物由生工生物工程(上海)股份有限公司合成,具体引物序列见表1。
使用梯度PCR仪(Polymerase Chain Reaction,PCR)进行核酸扩增。分别使用3种通用引物Cytb、COⅠ、16S rRNA对“鱼胶虫”幼虫的3份样品核酸进行扩增。反应体系(50 μL):上、下游引物(10 μmol/L)各2.0 μL,2.5 mM dNTP 4.0 μL,10X PCR Buffer 5.0 μL,MgCl2 1.5 μL,ddH2O 30 μL,HS Taq DNA聚合酶0.5 μL,7.2%牛血清白蛋白溶液(Bovine Serum Albumin,BSA)溶液0.5 μL,模板DNA 5.0 μL。PCR程序:第一步,94℃,4 min;第二步,94℃,45 s,50℃,45 s,72℃,1 min,36个循环;第三步72℃,5min,4℃,结束。
3 结果
3.1 外部形态特征鉴定结果
3.1.1 种名
学名:Dermestes maculatus Degeer, 1774
中文名:白腹皮蠹,因该种隶属于皮蠹属Dermestes Linnaeus, 1758,且其腹部腹面被有白色刚毛,故名为白腹皮蠢。
3.1.2 分类地位
鞘翅目Coleoptera Linnaeus, 1758
长蠹总科Bostrichoidea Latreille, 1802
皮蠹科Dermestidae Latreille, 1804
皮蠹亚科 Dermestinae Latreille, 1804
皮蠹族Dermestini Latreille, 1804
皮蠹属Dermestes Linnaeus, 1758
白腹皮蠹Dermestes maculatus Degeer, 1774
3.1.3 幼虫鉴别特征
白腹皮蠹龄期较小的幼虫一般体长7~9 mm,圆筒形,背部隆起,腹面平坦,全身覆盖长短不同的毛,背中线宽而清晰,不纵贯腹末(图1)。两侧触角各3节,基节粗短,着生几根刚毛,且集中一侧,末端不伸达第2 触角端部;第2节无刚毛,细长;第3节狭窄,端部有小尖突(图2A)。头部额前方两侧近前缘并列一对瘤突;上内唇是附在上唇内面的膜质衬里,边缘有1排宽扁至细的缘刚毛。其中,中间2根缘刚毛呈蘑菇状,粗短,各胸足胫节后面缘端在腹面的粗刺与背面的长刚毛之间无刚毛,端部腹面有一对基部相连而端部分叉的粗刺幼虫臀突均弯向前上方。臀突显著向上弯曲至端部,末端会变尖细而较直,其长为基部宽的2倍,由腹部第4或第5背板向后,每一背板具一列强的短刺。随着龄期的增长,幼虫个体会变粗壮,体表会被有许多刚毛,暗褐色,体长增长至10~15 mm,宽约3 mm。如图1、2所示。
3.1.4 成虫鉴别特征
白腹皮蠹的成虫一般体长可达5.5~10 mm,长椭圆形,黑褐色至黑色,体表有光泽。头部为下口式,额上方无中单眼,头部两侧及大部分额区密被白毛。锤状触角,11节,末端3节膨大,赤褐色。前胸背板密布细小刻点,两侧与前缘密被白色或黄白色毛,由此构成1条白色或黄色环状毛带,在侧缘部分的毛带比前缘的宽;中部着生黑色刚毛,杂生稀疏的白色刚毛或黄褐色刚毛;两侧边缘刚毛细,呈均匀弧形。后胸腹板全为白色,前侧片上有一大和椭圆形的黑毛斑并与中侧边接近。鞘翅长形,盖及腹末,鞘翅内缘末端显著突出呈刺状,鞘翅末端边缘具许多小而尖的锯齿,翅面密布细小刻点,密被黑色刚毛,混杂稀疏白色刚毛或淡黄褐色刚毛,无纵毛。腹面大部分密被白色刚毛,第1—5节腹板两侧前角各有1黑色毛斑,第5腹板中央末端具1斧形黑色毛斑,与两侧前角的黑斑间有白色刚毛相隔。雄虫腹部第4节腹面中央有一大而圆的浅窝,窝内生出1束赤色毛,雌虫第4节腹面无浅窝及毛束[15]。如图2所示。

A: 头部腹面观; B: 后足细节图; C: 腹部腹面观 标尺: A=B=C=1 mm
图2 白腹皮蠹幼虫局部特征图
Fig.2 Local charateristics of larvae Dermestes maculatus
3.2 分子生物学鉴定结果
3.2.1 琼脂糖凝胶电泳结果
以通用型引物Cytb-1/2、COⅠ-1/2、16S rRNA进行扩增后,产物通过2%琼脂糖凝胶电泳进行检测,发现以虫体不同部位的DNA分别为模板进行扩增后,PCR结果有所不同。引物Cytb-1/2:足、头部、胸腹部均出现特异性条带;引物16S rRNA-1/2:仅有头部和胸腹部出现特异性条带;引物COⅠ-1/2:足、头部、胸腹部均出现特异性条带,且头部和胸腹部亮度相对较强。将出现特异性条带的样本进行测序,如图3所示。
3.3 基因序列分析结果
利用 DNAMAN 8.0软件将双向测序结果进行拼接,登录美国国家生物技术信息中心(NCBI)进行序列同源性比较分析(http: //www.ncbi.nlm.nih.gov/blast/)。结果显示,本实验所提取的1—3号标本的Cytb、COⅠ、16S rRNA序列比对结果均为白腹皮蠹(Dermestes maculatus),结果一致,覆盖率及相似性见表2。
M: Marker; 1: 足; 2: 头部; 3: 胸腹部
图3 样品Cytb、COⅠ、16S rRNA基因扩增结果
Fig.3 Results of the Cytb、COⅠ、16S rRNA gene amplification in samples
3.4 系统树构建与分析
经过序列同源性比较分析后,查找了NCBI中皮蠹属下Cytb、COⅠ、16S rRNA的全部序列发现Cytb、16S rRNA的有效数据较少,故选择皮蠹属(Dermestes)下典型种的COⅠ序列(表3),包括Dermestes maculatus、Dermestes frischii、Dermestes coarctatus、Dermestes tessellatocollis、Dermestes haemorrhoidalis等,以及测序序列(2023-1、2023-2和2023-3)共同使用Genious软件绘制进化树进行分析(图4),可见测序序列与Dermestes maculatus(白腹皮蠹)在同一分支内,与Dermestes coarctatus种间遗传距离最近。在白腹皮蠹中COⅠ基因扩增效率高,且序列信息量大,能够有效区分其他物种,十分适合白腹皮蠹及其近缘种的物种鉴定及同源分析。
4 讨论
4.1 核酸有效提取
近年来,口岸截获的动物种类越来越多,物种鉴定的需求和精确度日益上升。针对完全变态的物种,其幼虫与成虫的差别很大。因此,需要经验丰富的基础分类学研究学者才能基于外部形态学精准鉴定物种。而物种特异性基因检测的分子鉴定可以有效补足外部形态鉴定经验不足的短板,为口岸物种鉴定提供数据支持。然而,在实际检测中发现,动物类样品的取样部位和核酸提取效率,对能否成功进行分子鉴定影响较大。在本研究中,结合以往的经验,比较了虫体3个部位(单侧全部足、头部、胸腹部)的核酸提取和PCR扩增效果。结果发现,3对DNA条形码的通用引物均可实现虫体特异性基因扩增,但足部提取的核酸仅在Cytb和COⅠ体系中成功扩增,可能由于个体较小,足部肌丝组织相对较少,主要多为几丁质,所以核酸提取效率相对较差。由于口岸截获的昆虫常无法保证其形态完整性且虫期不同,并不是每次截获的昆虫均为形态完好且具备鉴定能力的成虫。因而,对于样品量充足或个体较小,肌肉组织量相对较少的昆虫,建议选取头部及胸腹部作为核酸提取的主要取样部位;对于样品量不足,有保存价值的样品,建议采集单侧重复结构,例如:如足、附肢等结构,余下结构仍能作为形态鉴定标本留样。
4.2 联合DNA条形码物种鉴定
目前,DNA条形码技术是从分子遗传学角度对物种进行分类鉴定的重要手段,生命条形码联盟(the Consortium for the Barcode of Life,CBOL)推荐COⅠ作为动物物种鉴定的标准条形码,已有相关标准发布。但如果仅基于COⅠ一个多态基因进行鉴别,由于其突变率低,对于一些进化速度偏慢的物种,有时难以做出精准鉴定。一方面,口岸截获的活体动物或者动物制品种类繁多、近缘种多、品系复杂,有时可能存在未知物种,单一条形码会对分辨率产生影响;另一方面,使用标准条形码进行PCR,样品可能会因存在微生物污染或部分基因片段降解而导致无法特异性扩增。有时尽管可获得有效序列,但由于数据库基因信息缺失,没有可用于比对的参考序列,因而无法鉴定到种阶元甚至科属阶元,所以仅靠标准条形码,无法满足口岸物种鉴定的现实需求。随着新一代测序技术及物种基因组解析的不断发展,其他一些线粒体基因也证明了可作为“条形码”进行物种鉴定的潜力[16],联合多个条形码进行物种鉴定可显著提升条形码技术的分辨率。本研究通过组合COⅠ、Cytb及16S rRNA三种条形码进行虫体鉴定,不仅提高了核心序列获取有效率和分子鉴定的分辨率,还可对不同条形码的鉴定结果进行相互印证,鉴定结果更为准确可靠。
5 结论
本研究基于口岸实际截获的白腹皮蠹幼虫建立了白腹皮蠹幼虫图谱,并对该物种成虫及幼虫的外部形态学鉴定特征进行简要叙述。同时,使用联合DNA条形码技术对白腹皮蠹进行了分子生物学鉴定,研究思路和方法采取形态学与多组DNA条形码联合分析、鉴定昆虫幼虫种属的方式,具有较高的可靠性,可为口岸一线关员现场查验皮蠹类害虫提供可靠技术手段。在未来的实际工作中,昆虫类样本推荐提取头部或胸腹部的组织作为核酸提取样本,并结合样本实际外部形态学特征,筛选多态性高的多个核心条形码,形成组合式物种鉴定方式,在提高鉴定准确性的同时提升工作效率,一次性解决疑难样品的溯源鉴定,为口岸把关提供有力支撑。
参考文献
[1] 刘永平, 张生芳. 中国仓储品皮蠹害虫[M]. 北京: 农业出版社, 1988: 1-5.
[2] 张生芳. 中国储藏物甲虫[M]. 北京: 中国农业科技出版社, 1998: 100-101.
[3] 罗佑珍, 李云. 白腹皮蠹的生物学特性及温湿度对其生长的影响[J]. 云南农业大学学报, 1988, 11(2): 209-210.
[4] 轩静渊, 李隆术. 白腹皮蠹的繁殖特性[J]. 四川动物, 1989, 15(3): 12-14.
[5] 陈浮舟. 环氧乙烷杀灭皮张害虫—白腹皮蠹[J]. 青海畜牧兽医杂志, 1986: 13(5): 36-37.
[6] 李枷霖. 皮蠢科DNA条码分类技术研究[D] 苏州:苏州大学, 2015: 1-134.
[7] Háva, J. The World Catalogue of the Dermestidae (Coleoptera)[EB/OL]. 2024-01-18. http://dermestidae.wz.cz/world-dermestidae/.
[8] 陈岩, 朱水芳, 陈克. 谷斑皮蠹分子检测方法[J]. 植物检疫, 2010, 24(1): 22-23.
[9] 刘聪, 蒋湘, 樊武疆等. 花斑皮蠹和黑斑皮蠹(鞘翅目:皮蠹科)的快速分子鉴定[J]. 北京农学院, 2012, 27(2): 27-30.
[10] 周萍, 冯超伦, 王兴胜等. 三种重要皮蠹科害虫的幼虫形态与分子鉴定[J]. 植物保护学报, 2015, 42(1):51-58.
[11] Kaomud T, Vikas K, Devkant S, et al. Morphological and DNA Barcoding Evidence for Invasive Pest Thrips, Thrips parvispinus (Thripidae: Thysanoptera), Newly Recorded From India[J]. Journal of Insect Science, 2015(1): 1-4.
[12] Mound L A, Wheeler G S, Williams D A. Resolving cryptic species with morphology and DNA; thrips as a potential biocontrol agent of Brazilian peppertree, with a new species and overview of Pseudophilothrips (Thysanoptera)[J]. Zootaxa, 2010, 2432(2432): 59-68.
[13] Galal-Khallaf, A. PCR-based assessment of shellfish traceability and sustainability in international Mediterranean seafood markets[J]. Food Chemistry, 2016, 202: 302-308.
[14] Staats M, Advances in DNA metabarcoding for food and wildlife forensic species identification[J]. Analytical & Bioanalytical Chemistry, 2016, 408(17): 4615-4630.
[15] 胡晶红, 张永清, 丁代兄. 驴皮仓储害虫白腹皮蠹的识别与防治[J]. 山东中医杂志, 2013(5): 3. DOI:CNKI:SUN:SDZY.0.2013-05-030.
[16] Zhang J, Hanner R. Molecular Approach to the Identification of Fish in the South China Sea[J]. 2012, PLoS ONE, 7(2): e30621. DOI: 10.1371/journal.pone.0030621
基金项目:国家重点研发计划(2023YFC3304000,2021YFC2401005)
第一作者:杜思乐(1992—),女,汉族,北京人,博士,中级兽医师,主要从事动物源性成分及物种鉴定工作,E-mail: sile0228@163.com
通信作者:蒲静(1977—),女 ,汉族,河北唐山人,博士,正高级兽医师,主要从事物种鉴定和动物检疫工作,E-mail: pujing1229@126.com
1. 中国海关科学技术研究中心 北京 101113
2. 首都医科大学燕京医学院 北京 101300
1. Science and Technology Research Center of China Customs, Beijing 101113
2. Capital Medical University, Yanjing Medical College, Beijing 101300
表1 Cytb、COⅠ、16S rRNA的引物序列
Table 1 Sequences of Cytb, COⅠ, 16S rRNA
通用引物 | 序列 | 片段长度 (bp) |
Cytb-1 | 5' —TACCATGAGGACAAATRTCMTTYTG—3' | 500 |
Cytb-2 | 5' —CCTCCTAGTTTGTTAGGGATKGANCG—3' | |
COⅠ-1 | 5' —TITCIACIAAYCAYAARGAYATTGG—3' | 600~800 |
COⅠ-2 | 5' —TAIACYTCIGGRTGICCRAARAAYCA—3' | |
16S rRNA-1 | 5' —GACGAKAAGACCCTA—3' | 500~600 |
16S rRNA-2 | 5' —CGCTGTTATCCCTADRGTAAC—3' |

A: 背面观; B 腹面观; C: 侧面观 标尺: A=B=C=1 mm
图1 白腹皮蠹幼虫整体图
Fig.1 Habitus of larvae Dermestes maculatus
表2 3份样品的Cytb、COⅠ、16S rRNA扩增序列的覆盖率及相似性
Table 2 Query Cover and precent identity of amplified sequence by Cytb, COⅠ, 16S rRNA from three samples
靶基因 | 扩增序列 | 覆盖率 (%) | 相似性 (%) |
Cytb | ACCTGCTAATTTTACTAACTTACTTTCTGCATTCCTTATCTTGGACAATCAATTGTTACTTGATTATGAGGAGGATTTGCAGTTGATAATGCAACATTAAATCGTTTCTATACTCTCCATTTTTTACTACCTTTTATTATTGCTGCTTTAGTAATAATCCACCTATTATTCCTTCATCAAACAGGATCAAATAATCCTTTAGGAACAAATAGTAATGTTGATAAAATTCCATTTCACCCATATTTTTCTATAAAGGATTCTGTAGGATTTATTTTAATAATTTCTATTTTATTAATTTTAAATCTTACTAATCCCTATCTTCTAGGAGATCCTGATAATTTTATCCCAGCTAATCCTTTAGTAACTCCTGTTCATATTCAACCAGAATGATATTTTTTATTTGCCTATGCTATTCTTCGATCAATCCCTAACAAACTAGGAGG | 97 | 98.38 |
COⅠ | CTTTATTTTTTCTCTTTGGAGCATGAGCAGGTATAGTAGGAACATCCCTAAGAATACTAATTCGAACAGAATTAGGTATACCTGGATCTCTAATTGGTGACGATCAAATTTTTAATGTAATTGTTACAGCTCATGCATTTATTATAATTTTTTTCATAGTAATACCTATTATAATTGGTGGATTTGGAAATTGATTAGTTCCATTAATATTAGGAGCTCCTGATATAGCATTTCCCCGAATAAATAACATAAGATTTTGACTTCTTCCACCATCTTTATCTCTTTTATTAATAAGAAGAATGGTAGAAAGAGGAGCAGGAACAGGATGAACAGTTTATCCACCCCTATCAGCTAATATTGCACATGGAGGAGCTTCTGTTGATTTAGCAATTTTTAGATTACATCTTGCAGGAATTTCTTCAATTCTTGGAGCAGTAAACTTTATTACTACAGTAATTAATATACGATCAAAAGGAATAACTCCTGATCGAATACCTTTATTTGTTTGATCAGTAGCAATTACTGCTTTACTACTACTTTTATCTCTACCAGTTCTTGCTGGAGCAATCACAATATTACTAACTGATCGAAATCTAAATACTTCATTCTTTGATCCTGCAGGAGGTGGAGATCCTATTCTTTATCAACACTTATTCTGATTCTTCGGCCACCCCGAGGTCTAA | 97 | 99.10 |
16S rRNA | GGGTTCAGGAAGACTTAATATTTTAGCTTCTGCACCAAAAATAAATTTTAATCCAACATCGAGGTCGCAATCCCTTCTATTGATTAGAACTCTAAAGAAAGATTACGCTGTTATCCCTAAGGTAATTAAATCTTTTAATCAAAATTATGGATCAAATAATCACAAATAAGTGTTTAAATTTATAAAAGTTAAATCAATTTTAAAGCCACCCCAGCTAAACAAAAATTATTATAATAACAAATGATTCCAATAAATTATTATAAACTTAATGTTAAACTCTATAGGGTCTTCTCGTCTTTTAAAATTATTTAAGCTTTTTCACTTAAAAATAAAATTCATTAATTTTTATTGAGACACTATTTCTCTCGTCCAGCCATTCATTCCAGTTTTCAATAAAAAAACTAATTATTATGCTACCTTTGCACAGTTAAAATACCGCGGCCCTTCATTTCTACAGTGGGCAGACTAGACTTTAAATCATTATCAAAAAGACATGTTTTTGTAAAACAGGCGA | 98 | 97.81 |
表3 皮蠹属(Dermestes)物种COⅠ序列信息
Table 3 COⅠ sequence information of Dermestes species
种名 | GenBank 序列号 | 种名 | GenBank 序列号 | 种名 | GenBank 序列号 |
D. maculatus | KF956217.1 | D. frischii | LC276255.1 | D. olivieri | MN183054.1 |
D. maculatus | OR533643.1 | D. frischii | MK138567.1 | D. bicolor | KU909494.1 |
D. maculatus | OR533644.1 | D. frischii | MH936462.1 | D. lardarius | KU874801.1 |
D. maculatus | MZ631678.1 | D. frischii | MH936463.1 | D. lardarius | OP668959.1 |
D. maculatus | MZ631435.1 | D. frischii | NC044850.1 | D. szekessyi | KJ961991.1 |
D. maculatus | HM398865.1 | D. marmoratus | HQ582714.1 | D. dimidiatus | OQ842291.1 |
D. maculatus | HM398864.1 | D. talpinus | MF640807.1 | D. tessellatocollis | MK332620.1 |
D. maculatus | OP668960.1 | D. murinus | KM445458.1 | D. tessellatocollis | NC044849.1 |
D. maculatus | MW278858.1 | D. murinus | KM444236.1 | D. haemorrhoidalis | MH924954.1 |
D. maculatus | MK332617.1 | D. laniarius | KM442171.1 | D. haemorrhoidalis | MH924956.1 |
D. maculatus | MH936473.1 | D. laniarius | KM443663.1 | D. undulatus | KU909850.1 |
D. coarctatus | MK332607.1 | D. sardous | MN182762.1 | D. undulatus | KU494101.1 |
D. coarctatus | MK332610.1 | D. sardous | MT742293.1 | D. undulatus | JF887745.1 |
D. coarctatus | MK332611.1 | D. ater | NC053877.1 | / | / |
表3(续)
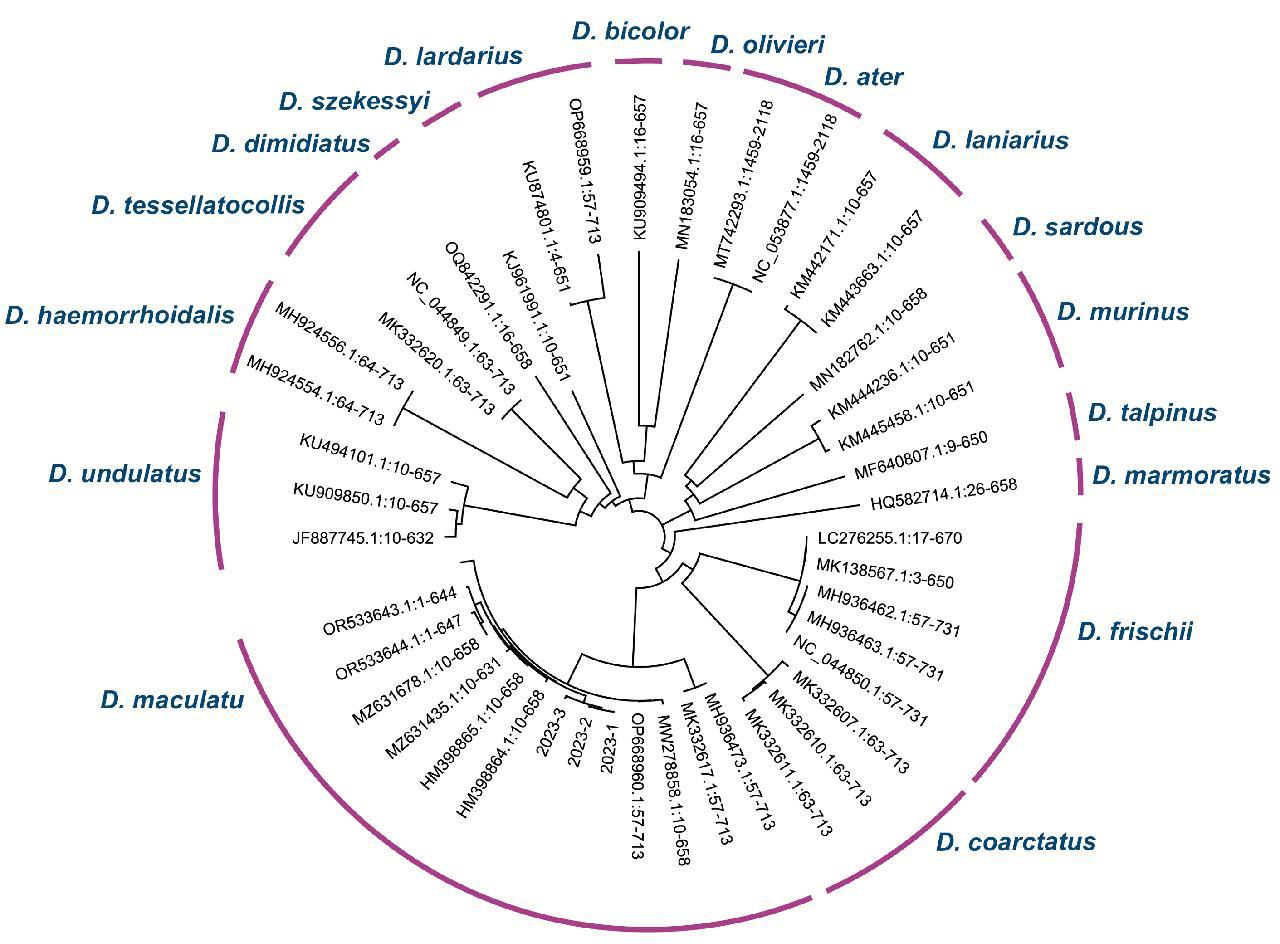
图4 基于COⅠ基因序列构建的系统NJ树
Fig.4 Phylogenetic tree of COⅠ nucleotide sequences







