CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
库洛胡黄连实时荧光PCR鉴别方法的建立
作者:周林 孙涛 滕少娜 何玲 杨登香 任凤鸣 孔德英 赵晓丽
周林 孙涛 滕少娜 何玲 杨登香 任凤鸣 孔德英 赵晓丽
周 林 1 孙 涛 1 滕少娜 1 何 玲 1 杨登香 1 任凤鸣 2 孔德英 1 赵晓丽 3 *
摘 要 本研究通过分析比对库洛胡黄连及其近似种的叶绿体psbA-trnH序列,设计特异性引物探针,建立了一种库洛胡黄连实时荧光PCR鉴别方法。应用该方法测试29份样品的DNA,结果表明本试验所建立的实时荧光PCR方法能够快速、准确、灵敏地鉴别库洛胡黄连。
关键词 库洛胡黄连;西藏胡黄连;实时荧光PCR;快速鉴别
Establishment of a Real-Time PCR Identification Method for Picrorhiza kurroa
ZHOU Lin1 SUN Tao1 TENG Shao-Na1 HE Ling1 YANG Deng-Xiang1
REN Feng-Ming2 KONG De-Ying1 ZHAO Xiao-Li3*
Abstract A real-time PCR method for identification of Picrorhiza kurroa was developed with specific primers and probes designed by analyzing and comparing the psbA-trnH gene sequences of Picrorhiza kurroa and its similar species. A total of 29 DNA samples were tested by this method. The results showed that the real-time PCR method established in this study enabled rapid, accurate and sensitive identification of Picrorhiza kurroa.
Keywords Picrorhiza kurroa; Neopicrorhiza scrophulariiflora; real-time PCR; rapid identification
胡黄连是我国传统中药,早在《唐本草》就有记载,因其性味功效似黄连而得名,来源于车前科植物库洛胡黄连(印度胡黄连)Picrorhiza kurroa Royle ex Benth.或西藏胡黄连Neopicrorhiza scrophulariiflora(Pennell)D. Y. Hong的根茎,具有退虚热、消疳热、清热燥湿、泻火解毒等功效,常用于阴虚骨蒸、潮热盗汗、小儿疳疾及湿热泻痢等[1-2]。2020年版《中华人民共和国药典》收载的胡黄连药材来源为西藏胡黄连[3]。由于被大量开发利用,库洛胡黄连的野生种质资源受到破坏[4],被纳入《濒危野生动植物种国际贸易公约》(CITES)附录加以保护。库洛胡黄连的准确鉴别是履行CITES公约、保护其野生种质资源的前提。
中药材最常用的鉴别方法是性状鉴别法,即通过眼观、鼻闻、口尝、手摸等手段来对药物的形状、大小、色泽、表面、质地、断面、气味等进行鉴别和描述[5]。但是库洛胡黄连与西藏胡黄连药材在外形特征上几乎难以区别[6-9],往往需要经验极为丰富的专业人员才能进行准确鉴别,并且随着制成片剂、丸剂等中药制剂后,鉴别难度更进一步增加。随着分子生物学技术的发展,DNA分子鉴定技术因其准确性、客观性、简便性等特点,为中药材的鉴别提供了新的方法。Hussain等[10]采用随机扩增多态性DNA(Random Amplified Polymorphic DNA,RAPD)法可有效区分库洛胡黄连及其伪混品兔耳草,但RAPD分子标记技术重复性及稳定性较差[11]。实时荧光PCR作为基因检测的重要手段,具有操作简便、灵敏、快捷、结果准确的特点[12-14]。本研究基于库洛胡黄连叶绿体psbA-trnH序列,开发适用于库洛胡黄连的实时荧光PCR鉴别方法,以期为我国CITES履约、物种保护、市场管理等提供技术支撑。
1 材料与方法
1.1 试验材料
供试样品包括12份库洛胡黄连样品、6份西藏胡黄连样品以及其他亲缘关系较近或形态近似的份样品,共计11种29份样品(表1)。样品均经过形态学结合DNA条形码技术鉴定,保存于重庆海关技术中心。
1.2 试剂与仪器
磁珠法植物基因组DNA提取试剂盒(珠海宝瑞生物公司);Premix Ex Taq(Probe qPCR)、EASY Dilution(TaKaRa宝生物工程(大连)有限公司);引物、探针及质粒(北京擎科生物科技股份有限公司)。
球磨仪(MM400,德国莱驰);超微量核酸蛋白检测仪(NanoDrop one,美国赛默飞);实时荧光定量PCR仪(StepOne plus,美国ABI)。
1.3 方法
1.3.1 DNA提取
对于根茎类样品,用75%酒精对样品表面进行擦洗,无菌水清洗并晾干后用球磨仪将样品研磨成粉;对于种子、叶片类样品,用75%酒精对样品表面进行清洗,无菌水清洗并晾干后利用液氮研磨成粉。随后,按照磁珠法植物基因组DNA提取试剂盒说明书进行样品DNA提取,提取的DNA用超微量核酸蛋白检测仪测定核酸质量和浓度,保存于-20℃冰箱备用。
1.3.2 引物与探针设计
以全部12份库洛胡黄连及6份西藏胡黄连样品的基因组DNA为模板,使用psbA-trnH序列通用引物fwd:5′-GTTATGCATGAACGTAATGCTC-3′,rev:5′-CGCGCATGGTGGATTC ACAATCC-3′,反应条件:95℃预变性4 min;94℃变性30 s,55℃退火1 min,72℃延伸1 min,35个循环,72℃延伸10 min[15],进行PCR扩增。PCR产物送至专业测序公司进行双向测序,经SeqMan软件去除测序结果两端低质量部分后进行拼接得到上述样品的psbA-trnH序列。将得到的各样品的psbA-trnH序列与GenBank数据库中所有的库洛胡黄连、西藏胡黄连以及亲缘关系较近的其他物种的psbA-trnH序列进行比对分析,根据库洛胡黄连的psbA-trnH序列的特异性位点,利用Primer Express 3.0软件设计引物探针,设计的引物经美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)网站中的Primer-BLAST分析,确保引物的特异性。
1.3.3 实时荧光PCR反应体系及反应条件
优化后的反应体系为荧光PCR反应预混液Premix Ex Taq(Probe qPCR)10 μL,上下游引物各0.5 μL(10 μmol/L),探针0.5 μL(10 μmol/L),ROX参比染料0.4 μL,DNA模板2 μL,灭菌去离子水补至20 μL。实时荧光PCR反应程序为:95℃预变性30 s;然后以95℃ 5 s,58℃ 30 s进行40个循环。每个循环中58℃ 30 s结束时设置荧光通道采集荧光信号。
1.3.4 特异性测试
以提取的29份样品DNA为模板,按上述反应体系及反应条件进行实时荧光PCR扩增,每个处理设2个重复并设置空白对照,用于验证本试验所建立方法的特异性。
1.3.5 灵敏度测试
由专业公司合成含有库洛胡黄连psbA-trnH序列的重组pΜC57质粒,根据重组质粒干粉重量及序列长度,计算拷贝数,计算公式为:质粒拷贝数=阿伏伽德罗常数×质粒干粉重量/(1个碱基对的平均分子量×序列总长度)。将重组质粒利用EASY Dilution连续10倍梯度稀释至浓度为0.5×107~0.5×100拷贝数/μL,以其为模板,根据1.3.3中方法进行实时荧光PCR扩增,测试该方法的灵敏度,并根据Ct值绘制标准曲线。
1.3.6 重复性测试
批内重复性是一次试验取0.5×105拷贝数/μL、0.5×103拷贝数/μL、0.5×101拷贝数/μL的3个浓度梯度的重组质粒,每个浓度梯度5个平行重复,利用1.3.3中方法进行实时荧光PCR扩增,根据Ct值计算批内变异系数(Coefficient of Variation,CV);批间重复性是5个不同的操作者利用1.3.3中方法对0.5×105拷贝数/μL、0.5×103拷贝数/μL、0.5×101拷贝数/μL的3个浓度梯度的重组质粒进行检测,根据Ct值计算批间变异系数(CV)。
2 结果与讨论
2.1 引物、探针序列
经PCR测序,12份库洛胡黄连样品所获得序列均与GenBank 数据库中库洛胡黄连叶绿体psbA-trnH序列(FJ848090.1)高度保守,未发现变异位点;6份西藏胡黄连样品所获得序列与数据库中西藏胡黄连的叶绿体全基因组序列(MK986819.1)同源性为100%。进一步比对分析发现,在叶绿体psbA-trnH序列中,所有库洛胡黄连在231位点均为“T”,其他物种均为“G”,据此设计探针,如图1所示。在探针两端片段设计1对库洛胡黄连引物,序列见表2。
表2 库洛胡黄连特异性引物探针序列
Table 2 Specific primer and probe seqμences of Picrorhiza kurroa
引物、探针名称 | 序列(5'-3') |
KR-F | ATCAAGGGGGTTGTTGCTCC |
KR-R | CATCCGCCCCTATCCCTAGA |
KR-P | FAM-CATCTAAATTCAATTTTGTGTCT-MGB |
注: FAM为发光基团, MGB为猝灭基团; 扩增长度为210 bp.
2.2 引物探针特异性测试
应用本试验建立的实时荧光PCR方法对11个物种共29份样品DNA进行检测,结果表明,12份库洛胡黄连样品DNA均出现特异性扩增曲线,而供试的其他物种的17份样品DNA及空白对照均无扩增曲线(图2)。结合在NCBI中比对的同源性与特异性结果,说明该引物与探针具有良好的特异性,能够用于库洛胡黄连的鉴别检测。
2.3 灵敏度测试及标曲的构建
以10倍稀释的标准质粒为模板进行灵敏度测试,从图3可以看出,当标准质粒浓度在0.5×107~0.5×101拷贝数/μL时,均可以得到典型的扩增曲线,其对应的Ct值的平均值分别为17.73、20.54、23.85、27.11、30.23、33.28、36.48。以扩增曲线的Ct 值为纵坐标,质粒浓度为横坐标,绘制标准曲线(图4)。所得线性方程为y = -3.148x+ 33.325,R2 = 0.999,扩增效率= 107.83%。该方法对标准质粒的最低检测限是5个拷贝/μL。
2.4 重复性测试
重复性测试结果发现批内CV值在0.80%~1.41%之间,批间CV值在1.81%~2.65%之间,均小于3%,说明该方法的重现性较好,重复性测试数据见表3。
3 结论
近年来,库洛胡黄连及其提取物已被证实在保护肝脏、心脏及肾脏,抗肿瘤、抗炎及调节免疫等方面具有多重药理作用[16-20]。对药材基原的准确鉴别,是保证药材质量和临床疗效的前提。本研究建立了一种库洛胡黄连实时荧光PCR鉴别方法,首先对比分析了胡黄连相关的常用条形码基因序列,根据库洛胡黄连在psbA-trnH序列(GeneBank登录号:FJ848090.1)中231 bp处与其他物种的差异设计库洛胡黄连特异性引物探针(图1)。随后,对该引物探针进行特异性验证,结果发现利用该引物探针,能够从29份样品中准确地识别12份库洛胡黄连样品,表明所建立的实时荧光PCR方法针对库洛胡黄连具有较好的特异性(图2)。最后,灵敏度测试结果显示,该方法检测库洛胡黄连目标序列标准质粒的最低检测限为5个拷贝/μL,具有较高的灵敏度(图3、图4)。在比对分析胡黄连相关的常用条形码序列时发现,对于其近似种,仅在库洛胡黄连的psbA-trnH序列中发现有稳定的SNP位点,但该区域的GC含量较少(图1),设计的探针Tm值较低,因此猝灭基团使用了可显著提高探针Tm值的小沟结合物(Minor Groove Binder,MGB)修饰。根茎类中药材的DNA含量往往较低,经干燥加工和存放后DNA会进一步发生降解,同时根茎类药材通常含有较多的多糖类、酚类等PCR抑制剂,因此使用普通PCR方法常出现扩增失败的情况。实时荧光PCR方法较普通PCR方法灵敏度更高,试验发现尽管9份根茎药材类库洛胡黄连样品的Ct值较3份种子类库洛胡黄连样品的Ct值均要高,但都在32以内,均能够成功检出。综上所述,本方法可为快速、准确地鉴别库洛胡黄连提供依据,有助于相关部门开展监管工作。
参考文献
[1] 南京中医药大学. 中药大辞典(下册)[M]. 上海: 上海科学技术出版社, 2006: 2184-2187.
[2] 周峰, 王艺涵, 刘燕萌, 等. 经典名方中胡黄连的本草考证[J]. 中国实验方剂学杂志, 2024.
[3] 国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2020: 253-254.
[4] Singh H, Gahlan P, Dutt S, et al. Why uproot Picrorhiza kurroa, an endangered medicinal herb[J]. Current Science, 2011, 100(7): 1055-1059.
[5] 胡妮娜, 田淑琴, 于景伟, 等. 传统中药鉴定方法的研究发展概况[J]. 中医药信息, 2008(3): 15-18.
[6] 李松, 孙利生, 唐锴. 西藏胡黄连与印度胡黄连的对比[J]. 首都食品与医药, 2015, 22(15): 55.
[7] 黄林清, 张恩娟, 王军. 胡黄连的研究进展[J]. 中国药业, 2007(7): 1-2.
[8] Maria M, Muhammad A, Rahmatullah Q, et al. Picrorhiza kurroa: An ethnopharmacologically important plant species of Himalayan region[J]. Pure and Applied Biology, 2015, 4(3): 407-417.
[9] Rokaya M B, Parajuli B, Bhatta K P, et al. Neopicrorhiza scrophulariiflora (Pennell) Hong: A comprehensive review of its traditional uses, phytochemistry, pharmacology and safety[J]. Journal of Ethnopharmacology, 2020, 247: 112250.
[10] Hussain M A, Bedi Y S. Authentication of Picrorhiza kurrooa Royle ex Benth. using DNA fingerprint[J]. International Journal of Agriscience, 2012, 2(6): 511-521.
[11] 时圣明, 潘明佳, 王洁, 等. 分子鉴定技术在中药中的应用[J]. 中草药, 2016, 47(17): 3121-3126.
[12] 龚美蓉, 陈凤丽, 曹晨, 等. 实时荧光定量PCR 技术及其在中医药研究中的应用[J]. 中国实验方剂学杂志, 2014, 20(22): 238-241.
[13] 周林, 孙涛, 滕少娜, 等. 人参实时荧光定量PCR鉴定方法的建立[J].西南大学学报(自然科学版), 2022, 44(7): 70-75.
[14] 孙涛, 周林, 滕少娜, 等. 双重实时荧光PCR快速鉴别人参和西洋参[J]. 世界科学技术-中医药现代化, 2022, 24(8): 2986-2994.
[15] 陈士林, 庞晓慧, 姚辉, 等. 中药DNA条形码鉴定体系及研究方向[J]. 世界科学技术-中医药现代化, 2011, 13(5): 747-754.
[16] Xiong K, Shi M, Zhang T, et al. Protective effect of picrosideⅠ against hepatic fibrosis in mice via sphingolipid metabolism, bile acid biosynthesis, and PPAR signaling pathway[J]. Biomedicine Pharmacotherapy, 2020, 131: 110683.
[17] 于倩, 宋昱, 赵林亚. 胡黄连苷Ⅱ调节HMGB1/RAGE信号通路对冠心病大鼠内皮细胞损伤的影响[J]. 中国免疫学杂志, 2024, 40(9): 1815-1821.
[18] Lou C, Zhao H, Zhu Z, et al. Picroside II, an iridoid glycoside from Picrorhiza kurroa, suppresses tumor migration, invasion, and angiogenesis in vitro and in vivo[J]. Biomedicine Pharmacotherapy, 2019, 120: 109494.
[19] Hussain A, Shadma W, Maksood A, et al. Protective effects of Picrorhiza kurroa on cyclophosphamide-induced immunosuppression in mice[J]. Pharmaceutical Research, 2013, 5(1): 30.
[20] Piao X, Liu B, Guo L, et al. Picroside II shows protective functions for severe acutepancreatitis in rats by preventing NF-κB-dependent autophagy[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017: 7085709.
基金项目:中国海关科学技术研究中心自立科研课题(2023HX06)
第一作者:周林(1992—),男,汉族,重庆潼南人,硕士,农艺师,主要从事植物检疫研究工作,E-mail: 295536182@qq.com
通信作者:赵晓丽(1983—),女,汉族,山西平遥人,博士,正高级农艺师,主要从事植物检疫研究工作,E-mail: xiaoli9390@163.com
1. 重庆海关技术中心 重庆 400020
2. 重庆市药物种植研究所 重庆 408435
3. 中国海关科学技术研究中心 北京 100026
1. Chongqing Customs Technology Center, Chongqing 400020
2. Chongqing Institute of Medicinal Plant Cultivation, Chongqing 408435
3. Science and Technology Research Center of China Customs, Beijing 100026
表1 试验材料信息
Table 1 Experimental material information
编号 | 中文名 | 学名 | 类型 | 来源 | 编号 | 中文名 | 学名 | 来源 | 类型 |
PK-01 | 库洛胡黄连 | P. kurroa | 药材 | 印度 | NS-04 | 西藏胡黄连 | N. scrophulariiflora | 中国西藏 | 药材 |
PK-02 | 库洛胡黄连 | P. kurroa | 药材 | 印度 | NS-05 | 西藏胡黄连 | N. scrophulariiflora | 中国西藏 | 种子 |
PK-03 | 库洛胡黄连 | P. kurroa | 药材 | 印度 | NS-06 | 西藏胡黄连 | N. scrophulariiflora | 中国西藏 | 叶片 |
PK-04 | 库洛胡黄连 | P. kurroa | 药材 | 印度 | VPO-01 | 婆婆纳 | Veronica polita | 中国重庆 | 叶片 |
PK-05 | 库洛胡黄连 | P. kurroa | 药材 | 印度 | VPE-01 | 阿拉伯婆婆纳 | V. persica | 中国重庆 | 叶片 |
PK-06 | 库洛胡黄连 | P. kurroa | 种子 | 印度 | VA-01 | 直立婆婆纳 | V. arvensis | 中国重庆 | 叶片 |
PK-07 | 库洛胡黄连 | P. kurroa | 种子 | 印度 | GS-01 | 肉叶地团花 | Globularia sarcophylla | 中国四川 | 叶片 |
PK-08 | 库洛胡黄连 | P. kurroa | 种子 | 印度 | VL-01 | 宽叶腹水草 | Veronicastrum latifolium | 中国四川 | 叶片 |
PK-09 | 库洛胡黄连 | P. kurroa | 药材 | 巴基斯坦 | PA-01 | 车前 | Plantago asiatica | 中国重庆 | 叶片 |
PK-10 | 库洛胡黄连 | P. kurroa | 药材 | 巴基斯坦 | PM-01 | 大车前 | P. major | 中国重庆 | 叶片 |
PK-11 | 库洛胡黄连 | P. kurroa | 药材 | 尼泊尔 | LI-01 | 全缘兔耳草 | Lagotis integra | 中国西藏 | 药材 |
PK-12 | 库洛胡黄连 | P. kurroa | 药材 | 尼泊尔 | CC-01 | 黄连 | Coptis chinensis | 中国湖北 | 药材 |
NS-01 | 西藏胡黄连 | N. scrophulariiflora | 药材 | 中国云南 | CC-02 | 黄连 | C. chinensis | 中国四川 | 药材 |
NS-02 | 西藏胡黄连 | N. scrophulariiflora | 药材 | 中国云南 | CC-03 | 黄连 | C. chinensis | 中国重庆 | 叶片 |
NS-03 | 西藏胡黄连 | N. scrophulariiflora | 药材 | 中国云南 |

方框处示意设计探针的区域, 库洛胡黄连的psbA-trnH序列在该区域与其他近似种相比, 至少存在3个碱基差异; 图中所选序列的依据为:除西藏胡黄连相关序列外, 选择库洛胡黄连psbA-trnH序列 (FJ848090.1)在NCBI网站BLAST结果中匹配度前5的物种序列, 这些物种均归属于车前科.
图1 库洛胡黄连与其近似种的psbA-trnH序列比对图
Fig.1 The psbA-trnH sequence alignment plot of Picrorhiza kurroa and its similar species


箭头所示为3份库洛胡黄连种子样品 (PK-06、PK-07及PK-08) 的扩增曲线,其起峰时间明显早于其他类型为药材的库洛胡黄连样品; 圆圈处示意其他17份DNA样品及空白对照的扩增情况.
图2 库洛胡黄连实时荧光PCR特异性扩增结果
Fig.2 Specific amplification results of Picrorhiza kurroa by real-time PCR

①—⑧分别为初始浓度为0.5×107~0.5×100拷贝数/μL的标准质粒的扩增曲线, 其中①—⑦即0.5×107~0.5×101拷贝数/μL浓度时具有明显的阳性扩增曲线.
图3 库洛胡黄连实时荧光PCR灵敏度测试结果
Fig.3 Sensitivity test results of Picrorhiza kurroa by real-time PCR

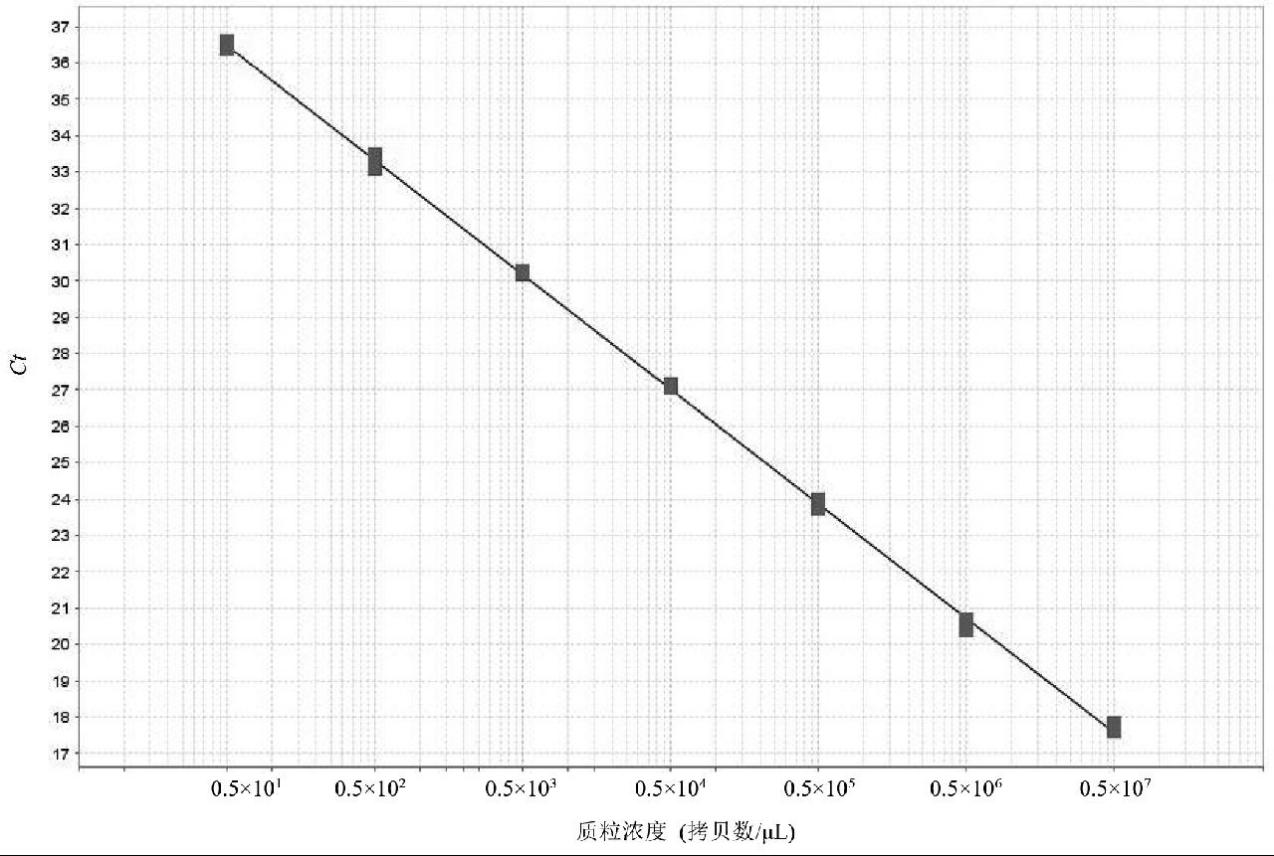
图4 库洛胡黄连实时荧光PCR扩增标准曲线
Fig.4 The standard curve of Picrorhiza kurroa by real-time PCR
表3 重复性测试结果
Table 3 Repeatability test results
类别 | (拷贝数/μL) | Ct 值 | 平均值 | SD | CV | ||||
重复1 | 重复2 | 重复3 | 重复4 | 重复5 | |||||
批内 | 0.5×105 | 23.84 | 23.58 | 24.12 | 23.88 | 23.92 | 23.87 | 0.19 | 0.80 |
0.5×103 | 30.23 | 30.58 | 30.58 | 29.85 | 29.98 | 30.24 | 0.34 | 1.12 | |
0.5×101 | 36.38 | 36.05 | 37.22 | 37.09 | 37.12 | 36.77 | 0.52 | 1.41 | |
批间 | 0.5×105 | 23.58 | 24.12 | 23.15 | 24.22 | 23.85 | 23.78 | 0.43 | 1.81 |
0.5×103 | 30.13 | 30.88 | 29.85 | 31.02 | 29.25 | 30.23 | 0.74 | 2.45 | |
0.5×101 | 37.29 | 37.79 | 36.07 | 36.43 | 35.34 | 36.58 | 0.97 | 2.65 | |







