CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
固相萃取净化-高效液相色谱法测定饮料中β -羟基-β -甲基丁酸钙
作者:张文华 侯建波 陈安 汪鹏 祝泽龙 严颖鹏 何建敏 徐敦明
张文华 侯建波 陈安 汪鹏 祝泽龙 严颖鹏 何建敏 徐敦明
摘 要 本研究建立了固相萃取-高效液相色谱法测定饮料中β-羟基-β-甲基丁酸钙含量的分析方法。样品采用水振荡提取,二氯甲烷萃取,经PXA固相萃取柱净化,以乙腈-0.02 mol/L磷酸二氢钾溶液为流动相,采用C18色谱柱分离,以流速1.0 mL/min进行梯度洗脱,二极管阵列检测器检测,外标法定量。研究结果显示,β-羟基-β-甲基丁酸钙在0.020~2.00 mg/mL的浓度范围内线性良好,相关系数为0.9993。3个浓度水平的平均加标回收率在92.4%~105%之间,相对标准偏差为0.22%~2.44%,方法检出限为0.05 g/100g,定量限为0.10 g/100g。结果表明,该方法净化效果好、分离良好、专属性强、重复性好、测定结果准确可靠,可满足饮料中β-羟基-β-甲基丁酸钙的含量测定。
关键词 β-羟基-β-甲基丁酸钙;饮料;固相萃取;高效液相色谱法
Determination of Calcium β-Hydroxy-β-Methylbutyrate in Beverages by Solid-Phase Extraction
and High-Performance Liquid Chromatography
ZHANG Wen-Hua1 HOU Jian-Bo1 CHEN An1 WANG Peng1
ZHU Ze-Long1 YAN Ying-Peng1 HE Jian-Min1 XU Dun-Ming2
Abstract A method for the determination of calcium β-hydroxy-β-methylbutyrate (CaHMB) in beverages by solid phase extraction (SPE) coupled with high-performance liquid chromatography (HPLC) was established. Samples were extracted using water oscillation, followed by dichloromethane extraction and purification on a PXA solid-phase extraction column. The analytes were separated on a C18 column with a mobile phase consisting of acetonitrile and 0.02 mol/L potassium dihydrogen phosphate solution. Gradient elution was performed at a flow rate of 1.0 mL/min, and detection was achieved using a diode array detector. Quantification was based on the external standard method. CaHMB exhibited good linearity over the concentration range of 0.020-2.00 mg/mL (R2 = 0.9993). The average recoveries at three concentration levels ranged from 92.4%-105%, with relative standard deviations (RSDs) of 0.22%-2.44%. The limit of detection (LOD) was 0.05 g/100 g, and the limit of quantification (LOQ) was 0.10 g/100 g. The method demonstrated good purification efficiency, separation specificity, repeatability, and accuracy, making it suitable for the determination of CaHMB in beverages.
Keywords calcium β-hydroxy-β-methyl butyrate (CaHMB); beverages; solid-phase extraction; high-performance liquid chromatography
基金项目:海关总署科研项目(2023HK127)
第一作者:张文华(1984—),男,汉族,江西贵溪人,博士,正高级工程师,主要从事进出口食品检验工作,E-mail: zwh@zaiq.org.cn
1. 杭州海关技术中心 杭州 310016
2. 厦门海关技术中心 厦门 361013
1. Hangzhou Customs Technical Center, Hangzhou 310016
2. Xiamen Customs Technical Center, Xiamen 361013
β-羟基-β-甲基丁酸(β-hydroxy-β-methylbuty- rate,HMB)是一种含5个碳原子的有机酸,是亮氨酸在体内通过其代谢产物α-酮异己酸产生的一种衍生物。HMB具有促进蛋白质合成、减少肌肉损伤、增强机体免疫和维护细胞膜完整性等生物学功能[1-9]。由于HMB性质不稳定,为方便使用和储存,一般采用合成法将HMB转化成β-羟基-β-甲基丁酸钙(Calcium β-hydroxy-β-methylbutyrate,CaHMB),结构式如图1所示[10]。国家卫生健康委2025年第1号公告《关于甜叶菊多酚等20种“三新食品”的公告》[11]规定CaHMB的每日推荐食用量不超过6 g。CaHMB作为一类创新的营养素,已被广泛应用于饮料、乳制品、能量棒、巧克力制品等食品中。
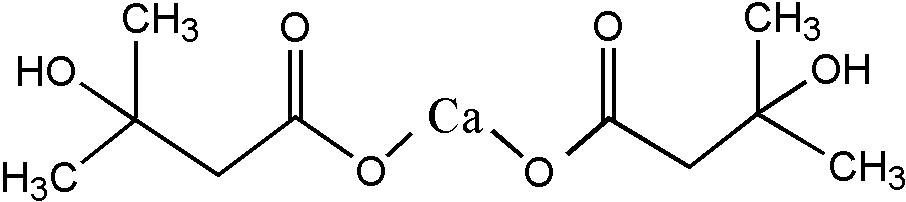
图1 β-羟基-β-甲基丁酸钙结构式
Fig.1 The chemical structure of CaHMB
目前食品中CaHMB的检测方法主要有气相色谱法[12]、高效液相色谱法[13-19]、气相色谱-串联质谱法[20-21]、高效液相色谱-质谱联用法[22-23]等。现有参考文献所报道检测方法的前处理手段主要是直接用盐酸溶液提取,而无进一步的净化处理步骤,无法对添加CaHMB的相关产品实现准确定量。由于一些固体饮料的成分复杂,对目标物的准确检测存在干扰,上机分析前需要进行净化和富集。为此,本研究建立了一种基于固相萃取净化-高效液相色谱法检测饮料中的β-羟基-β-甲基丁酸钙含量的分析方法。
1 材料与方法
1.1 仪器、材料与试剂
高效液相色谱仪(Thermo UltiMate3000,配有DAD检测器,美国赛默飞公司);电子天平(ME104E,瑞士梅特勒托利多公司);超声波清洗器(P300H,购于德国艾尔玛公司);涡旋混匀器(WH-861,太仓市华利达实验设备有限公司);氮吹仪(N-EVAPTM111,美国Organomation公司);超纯水仪(Synergy185,美国密理博公司);高速冷冻离心机(Multifuge X1R,美国赛默飞公司);微孔过滤膜(0.45 μm,有机相,上海迪柯马科技发展有限公)司;Poly-Sery MAX固相萃取柱(6 mL,500 mg,上海安谱实验科技股份有限公司),ProElut PXA固相萃取柱(6 mL,500 mg,上海迪柯马科技发展有限公司),Oasis MAX固相萃取柱(6 mL,500 mg,沃特世科技(上海)有限公司),使用前依次用5 mL甲醇和5 mL水进行活化。
二氯甲烷、甲醇、乙腈均为色谱纯(德国默克公司);磷酸二氢钾为分析纯(广东汕头西陇科学股份有限公司);氨水、磷酸、盐酸均为分析纯(国药集团化学试剂有限公司)。
1.2 标准储备液及工作液的配置
(1)β-羟基-β-甲基丁酸钙标准品储备液(50.0 mg/mL):准确称取0.5 g(精确至0.0001 g)β-羟基-β-甲基丁酸钙标准品,用水溶解后,定容至10 mL,混匀后转移至棕色玻璃瓶中,于4℃避光密封保存,保存期为3个月。
(2)β-羟基-β-甲基丁酸钙标准中间液(10.0 mg/mL):准确吸取β-羟基-β-甲基丁酸钙标准储备液2 mL于10 mL容量瓶中,用水定容至刻度,混匀,配制成质量浓度为10 mg/mL的标准中间液,临用现配。
(3)β-羟基-β-甲基丁酸钙标准系列工作液:分别吸取适量标准中间液,用水配制成浓度分别为0.020 mg/mL、0.050 mg/mL、0.10 mg/mL、0.20 mg/mL、0.50 mg/mL、1.00 mg/mL、2.00 mg/mL的系列工作液,临用现配。
1.3 样品前处理
1.3.1 样品提取
称取1 g(精确至0.01 g)试样于50 mL离心管中,加入10 mL水,混匀,加入2 mL二氯甲烷,振荡5 min,以8000 r/min离心5 min,上清液转移至25 mL容量瓶中,样品残渣再用10 mL水提取1次,合并2次提取液,用水定容至刻度,摇匀,取2.5 mL样品溶液于15 mL离心管中,加入5 mL 5%氨水,混匀,待净化。
1.3.2 净化
取待净化液通过活化后的固相萃取柱,依次用5 mL水、5 mL 0.005%盐酸甲醇溶液淋洗,弃去淋洗液。用6 mL 0.5%盐酸甲醇溶液洗脱,收集洗脱液,移取1 mL水加入洗脱液中,混匀,在40°C下氮气吹至小于1.0 mL,用水定容至1 mL,涡旋混匀,经滤膜过滤后待进样。
1.4 色谱条件
色谱柱:C18(4.6 mm×250 mm,5.0 μm);柱温:30°C;流动相:A相:0.02 mol/L磷酸二氢钾溶液(pH 3.0);B相:乙腈,洗脱梯度0~17 min,98%A;17~17.5 min,98%~40%A;17.5~21.0 min,40%A;21.0~21.5 min,40%~98%A;21.5~35 min,98%A;流速:1 mL/min;进样量:10 μL;检测波长:208 nm。
2 结果与讨论
2.1 固相萃取柱的选择
β-羟基-β-甲基丁酸钙化合物易溶于水,通常会选择反向固相萃取小柱或者强碱性阴离子固相萃取柱作为净化手段。实验首先测试了反向C18净化小柱(500 mg/6 mL)和反向PLS(150 mg/6 mL)对标准溶液的吸附效果。吸取6 mL水至15 mL离心管中,加入0.1 mL浓度为10 mg/mL标准溶液,混匀后,分别加入到活化后的反向C18和反向PLS净化小柱中,收集流出液,过膜后上机检测。结果显示,流出液的回收率分别为85.0%和75.0%,大部分CaHMB未被反向C18和反向PLS净化小柱吸附,在反相填料上的保留能力较弱。
β-羟基-β-甲基丁酸钙化合物结构含有羧基,可选择具有离子交换能力的吸附剂保留目标物,因此,本实验考察了Waters Oasis MAX、Dikma ProElut PXA、安谱CNW Poly-Sery MAX 3种不同型号的混合型强阴离子交换柱对目标物的净化效果。实验分别称取4种代表性食品基质(果汁、茶饮料、咖啡和功能饮料1.0 g于50 mL离心管中,加入0.1 mL浓度为10 mg/mL标准溶液,按照1.3.1实验步骤进行提取,收集的净化液分别通过上述3种固相萃取柱进行净化,用6 mL 0.5%盐酸甲醇溶液洗脱,收集洗脱液,将1 mL水加入洗脱液中,混匀,40°C下氮气吹至1.0 mL,过膜后上机测定,实验结果如图2所示。
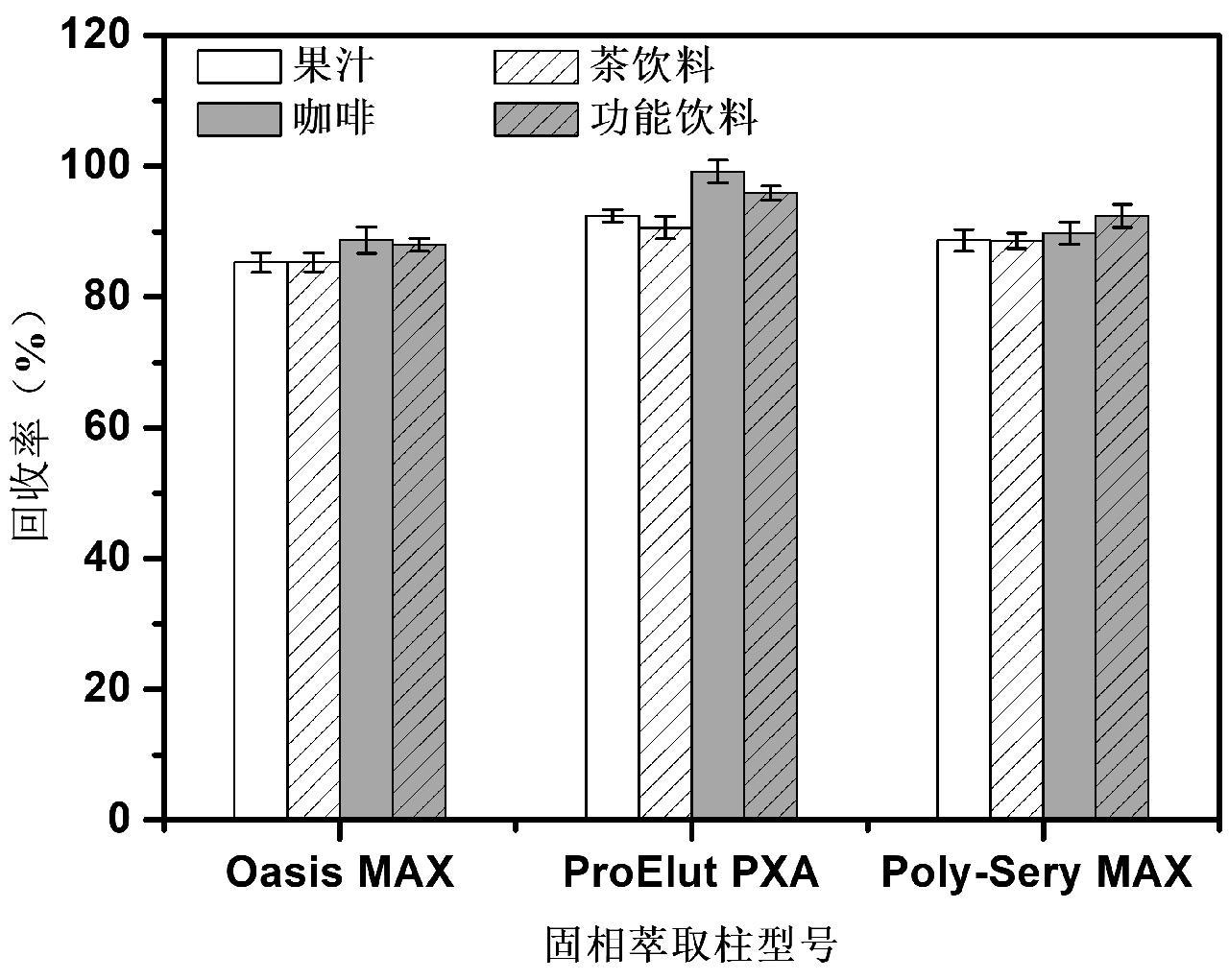
图2 不同型号固相萃取柱对不同样品基质中β-羟基-β-甲基丁酸钙回收率的影响
Fig.2 Effect of different types of SPE columns on the recovery rate of CaHMB in different sample matrices
从图2中可以看出,3种型号阴离子交换柱对果汁、茶饮料、咖啡和功能饮料基质4种代表性基质中的回收率和净化效果均无明显区别,相比之下,采用PXA过柱时溶液流速更容易控制,因此最终采用DIKMA PXA小柱作为样品前处理的阴离子交换柱。
2.2 固相萃取柱的柱容量考察
实验采用标准溶液上柱的方式考察1 mg、5 mg、10 mg、25 mg、50 mg不同上样量对PXA固相萃取柱目标物回收率的影响。分别移取1 mL上述浓度的标准溶液于5个15 mL离心管中,均加入5 mL 5%氨水,混匀,按照1.3.2通过PXA固相萃取柱进行净化,在净化收集的洗脱液中加入1 mL水,混匀,在40℃水浴下吹至1 mL,过膜后,上机测定。上柱量在10 mg以内,回收率都在98.0%以上,当上柱量达到25 mg时,回收率只有87.2%;当上柱量达到50 mg时,回收率只有43.4%(图3)。因此,本实验β-羟基-β-甲基丁酸钙的最大上柱量控制在10 mg以内。
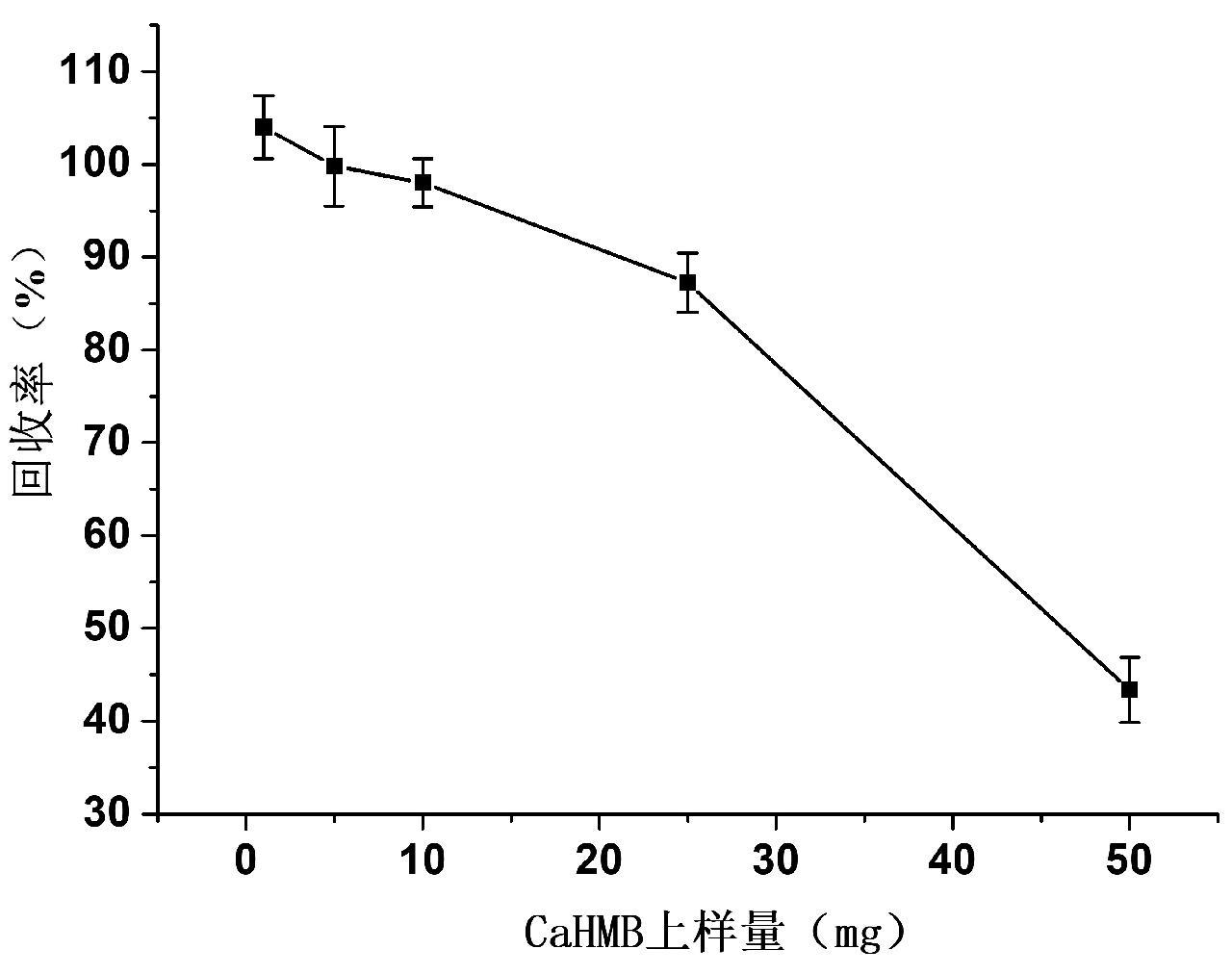
图3 固相萃取柱上柱容量的考察
Fig.3 Investigation of column capacity on SPE column
2.3 洗脱液考察
称取1 g代表性基质果汁4份于4个50 mL离心管中,分别加入0.1 mL浓度为10 mg/mL标准溶液,按照1.3.1提取步骤进行提取,取2.5 mL提取液于15 mL离心管中,加入5 mL 5%氨水,混匀后进行固相萃取,先依次用5 mL水和0.005%盐酸甲醇溶液淋洗,再分别用0.05%盐酸甲醇溶液、0.1%盐酸甲醇溶液、0.5%盐酸甲醇溶液、4%甲酸甲醇溶液作为洗脱液进行洗脱,在所收集的洗脱液中加入1 mL水,混匀,在40℃水浴下氮吹浓缩至1 mL,过膜后,经液相色谱检测。实验回收率结果依次为0%、0%、95.9%和87.4%,表明当采用0.05%盐酸甲醇溶液和0.1%盐酸甲醇溶液洗脱时,目标物均为未被洗脱出来;当采用4%甲酸甲醇溶液,色谱图中甲酸峰影响结果准确定量;当采用0.5%盐酸甲醇溶液洗脱时,回收率最高,因此本实验最终选择0.5%盐酸甲醇作为洗脱液。
2.4 洗脱体积的考察
为确保β-羟基-β-甲基丁酸钙过净化小柱时能被完全洗脱,实验考察了不同体积的洗脱液对目标物回收率的影响。分别称取1 g代表样品果汁5份于5个50 mL离心管中,分别加入0.1 mL浓度为10 mg/mL标准溶液,按照1.3.1实验步骤进行提取,移取2.5 mL提取液于15 mL离心管中,加入5 mL 5%氨水,混匀后进行固相萃取,依次用5 mL水和0.005%盐酸甲醇溶液淋洗,再分别用3 mL、4 mL、5 mL、6 mL、7 mL不同体积0.5%盐酸甲醇溶液进行洗脱,收集洗脱液,在洗脱液中加入1 mL水,混匀,在40℃水浴下氮吹浓缩至1 mL,过膜后,经液相色谱检测,实验回收率结果分别为1.8%、84.8%、90.8%、95.9%和96.3%。结果表明,随着洗脱体积的增大,目标物回收率逐渐提高;当洗脱体积为6 mL时,回收率为95.9%,再增加洗脱体积至7 mL,回收率为96.3%,基本保持不变。因此,为避免洗脱出干扰杂质,本实验选择6 mL作为洗脱液体积。
2.5 方法学考察
2.5.1 线性范围和定量限
将逐级稀释的标准工作溶液分别进样,按照上述色谱条件进行测定,以对应峰面积为纵坐标(Y),标准溶液的质量浓度为横坐标(X),绘制标准曲线,进行线性回归计算,β-羟基-β-甲基丁酸钙标准溶液在0.020~2.00 mg/mL 范围内呈良好线性关系,相关系数(R2)分别为0.9993。以不含目标物的果汁、茶饮料、咖啡、功能饮料作为本底,采用加标的方式考察方法的检出限和定量限,分别以S/N≥3和S/N≥10作为方法的检出限和定量下限,得到β-羟基-β-甲基丁酸钙的检出限(LOD)为0.05 g/100g,定量限(LOQ)为0.10 g/100g。相关结果见表1。
2.5.2 回收率和精密度
选择不含待测物的果汁、茶饮料、咖啡和功能饮料进行加标回收试验。分别添加0.10 g/100 g、1.00 g/100 g、10.00 g/100 g 3种含量水平,按照本方法进行测定,每个水平单独测定6次,平均加标回收率为92.4%~105%,相对标准偏差为0.22%~2.44%,回收率和精密度实验结果见表2。该回收率和精密度符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》[24]的要求,能够满足饮料中的β-羟基-β-甲基丁酸钙分析要求,可用于日常分析的检测。
2.6 净化效果对比
实验选择基质比较复杂的咖啡样品,分别称取样品2份,一份咖啡样品按照1.3.1节步骤进行提取,提取液过膜后,上机分析检测,谱图基线很高,干扰峰很多,无法进行准确定量分析(图4A);另一份咖啡样品按照1.3.1和1.3.2节步骤进行实验,净化液过膜后,上机分析检测(图4B),谱图基线平稳,目标峰附近无干扰峰,净化效果良好,可准确测定结果。
2.7 实际样品的测定
选择10款添加有CaHMB的市售饮料,按照本方法开展检测工作,测定结果见表3。结果表明,本法测得的饮料中β-羟基-β-甲基丁酸钙含量与其标签值基本一致,实测值占比标签值的比例范围为99.2%~106%。按照产品中的推荐服用量,该10款产品满足每日CaHMB摄入量均不超过公告中6 g/d的要求[11]。
表3 实际样品中β-羟基-β-甲基丁酸钙的测定结果
Table 3 Results of CaHMB in real samples
样品名称 | 实测值 (g/100 g) | 标签值 (g/100 g) | 实测值/标签值 (%) |
饮料1 | 0.520 | 0.5 | 104 |
饮料2 | 5.02 | 5.0 | 100 |
饮料3 | 0.598 | 0.6 | 99.7 |
饮料4 | 5.83 | 5.8 | 101 |
饮料5 | 5.72 | 5.75 | 99.5 |
饮料6 | 1.01 | 1.0 | 101 |
饮料7 | 2.52 | 2.5 | 101 |
饮料8 | 6.45 | 6.5 | 99.2 |
饮料9 | 8.06 | 8.0 | 101 |
饮料10 | 2.12 | 2.0 | 106 |
3 结论
本研究建立了一种基于固相萃取净化-高效液相色谱法检测饮料中的β-羟基-β-甲基丁酸钙的方法。方法平均加标回收率范围为92.4%~105%,相对标准偏差为0.22%~2.44%。相比其他文献报道的方法,本方法增加固相萃取净化步骤,净化效果好,特异性高,能够满足实验室样品中β-羟基-β-甲基丁酸钙的日常检测要求。
参考文献
[1] Prado, C. M., Orsso, C. E., Pereira, S. L., et al. Effects of β-hydroxy β-methylbutyrate (HMB) supplementation on muscle mass, function, and other outcomes in patients with cancer: a systematic review[J]. Journal of cachexia, sarcopenia and muscle, 2022,13(3) : 1623-1641.
[2] Lin, Z., Zhao, Y., Chen, Q. Effects of oral administration of β-hydroxy β-methylbutyrate on lean body mass in older adults: a systematic review and meta-analysis[J]. European Geriatric Medicine, 2021, 12(2): 239-251.
[3] 田林,陈锦瑶. β-羟基-β-甲基丁酸钙安全性和有效性研究进展[J]. 食品安全质量检测学报, 2021, 12(16): 6565-6572.
[4] Stuart, M. P., Kyle, J. L., Alysha, C. D. S, et al. An umbrella review of systematic reviews of β-hydroxy-β-methyl butyrate supplementation in ageing and clinical practice[J]. Journal of cachexia, sarcopenia and muscle, 2022, 13: 2265-2275.
[5] Baxter, J. H., Carlos, J. L., Thurmond, J., et al. Dietary toxicity of calcium β-hydroxy-β-methyl butyrate (CaHMB) [J]. Food and Chemical Toxicology, 2005, 43: 1731-1741.
[6] Nishizaki, K., Ikegami, H., Tanaka, Y., et al. Effects of supplementation with a combination of β-hydroxy-β-methyl butyrate, L-arginine, and L-glutamine on postoperative recovery of quadriceps muscle strength after total knee arthroplasty[J]. Asia-pacific Journal of Chemical Engineering, 2015: 24(3): 412-420.
[7] Mu, H., Yang C. B., Zhang, Y., et al. Dietary β-Hydroxy-β-Methylbutyrate Supplementation Affects Growth Performance, Digestion, TOR Pathway, and Muscle Quality in Kuruma Shrimp (Marsupenaeus japonicas) Fed a Low Protein Diet[J]. Aquaculture Nutrition, 2023, 2023(1): 9889533.
[8] Aoki, K., Konno, M., Tokinoya, K., et al. Long-Term Habitual Exercise and Combination of β-Hydroxy-β-Methylbutyrate plus Black Ginger Alter the Autophagy and Mitochondria Related Genes in SAMP8 Mice[J]. Journal of Nutritional Science and Vitaminology, 2022, 68: 39-46.
[9] Kamo, N., Kaido, T., Uozumi, R., et al. Effect of administration of β-hydroxy-β-methyl butyrate-enriched formula after liver transplantation: A pilot randomized controlled trial[J]. Nutrition, 2020, 79: 110871.
[10] Peng, L. N., Cheng, Y. C., Yu, P. C., et al. Oral nutritional supplement with β-hydroxy-β-methyl butyrate (HMB) improves nutrition, physical performance and ameliorates intramuscular adiposity in pre-frail older adults: a randomized controlled trial[J]. The Journal of Nutrition, Health & Aging, 2021, 25(6): 767-773.
[11] 国家卫生健康委. 《关于甜叶菊多酚等20种“三新食品”的公告》(2025年第1号) [EB/OL]. [2025-01-27][2025-03-10]. http://www.nhc.gov.cn/sps/s7890/202501/7b22c4b629b74a0584abcdd482debc56.shtml
[12] Paik M. J., Kim K. R. Sequential ethoxycarbonylation, methoximation and tert-butyldimethylsilylation for simultaneous determination of amino acids and carboxylic acids by dual-column gas chromatography[J]. Journal of Chromatography. A, 2004: 1034(1-2): 13-23.
[13] Baxter J. H., Phillips R. R., Dowlati L., et al. Direct Determination of β-Hydroxy-β-Methylbutyrate (HMB) in Liquid Nutritional Products[J]. Food Analytical Methods, 2011. 4: 341-346.
[14] 王小妹,温恺嘉,李益,等. HPLC法测定大豆肽蛋白质粉中β-羟基-β-甲基丁酸的含量[J]. 今日药学, 2017, 27(8): 525-527.
[15] 杨学灵, 奈世杰, 魏嘉良, 等. β-羟基-β-甲基丁酸钙含量测定及掺假判别[J]. 广州化学, 2018, 43(2): 30-40.
[16] 杨涛, 滕丕合, 米运宏, 等. 特殊医学用途全营养配方食品中β-羟基-β-甲基丁酸钙的含量测定[J]. 食品安全质量检测学报, 2023, 14(5): 258-264.
[17] 朱桂芳, 喻琼, 卢鑫, 等. 运动营养食品中β-羟基-β-甲基丁酸钙的含量测定[J]. 食品科技, 2023, 48(10): 248-253.
[18] 王小妹, 温恺嘉, 李益, 等. LC法一种测定大豆肽蛋白质粉中β-羟基-β-甲基丁酸含量的方法:中国, 201611149150.4 [P]. 2017-04-26 [2024-07-12].
[19] Watanabe, T., Oguchi, K. I., Ebara, S., et al. Measurement of 3-hydroxyisovaleric acid in urine of biotin-deficient infants and mice by HPLC[J]. Journal of Nutrition, 2005, 135(3): 615-618.
[20] 王明明, 朱晓蕾, 李青. GC-MS/MS法测定保健饮品中β-羟基-β-甲基丁酸及其钙盐的含量[J]. 食品安全导刊, 2023, 6: 106-109.
[21] Liebich H. M., Gesele E. Profiling of organic acids by capillary gas chromatography-mass spectrometry after direct methylation in urine using trimethyloxonium tetrafluoroborate[J]. Journal of Chromatography A, 1999, 843(1-2): 237-245.
[22] 刘萍. 一种液体饮料中β-羟基-β-甲基丁酸及其钙盐的测定和确证方法:中国, 201910985093.0[P]. 2019-12-27 [2024-07-12].
[23] Deshpande, P., Jie Z., Subbarayan R., Mamidi V.K., et al. Development and validation of LC-MS/MS method for the estimation of β-hydroxy-β-methylbutyrate in rat plasma and its application to pharmacokinetic studies[J]. Biomedical Chromatography: An International Journal Devoted to Research in Chromatographic Methodologies and Their Applications in the Biosciences, 2013, 27: 142-147.
[24] GB/T 27404—2008. 实验室质量控制规范 食品理化检测[S]. 北京: 中国标准出版社, 2008.
表1 β-羟基-β-甲基丁酸钙的线性范围、线性方程、相关系数、检出限和定量限
Table 1 Linear range, linear equations, correlation coefficients, limits of detection and limits of quantification of CaHMB
化合物名称 | 线性范围 (mg/mL) | 线性方程 | 相关系数 (R2) | 检出限 (g/100 g) | 定量限 (g/100 g) |
CaHMB | 0.020~2.00 | Y = 4.2648X-0.03 | 0.9993 | 0.05 | 0.10 |
表2 不同食品基质中β-羟基-β-甲基丁酸钙的加标回收率和精密度(n = 6)
Table 2 Recoveries and RSDs of CaHMB spiked in different sample matrices (n = 6)
样品基质 | 加标水平 (g/100g) | 日内平均回收率 (%) | 日内RSDs (%) | 日间平均回收率 (%) | 日间RSDs (%) |
果汁 | 0.10 | 102 | 0.50 | 92.4 | 1.80 |
1.00 | 99.6 | 0.73 | 94.4 | 1.25 | |
10.00 | 105 | 0.22 | 93.4 | 1.36 | |
茶饮料 | 0.10 | 103 | 0.65 | 92.6 | 1.89 |
1.00 | 101 | 0.30 | 92.5 | 1.95 | |
10.00 | 103 | 0.55 | 93.8 | 1.99 | |
功能饮料 | 0.10 | 103 | 0.51 | 95.7 | 2.44 |
1.00 | 102 | 0.42 | 96.2 | 2.02 | |
10.00 | 98.2 | 0.45 | 97.8 | 1.34 |
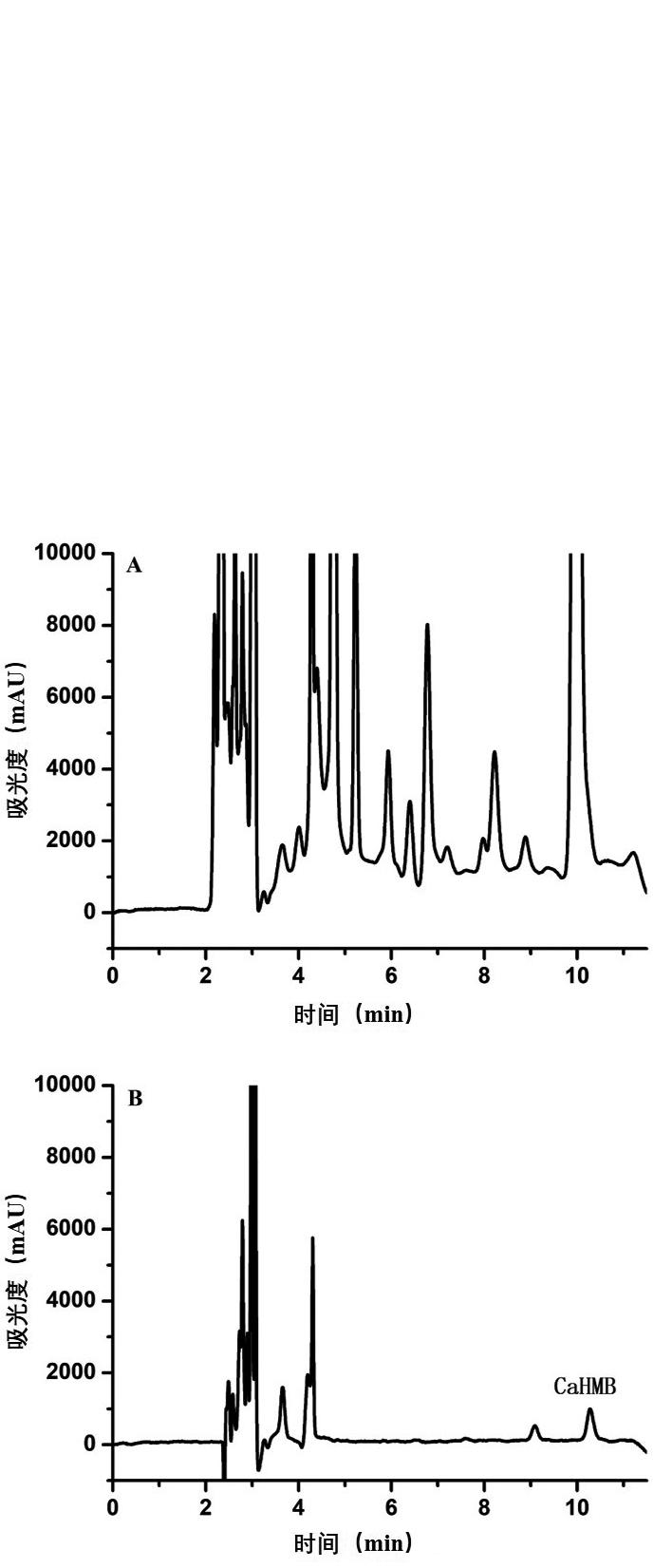
图4 未净化(A)与净化后(B)的咖啡样品比较谱图
Fig.4 Comparative chromatogram of unpurified (A) and purified (B) of coffee samples







