CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
17种印度尼西亚进境观赏鱼COⅠ基因条形码研究与应用
作者:万超 李成镛 王翛 孙芳芳 杨爱馥 陆冠亚 耿庆华 蒲静
万超 李成镛 王翛 孙芳芳 杨爱馥 陆冠亚 耿庆华 蒲静
摘 要 本研究应用通用引物测定了4目7科共17种常见的印度尼西亚进境观赏鱼COⅠ基因传统DNA条形码序列和COⅠ基因微型条形码序列,并应用MEGA软件对两套条形码序列进行同源性比较和系统发育分析。结果表明,COⅠ基因传统DNA条形码和微型条形码均可对小丑泥鳅、钻石红莲灯鱼、一眉道人鱼、鲁哈尼道金斯鲃等观赏鱼进行准确鉴定;研究发现两者进化树差异不显著,表明可以利用COⅠ基因微型条形码序列代替COⅠ基因传统DNA条形码序列对进境观赏鱼进行鉴定。但对形态十分相似的慈鲷科观赏鱼,以及黑骨舌鱼和美丽硬仆骨舌鱼等同一个物种不同品系的观赏鱼,仅依靠COⅠ基因传统DNA条形码和微型条形码技术难以区分,下一步还需要研究进化速度更快的DNA基因条码。
关键词 DNA条形码;DNA微型条形码;观赏鱼;物种鉴定;COⅠ基因
Research on COⅠGene Barcoding of 17 Indonesian Imported Ornamental Fish Species and Its Application
WAN Chao1 LI Cheng-Yong2 WANG Xiao1 SUN Fang-Fang2
YANG Ai-Fu1 LU Guan-Ya3 GENG Qing-Hua2* PU Jing4*
Abstract In this study, universal primers were used to determine the COⅠgene sequences of traditional DNA barcodes and microbarcodes for 17 common Indonesian imported ornamental fish species, representing 4 orders and 7 families. We Performed homology comparison and phylogenetic analysis on two sets of barcode sequences using MEGA. The results showed that both traditional DNA barcodes and microbarcodes of COⅠgenes could accurately identify ornamental fish species such as Botia macracanthus, Rasbora axlerodi, Denison barb, and Dawkinsia rohani. The phylogenetic trees constructed from these two barcode sequences showed no significant differences, suggesting that the COⅠ gene microbarcode sequences could replace traditional DNA barcodes for the identification of imported ornamental fish. However, for species with highly similar morphologies, such as family Cichlidae, and different strains of the same species, such as Osteoglossum ferreirai and Scleropages formosus, accurate differentiation remains challenging using only COⅠ gene barcodes. Further research on DNA barcodes with higher evolutionary rates is recommended.
Keywords DNA barcode; DNA microbarcode; ornamental fish; species identification; COⅠgene
基金项目:海关总署科研计划项目(2023HK044);大连海关科研项目(2023DK03,2023DK04);海科中心自立科研课题(2023HZ01)
第一作者:万超(1980—),男,汉族,辽宁营口人,博士,高级工程师,主要从事物种鉴定和动物检疫工作,E-mail: 656596961@qq.com
通信作者:耿庆华(1977—),女,汉族,辽宁本溪人,博士,正高级兽医师,主要从事物种鉴定和动物检疫工作,E-mail: genghua77@163.com
共同通信作者:蒲静(1977—),女,汉族,河北唐山人,博士,正高级兽医师,主要从事物种鉴定和动物检疫工作,E-mail: pujing1229@126.com
1. 大连海关 大连 116001
2. 沈阳海关 沈阳 110016
3. 南京海关动植物与食品检测中心 南京 210001
4. 中国海关科学技术研究中心 北京 10000
1. Dalian Customs Technology Center, Dalian 116001
2. Shenyang Customs, Shenyang 110016
3. Nanjing Customs Animal and Plant and Food Testing Center, Nanjing 210001
4. China Customs Science and Technology Research Center, Beijing 10000
近年来,我国观赏鱼产业和国际贸易快速发展,从国外引进的观赏鱼品种也在日益多样化。据海关总署网站发布数据,目前允许进境的观赏鱼有130多个科、12941个种。印度尼西亚作为主要观赏鱼出口国,无论进口数量还是进口总额都排在我国观赏鱼进口前列。很多来自印度尼西亚的观赏鱼,如美丽硬仆骨舌鱼(Scleropages formosus),俗称为“金龙鱼”,已经被列入《濒危野生动植物种国际贸易公约》(CITES)的附录Ⅰ[1],而列入附录Ⅰ的物种是已经受到或可能受到贸易影响而有灭绝危险的物种。这些物种的任何跨国流通都需要进口国和出口国同时开具许可证,不允许进行商业目的的国际贸易。另外,海关总署已经禁止如脂鲤科等有潜在外来物种入侵风险的科目进入我国[2]。同时,由于进境观赏鱼种类繁多,而且大部分观赏鱼在引进时都是小鱼苗的状态,很难从形态学上进行鉴定,加大了海关口岸执法的难度。因此对观赏鱼物种的准确鉴定,成为观赏鱼国际贸易中迫切需要解决的问题。
传统的形态学鉴别方法主要依据鱼类的形态、体色和斑纹等特征,由于很多鱼类的形态特征容易受年龄、环境和养殖条件等因素的影响,尤其是许多鱼类的卵和幼体很难进行形态学鉴别。因此,仅根据外部形态特征对观赏鱼进行分类和鉴别可能不够准确,迫切需要开发更加准确的物种鉴别方法。DNA条形码(DNA Barcode)技术被广泛地应用在养殖鱼类的分类与鉴定中[3-6]。张馨月等[7]针对部分拖网渔获物进行DNA条形码研究,认为DNA条形码可以作为鱼种鉴定的一种便捷有效方式,同时可以对鱼类形态学分类系统进行补充和修订。线粒体细胞色素C氧化酶1(cytochrome coxidase 1,COⅠ)基因由于具有相对高的种内变异和低度的种间变化,富含较多的系统发育信号等特点,常常被用于物种的分类和鉴定[8-9]。同时因其拥有适宜的长度,容易被通用引物扩增,成为主要的DNA条形码之一。陈信忠等[10]研究发现16S rRNA基因和COⅠ基因作为基因条形码可以在物种水平对亚洲龙鱼、珍珠龙鱼、双须骨舌鱼、神仙鱼、接吻鱼、孔雀鱼和珍珠毛足鲈等观赏鱼进行准确地鉴别。应用COⅠ基因构建的系统发育树比16S rRNA基因更加接近现有的鱼类分类体系。但是,DNA条形码技术在观赏鱼鉴定方面的应用也存在一些问题。如鱼类DNA的易降解性影响了条形码技术的适用性;观赏鱼常被制成标本,扩增序列长度限制影响了DNA条形码技术在福尔马林浸泡或馆藏标本的应用。微型条形码的长度一般为200 bp,在DNA降解样本中的扩增成功率相对较高,并保留足够的物种分辨能力。程鹏等[11]以分段微型DNA条形码对53种鱼类进行鉴别分类,发现靠近5'端微型条码与DNA条形码分类结果基本一致。
本研究针对消费者喜爱的来自印度尼西亚的无背鱼科、慈鲷科、鳅科、鲤科、丝足鲈科、鳢科和骨舌鱼科的17种常见观赏鱼的COⅠ基因传统DNA条形码和微型条形码进行研究,分析它们之间系统发育关系和遗传距离,探讨两种条形码在观赏鱼种类鉴别中的作用。
1 材料与方法
1.1 实验材料
所有实验用的线翎电鳗、三角鲷、十带罗丽鲷、灰体蓝首鱼、库勒潘鳅、小丑泥鳅、钻石红莲灯鱼、一眉道人鱼、鲁哈尼道金斯鲃、黑斑道金斯鲃、横带墨头鱼、斗鱼、锯盖足鲈、侧眼鳢、双须骨舌鱼、黑骨舌鱼由进口养殖渔场获得,每种鱼选择色彩形态一致的10条采集鱼鳍或鱼尾,美丽硬仆骨舌鱼序列由NCBI数据库收集得到,具体信息见表1。
1.2 仪器和试剂
Q5荧光PCR仪(美国应用生物系统中国分公司);台式冷冻离心机,EX3600全自动核酸提取仪,核酸提取试剂盒(上海之江生物科技股份有限公司);sybrgreen(天根生化科技(北京)有限公司)。
1.3 实验方法
1.3.1 条码基因筛选合成
根据生命条形码联盟(Consortium for the Barcode of Life,CBOL)推荐的鱼类DNA条形码COⅠ基因,并参考相关文献资料[12-17],引物由生工生物工程(上海)股份有限公司合成。
1.3.2 DNA提取
用洁净灭菌的手术剪取鱼鳍或鱼尾约100 mg,按照核酸提取试剂盒方法提取鱼的基因组DNA,提取的DNA放置于-20℃冰箱保存备用。
1.4 PCR扩增序列测定
实验采用25 μL扩增体系,包括2X Premix 12.5 μL,上下游引物各1 μL,灭菌双蒸水7 μL,DNA模板3.5 μL。PCR产物用2%琼脂糖凝胶电泳观察拍照后,送至生工生物工程(上海)股份有限公司长春测序部进行双向测序。
1.5 数据库比对
将所测的COⅠ基因的传统DNA条形码基因序列和微条形码基因序列在GenBank和BLOG SYSTEMS数据库中搜索相似序列进行鉴定。
1.6 DNA序列分析系统进化分析
使用Bioedit 7.0进行序列比对,用MEGA 6.0.6计算K2P种间和种内遗传距离,构建NJ系统进化树。通过和已有的形态学分类比较,筛选系统进化树建树方法。
2 结果与分析
2.1 观赏鱼COⅠ基因序列
17种观赏鱼COⅠ基因序列测定与分析结果表明,绝大多数种类的种内基因序列差异很小。选择这些观赏鱼的COⅠ基因同种比较一致的序列,利用BLAST与GenBank数据库序列进行比较,同源性大于99%的GenBank登录号见表3。
2.2 COⅠ基因传统DNA条形码序列和微条码基因序列系统进化分析
2.2.1 COⅠ基因碱基差异分析
通过对17种观赏鱼COⅠ基因传统DNA条形码序列(美丽硬仆骨舌鱼序列从基因库中获得)和微条码基因序列进行比对分析,分别保留共有序列658 bp和151 bp,用于合并分析。结果表明,17种观赏鱼的COⅠ基因传统DNA条形码序列的平均碱基组成为T:29.6、C:27.5、A:25.2、G:17.6,其中G+C含量(45.1%)低于A+T含量(54.9%)(表4);微条码基因序列的平均碱基组成为T:29.1、C:25.4、A:25.2、G:20.4,其中G+C含量(45.8%)低于A+T含量(54.3%)(表5),碱基组成表现出明显偏移性,COⅠ基因传统DNA条形码序列C碱基数和微条码基因序列的G碱基数差异较大。COⅠ基因传统DNA条形码序列各密码碱基含量结果显示,第1密码子G+C含量最高,平均55.2%(50.7%~57.4%),第2密码子G+C含量较稳定42.9%(42%~43.7%),第三密码子G+C含量平均为37.4%,变化范围7.5%~50%;微条码基因序列各密码碱基含量结果显示,第1密码子G+C含量最高,平均61.7%(57.1%~67.3%),第2密码子G+C含量较稳定38.4%(35.1%~40%),第三密码子G+C含量平均为37.1%,变化范围为22%~56%。
2.2.2 17种观赏鱼COⅠ基因两种条形码序列系统发育树
通过MEGA 6.0.6对17种观赏鱼的COⅠ基因序列和微条码基因序列进化建树分析,基于K2P模型分别构建系统发育树(NJ树),如图3—图4所示,两种长微条形码基因序列构建的系统进化发育树在17种观赏鱼分类中略有差异,在COⅠ基因传统DNA条形码序列NJ系统发育树中,线翎电鳗和库勒潘鳅聚为一类,再和大刺色鳅聚为一类,形成第一分支;钻石红莲灯鱼和锯盖足鲈聚成一小类,再和下游横带墨头鱼、鲁哈尼道金斯鲃、黑斑道金斯鲃等鲤科聚成第二分支;黑骨舌鱼和美丽硬仆骨舌鱼差异较小,和上游双须骨舌鱼聚成一小类,其上游分别为灰体蓝首鱼和斗鱼,该分支和鲈形目鳢科侧眼鳢、鲈形目慈鲷科的三角鲷及十带罗丽鲷构成第三分支;在微条码基因序列进化建树中,大刺色鳅单独成为一分支,灰体蓝首鱼和斗鱼聚为一小支后与3种硬骨舌聚为一类,其他和COⅠ进化树基本一致。本研究结果与形态学分类结果基本一致,表明两种COⅠ基因条形码可以有效区分大部分观赏鱼物种。
2.2.3 17种观赏鱼遗传距离分析
17种观赏鱼的COⅠ基因传统DNA条形码和微条码基因序列遗传距离见表6和表7,两种序列遗传距离除了双须骨舌鱼与黑骨舌鱼的遗传距离分别只有0.073和0.078以外,其他各种观赏鱼之间的COⅠ基因和微条码基因序列遗传距离都很大,绝大多数物种之间都大于0.25,具有极大的遗传分化;部分鱼种如鲈形目慈鲷科的三角鲷和十带罗丽鲷,遗传距离分别为0.127和0.063,虽然差异略大,但是都在中等程度的遗传分化范围内。同样情况出现在一眉道人鱼和鲁哈尼道金斯鲃中,遗传距离分别为0.133和0.182,按数值前者为中等程度的遗传分化,后者为群体间有高度遗传分化,可见两种序列导致部分鱼种进化距离差异较大。
3 讨论与结论
作为形态学的替代方法,DNA条形码鉴定成为观赏鱼鉴定的主要方法之一。研究显示,虽然COⅠ基因可以较好地对观赏鱼进行分类,但不能完全取代传统形态学方法在分类中的重要作用。根据传统形态学鉴定方法,本研究的17种鱼类分成了4目7科,其中骨舌鱼目包括黑骨舌鱼、美丽硬仆骨舌鱼、双须骨舌鱼;鲤形目包括库勒潘鳅、大刺色鳅、钻石红莲灯鱼、一眉道人鱼、鲁哈尼道金斯鲃、 黑斑道金斯鲃、横带墨头鱼;鲈形目包括三角鲷、十带罗丽鲷、灰体蓝首鱼、斗鱼、锯盖足鲈、侧眼鳢;电鳗目仅有线翎电鳗一种。本研究的通用DNA条形码和微条码NJ树显示,鲤科的7种鱼分为鳅科和鲤科两个分支,线翎电鳗不属于鲤科却聚为一支,与形态学进化树略有差异,这有可能与杂交繁殖有关系。
本研究将COⅠ基因微条码方法应用于进境观赏鱼的鉴定和分析中,与COⅠ基因传统DNA条形码方法相比,同样能有效地区分17种观赏鱼,仅在鲈形目的斗鱼和灰体蓝首鱼两种鱼的区分中略有差异。经遗传距离分析,两种鉴定方法的遗传平均距离分别为0.254和0.239,物种之间的遗传距离也基本保持一致,碱基组成差异不大,表明微型条形码可以保留足够物种遗传差异信息,具有良好的代替传统DNA条形码的优势,可以利用COⅠ基因微型条形码序列代替COⅠ基因传统DNA条形码序列对观赏鱼进行鉴定。微型条形码同传统DNA条形码相比,具有扩增效率高、特异性更好、引物通用性强、测序简单等优点;且具有较强的物种分类鉴定能力,而且解决了通用DNA条形码对DNA降解样本检测效率低和不准确等问题,使人们利用DNA条形码对馆藏标本或其他DNA已降解的标本进行分类鉴定成为可能,也更适用于大规模、高通量通关检测的需求。
参考文献
[1]中华人民共和国濒危物种进出口管理办公室公告(2023年第1号) (《濒危野生动植物种国际贸易公约》附录中文版)[EB/OL].
国家林业和草原局官网(2023-02-23) https://www.forestry.gov.cn/c/www/gkzfwj/380010.jhtml
[2] 17万条“宝莲灯鱼”违规进境被查获[EB/OL]. 中华人民共和国广州海关官网(2024-08-12) http://shenzhen. customs.gov.cn/guangzhou_customs/381565/381566/6037405/index.html.
[3] Chambers E.A., P.D. Hebert. Assessing DNA Barcodes for Species Identification in North American Reptiles and Amphibians in Natural History Collections[J]. PLoS One, 2016. 11(4): e0154363.
[4] A Hausmann, SE Miller, JD Holloway, et al. Calibrating the taxonomy of a megadiverse insect family: 3000 DNA barcodes from geometrid type specimens (Lepidoptera, Geometridae)[J]. Genome, 2016, 59(9): 671-684.
[5] Hebert P, S Ratnasingham, EV Zakharov, et al. Counting animal species with DNA barcodes: Canadian insects[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2016. 371(1702).
[6] Steinke D, Prosser, P.D. Hebert. DNA barcode of Marine Metazoans[J]. Methods in Molecular Biology, 2016, 1452: 155-68.
[7]张馨月, 刘岩, 张秀梅, 等. 基于CO Ⅰ基因的西南大西洋部分经济鱼类DNA条形码鉴定[J]. 水生生物学报, 2014, 38(6): 1161-1167.
[8] STEINKE D,ZEMLA K TS, HEBERTP D. Barcoding nemo: DNA-based identifications for the ornamental fish trade[J]. Public Library of Science One, 2009, 4(7): e6300.
[9] PALUMBI S R. Nucleic acids II:the polymerase chain reaction. In Hillis DM, MoritzC, Mable BK (Eds.). Molecular Systematics. Massachusetts[M]. Sunderland: Sinauer &. Associates Inc, 1996: 205-247.
[10]陈信忠, 郭书林, 龚艳清, 等. 16S rRNA和COⅠ基因条形码在12种观赏鱼种类鉴定中的应用[J]. 福建农业学报, 2016, 31(12): 1267-1272.
[11]程鹏, 张爱兵, 王忠锁. 微型DNA条形码在鱼类识别上的应用[J]. 首都师范大学学报(自然科学版), 2012, 33(2): 1267-1272.
[12] Lobo J., et al. Contrasting morphological and DNA barcode-suggested species boundaries among shallow-water amphipod fauna from the southern European Atlantic coast[J]. Genome, 2017. 60(2): 147-157.
[13] Seidel M.Morphology and DNA barcode reveal a new species of Eudicella from East Africa (Coleoptera: Scarabaeidae: Cetoniinae)[J]. Zootaxa, 2016, 4137(4): 535-544.
[14] Ward R. Hanner and P.D. Hebert. The campaign to DNA barcode all fishes, FISH-BOL[J]. Journal of fish biology, 2009, 74(2): 329-356.
[15] Kim S, Won K, Hae-Seok E, et al. DNA barcode-based molecular identification system for fish species[J]. Molecules and Cells, 2010, 30(6): 507-512.
[16] Chang C, Hanyang L, Yung-Chieh C, et al. DNA barcodes of the native ray-finned fishes in Taiwan[J]. Molecular Ecology Resources, 2017, 17(4): 796-805.
[17] Kralik P, M Ricchi. A Basic Guide to Real Time PCR in Microbial Diagnostics: Definitions, Parameters, and Everything[J]. Front Microbiol, 2017, 8: 108.
表1 17种印度尼西亚进境观赏鱼
Table 1 17 species of Indonesian imported ornamental fish
观赏鱼拉丁名 | 样品名称 | 所属属别 | 所属科 |
Apteronotus albifrons | 线翎电鳗 | 翎电鳗属 | 电鳗目无背鱼科 |
Uaru amphiacanthoides | 三角鲷 | 三角丽鱼属 | 鲈形目慈鲷科 |
Rocio octofasciata | 十带罗丽鲷 | 罗丽鲷属 | |
Tropheus duboisi | 灰体蓝首鱼 | 蓝首鱼属 | |
Pangio kuhlii | 库勒潘鳅 | 潘鳅属 | 鲤形目鳅科 |
Chromobotia macracanthus | 大刺色鳅 | 沙鳅属 | |
Sundadanio axelrodi | 钻石红莲灯鱼 | 异他鿕属 | 鲤形目鲤科 |
Puntius denisonii | 一眉道人鱼 | 无须魮属 | |
Dawkinsia rohani | 鲁哈尼道金斯鲃 | 无须魮属 | |
Dawkinsia filamentosa | 黑斑道金斯鲃 | 无须魮属 | |
Garra flavatra | 横带墨头鱼 | 墨头鱼属 | |
Betta splendens | 斗鱼 | 斗鱼属 | 鲈形目丝足鲈科 |
Sphaerichthys osphromenoides | 锯盖足鲈 | 锯盖足鲈属 | |
Channa pleurophthalma | 侧眼鳢 | 鳢属 | 鲈形目鳢科 |
Osteoglossum bicirrhosum | 双须骨舌鱼 | 骨舌鱼属 | 骨舌鱼目骨舌鱼科 |
Osteoglossum ferreirai | 黑骨舌鱼 | 骨舌鱼属 | |
Scleropages formosus | 美丽硬仆骨舌鱼 | 硬仆骨舌鱼属 |
表2 引物序列及PCR反应条件
Table 2 Primer sequences and PCR reaction conditions
基因 | 引物名称 | 引物序列 ( 5 ′ ~ 3 ′ ) | 反应条件 | 条带大小 (bp) |
CO Ⅰ传统DNA条形码 | FF2d | TTCTCCACCAACCACAARGAYATYGG | 94℃ 30 s; 94℃ 10 s, 60℃ 30 s, 72℃ 45 s, 40个循环; 72℃ 10 min | 655 |
FF2r | CACCTCAGGGTGTCCGAARAAYCARAA | |||
CO Ⅰ 微型条形码 | FFmini-F | CTCAACYAATCAYAAAGATATYGGCAC | 94℃ 30 s; 94℃ 10 s, 60℃ 30 s, 72℃ 45 s, 40个循环; 72℃ 10 min | 192 |
Fmini-R | GGYATNACTATRAAGAAAATTATTAC |
表3 17种进境观赏鱼COⅠ基因同源性大于99%的GenBank登录号
Table 3 GenBank accession numbers of 17 species of ornamental fish with COⅠgene homology greater than 99%
观赏鱼拉丁名 | GenBank登录号 |
Apteronotus albifrons | KU568756.1 |
Uaru amphiacanthoides | DQ119220.1 |
Rocio octofasciata | KU569023.1 |
Tropheus duboisi | KU569070.1 |
Pangio kuhlii | KU568954.1 |
Puntius denisonii | JX181843.1 |
Sundadanio axelrodi | JF915681.1 |
Dawkinsia rohani | JX975491.1 |
Dawkinsia filamentosa | MN342747.1 |
Garra flavatra | MN342591.1 |
Betta splendens | KU568769.1 |
Sphaerichthys osphromenoides | MW021427.1 |
Channa pleurophthalma | KJ937390.1 |
Osteoglossum bicirrhosum | JQ667558.1 |
Osteoglossum ferreirai | DSMIS296-12 |
Chromobotia macracanthus | KT781506.1 |
Scleropages formosus | KY131791.1 |
表4 COⅠ基因传统DNA条形码序列碱基含量统计表
Table 4 Table of base composition statistics for traditional COⅠ DNA barcode sequences
观赏鱼拉丁名 | 碱基含量 (%) | |||||||||||||||||||
T(U) | C | A | G | Total | T-1 | C-1 | A-1 | G-1 | Pos #1 | T-2 | C-2 | A-2 | G-2 | Pos #2 | T-3 | C-3 | A-3 | G-3 | Pos #3 | |
Apteronotus albifrons | 29.9 | 28.8 | 24.8 | 16.4 | 652.0 | 28 | 32.6 | 31.7 | 7.3 | 218.0 | 19 | 25.3 | 26.7 | 28.6 | 217.0 | 42 | 28.6 | 16.1 | 13.4 | 217.0 |
Uaru amphiacanthoides | 29.8 | 29.0 | 23.1 | 18.1 | 590.0 | 27 | 32.5 | 29.4 | 10.7 | 197.0 | 19 | 25.4 | 26.4 | 29.4 | 197.0 | 43 | 29.1 | 13.3 | 14.3 | 196.0 |
Rocio octofasciata | 29.0 | 29.8 | 24.2 | 17.0 | 658.0 | 26 | 35.0 | 31.4 | 7.3 | 220.0 | 19 | 26.0 | 26.0 | 29.2 | 219.0 | 42 | 28.3 | 15.1 | 14.6 | 219.0 |
Tropheus duboisi | 29.3 | 29.3 | 23.0 | 18.4 | 652.0 | 28 | 33.0 | 28.9 | 10.1 | 218.0 | 18 | 26.7 | 24.9 | 30.4 | 217.0 | 42 | 28.1 | 15.2 | 14.7 | 217.0 |
Pangio kuhlii | 26.7 | 31.1 | 23.0 | 19.2 | 652.0 | 22 | 37.6 | 28.4 | 12.4 | 218.0 | 17 | 27.2 | 25.3 | 30.4 | 217.0 | 41 | 28.6 | 15.2 | 14.7 | 217.0 |
Puntius denisonii | 27.6 | 27.9 | 26.7 | 17.7 | 655.0 | 23 | 28.3 | 41.1 | 7.3 | 219.0 | 18 | 27.1 | 23.9 | 31.2 | 218.0 | 42 | 28.4 | 15.1 | 14.7 | 218.0 |
Sundadanio axelrodi | 29.8 | 27.1 | 24.7 | 18.4 | 635.0 | 26 | 28.9 | 34.1 | 10.9 | 211.0 | 22 | 24.1 | 24.1 | 30.2 | 212.0 | 42 | 28.3 | 16.0 | 14.2 | 212.0 |
Dawkinsia rohani | 28.5 | 26.9 | 28.1 | 16.5 | 516.0 | 24 | 25.0 | 45.3 | 5.8 | 172.0 | 19 | 26.2 | 25.0 | 29.7 | 172.0 | 42 | 29.7 | 14.0 | 14.0 | 172.0 |
Dawkinsia filamentosa | 27.2 | 27.2 | 29.3 | 16.3 | 651.0 | 21 | 27.2 | 48.4 | 3.2 | 217.0 | 19 | 25.8 | 24.4 | 30.9 | 217.0 | 41 | 28.6 | 15.2 | 14.7 | 217.0 |
Garra flavatra | 30.4 | 25.7 | 26.7 | 17.2 | 651.0 | 29 | 24.0 | 40.1 | 6.5 | 217.0 | 20 | 24.9 | 24.9 | 30.4 | 217.0 | 42 | 28.1 | 15.2 | 14.7 | 217.0 |
Betta splendens | 34.7 | 22.5 | 25.2 | 17.6 | 652.0 | 39 | 17.4 | 33.0 | 10.1 | 218.0 | 22 | 22.6 | 27.2 | 28.1 | 217.0 | 42 | 27.6 | 15.2 | 14.7 | 217.0 |
Sphaerichthys osphromenoides | 32.0 | 24.8 | 24.2 | 19.1 | 654.0 | 33 | 24.3 | 31.7 | 11.0 | 218.0 | 21 | 22.0 | 25.7 | 31.7 | 218.0 | 42 | 28.0 | 15.1 | 14.7 | 218.0 |
Channa pleurophthalma | 27.5 | 29.8 | 25.0 | 17.8 | 652.0 | 23 | 34.9 | 33.0 | 9.2 | 218.0 | 18 | 25.8 | 26.7 | 30.0 | 217.0 | 42 | 28.6 | 15.2 | 14.3 | 217.0 |
Osteoglossum bicirrhosum | 31.4 | 25.8 | 25.5 | 17.3 | 652.0 | 33 | 25.2 | 34.9 | 7.3 | 218.0 | 20 | 24.0 | 26.3 | 30.0 | 217.0 | 42 | 28.1 | 15.2 | 14.7 | 217.0 |
Osteoglossum ferreirai | 29.3 | 27.6 | 25.8 | 17.2 | 651.0 | 28 | 29.5 | 35.5 | 7.4 | 217.0 | 18 | 25.3 | 26.7 | 29.5 | 217.0 | 42 | 28.1 | 15.2 | 14.7 | 217.0 |
Scleropages formosus | 27.8 | 29.8 | 24.2 | 18.2 | 654.0 | 23 | 35.8 | 32.6 | 8.3 | 218.0 | 18 | 25.7 | 24.8 | 31.7 | 218.0 | 42 | 28.0 | 15.1 | 14.7 | 218.0 |
Chromobotia macracanthus | 32.1 | 24.9 | 26.1 | 16.9 | 655.0 | 32 | 23.3 | 39.7 | 5.0 | 219.0 | 22 | 22.9 | 23.4 | 31.2 | 218.0 | 42 | 28.4 | 15.1 | 14.7 | 218.0 |
平均值 | 29.6 | 27.5 | 25.2 | 17.6 | 640.1 | 27 | 29.1 | 35.2 | 8.2 | 213.7 | 19 | 25.1 | 25.4 | 30.2 | 213.2 | 42 | 28.4 | 15.1 | 14.5 | 213.2 |
表5 COⅠ基因微条码序列碱基含量统计表
Table 5 Table of base composition statistics for COⅠ microbarcode sequences
观赏鱼拉丁名 | 碱基含量 (%) | |||||||||||||||||||
T(U) | C | A | G | Total | T-1 | C-1 | A-1 | G-1 | Pos #1 | T-2 | C-2 | A-2 | G-2 | Pos #2 | T-3 | C-3 | A-3 | G-3 | Pos #3 | |
Apteronotus albifrons | 29.7 | 23.6 | 25.7 | 20.9 | 148.0 | 34 | 28.0 | 28.0 | 10.0 | 50.0 | 14 | 20.4 | 26.5 | 38.8 | 49.0 | 41 | 22.4 | 22.4 | 14.3 | 49.0 |
Uaru amphiacanthoides | 27.2 | 24.5 | 27.8 | 20.5 | 151.0 | 25 | 27.5 | 41.2 | 5.9 | 51.0 | 14 | 24.0 | 24.0 | 38.0 | 50.0 | 42 | 22.0 | 18.0 | 18.0 | 50.0 |
Rocio octofasciata | 27.8 | 24.5 | 28.5 | 19.2 | 151.0 | 25 | 29.4 | 43.1 | 2.0 | 51.0 | 16 | 22.0 | 24.0 | 38.0 | 50.0 | 42 | 22.0 | 18.0 | 18.0 | 50.0 |
Tropheus duboisi | 27.7 | 25.0 | 25.7 | 21.6 | 148.0 | 30 | 28.0 | 36.0 | 6.0 | 50.0 | 10 | 26.5 | 22.4 | 40.8 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Pangio kuhlii | 27.0 | 31.1 | 20.9 | 20.9 | 148.0 | 22 | 50.0 | 22.0 | 6.0 | 50.0 | 16 | 22.4 | 22.4 | 38.8 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Puntius denisonii | 27.0 | 27.7 | 23.0 | 22.3 | 148.0 | 24 | 38.0 | 28.0 | 10.0 | 50.0 | 14 | 24.5 | 22.4 | 38.8 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Sundadanio axelrodi | 29.7 | 24.3 | 27.0 | 18.9 | 111.0 | 38 | 24.3 | 29.7 | 8.1 | 37.0 | 11 | 27.0 | 27.0 | 35.1 | 37.0 | 41 | 21.6 | 24.3 | 13.5 | 37.0 |
Dawkinsia rohani | 26.1 | 27.9 | 27.0 | 18.9 | 111.0 | 27 | 35.1 | 32.4 | 5.4 | 37.0 | 11 | 27.0 | 27.0 | 35.1 | 37.0 | 41 | 21.6 | 21.6 | 16.2 | 37.0 |
Dawkinsia filamentosa | 29.3 | 24.5 | 25.9 | 20.4 | 147.0 | 29 | 30.6 | 36.7 | 4.1 | 49.0 | 16 | 22.4 | 22.4 | 38.8 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Garra flavatra | 33.3 | 23.1 | 24.5 | 19.0 | 147.0 | 43 | 24.5 | 32.7 | .0 | 49.0 | 14 | 24.5 | 22.4 | 38.8 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Betta splendens | 35.1 | 17.6 | 25.7 | 21.6 | 148.0 | 46 | 10.0 | 32.0 | 12.0 | 50.0 | 16 | 22.4 | 26.5 | 34.7 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Sphaerichthys osphromenoides | 27.7 | 27.7 | 25.0 | 19.6 | 148.0 | 24 | 40.0 | 30.0 | 6.0 | 50.0 | 16 | 22.4 | 24.5 | 36.7 | 49.0 | 43 | 20.4 | 20.4 | 16.3 | 49.0 |
Channa pleurophthalma | 24.3 | 27.7 | 27.7 | 20.3 | 148.0 | 20 | 36.0 | 40.0 | 4.0 | 50.0 | 10 | 26.5 | 24.5 | 38.8 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Osteoglossum bicirrhosum | 33.1 | 23.6 | 22.3 | 20.9 | 148.0 | 40 | 28.0 | 24.0 | 8.0 | 50.0 | 16 | 22.4 | 24.5 | 36.7 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Osteoglossum ferreirai | 29.7 | 26.4 | 24.3 | 19.6 | 148.0 | 32 | 34.0 | 28.0 | 6.0 | 50.0 | 14 | 24.5 | 26.5 | 34.7 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Scleropages formosus | 25.9 | 28.6 | 23.8 | 21.8 | 147.0 | 20 | 42.9 | 30.6 | 6.1 | 49.0 | 14 | 22.4 | 22.4 | 40.8 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
Chromobotia macracanthus | 33.1 | 23.6 | 24.3 | 18.9 | 148.0 | 42 | 26.0 | 32.0 | .0 | 50.0 | 14 | 24.5 | 22.4 | 38.8 | 49.0 | 43 | 20.4 | 18.4 | 18.4 | 49.0 |
平均值 | 29.1 | 25.4 | 25.2 | 20.4 | 143.8 | 31 | 31.3 | 32.2 | 5.8 | 48.4 | 14 | 23.8 | 24.2 | 37.9 | 47.7 | 42 | 20.8 | 19.1 | 17.6 | 47.7 |
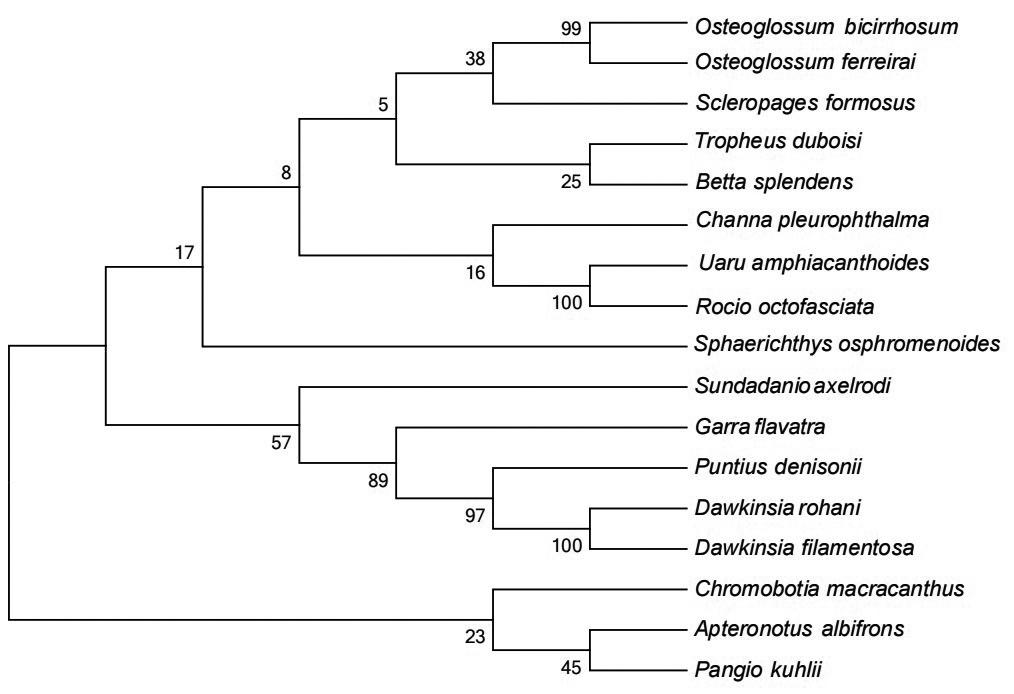
图1 基于COⅠ基因传统DNA条形码序列的NJ系统进化树
Fig.1 NJ phylogenetic tree based on traditional COⅠ DNA barcode sequences
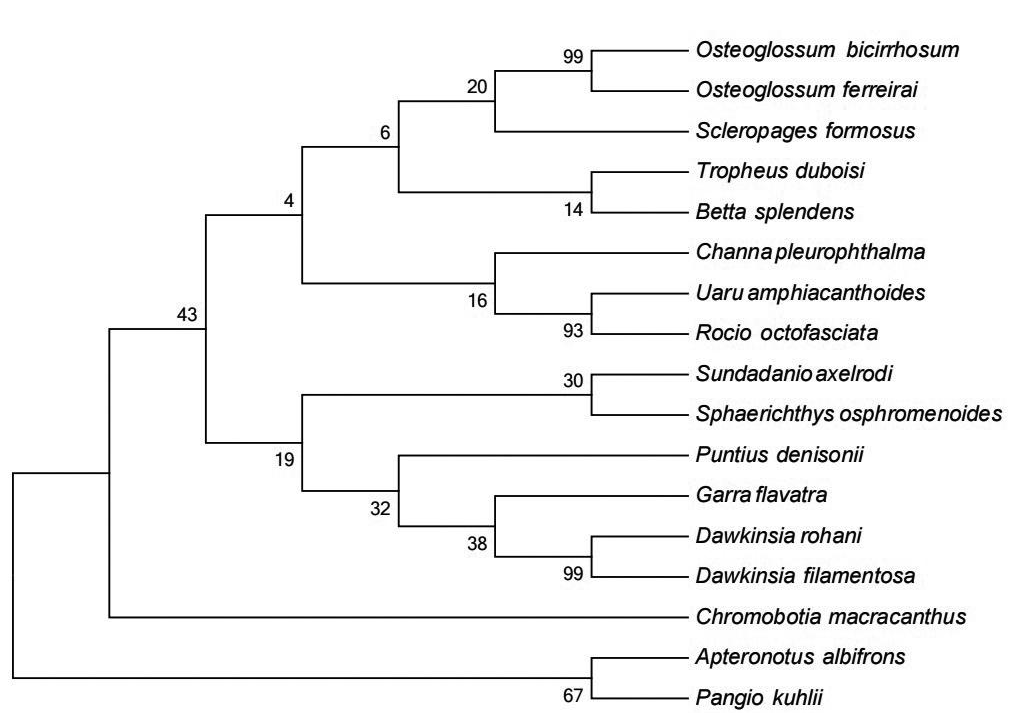
图2 基于COⅠ基因微条形码序列的NJ系统进化树
Fig.2 NJ phylogenetic tree based on COⅠDNA microbarcode sequences
表6 17种进境观赏鱼COⅠ基因传统DNA条形码序列的遗传距离
Table 6 Genetic distance of traditional CO Ⅰ gene DNA barcode sequences in 17 species of ornamental fish
观赏鱼拉丁名 | 遗传距离 | |||||||||||||||
albifrons | thoides | octofasciata | duboisi | kuhli | denisonii | axelrodi | rohani | Daw kinsia filamentosa | flavatra | splendens | osphromenoides | thalma | rhosum | ferreirai | es formosus | |
Apteronotus albifrons | ||||||||||||||||
Uaru amphiacanthoides | 0.301 | |||||||||||||||
Rocio octofasciata | 0.280 | 0.127 | ||||||||||||||
Tropheus duboisi | 0.300 | 0.220 | 0.230 | |||||||||||||
Pangio kuhli | 0.271 | 0.262 | 0.236 | 0.241 | ||||||||||||
Puntius denisonii | 0.307 | 0.276 | 0.248 | 0.267 | 0.232 | |||||||||||
Sundadanio axelrodi | 0.300 | 0.307 | 0.281 | 0.261 | 0.277 | 0.236 | ||||||||||
Daw kinsia rohani | 0.337 | 0.260 | 0.263 | 0.254 | 0.255 | 0.133 | 0.226 | |||||||||
Daw kinsia filamentosa | 0.301 | 0.257 | 0.251 | 0.237 | 0.234 | 0.117 | 0.230 | 0.038 | ||||||||
Garra flavatra | 0.322 | 0.280 | 0.261 | 0.248 | 0.251 | 0.171 | 0.230 | 0.191 | 0.163 | |||||||
Betta splendens | 0.323 | 0.311 | 0.280 | 0.297 | 0.313 | 0.304 | 0.275 | 0.306 | 0.282 | 0.292 | ||||||
osphromenoides | 0.335 | 0.259 | 0.258 | 0.248 | 0.300 | 0.273 | 0.303 | 0.293 | 0.269 | 0.258 | 0.281 | |||||
Channa pleurophthalma | 0.325 | 0.226 | 0.215 | 0.239 | 0.263 | 0.254 | 0.293 | 0.235 | 0.230 | 0.252 | 0.252 | 0.253 | ||||
bicirrhosum | 0.314 | 0.250 | 0.288 | 0.267 | 0.257 | 0.250 | 0.276 | 0.261 | 0.266 | 0.248 | 0.252 | 0.260 | 0.236 | |||
Osteoglossum ferreirai | 0.290 | 0.241 | 0.257 | 0.255 | 0.243 | 0.249 | 0.259 | 0.255 | 0.247 | 0.251 | 0.246 | 0.269 | 0.222 | 0.073 | ||
Scleropages formosus | 0.278 | 0.243 | 0.252 | 0.247 | 0.246 | 0.243 | 0.239 | 0.245 | 0.222 | 0.231 | 0.273 | 0.276 | 0.244 | 0.218 | 0.219 | |
macracanthus | 0.300 | 0.276 | 0.261 | 0.253 | 0.220 | 0.218 | 0.270 | 0.219 | 0.204 | 0.206 | 0.294 | 0.287 | 0.260 | 0.225 | 0.230 | 0.246 |
表7 17种进境观赏鱼CO Ⅰ基因微条形码基因序列的遗传距离
Table 7 Genetic distance of CO Ⅰ gene DNA microbarcode sequences in 17 species of ornamental fish
观赏鱼拉丁名 | 遗传距离 | |||||||||||||||
albifrons | anthoides | octofasciata | duboisi | kuhlii | denisonii | axelrodi | rohani | flamentosa | flavatra | splendens | osphromenoides | thalma | bicirrhosum | ferreirai | formosus | |
Apteronotus albifrons | ||||||||||||||||
amphiacanthoides | 0.316 | |||||||||||||||
Rocio octofasciata | 0.302 | 0.063 | ||||||||||||||
Tropheus duboisi | 0.336 | 0.177 | 0.195 | |||||||||||||
Pangio kuhlii | 0.278 | 0.267 | 0.256 | 0.233 | ||||||||||||
Puntius denisonii | 0.375 | 0.192 | 0.190 | 0.229 | 0.226 | |||||||||||
Sundadanio axelrodi | 0.320 | 0.225 | 0.237 | 0.213 | 0.277 | 0.206 | ||||||||||
Dawkinsia rohani | 0.380 | 0.196 | 0.194 | 0.259 | 0.245 | 0.182 | 0.194 | |||||||||
Dawkinsia flamentosa | 0.366 | 0.168 | 0.166 | 0.220 | 0.230 | 0.159 | 0.205 | 0.009 | ||||||||
Garra flavatra | 0.376 | 0.203 | 0.201 | 0.201 | 0.253 | 0.135 | 0.184 | 0.137 | 0.109 | |||||||
Betta splendens | 0.360 | 0.225 | 0.223 | 0.227 | 0.326 | 0.289 | 0.250 | 0.247 | 0.235 | 0.239 | ||||||
osphromenoides | 0.302 | 0.217 | 0.207 | 0.244 | 0.250 | 0.190 | 0.214 | 0.218 | 0.201 | 0.226 | 0.329 | |||||
pleurophthalma | 0.328 | 0.146 | 0.153 | 0.169 | 0.250 | 0.219 | 0.282 | 0.233 | 0.203 | 0.201 | 0.201 | 0.244 | ||||
bicirrhosum | 0.407 | 0.288 | 0.274 | 0.234 | 0.291 | 0.286 | 0.279 | 0.315 | 0.314 | 0.220 | 0.236 | 0.342 | 0.227 | |||
0steoglossum ferreirai | 0.349 | 0.258 | 0.217 | 0.219 | 0.265 | 0.287 | 0.268 | 0.279 | 0.278 | 0.229 | 0.217 | 0.309 | 0.173 | 0.078 | ||
Scleropages formosus | 0.341 | 0.202 | 0.241 | 0.222 | 0.252 | 0.258 | 0.253 | 0.229 | 0.246 | 0.244 | 0.293 | 0.272 | 0.201 | 0.238 | 0.196 | |
Chromobotia macracanthus | 0.297 | 0.202 | 0.189 | 0.245 | 0.195 | 0.250 | 0.314 | 0.237 | 0.199 | 0.206 | 0.260 | 0.248 | 0.213 | 0.260 | 0.208 | 0.221 |







