CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
鹰嘴豆褐斑病菌Didymella rabiei的检疫鉴定
作者:张海鹏 黎婉芬 许然 卢乃会 黄艳 闫晓东 翟月峰 边勇
张海鹏 黎婉芬 许然 卢乃会 黄艳 闫晓东 翟月峰 边勇
摘 要 本研究通过形态特征鉴定方法、内转录间隔区(Internal Transcribed Spacer,ITS)与β微管蛋白(β-tubulin,TUB)序列分析,以及致病性测定方法对分离物Y2进行鉴定。形态特征鉴定结果表明,分离物Y2菌落初期颜色为橄榄灰,气生菌丝稀疏,随着培养时间延长逐渐加深至黑色,菌落中心部位明显隆起,产生大量黑色分生孢子器,分生孢子椭圆形至长椭圆形,两端直或稍弯,无色,单胞,内有些许小油球,多数无隔,大小为8.37(7.91~10.57)μm × 4.03(3.67~4.58)μm。其ITS、TUB序列与GeneBank中多株鹰嘴豆褐斑病菌相似性达100%;基于ITS和TUB序列的系统发育树显示,分离物Y2与Didymella rabiei处于同一分支。将分离物接种于鹰嘴豆幼苗会引起褐斑坏死。根据上述结果,将分离物Y2鉴定为鹰嘴豆褐斑病菌(Didymella rabiei)。
关键词 鹰嘴豆褐斑病菌;内转录间隔区;β微管蛋白
Quarantine and Identification of Didymella rabiei
ZHANG Hai-Peng1,2 LI Wan-Fen2 XU Ran2 LU Nai-Hui3 HUANG Yan2
YAN Xiao-Dong2 ZHAI Yue-Feng4 BIAN Yong5*
Abstract In this study, the isolate Y2 was identified by morphological characterization, internal transcribed spacer (ITS) and β-tubulin (TUB) sequence analysis, and pathogenicity assays. Morphological observations showed that the color of the early colonies of isolate Y2 was olive gray, with sparse aerial mycelium, which gradually deepened to black with the cultivation time. The center of the colony became prominently raised, producing a large number of black pycnidia, which were ellipsoid to long ellipsoid, straight or slightly curved at the both ends, colorless, single-celled, with some small oil globules inside, and most of them were non-septate, and the size of the spores was 8.37 (7.91-10.57) μm × 4.03 (3.67-4.58) μm. Its ITS and TUB sequences in GeneBank showed 100% similarity to several strains of Didymella rabiei and the phylogenetic tree based on ITS and TUB sequences also showed that isolate Y2 was in the same branch with Didymella rabiei. The isolate caused brown spot necrosis when inoculated in chickpea seedlings. Based on the above results, isolate Y2 was identified as Didymella rabiei.
Keywords Didymella rabiei; internal transcribed spacer (ITS); β-tubulin (TUB)
基金项目:广东省口岸安全智能化检测重点实验室资助(2023B1212010011)
第一作者:张海鹏(1991—),男,汉族,广东广州人,硕士,农艺师,主要从事植物检疫工作,E-mail: 1225882835@qq.com
通信作者:边勇(1981—),男,汉族,陕西延安人,硕士,研究员,主要从事生物安全工作,E-mail: bianyong1627@126.com
1. 广东省口岸安全智能化检测重点实验 广州 510700
2. 黄埔海关技术中心 东莞 523087
3. 湛江海关技术中心 湛江 524022
4. 黄埔海关后勤管理中心 广州 510700
5. 中国海关科学技术研究中心 北京 100026
1. Guangdong Provincial Key Laboratory of Intelligent Port Security Inspection, Guangzhou 510700
2. Huangpu Customs Technology Center, Dongguan 523087
3. Zhanjiang Customs District Technology Center, Zhanjiang 524022
4. Huangpu Customs Logistics Management Center, Guangzhou 510700
5. Science and Technology Research Center of China Customs, Beijing 100026
鹰嘴豆(Cicer arietinum L.)是世界上继菜豆(Phaseolus vulgaris)和豌豆(Pisum sativum)之后重要的豆科粮食作物,2022年全球鹰嘴豆的年产量达1720万吨,总种植面积约为1780万公顷[1]。而由Didymella rabiei引起的鹰嘴豆褐斑病菌是全球许多鹰嘴豆种植区的主要生产制约因素之一,对全球鹰嘴豆行业构成重大生物威胁[2-4]。
鹰嘴豆褐斑病菌(Didymella rabiei)属子囊菌门(Ascomycota),格孢腔菌目(Pleosporales),亚隔孢壳科(Didymellaceae),亚隔孢壳属(Didymella),可通过土壤、种子、病残体传播病害,种传发病率达84%,其寄主包括鹰嘴豆、田豌豆和扁豆,无性型为Ascochyta rabiei,有性型为D. rabiei [5-6],是一种单倍体、异宗配合的子囊菌门真菌,能杀死宿主组织并在死亡组织中繁殖,在植物的所有阶段均可感染,可导致40% ~50%产量损失,严重的时候甚至会导致颗粒无收[6-8]。据报道,该病原菌在巴基斯坦、保加利亚、澳大利亚、伊朗、美国等国家均有分布,曾危害鹰嘴豆等作物并造成经济损失[9-15];我国仅新疆地区有过该病害的报道,曾一度成为制约新疆地区鹰嘴豆生产的重要因素之一[1,16]。该病菌抗逆能力强,在植物病残体上存活多年仍有侵染能力,厄瓜多尔、秘鲁和日本等国家已将其列为植物检疫性有害生物以防止其进一步扩散并造成危害。本研究通过形态特征鉴定结合分子生物学的方法对鹰嘴豆褐斑病菌进行准确鉴定,旨在解决传统形态学鉴定中可能存在的物种模糊性问题,并为后续病害防控提供依据。
1 材料与方法
1.1 材料
1.1.1 样品
分离物Y2来源于本实验室分离培养。
1.1.2 培养基
马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)含有氯霉素100 μg/mL,用于病菌分离、纯化和保存,购于广州环凯微生物科技有限公司。
1.1.3 试剂
DNA提取试剂盒(天根DP320-02,天根生化科技有限公司);2×Taq Master Mix (AG11112,湖南艾科瑞生物科技有限公司);2000 bp Marker(生工生物工程(上海)股份有限公司);其他试剂均为分析纯。
1.1.4 仪器
Axiolab5显微镜、 AXIO Zoom.V16解剖镜及其成像系统(德国 Zeiss 公司);Biometra TONE梯度PCR仪(德国耶拿分析仪器有限公司(Biometra)); BIO-RAD水平电泳设备(伯乐公司);C200凝胶成像系统(Azure Biosystems公司);NanoDrop超微量分光光度计(美国丹诺尔公司)。
1.2 方法
1.2.1 病原菌的分离与纯化
将样品倒在洁净白搪瓷盘上,从中挑选变色、畸形、皱缩等外观异常的鹰嘴豆,1%次氯酸钠表面消毒约3 min后,用无菌水洗3次,放于无菌滤纸上,干燥后置于PDA培养基上,每皿约放置10粒种子,于25℃黑暗培养,并于第4天后开始观察,挑取边缘菌丝进行纯化和培养。分离获得1株气生菌丝稀疏、生长速度缓慢的分离物Y2。
1.2.2 病原菌形态鉴定
纯化后的分离物Y2接种于直径7 cm的PDA中,于25℃培养箱黑暗培养8 d后,观察记录菌落正反面颜色、气生菌丝疏密程度。用灭菌接种针挑取分离物Y2制成临时玻片,置于显微镜下观察分生孢子器、分生孢子和厚垣孢子等形态特征,并对其进行测量与记录。
1.2.3 基因组DNA提取
用灭菌枪头刮取分离物Y2的菌丝体,使用天根DNA提取试剂盒DP320-02,参照说明书进行病原菌DNA提取。提取的DNA经NanoDrop超微量分光光度计测量浓度后,冻存于-20℃冰箱备用。
1.2.4 序列扩增和测序
采用 β-tubulin(TUB)引物 Btub2Fd:5'-GTBC ACCTYCARACCGGYCARTG-3'、Btub4Rd:5'-CCRGAYTGRCCRAARACRAAGTTGTC-3' [17]和Internal Transcribed Spacer(ITS)引物ITS5:5'-GGAAGTAAAAGTCGTAACAAGG-3'、ITS4:5'-TCCTCCGCTTATTGATATGC- 3' [18]对Y2基因组DNA进行PCR 扩增,引物由生工生物工程(上海)股份有限公司合成。PCR反应体系25 μL,包括2X Pro Taq Master Mix(dye plus)*1 12.5 μL,上、下游引物(10 μM/L)各1 μL,2 μL样品DNA,加水补至25 μL。反应程序为:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 40 s,循环35次;72℃ 10 min。PCR扩增产物经2%琼脂糖凝胶电泳检测,确认扩增成功后,扩增产物送生工生物工程(上海)股份有限公司进行双向测序。
1.2.5 序列比对分析
利用美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库对分离物Y2测得的ITS和TUB序列进行比对分析。从GeneBank中下载鹰嘴豆褐斑病菌、同属菌株和其他菌株的ITS、TUB序列,以下载的大豆茎溃疡病菌(Diaporthe caulivora)序列为外围菌株,使用Mega 6.0软件,基于ITS和TUB序列以最大似然法(Maximum Likelihood)构建系统发育树,自举检验(Bootstrap)1000次。
1.2.6 致病性测定
将健康鹰嘴豆种子用无菌水清洗3次,浸泡30 min后播种于直径9 cm花盆中,选择苗期进行接种,接种处经70%酒精表面消毒后,用灭菌处理后的接种针在茎部表面轻轻刺伤形成伤口,将在PDA平板上培养好的分离物用打孔器在菌落边缘打取菌饼,转移至种苗伤口处,并将蘸有无菌水的湿润灭菌脱脂棉覆盖接种处,25℃培养,接种7 d后观察记录发病情况,以接种无菌PDA培养基块作为对照。
2 结果与讨论
2.1 危害症状
鹰嘴豆种子的表面形成橄榄灰至棕褐色的病斑,随着病斑扩大,染病部位表面出现大量菌丝和分生孢子器,分生孢子器随时间推移逐渐变黑,喷出的分生孢子液乳白色,质地胶状,如图1所示。
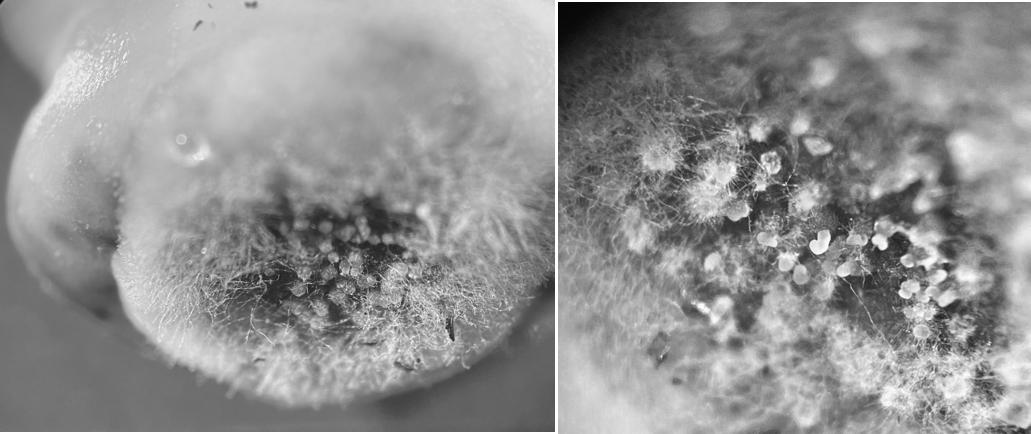
图1 鹰嘴豆上的危害症状
Fig.1 Symptoms of Didymella rabiei on chickpea
2.2 分离物形态特征
分离物Y2在PDA平板上气生菌丝浓密,菌落边缘不规则,培养初期菌落颜色为橄榄灰,随着培养时间增加,颜色逐渐加深至黑色(图2);菌落中心部位明显隆起,且产生大量黑色分生孢子器,分生孢子器圆锥形至圆形、棍棒状,分生孢子器顶端有一孔口,培养后期喷出大量胶质状的分生孢子液,分生孢子大多椭圆形至长椭圆形,两端直或稍弯,无色,单胞,内有些许小油球,多数无隔,大小为8.37(7.91~10.57)μm × 4.03(3.67~4.58)μm(图3)。
2.3 序列分析
引物ITS4/ITS5扩增产物测序后获得约512 bp序列,于NCBI中进行比对,结果表明,与D. rabiei模式菌株CBS 237.37(EU167600.1)等43个编号的相似性达100%;与D. rabiei菌株OP967924.1、KP859584.1、KP859586.1等15个编号相似性达99.81%,序列差异为1 bp;与D. rabiei菌株KP859583.1编号相似性达99.62%,序列差异为2 bp。
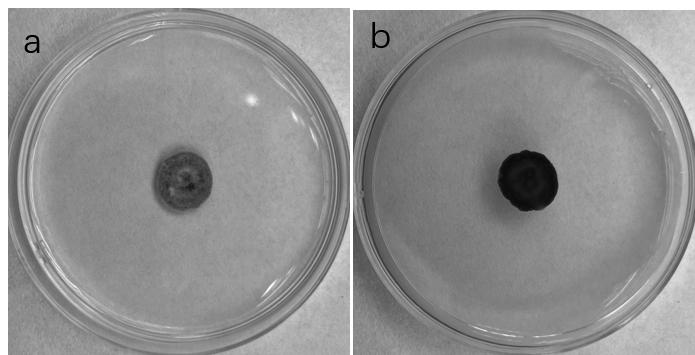
a: 菌落正面; b: 菌落反面
图2 分离物Y2菌落(PDA 22℃培养8 d)
Fig.2 Colony of isolate Y2 (PDA 22℃ for 8 d)
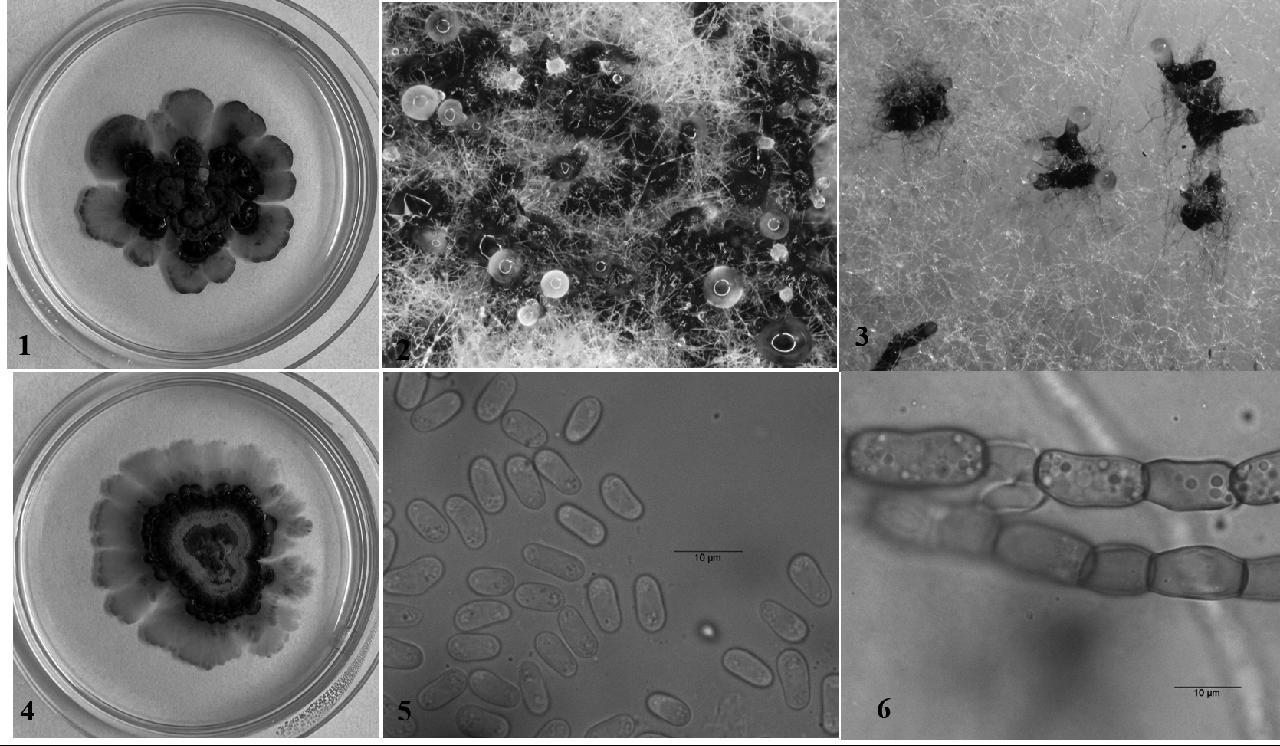
1、4: 菌落正面; 2、3: 分生孢子器; 5: 分生孢子; 6: 厚垣孢子
图3 分离物Y2的形态特征
Fig.3 Morphological characterization of isolate Y2
引物Btub2Fd/Btub2Rd扩增产物测序后获得约320 bp序列,于NCBI中进行比对,结果表明,与D. rabiei菌株MT904283.1、GU237533.1、KM244529.1等14个编号的相似性达100%;与D. rabiei菌株MN983727.1编号相似性达99.7%,序列差异为1 bp。
基于ITS和TUB序列构建系统发育树,结果表明,分离物Y2和GeneBank中D. rabiei位于同一分支,分离物Y2与D. rabiei的亲缘关系最近(图4)。
2.4 致病性测定
将分离物Y2接种于健康鹰嘴豆幼苗7 d后,接种部位组织出现褐变枯死,幼苗倒伏,接种无菌PDA培养基块的部位未出现褐变枯死症状(图5)。从接种发病部位进行病菌分离、鉴定,结果显示,分离病菌的菌落性状与接种病菌一致,序列分析证实接种后分离病菌为D. rabiei,分离病菌与接种病菌相同,完成柯赫氏法则验证。
图4 基于ITS和TUB序列的系统发育树
Fig.4 Phylogenetic tree based on ITS and TUB sequences
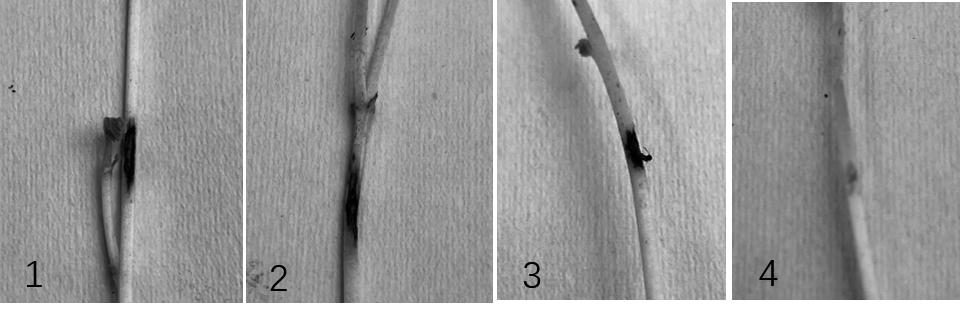
1、2、3: 接种分离物Y2; 4: 接种无菌PDA培养基块
图5 鹰嘴豆褐斑病菌致病性测定(7 d)
Fig.5 Pathogenicity assay of Didymella rabiei (7 d)
3 结果与讨论
Nene Y L[19]描述该病菌的分生孢子为透明、椭圆形、两端略弯曲,大小为6~12 μm× 4~6 μm;Viotti等[20]描述该病菌的分生孢子为9.3~12.9(11.3 ± 1.12)μm × 3.3~5.0(4.2 ± 0.51)μm;Basandrai等[21]描述该病原菌的分生孢子大小为:14.0~6.2 μm × 10.7~4.6 μm;本研究的测量结果为8.37(7.91~10.57)μm × 4.03(3.67~4.58)μm。本研究种苗致病性测定情况与Singh R等[8]的描述一致,且分子生物学方法也将该病原菌指向D. rabiei。因此,将该病原菌鉴定为Didymella rabiei。
该病原菌的危害性大,根据文献报道,1993年在巴基斯坦造成鹰嘴豆种植区25%~50%面积受害[9];造成保加利亚年度产量损失在20%~50%之间,更甚者可达100%,澳大利亚鹰嘴豆行业投入控制该病原菌的费用约3490万美元,产量损失达480万美元[10];美国和伊朗由于该病原菌侵害造成的损失分别高达90%和100%[11-14];在我国新疆曾造成40%~50%产量损失,成为鹰嘴豆产业发展的重要制约因素之一[16-17]。此外,该病原菌的抗逆性强,可以在鹰嘴豆病残体上存活多年仍保持侵染能力[22],在室内常温条件下干燥保存5年后,仍可以从鹰嘴豆病残体中分离纯化出病原菌D. rabiei[23];其适应性强,曾在我国新疆有该病原菌入侵和定殖的报道[1,16,23]。综上所述,笔者建议口岸相关监管部门加大对该病原菌的关注度,加强对进口植物及其产品的监测与防控,以保障我国鹰嘴豆产业的健康发展和农业生产安全。
参考文献
[1] Liu S, Wu Y, Li Y, et al. Genome-Wide Identification and Expression Analysis of Heat Shock Protein 20 (HSP20) Gene Family in Response to High-Temperature Stress in Chickpeas (Cicer arietinum L.)[J]. Agronomy, 2024, 14(8): 1696. DOI: 10.3390/agronomy14081696.
[2] Vaghefi N, Bar I, Lawley J W, et al. Population-level whole-genome sequencing of Ascochyta rabiei identifies genomic loci associated with isolate aggressiveness[J]. Microbial Genomics, 2024, 10(11): 001326. DOI: 10.1099/mgen.0.001326.
[3] Farahani S, Talebi R, Maleki M, et al. Pathogenic diversity of Ascochyta rabiei isolates and identification of resistance sources in core collection of chickpea germplasm[J]. The Plant Pathology Journal, 2019, 35(4): 321-329.
[4] Dariva F D, Arman A, Morales M, et al. Identification of novel candidate genes for Ascochyta blight resistance in chickpea[J]. Scientific Reports, 2024, 14(1): 31415. DOI: 10.3389/fpls.2022.942220.
[5] De Gruyter J, Aveskamp M M, Woudenberg J H C, et al. Molecular phylogeny of Phoma and allied anamorph genera: towards a reclassification of the Phoma complex[J]. Mycological Research, 2009, 113(4): 508-519.
[6] Fanning J, Brand J, Munoz Santa I, et al. Management of chickpea Ascochyta blight using fungicides and cultivar resistance improves grain yield, quality, and grower profitability[J]. Frontiers in Plant Science, 2022, 13: 942220. DOI: 10.3389/fpls.2022.942220.
[7] Pastor S, Crociara C, Valetti L, et al. Screening of chickpea germplasm for Ascochyta blight resistance under controlled environment[J]. Euphytica, 2022, 218(2): 12. DOI: 10.1007/s10681-021-02963-0.
[8] Singh R, Kumar K, Purayannur S, et al. Ascochyta rabiei: A threat to global chickpea production[J]. Molecular Plant Pathology, 2022, 23: 1241-1261.
[9] Ihsan A, Saqib M, Rafique K. Prevalence and yield losses due to Ascochyta rabiei in chickpea crops of Punjab, Pakistan[J]. Pakistan Journal of Botany, 2018, 50(3): 1123-1130.
[10] Foresto E, Carezzano M E, Giordano W, et al. Ascochyta blight in chickpea: an update[J]. Journal of Fungi, 2023, 9(2): 203. DOI: 10.3390/jof9020203.
[11] Farahani S, Talebi R, Maleki M, et al. Mating type distribution, genetic diversity and population structure of Ascochyta rabiei, the cause of Ascochyta blight of chickpea in western Iran[J]. Phytopathologia Mediterranea, 2021, 60(1): 3-12.
[12] Bayahi K, Chaar H. Genetic Study and Temporal Dynamics of the Reaction to Ascochyta rabiei Epidemic in Improved Lines and Cultivars of Chickpea (Cicer arietinum L.)[J]. Legume Science, 2024, 6(3): e243. DOI: 10.1002/leg3.243.
[13] Vafaei S H, Rezaee S, Moghadam A A, et al. Virulence diversity of Ascochyta rabiei the causal agent of Ascochyta blight of chickpea in the western provinces of Iran[J]. Archives of Phytopathology and Plant Protection, 2015, 48(17-20): 921-930.
[14] Owati A S, Bright A, Pasche J S, et al. The Detection and Characterization of QoI-Resistant Didymella rabiei Causing Ascochyta Blight of Chickpea in Montana[J]. Frontiers in Plant Science, 2017, 8: 1165. DOI: 10.3389/fpls.2017.01165.
[15] Barilli E, Cobos M J, Rubiales D. Clarification on Host Range of Didymella pinodes the Causal Agent of Pea Ascochyta Blight[J]. Frontiers in Plant Science, 2016, 7: 592. DOI: 10.3389/fpls.2016.00592.
[16] 马德成, 魏建华, 曾繁明, 等. 新疆鹰嘴豆褐斑病的发生[J]. 植物检疫, 2008, 22(4): 245-246.
[17] 段丽君, 吕燕, 张慧丽, 等. 基于 DNA 序列分析的葡萄茎枯病菌检疫鉴定[J]. 植物检疫, 2020, 34(4): 22-30.
[18] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J]. PCR protocols: a guide to methods and applications, 1990, 18(1): 315-322.
[19] Nene Y L. A review of Ascochyta blight of chickpea[J]. International Journal of Pest Management, 1982, 28: 61-70.
[20] Viotti G, Carmona M A, Scandiani M, et al. First Report of Ascochyta rabiei Causing Ascochyta Blight of Chickpea in Argentina[J]. Plant Disease, 2012, 96(9): 1375-1375.
[21] Basandrai A K, Pande S, Kishore G K, et al. Cultural, Morphological and Pathological Variation in Indian Isolates of Ascochyta rabiei, the Chickpea Blight Pathogen[J]. Plant Pathology Journal, 2005, 21: 207-213.
[22] Bahr L, Castelli M V, Barolo M I, et al. Ascochyta blight: isolation, characterization, and development of a rapid method to detect inhibitors of the chickpea fungal pathogen Ascochyta rabiei[J]. Fungal biology, 2016, 120(3): 424-432.
[23] 马丽娟, 张巨松, 李利民, 等. 鹰嘴豆种质资源对 Ascochyta rabiei 的抗性评价及遗传多态性分析[J]. 植物遗传资源学报, 2013, 14(6): 1179-1184.







